苹果轮纹病菌抗戊唑醇突变体UV-TS1-10的生理生化特性
付 丽, 曲健禄, 武海斌, 翟 浩, 李晓军, 范 昆
(山东省果树研究所, 泰安 271000)
苹果轮纹病菌抗戊唑醇突变体UV-TS1-10的生理生化特性
付 丽, 曲健禄, 武海斌, 翟 浩, 李晓军, 范 昆*
(山东省果树研究所, 泰安 271000)
利用苹果轮纹病菌敏感菌株TS1和抗戊唑醇突变体UV-TS1-10进行了苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)活力、可溶性蛋白含量及酯酶同工酶图谱等生理生化特性的测定。经不同浓度药剂处理0~24 h,抗性突变体UV-TS1-10体内PAL活性一直高于敏感菌株TS1,两者都呈现先上升后下降的趋势,并在1.5 h达到最高值;抗药突变体UV-TS1-10体内POD活力也高于TS1,一直处于上升趋势,24 h达到最高值时两菌株活力差异最大;UV-TS1-10体内可溶性蛋白含量为TS1的1.3倍,同一菌株在不同浓度戊唑醇处理后可溶性蛋白含量差异不大,稳定性好;抗药突变体UV-TS1-10比敏感菌株TS1的酯酶同工酶图谱少了一条Rf=0.33的谱带,多了Rf=0.14的特征性谱带,表明抗戊唑醇突变体UV-TS1-10其生理生化特性发生了较大变化。本文以研究敏、抗菌株间生理生化特性的差异为基础,探讨苹果轮纹病菌对戊唑醇可能的抗性机制,为科学地指导生产用药提供理论依据。
苹果轮纹病菌; 戊唑醇; 抗性突变体; 生理生化特性
苹果轮纹病(apple ring rot)是由葡萄座腔菌(Botryosphaeriadothidea)引起的一种世界性真菌病害,能够侵染生长期的果实、枝干,采后贮藏期也发生严重,是苹果生产中一种重要病害[1]。该病原寄主范围广泛,能够侵染苹果[2]、梨[3]、开心果[4]、山核桃[5]、桉树[6]、蓝莓[7]等多种经济作物,带来巨大的经济损失。针对该病原菌,生产上多以化学药剂进行防治,如多菌灵、代森锰锌和戊唑醇等,其中以戊唑醇的防治效果最好[8]。戊唑醇是三唑类杀菌剂,通过杂环上的氮原子与甾醇14α-去甲基化酶P450结合,抑制酶的活性,最终起到杀菌作用。由于其独特的作用机制已广泛应用于水稻、小麦、玉米、葡萄[9-12]等多种农作物病害的防治。但是目前,已有报道发现小麦叶枯病菌(Mycosphaerellagraminicola)[13]、草坪币斑病菌(Sclerotiniahomoeocarpa)[14]、甜菜褐斑病菌(Cercosporabeticola)[15]、花生褐斑病菌(C.arachidicola)[16]、桃褐腐病菌(Moniliniafructicola)[17]等多种病原菌对戊唑醇出现了抗药性。田间病原菌抗药性的发展可能会带来农药使用量的增加和农药残留的超标,因此对于抗药性的研究迫在眉睫。
在病原菌抗药性产生的同时,生理生化特性也会随之变化,在前期的研究中,范昆等[18]发现苹果轮纹病菌抗戊唑醇突变体和敏感菌株在菌丝生长速率等生物学特性方面存在差异。目前尚未见关于苹果轮纹病菌抗戊唑醇突变体生理生化特性的系统报道,而该特性对探明菌株的抗药性机理及进行抗性风险评估具有重要意义。本研究继续以苹果轮纹病菌敏感菌株TS1和抗戊唑醇突变体UV-TS1-10为试材,研究比较突变体在苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、可溶性蛋白含量及酯酶同工酶等方面的生理生化特性差异,分析敏感菌株与抗性菌株对戊唑醇的适应性差异,为其更进一步的研究打下基础。
1 材料与方法
1.1 供试材料
菌株:苹果轮纹病菌敏感菌株TS1和抗性菌株UV-TS1-10,均由山东省果树研究所植保室分离保存。敏感菌株TS1采自山东省泰山南天门未施用过戊唑醇的苹果树上;抗性菌株UV-TS1-10为通过敏感菌株TS1紫外诱导的抗戊唑醇突变体,抗性倍数达67.88[18]。
药剂及试剂:98%戊唑醇(tebuconazole)原药(江苏常隆化工有限公司),用丙酮溶解并配成1×104μg/mL的母液,置4℃冰箱中备用。聚乙烯吡咯烷酮(PVP,进口分装)、L-苯丙氨酸(Solarbio,P0010)、乙酸-1-萘酯(Solarbio)、乙酸-2-萘酯(阿拉丁)、愈创木酚及其余试剂均为分析纯,4×protein native PAGE loading buffer(TaKaRa,9175)。
主要仪器:Ultrospec 2100 pro紫外分光光度计(Amersham Biosciences);5810R高速冷冻离心机(Eppendorf)、DYY-6D型电泳仪(北京市六一仪器厂);GXZ智能型光照培养箱(宁波江南仪器厂)。
1.2 方法
1.2.1 菌丝制备
将供试菌株TS1和UV-TS1-10在PDA培养基上于28℃黑暗培养3 d,于菌落边缘打取直径7 mm的菌饼,分别接入PDA平板,28℃黑暗条件培养5 d。刮取新鲜菌丝,经重蒸水冲洗,真空抽滤后各称取鲜菌丝2.0 g,分别放入含有质量浓度为1.0、5.0、25.0 μg/mL的戊唑醇药液的三角瓶中,于28℃恒温、120 r/min下分别振荡培养0、1.5、6和24 h。将各处理菌丝用重蒸水冲洗5次,真空抽滤后-80℃备用。以0.1 μg/mL丙酮溶剂稀释液为对照,每个处理重复3次。
1.2.2 苯丙氨酸解氨酶(PAL)活力测定
参照Southerton等[19]的方法,略有改进。反应体系为:pH 8.7硼酸缓冲液2.0 mL、酶液0.5 mL、0.02 mol/L的L-苯丙氨酸1 mL。对照用0.5 mL硼酸缓冲液代替酶液。40℃水浴,反应60 min后用0.5 mL 6 mol/L的盐酸终止反应。用分光光度计在290 nm处测定吸光度(A)的变化。重复3次。
1.2.3 过氧化物酶(POD)活力测定
采用愈创木酚比色法[20],并略加改进。反应体系为: pH 5.8磷酸缓冲液2.0 mL,3%H2O21 mL,0.05 mol/L愈创木酚1 mL、酶液1.0 mL。37℃水浴,反应15 min后迅速转入冰浴中,对照以缓冲液代替酶液。用紫外分光光度计在470 nm处测定反应3 min时的吸光度(A)。每隔30 s记录1次,共记录6次,以每1 min内A470变化0.01为1个酶活力单位(μmol/min)。重复3次。
1.2.4 可溶性蛋白含量测定
采用考马斯亮蓝G-250法[21]。
1.2.5 酯酶同工酶电泳
参照夏晓明[22]的方法,但略有改进。配制质量分数分别为7.5%的分离胶和3%的浓缩胶。吸取16 μL酶液,与4 μL Buffer混匀后分别注入点样孔,于4℃下进行恒压电泳(电压240 V,电泳时间3 h左右)。每个样品重复3次。酯酶同工酶采用乙酸萘酯法染色[22],略有改动。凝胶染色后测定溴酚蓝与各酶带在分离胶中的迁移距离。
1.3 统计分析
酶活力测定结果采用SPSS 16.0 统计软件进行方差分析,所得数据利用Duncan氏新复极差检验法分析差异显著性(α=0.05)。
2 结果与分析
2.1 TS1和UV-TS1-10菌株的PAL活力
TS1和UV-TS1-10菌株经不同浓度戊唑醇处理以后,菌株体内PAL活力变化如图1所示。经1、5、25 μg/mL不同浓度戊唑醇处理后,敏感性和抗性菌株体内的PAL活力变化均表现为先上升后下降的趋势。不同戊唑醇浓度处理下,抗性菌株UV-TS1-10的PAL活力均高于敏感菌株TS1。相同戊唑醇浓度处理下,PAL活力呈现先升高再下降的趋势,TS1和UV-TS1-10菌株体内PAL活力都在1.5 h处理时达到最高值。UV-TS1-10的PAL活力变化幅度相较于TS1要高。试验中还发现,对照样品中,0~24 h期间敏感性和抗性菌株体内的PAL活力也表现为先上升后下降的状态,最高值均仅为起始值的1.3倍,表明在丙酮稀释液状态下,PAL活性也会发生变化,只是变化的趋势较缓。

图1 不同浓度戊唑醇处理后TS1和UV-TS1-10菌株体内PAL活力Fig.1 Comparison of the PAL activities of TS1 and UV-TS1-10 treated with different concentrations of tebuconazole
2.2 TS1和UV-TS1-10菌株的POD活力
不同浓度戊唑醇处理不同时间后,TS1和UV-TS1-10体内过氧化物酶(POD)的活力变化见图2。随着戊唑醇处理浓度的升高,UV-TS1-10和TS1体内的POD活力随着处理时间的增加不断升高,处理1.5 h和6 h之间上升趋势均较缓,24 h的POD活性急剧增加。UV-TS1-10和TS1体内的POD活性在戊唑醇浓度为25 μg/mL时达到最大值;由于0 h POD活力初始值较低,TS1菌株的POD活力0~24 h增长倍数比UV-TS1-10菌株高;UV-TS1-10和TS1在各浓度药剂处理下的POD活力均明显高于无药处理;在相同处理条件下,UV-TS1-10体内POD活力明显高于TS1。
2.3 TS1和UV-TS1-10菌株体内可溶性蛋白含量比较
不同浓度戊唑醇处理不同时间后,TS1和UV-TS1-10体内可溶性蛋白含量变化见图3。处理和对照的TS1和UV-TS1-10体内的可溶性蛋白含量均出现先下降后上升的趋势,处理6 h时达到最低值,为起始值的1/7;在处理24 h时TS1和UV-TS1-10体内可溶性蛋白含量又稍有升高,但不及起始值的1/2。不同浓度戊唑醇处理的TS1和UV-TS1-10体内可溶性蛋白含量变化不大,但UV-TS1-10的体内可溶性蛋白含量在处理0/1.5 h时高于TS1,处理6 h和24 h时低于TS1,变化明显。
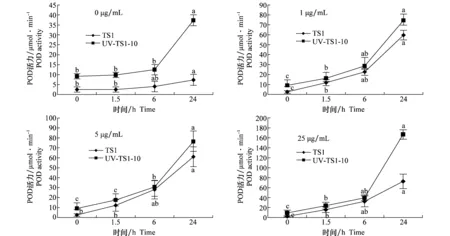
图2 不同浓度戊唑醇处理后TS1和UV-TS1-10菌株体内POD活力Fig.2 Comparison of the POD activities of TS1 and UV-TS1-10 treated with different concentrations of tebuconazole
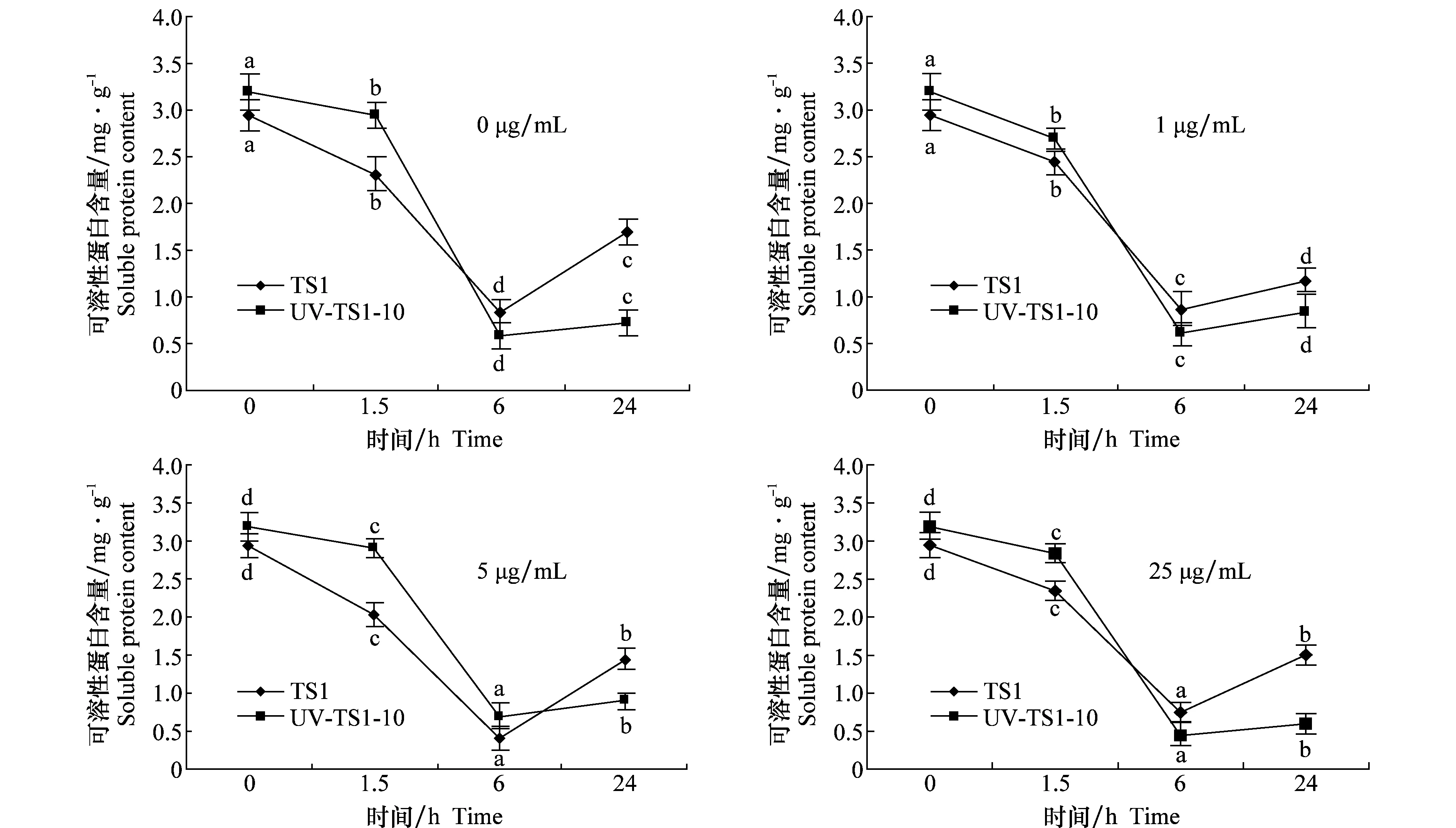
图3 不同浓度戊唑醇处理后TS1和UV-TS1-10菌株体内可溶性蛋白含量Fig.3 Comparison of soluble proteins of TS1 and UV-TS1-10 treated with different concentrations of tebuconazole
2.4 TS1和UV-TS1-10菌株酯酶同工酶电泳图谱分析
TS1和UV-TS1-10菌株酯酶同工酶电泳图谱见图4。TS1和UV-TS1-10菌株酯酶同工酶电泳图谱存在特异性差异,TS1(图4中1~4)有两条酶带标记为a、b,其Rf分别为0.33、0.43,酶带a颜色较深,酶带b颜色较浅;UV-TS1-10(图4中5~8)有2条酶带标记为b、c,其Rf为0.43和0.14,酶带b与TS1的酶带b相似,酶带c颜色较酶带a深,为UV-TS1-10的特征性谱带。

图4 敏感菌株TS1和抗性菌株UV-TS1-10酯酶同工酶电泳图谱Fig.4 Electrophoretic patterns of esterases of tebuconazole-resistant and-susceptible isolates of Botryosphaeria dothidea
3 讨论
苹果轮纹病的化学防治一直以来是苹果生产中的重要方面,面对轮纹病抗药性的不断发展,我们对采集的菌株进行了室内筛选并诱导出稳定的抗性菌株。2012年我们对敏感菌株TS1和抗性菌株UV-TS1-10进行了生物学特性的研究[18],发现TS1和UV-TS1-10在致病力、适宜生长温度、适宜pH等方面差异不明显,但是菌丝生长速度及菌丝干重差异较大,所以本文以敏感菌株和突变菌株为材料,研究两者之间生理生化特性的差异,以明确苹果轮纹病菌对戊唑醇可能的抗性机制,为科学指导生产用药提供理论依据。
当生物体遭遇逆境时,生物体内的苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、可溶性蛋白和酯酶同工酶等会相应地发生变化。一般认为,PAL活力与植物的抗逆性息息相关,当植物遇到逆境时苯丙烷类代谢被激活,PAL活性迅速上升,并表现出规律性的变化,其下游途径中的某些酶类的活性也升高[23]。对于丝状真菌的研究也有相似的结果:陈彦等[24]发现,葡萄白腐病菌的抗多菌灵菌株中的PAL活力始终高于敏感菌株,认为逆境条件可诱导病原菌体内的PAL活力升高。随后姜莉莉等[25]对草莓枯萎病的研究发现,抗多菌灵的菌株PAL活力也要高于敏感菌株。本研究中,苹果轮纹病菌敏感菌株TS1和抗性突变菌株UV-TS1-10体内的PAL活力随着药剂处理浓度的升高而升高,且抗性菌株的PAL活力均高于敏感菌株,与前人的研究相似;同时也表明了PAL这种胞内诱导酶,随着激发因子浓度增大,PAL基因的转录活性越高,PAL活力也更大[23]。对于本研究中,PAL活力在0~1.5 h表现为上升,1.5~24 h呈现下降的趋势,也与其他PAL活力研究结果相似:Song等[26]发现被丛枝菌根真菌(arbuscular mycorrhizal fungi)侵染的番茄植株,其PAL活力在侵染后18~48 h表现出上升,48 h以后下降,总体表现为先上升后下降;张晓晓等[27]使用UV-C照射苹果果实,其抗苹果灰霉病的能力提高的同时PAL活力也呈现出先上升后下降的趋势。究其原因可能与PAL是连接生物初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,所以在受到激发时PAL会首先作出反应,开启苯丙烷类代谢,随着时间的延长生物体逐渐适应,所以PAL活力下降。以上结果证明PAL活力与苹果轮纹病菌对戊唑醇的抗性相关,但机理还需进一步深入研究。
过氧化物酶(POD)是由微生物或植物产生的一类氧化还原酶,是以过氧化氢为电子受体催化底物氧化的酶,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。本研究结果中,随着戊唑醇对TS1和UV-TS1-10处理时间的延长,相同戊唑醇浓度下的POD活性呈现一直上升的趋势,且UV-TS1-10的POD活性比TS1的要高;相同处理时间下,戊唑醇浓度越高其POD活性越高,且抗性菌株POD活力高于敏感菌株。该结果与禾谷丝核菌和草莓枯萎病的抗戊唑醇菌株生理生化研究结果一致[22,25]。表明菌体为了防止膜脂的过氧化,通过提高参与膜保护酶活性来减轻逆境对细胞的损伤,这种保护性的酶就包括过氧化物酶。POD活性越高,消除氧自由基的能力越强,菌株抗逆性也越强。不断有研究指出过氧化物酶体系与病原菌的致病性息息相关[27-29],而且POD在微生物体内具有多种同工酶,POD同工酶的差异在一程度上反应菌体个体之间基因的差异,因此把它用做鉴定的指标,具有很好的参考价值[30]。所以在菌体持续受到戊唑醇的作用时,苹果轮纹病菌的POD活力一直呈现上升的趋势,也表明POD活力与苹果轮纹病菌株对戊唑醇的抗性有关,具体的影响还有待试验。
可溶性蛋白是以小分子的状态溶于水或其他溶剂的蛋白,其含量的增加是环境胁迫下菌丝渗透调节的重要手段。本研究中戊唑醇处理前期,苹果轮纹病菌可溶性蛋白的含量比较高,后期降低的原因可能是在戊唑醇的胁迫下,相关基因表达增加了菌体内的蛋白质含量,这与植物在逆境中可溶性蛋白含量的变化一致。在胁迫条件下,植物体内会产生抗性蛋白,随着胁迫强度和时间的增加,蛋白质合成酶活性下降,分解酶活性上升,最终导致可溶性蛋白含量的降低[31-32]。图3的结果也表明TS1和UV-TS1-10在不同浓度戊唑醇处理前后蛋白含量的变化不大,只是抗性菌株比敏感菌株的可溶性蛋白的含量高,也说明不同菌株可溶性蛋白的含量相对稳定,是鉴别不同菌株的可靠方法。
酯酶同工酶是催化酯类化合物水解酶的酶系,可以水解大量非生理存在的酯类化合物,因此有解毒作用,与抗性相关[33]。酯酶同工酶电泳是进行真菌分类、抗药性菌株监测及抗性机理研究的有效手段。前人研究发现[25],草莓枯萎病菌的抗戊唑醇突变体与敏感菌株的酯酶同工酶电泳图谱中,Rf=0.24的主酶带是抗性菌株中稳定存在而敏感菌株所缺少的,认为该酶带与草莓枯萎病菌的抗药性有关。夏晓明[22]在研究禾谷丝核菌时也有相似的结果。本研究在酯酶同工酶电泳图谱中,UV-TS1-10比TS1少了Rf=0.33的酶带,但是多了Rf=0.14的一条酶带,且酶带颜色最深,推测该酶带与抗药性可能存在相关性。与其他研究不同的是,本研究中酯酶同工酶电泳图谱中酶带数量很少,说明苹果轮纹病菌中该酶的多样性低,其主要原因还需进一步研究。
总之,与敏感菌株TS1相比,抗戊唑醇菌株UV-TS1-10的生理生化特性发生了显著变化,苯丙氨酸解氨酶、过氧化物酶、可溶性蛋白和酯酶同工酶等酶类的变化代表了蛋白质水平的差异,这种差异又是由基因的变异引起的,所以苹果轮纹病菌抗戊唑醇的抗性机制还需进一步深入研究。室内诱导的抗性菌株已经出现抗药性,生产中如果放任药剂的过量使用,抗性菌株的出现只是时间问题,因此科学、合理的田间用药是控制病原菌抗药性产生的首要方式。
[1] 康玲, 郝红梅, 杨振英, 等. 苹果轮纹病研究进展[J]. 中国农学通报, 2009, 25(9): 188-191.
[2] Tang W, Ding Z, Zhou Z Q, et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China isBotryosphaeriadothidea[J]. Plant Disease, 2012, 96(4): 486-496.
[3] 顾雪迎, 王洪凯, 郭庆元. 苹果、梨轮纹病研究进展[J]. 浙江农业科学, 2015, 56(8): 1242-1246.
[4] Ma Zhonghua, Michailides T J. Characterization ofBotryosphaeriadothideaisolates collected from pistachio and other plant hosts in California [J]. Phytopathology, 2002, 92(5): 519-526.
[5] 戴德江, 马海芹, 沈瑶, 等. 几种杀菌剂对山核桃干腐病的室内活性筛选与应用[J]. 农药, 2015, 54(3): 217-219.
[6] Smith H, Wingfield M J, Petrini O.Botryosphaeriadothideaendophytic inEucalyptusgrandisandEucalyptusnitensin South Africa [J]. Forest Ecology and Management, 1996, 89: 189-195.
[7] 徐成楠, 张红军, 迟福梅, 等. 蓝莓枝枯病菌Botryosphaeriadothidea的寄主范围研究[J]. 中国果树, 2015(2): 43-45.
[8] 周增强,冯贵馨,孟秀灵,等.戊唑醇及其复配剂防治苹果轮纹病的田间药效试验[J].中国农学通报,2003,19(1):114-116.
[9] 汪汉成,周明国, 张艳军, 等. 戊唑醇对立枯丝核菌的抑制作用及在水稻上的应用[J]. 农药学学报, 2007, 9(4): 357-362.
[10]祁之秋, 周明国. 戊唑醇对小麦纹枯病菌的抑菌作用[J]. 农药学学报, 2003, 5(3): 80-84.
[11]王雅玲, 杨代斌, 袁会珠, 等. 低温胁迫下戊唑醇和苯醚甲环唑种子包衣对玉米种子出苗和幼苗的影响[J]. 农药学学报, 2009, 11(1): 59-64.
[12]叶佳, 张传清. 葡萄炭疽病菌对甲基硫菌灵、戊唑醇和醚菌酯的敏感性检测[J]. 农药学学报, 2012, 14(1): 111-114.
[13]Leroux P, Albertini C, Gautier A, et al. Mutations in the CYP51 gene correlated with changes in sensitivity to sterol 14alpha-demethylation inhibitors in field isolates ofMycosphaereliagraminicola[J]. Pest Management Science, 2007, 63(7): 688-698.
[14]Hulvey J, Popko J T Jr, Sang H, et al. Overexpression of ShCYP51B and ShatrD inSclerotiniahomoeocarpaisolates exhibiting practical field resistance to a demethylation inhibitor fungicide [J]. Applied and Environmental Microbiology, 2012, 78(18): 6674-6682.
[15]Bolton M D, Birla K, Rivera-Varas V, et al. Characterization of CbCyp51 from field isolates ofCercosporabeticola[J]. Phytopathology, 2012, 102(3): 298-305.
[16]Johnson R C, Cantonwine E G.Post-infection activities of fungicides againstCercosporaarachidicolaof peanut (Arachishypogaea)[J]. Pest Management Science, 2014, 70(8): 1202-1206.
[17]Chen Fengping, Lin Dong, Wang Jingyuan, et al. Heterologous expression of theMoniliniafructicolaCYP51 (MfCYP51) gene inPichiapastorisconfirms the mode of action of the novel fungicide, SYP-Z048 [J]. Frontiers in Microbiology, 2015, 6: 457.
[18]范昆, 鲁宁琳, 李晓军, 等. 抗戊唑醇苹果轮纹病菌的紫外诱导及其生物学特性[J]. 农药学学报, 2012, 14(4): 383-390.
[19]Southerton S G, Deverall B J. Changes in phenylalanine ammonia-lyase and peroxidase activities in wheat cultivars expressing resistance to the leaf rust fungus [J]. Plant Pathology, 1990, 39(2): 223-230.
[20]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 164-165, 213-214.
[21]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dying binding [J]. Analytical Biochemistry, 1976, 72: 248-254.
[22]夏晓明.禾谷丝核菌(Rhizoctoniacerealis)对戊唑醇的抗性机制研究[D].泰安: 山东农业大学, 2006.
[23]徐晓梅, 杨曙光. 苯丙氨酸解氨酶研究进展[J]. 安徽农业科学, 2009, 37(31): 15115-15117.
[24]陈彦, 刘长远, 赵奎华, 等. 葡萄白腐病菌对多菌灵不同抗性菌株生理生化特性研究[J]. 辽宁农业科学, 2007(2): 63-64.
[25]姜莉莉, 王红艳, 夏晓明, 等. 草莓枯萎病菌抗戊唑醇突变体ZY-W的生理生化特性[J]. 农药学学报, 2012, 14(1): 42-50.
[26]Song Yuanyuan, Chen Dongmei, Lu Kai, et al. Enhanced tomato disease resistance primed by arbuscular mycorrhizal fungus [J]. Frontiers in Plant Science, 2015, 6: 786.
[27]张晓晓,周会玲,田蓉,等.短波紫外线照射对苹果采后灰霉病抗性诱导作用[J].食品科学,2015, 36(2):242-249.
[28]Papapostolou I, Georgiou C D.Superoxide radical is involved in the sclerotial differentiation of filamentous phytopathogenic fungi: identification of a fungal xanthine oxidase [J]. Fungal Biology, 2010, 114(5/6): 387-395.
[29]Kawasaki L, Aguirre J. Multiple catalase genes are differentially regulated inAspergillusnidulans[J]. Journal of Bacteriology, 2001, 183(4): 1434-1440.
[30]顾雯雯, 胡亚婷, 韩英, 等. 植物过氧化物酶同工酶的研究进展[J]. 安徽农业科学, 2014, 42(34): 12011-12013.
[31]Aremu D A, Ezomo O F, Meshitsuka S.Gene expression in primary cultured astrocytes affected by aluminum: alteration of chaperons involved in protein folding [J]. Environment Health and Preventive Medicine, 2011, 16(1): 16-24.
[32]Vassilev A, Lidon F.Cd-induced membrane damages and changes in soluble protein and free amino acid contents in young barley plants [J]. Emirates Journal of Food & Agriculture, 2011, 23(2): 130-136.
[33]乔传令, 王靖, 邢建民. 不同地区小菜蛾种群的抗药性及酯酶同工酶的研究[J]. 农药学学报, 2000, 2(4): 33-39.
(责任编辑:田 喆)
Physiological and biochemical characteristics of tebuconazole-resistant isolate ofBotryosphaeriadothideaUV-TS1-10
Fu Li, Qu Jianlu, Wu Haibin, Zhai Hao, Li Xiaojun, Fan Kun
(Shandong Institute of Pomology, Tai’an 271000, China)
A tebuconazole-resistant isolate ofBotryosphaeriadothidea, UV-TS1-10, was isolated by UV treatment of sensitive strain TS1, and its physiological and biochemical characteristics of phenylalanine ammonia lyase (PAL), peroxidase (POD), soluble protein contents and electrophoretic patterns of esterases were determined. The results showed that, when treated with different concentrations of tebuconazole for 0-24 h, the activity of PAL of UV-TS1-10 was higher than that of TS1 at all time.The value of PAL was increased firstly and peaked at 1.5 h, and then decreased. The values of POD in the two isolates were rising all the time, and reached the top at 24 h, and the difference between the two isolates reached the top at that time.The soluble protein content of UV-TS1-10 was 0.3 folds higher than that of TS1 and there was no difference for the same strain with different concentrations of tebuconazole. In the electrophoretic patterns of esterases, one characteristic band (Rf=0.33) was lost and a new one (Rf=0.14) was found in UV-TS1-10.As the result showed,the development of fungicide resistance was accompanied by the changes of the physiological and biochemical characteristics. The study of sensitive and resistant strains ofB.dothideahas great significance for formulating strategies of resistance management and monitoring resistance groups ofB.dothideain the field for the future.
Botryosphaeriadothidea; tebuconazole; resistant mutant; physiological and biochemical characteristics
2016-01-14
2016-03-07
山东省自然科学基金(ZR2013CQ040);泰安市科技攻关项目(201540699);山东省农业科学院青年科研基金(2016YQN32);山东省果树研究所所长基金
S 436.611.1
A
10.3969/j.issn.0529-1542.2016.06.007
* 通信作者 E-mail:kunstage@163.com

