蔬菜蚜虫抗药性现状及抗性治理策略
汤秋玲, 马康生, 高希武
(中国农业大学昆虫系, 北京 100193)
蔬菜蚜虫抗药性现状及抗性治理策略
汤秋玲, 马康生, 高希武*
(中国农业大学昆虫系, 北京 100193)
蚜虫是为害蔬菜作物的一类重要害虫,如不防治会给蔬菜生产造成重大经济损失。长期以来主要依靠使用农药防治蔬菜蚜虫,但由于化学农药的不合理使用,蔬菜蚜虫对有机磷、拟除虫菊酯、氨基甲酸酯、新烟碱等多种类型的杀虫药剂均产生了不同程度的抗性。本文对常见的蔬菜蚜虫的抗药性现状、抗药性机理以及治理策略进行了论述,以期为该类害虫的可持续控制提供参考。
蚜虫; 抗药性; 抗药性机制; 抗药性治理
蔬菜是一类以新鲜菜叶和果实为食用的作物的统称。蔬菜作物上的蚜虫统称蔬菜蚜虫,俗称蜜虫、腻虫,属半翅目(Hemiptera)蚜科(Aphididae),是蔬菜作物生产过程中的主要害虫。依据CNKI和Web of Science数据库检索结果,至2016年为害蔬菜的蚜虫种类约有30种(表1)。蔬菜蚜虫不仅以成虫、若虫群聚在蔬菜生长点、幼苗、嫩茎、嫩叶和叶背直接刺吸汁液为害,导致被害植株生长速率低、产生叶斑、发黄、发育不良、卷叶、产量降低、枯萎甚至死亡,同时通过分泌蜜露覆盖植物表面,导致霉菌滋生,光合作用降低以及传播病毒,间接造成蔬菜严重经济损失。由于蚜虫具有孤雌生殖和两性生殖方式、繁殖周期短、年世代数多、可周年发生、迁飞,非常适应蔬菜生长快、生育期短、复种指数高等特点,致使蔬菜蚜虫的发生危害严重。对蔬菜蚜虫的防治长期以来主要依赖于化学药剂,由此造成蔬菜田单位面积内用药剂量常常高于其他作物,蔬菜蚜虫承受着较大的药剂选择压,从而导致其抗性发生较快,抗性水平也较高。
目前,桃蚜(Myzuspersicae)、瓜蚜(Aphisgossypii)、萝卜蚜(Lipaphiserysimi)、甘蓝蚜(Brevicorynebrassicae)、大豆蚜(Aphisglycines)和豆蚜(Aphiscraccivora)等多种蔬菜蚜虫对有机磷、拟除虫菊酯、氨基甲酸酯、新烟碱等多种类型杀虫药剂已产生了不同程度的抗性。普遍产生的杀虫剂抗药性对有效防治蔬菜蚜虫提出了挑战,蔬菜蚜虫杀虫剂抗药性治理已成为亟待解决的问题。本文就蔬菜蚜虫的抗药性研究进展做一综述,以期为制定蔬菜蚜虫有效治理策略提供参考。
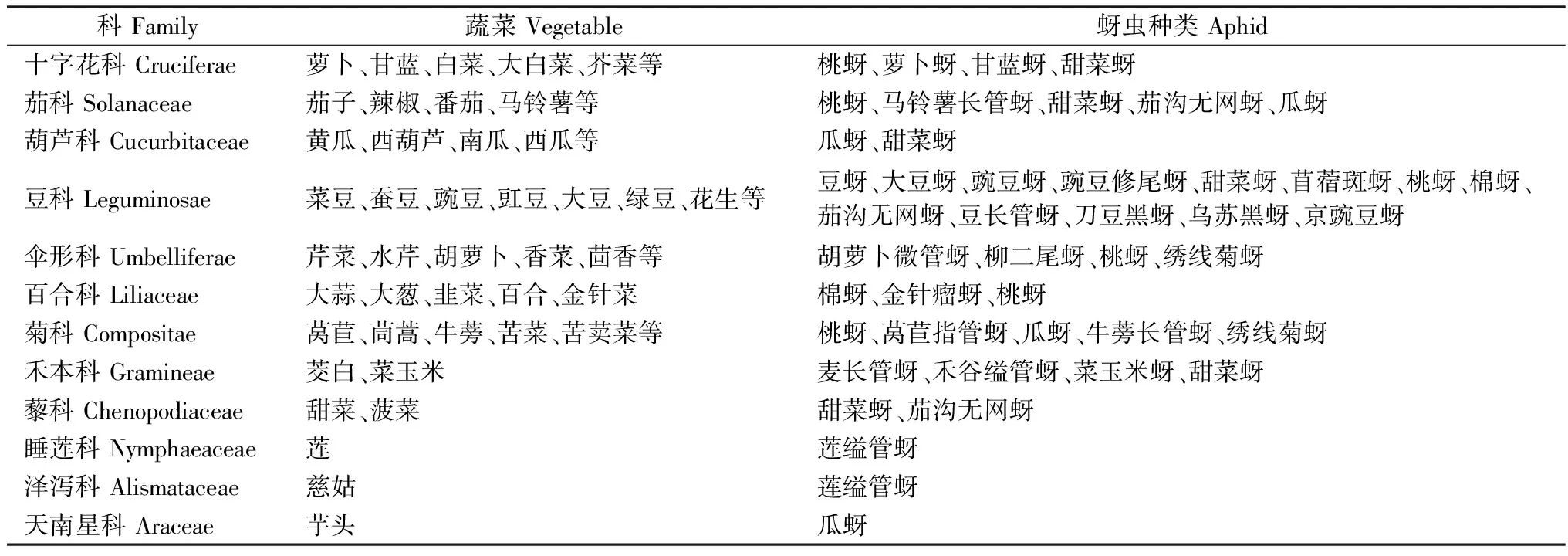
表1 蔬菜蚜虫及其寄主
1 蔬菜蚜虫抗药性现状
1.1 蔬菜蚜虫对有机磷类杀虫剂的抗性
有机磷类杀虫剂于20世纪50年代进入市场,多数属高毒或中等毒性杀虫药剂,少数为低毒。由于有机磷类杀虫剂杀虫谱广,且具有触杀、胃毒、熏蒸等多种杀虫方式的特点,该类杀虫剂在很长时间内被广泛用来防治蔬菜蚜虫。尽管有机磷类杀虫剂具有高效速杀性能,但由于长期大量单一使用,很快就有多种蔬菜蚜虫对其产生了严重的抗性。
早在20世纪六七十年代,就有报道发现蔬菜蚜虫对有机磷类杀虫剂产生了较高抗性。其中桃蚜对有机磷抗性的报道较多,在1966年,Dunn和Kempton[1]就发现桃蚜对内吸磷(demeton-methyl)已产生了25倍的抗性,此后就不断有桃蚜田间种群对有机磷杀虫剂产生了抗药性的报道[2-3]。在国内,自1990年起有大量报道发现桃蚜的有机磷类药剂抗药性。1991年,高希武等监测发现北京地区桃蚜种群对乐果、马拉硫磷、乙酰甲胺磷等有机磷杀虫剂均已产生不同程度的抗性[4]。研究发现,1986-1990年间,北京地区桃蚜对有机磷类药剂的抗性发展迅速,监测的4个桃蚜田间种群对有机磷类杀虫剂均产生了较高的抗性,其中对乐果、氧乐果、倍硫磷和马拉氧磷4种有机磷杀虫剂产生了100倍以上的抗性[5]。瓜蚜作为蔬菜作物上的一种重要害虫,早在1992年就有报道发现其田间种群对乐果、马拉硫磷和乙酰甲胺磷等有机磷杀虫剂产生了中等水平的抗药性[6]。此外,还有多种蔬菜蚜虫有机磷抗药性在田间被监测到,如陈根和吴刚在2005年对福州市菜缢管蚜(Lipaphiserysimi)(萝卜蚜)对有机磷农药抗性的监测发现,福州市菜缢管蚜对甲胺磷产生了54.1~56.5倍的抗性[7];2010年巴基斯坦甘蓝蚜田间种群对丙溴磷产生了中等水平抗性[8]。
1.2 蔬菜蚜虫对氨基甲酸酯类杀虫剂的抗性
1957年,第一种氨基甲酸酯类杀虫剂——甲萘威商品化使用。因该类药剂具有杀虫谱广、低毒、廉价等特点,因此,在甲萘威商品化后短短的几年时间内就相继有多种氨基甲酸酯类杀虫药剂问世,如涕灭威、灭多威、克百威、丁硫克百威等。与有机磷杀虫剂一样,氨基甲酸酯类杀虫剂被广泛用于蔬菜蚜虫的防治,但蔬菜蚜虫对该类药剂同样迅速产生了抗药性。
1977年,Devonshire等[9]对苏格兰桃蚜田间种群进行了生物测定,发现部分种群对氨基甲酸酯类药剂产生了中等水平抗性。同样在英国[10],发现桃蚜种群对抗蚜威(pirimicarb)和乙硫苯威(ethiofencarb)两种氨基甲酸酯类药剂产生了低水平抗性。20世纪90年代,我国报道发现桃蚜田间种群对氨基甲酸酯类药剂产生了不同水平的抗性,其中对抗蚜威的抗性高达为245倍,对灭多威也有39倍的抗性[4-5]。Umina等报道了澳大利亚桃蚜田间种群对杀虫药剂的抗药性情况,其中对氨基甲酸酯类药剂已产生了极高水平的抗性[11]。在国内,对2014年桃蚜田间种群的抗性监测结果表明,我国华南地区桃蚜对丁硫克百威和抗蚜威两种氨基甲酸酯类药剂表现出中等水平的抗药性,抗性倍数为8.1~28.0[12]。其他蔬菜蚜虫对氨基甲酸酯类药剂的抗药性也有报道,陈根和吴刚测定发现,福州地区菜缢管蚜对丁硫克百威产生了7~9倍的低水平抗性[7]。闫彦萍等[13]测定发现,山西省长治、晋中两个甘蓝蚜田间种群对灭多威产生了低水平抗性。
1.3 蔬菜蚜虫对拟除虫菊酯类杀虫剂的抗性
拟除虫菊酯类药剂是一类根据除虫菊素化学结构仿制而成的杀虫药剂,自20世纪七八十年代问世以来,被广泛应用于蔬菜蚜虫的防治。但很快也出现了抗药性问题,并且抗药性发展明显快于有机磷等药剂[14]。
早在1976年,Sawicki和Rice发现桃蚜室内种群对拟除虫菊酯类药剂产生了较高的抗药性[10],之后便有大量桃蚜田间种群拟除虫菊酯抗药性的报道。1986年,Choi和Kim发现在韩国桃蚜田间种群对氯氰菊酯和氰戊菊酯产生了抗药性[15]。此后,在我国、希腊、英国、法国、意大利等多个国家均发现桃蚜田间种群对拟除虫菊酯类药剂产生了多种水平的抗性[16-21]。除桃蚜外,在其他多种蔬菜蚜虫种群中,拟除虫菊酯抗药性也有不少报道。Carletto等发现茄子上的瓜蚜种群对氯氰菊酯产生了41.2倍的抗性[22]。Xi等筛选的大豆蚜室内种群对高效氯氰菊酯产生了76.67倍的抗药性[23]。陈青和卢芙萍报道海南豇豆蚜(Aphiscraccivora)对三氟氯氰菊酯和氰戊菊酯产生了不同程度的抗药性[24]。滕全利等报道发现,晋中地区甘蓝蚜对高效氯氰菊酯和氰戊菊酯两种拟除虫菊酯杀虫剂分别产生了14.34倍和83.33倍的抗药性[25]。总体来看,自从20世纪90年代产生抗药性以来,蔬菜蚜虫对拟除虫菊酯类药剂的抗药性水平普遍偏高。
1.4 蔬菜蚜虫对新烟碱类杀虫剂的抗性
新烟碱类杀虫药剂是一类重要的具有内吸特性的化学杀虫剂,对多数重要刺吸式口器害虫具有很高的防治效果,目前已在全世界范围内广泛使用。1991年,拜耳公司率先推出了第一个新烟碱类药剂吡虫啉,随后又相继开发出了烯啶虫胺、啶虫脒、噻虫嗪等一系列药剂。新烟碱类杀虫剂的使用在防治蔬菜蚜虫中起到了重要的作用,防治效果非常显著,但随着使用频率、年限的增加,在2000年左右,就有报道指出蔬菜蚜虫对该类药剂也产生了抗药性。
早在1996年,就有桃蚜对新烟碱类药剂敏感性降低的报道[26]。2004-2007年,美国东部多个桃蚜种群对吡虫啉产生了不同水平的抗药性,有部分桃蚜已产生中等水平的抗性[27]。Philippou等发现一个来自希腊的桃蚜品系(5191A)对吡虫啉产生了60倍的高水平抗性[21]。2009年,一个采自法国南部的桃蚜种群(FRC)对新烟碱类药剂产生了极高水平的抗性[28]。2005年以前在国内关于桃蚜对新烟碱类药剂的抗性报道较少,但之后,相关文献报道越来越多,桃蚜对新烟碱类药剂的抗性发展速度非常快。2009年,柏建等发现湖南桃蚜种群对吡虫啉已经产生34倍的抗性[29],之后山东、北京、辽宁和湖北等地的桃蚜种群对吡虫啉也产生了39~203倍抗性[30]。
2006年,闫彦萍等测定发现山西省长治甘蓝蚜种群仅对啶虫脒产生了低水平抗性,而晋中种群对吡虫啉和啶虫脒两种新烟碱类杀虫剂均产生了低水平抗性[13]。在大豆蚜上同样发现了新烟碱类杀虫剂抗药性,2010-2011年,杨帅对黑龙江哈尔滨、吉林长春、河北沧州、山东济南、内蒙古赤峰等5个地区的大豆蚜田间种群吡虫啉抗性进行了监测,发现除长春种群为低水平抗性外,其他4个地方种群对吡虫啉均产生了中等水平的抗性[31]。
1.5 蔬菜蚜虫对有机氯和环戊二烯类杀虫剂的抗性
有机氯和环戊二烯类杀虫剂,如DDT、六六六、硫丹、林丹等,曾在20世纪四五十年代被用于蔬菜蚜虫的防治。但由于其高残留毒性、难降解、对非靶标生物的高毒性等问题,在20世纪七八十年代就逐步被禁用,被随后迅速发展起来的有机磷类和氨基甲酸酯类药剂所取代。我国于1983年也正式停止了DDT和六六六的生产。因此关于蔬菜蚜虫对这两类药剂抗性的报道相对较少。
Wolfenbarger曾报道美国佛罗里达州马铃薯上的桃蚜对DDT和氯丹(chlordane)产生了抗药性[32]。1978年,Attia和Hamilton发现澳大利亚桃蚜种群对DDT产生了10~21倍的抗性[33]。柏建等发现湖南桃蚜种群对硫丹产生了12.3倍的抗性[29]。2010年,刘俊丽监测发现我国9个桃蚜田间种群对硫丹的抗性基本属于敏感或低水平抗性,抗性倍数介于1~9倍之间[17]。2014年,广东省5个桃蚜田间种群对硫丹产生了低至中等水平的抗药性,抗性倍数在3~18倍之间[34]。
1.6 蔬菜蚜虫对大环内酯双糖类药剂的抗性
生物源农药阿维菌素是一类具有杀虫、杀螨、杀线虫活性的十六元大环内酯双糖类化合物,自1996年在我国登记开始使用。因其具有广谱、高效、环境友好、作用机制独特及与其他药剂不易产生交互抗性等特点而广泛用于多种害虫的防治。这类药剂开始并未用于蚜虫防治,但是曾长期大量用于防治鳞翅目害虫,导致蔬菜蚜虫对阿维菌素及其衍生产品产生了抗药性。
陈根和吴刚[7]监测发现福建福州田间菜缢管蚜上街种群和建新种群分别对阿维菌素产生了中、高水平抗性。禾谷缢管蚜(Rhopalosiphumpadi)是茭白和菜玉米上的一类重要害虫,在河南和重庆田间禾谷缢管蚜已对阿维菌素产生了中等水平抗性[35]。此外,多种蔬菜蚜虫对阿维菌素的一个升级产品甲氨基阿维菌素苯甲酸盐(甲维盐)也产生了不同程度的抗性,例如湖南田间桃蚜种群和巴基斯坦田间甘蓝蚜种群均对甲维盐产生了高水平抗性[8, 29]。
2 蔬菜蚜虫的抗药性机制
虽然化学防治仍是蔬菜蚜虫防治的重要手段,但是随着蔬菜蚜虫杀虫剂抗药性的不断产生和提高,抗药性已成为限制蔬菜蚜虫有效防治的重要因素。因此,抗药性机制的研究显得尤为重要,对抗性机制的研究是解决蔬菜蚜虫抗药性及实现蔬菜蚜虫有效防控的基础。
蔬菜蚜虫抗药性研究表明,其抗药性机制主要涉及表皮穿透性降低、对药剂代谢能力增强、靶标敏感性降低等几个方面(表2),本文将主要从细胞色素P450、酯酶和谷胱甘肽S-转移酶等介导的代谢抗性和靶标抗性两方面进行论述。
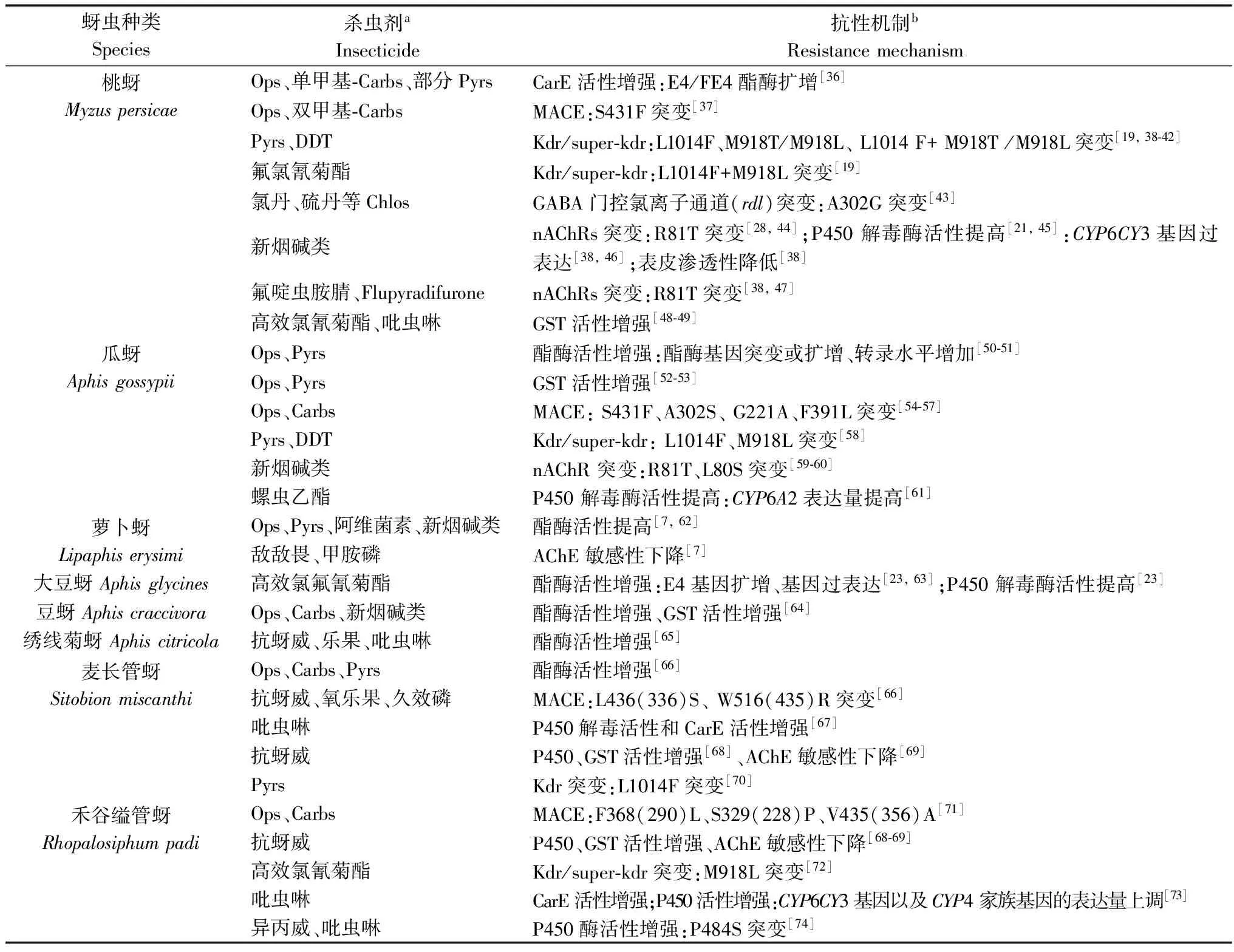
表2 蔬菜蚜虫抗药性机制1)
1)aOps:有机磷类;Carbs:氨基甲酸酯类;Pyrs:拟除虫菊酯类;Chlos:有机氯类。bCarE:羧酸酯酶;MACE:变构的乙酰胆碱酯酶;Kdr/super-kdr:击倒/超击倒抗性;GABA:γ-氨基丁酸;nAChRs:烟碱型乙酰胆碱受体;GST:谷胱甘肽S-转移酶;AChE:乙酰胆碱酯酶。
aOps:Organophosphorus;Carbs:Carbamates;Pyrs:Pyrethroids;Chlos:Organochlorine.bCarE:Carboxylesterase; MACE:Mutated acetylcholinesterase; Kdr/super-kdr:Knock down resistance/super knock down resistance; GABA:γ-aminobutyric acid; nAChRs: Nicotinic acetylcholine receptor; GST:GlutathioneS-transferase; AChE:Acetylcholinesterase.
2.1 细胞色素P450介导的抗药性
细胞色素P450(简称P450),是一类古老的超蛋白家族,广泛存在于几乎所有的生物体中。P450酶系是分布在细胞平滑内质网膜上的一种氧化酶系,能催化各种内源和外源化合物的氧化。P450对杀虫剂的代谢作用直接影响到昆虫对杀虫剂的耐受性,由P450介导的杀虫剂代谢解毒作用是许多昆虫对杀虫剂产生抗性的普遍机理[75]。
作为外源性化合物,杀虫剂进入昆虫体内后由解毒酶催化降解,而P450作为I相解毒酶在这一过程中起重要作用。P450介导的杀虫剂抗药性涉及基因转录上调、基因重复以及结构基因变异等多种分子机制。其中P450基因转录上调在蔬菜蚜虫杀虫剂抗药性报道中较为常见。研究表明,P450介导的解毒代谢在桃蚜对新烟碱类药剂的抗性中起重要作用[21, 45],而CYP6CY3基因的过表达是抗药性产生的关键[45]。Xi等研究发现,大豆蚜对高效氯氟氰菊酯抗性的产生同样与P450基因的上调表达有关[23]。Peng等研究表明,棉蚜对螺虫乙酯(spirotetramat)的抗性产生与CYP6A2的过表达有关[61]。
2.2 羧酸酯酶介导的抗药性
酯酶是昆虫体内一种重要的代谢酶系,可以通过水解酯键或与亲酯类结合,来降低有毒化合物毒性。目前,许多用于蔬菜蚜虫化学防治的杀虫剂,如有机磷类、氨基甲酸酯类、拟除虫菊酯类杀虫剂,其分子结构中都含有酯键,因此,蔬菜蚜虫杀虫剂抗药性与酯酶密切相关。羧酸酯酶(CarE)是作为昆虫体内重要的解毒酶系之一,能够催化水解含羧基酯键、酰胺键和硫酯键的化合物[31],在昆虫对杀虫剂的抗性中起重要作用。
Needham和Sawicki[76]1971年发现一个有机磷抗性桃蚜的酯酶对其模式底物α-乙酸萘酯(α-naphthyl acetate,α-NA)的水解能力增强,第一次将酯酶活性的改变与有机磷抗性相关联。Devonshire[9]于1977年发现桃蚜对有机磷药剂的抗性与羧酸酯酶活性确实有关,之后研究证实这是由酯酶基因扩增引起的抗性[77-78]。郑炳宗等[79]研究发现,瓜蚜(棉蚜)对拟除虫菊酯产生了抗药性,且其抗性机制与羧酸酯酶活性增加有关。随后,高希武和郑炳宗在研究几种杀虫剂对拟除虫菊酯的增效作用时发现,这些杀虫剂对桃蚜或瓜蚜羧酸酯酶的活性具有明显的抑制作用,且其抑制能力与对拟除虫菊酯的增效作用呈显著正相关,说明羧酸酯酶在桃蚜和瓜蚜对拟除虫菊酯抗性中起重要作用[4]。Cao等研究发现,棉蚜氧化乐果抗性品系羧酸酯酶活性明显高于敏感品系,同时发现棉蚜羧酸酯酶基因的过表达可能参与氧化乐果抗性机制的形成[50]。随后,Pan等发现在棉蚜马拉硫磷抗性品系中羧酸酯酶活性也明显高于敏感品系,进一步研究发现,羧酸酯酶基因拷贝数的增加和转录水平的提高可能在棉蚜马拉硫磷抗性形成中起重要作用[51]。此外,曹传旺等[80]利用荧光标记的溴氰菊酯和高效氯氰菊酯为底物,研究了棉蚜羧酸酯酶对这两种药剂的代谢情况。结果表明无论是棉蚜氧化乐果抗性品系,还是溴氰菊酯抗性品系,其羧酸酯酶对这两种荧光底物的代谢活性都高于敏感品系,说明棉蚜羧酸酯酶可能参与棉蚜对氯氰菊酯和氧化乐果抗药性的形成。此外,萝卜蚜和豆蚜对有机磷、拟除虫菊酯、阿维菌素和新烟碱类药剂的抗性产生与酯酶活性的增强有关[7, 62, 64]。
2.3 谷胱甘肽S-转移酶介导的抗药性
谷胱甘肽S-转移酶(GST)是一类具有多种生理功能的酶,能催化还原型谷胱甘肽与各种亲电化合物进行亲核加成反应,增强水溶性,进而将它们排出体外。因此,谷胱甘肽S-转移酶在昆虫杀虫剂抗性中有重要作用。已有不少报道发现GST在昆虫抗药性产生过程中起关键作用,其在昆虫有机磷、有机氯和拟除虫菊酯类杀虫剂抗药性形成过程中的作用尤为突出。
帅霞等[48]对桃蚜高效氯氰菊酯抗性品系和敏感品系谷胱甘肽S-转移酶活性的测定结果表明,抗性品系谷胱甘肽S-转移酶活性明显高于敏感品系,从而认为谷胱甘肽S-转移酶活性的增加与桃蚜抗性相关。陈亮等[49]研究认为,谷胱甘肽S-转移酶活性的增加是桃蚜吡虫啉抗性产生的主要机理。潘文亮等[52]研究发现,谷胱甘肽S-转移酶活力增强在棉蚜对吡虫啉的抗性中起重要作用。同样,郭天凤等[53]研究也表明,棉蚜吡虫啉和啶虫脒抗性品系谷胱甘肽S-转移酶活性明显高于敏感品系。
2.4 靶标抗性
靶标抗性是昆虫产生抗药性的重要机制,是由昆虫体内靶标部位对杀虫剂敏感度降低而引起的抗性。已知的靶标抗性,多数是由于靶标位点突变引起的。杀虫剂作用靶标主要有乙酰胆碱酯酶(acetylcholinesterase,AChE)、乙酰胆碱受体(acetylcholine receptor, AChR)、钠离子通道(sodium channel)、γ-氨基丁酸(gamma-aminobutyric acid,GABA)受体等,这些靶标敏感性的下降是害虫抗药性产生的重要机制。目前已经证实,AChE不敏感是造成有机磷和氨基甲酸酯类杀虫剂抗性的主要原因[81],钠离子通道不敏感造成昆虫对拟除虫菊酯和DDT的抗性[39-40, 82],而GABA受体不敏感则引起了昆虫对环二烯杀虫剂的抗性[83]。
乙酰胆碱酯酶(AChE),是一种丝氨酸水解酶,可以快速水解在突触间的神经递质乙酰胆碱,从而终止神经冲动的传导,是杀虫剂在神经系统中的主要靶标之一。乙酰胆碱酯酶变构引起的靶标抗性在多种蔬菜蚜虫中都有报道,如棉蚜乙酰胆碱酯酶(S431F和A302S突变等)敏感度降低导致棉蚜对毒死蜱、内吸磷、乐果、氧乐果、丁硫克百威、抗蚜威、灭多威等多种杀虫剂产生了抗药性[54, 56-57]。同样,桃蚜对抗蚜威和唑蚜威产生抗药性的机制为AChE靶标不敏感性,即变构的乙酰胆碱酯酶(S431F突变)引起的,变构的AChE导致桃蚜对抗蚜威产生了极高水平的抗性[81]。
钠离子通道是存在于大多数动物可兴奋细胞膜上的一种大分子糖基化蛋白,主要调控细胞膜钠离子的瞬时通透性,在细胞兴奋性的传导上具有重要作用,是拟除虫菊酯类杀虫剂的作用靶标。钠离子通道基因发生突变引起的杀虫剂抗药性在桃蚜、棉蚜等蔬菜蚜虫中多有报道,如研究发现,桃蚜钠离子通道IIS6跨膜区的L1014F和M918T突变是桃蚜对拟除虫菊酯类和DDT产生抗药性的主要原因[38-40]。
昆虫GABA受体是环戊二烯类药剂的主要作用靶标。虽然目前硫丹等环戊二烯类杀虫剂已被淘汰,但由于历史积累及此类药剂的高残留活性,使得桃蚜对此类药剂仍然产生了抗药性[84]。桃蚜对硫丹等环戊二烯类药剂的抗性是由于一个GABA受体亚基(resistance to dieldrine, rdl)的302位丙氨酸被丝氨酸或甘氨酸替代,进而导致GABA受体不敏感所引起。
3 蔬菜蚜虫抗性治理策略
抗性治理的目的是保持害虫对杀虫剂的敏感性,达到低剂量的药剂控制其危害[85]。目前,抗性治理有多种策略,其中基本的策略是适度治理、饱和治理和多向进攻治理等三种。在杀虫剂抗性治理中这些治理策略单独使用很难达到治理目标,通常是两种或多种策略同时使用。适度治理主要措施有:采用比较低的施药剂量,使害虫种群保留一定比例的敏感基因型,尽量减少施药次数,选用残效较短的化合物,避免用缓释剂,主要针对成虫施药,进行局部施药或保留不处理的“庇护区”,留下不用药剂处理的世代和种群,尽量提高施药害虫种群的阈限,通过利用种群中抗性个体的适合度低于敏感个体的条件来保持害虫的敏感性,从而延缓抗性的发展。饱和治理主要措施是采用高水平的施药技术,使大剂量药剂施于靶标害虫,消灭害虫种群中抗性遗传上的杂合子,达到延缓抗性发生发展的目的或者采取低剂量的药剂与增效剂混用达到这一目的。在实施饱和治理措施时,一般在每次施药以后,要有对杀虫剂敏感的个体迁入防治区,才能达到延缓抗性发生发展的目的。多向进攻治理主要是根据毒物对生物的多位点作用,使靶标不易产生抗性,然而要求一个化合物具有多位点作用机制相当困难,但可将几个独立作用机制的化合物混用或轮用来实现。
3.1 加强蔬菜蚜虫抗性监测,合理选用杀虫剂
抗性监测是诊断蔬菜蚜虫抗药性是否产生、发生程度,判断已实施的抗性治理措施是否有效的最简单有效的手段,监测的结果直接关系到蔬菜蚜虫综合治理体系和抗性治理策略的制定。蔬菜蚜虫的抗性治理的主要关键点是要对早期抗性水平进行监测和评估,并以此来指导杀虫剂的使用。
3.2 作用机制不同或负交互抗性的药剂的混合使用
杀虫剂的混用就是利用一组具有独立作用机制的化合物,形成多位点作用机制,其中任何一个化合物的选择压力都将低于抗性发展的要求而达到防治害虫的目的。在杀虫剂混用中,一种组分不能杀死的个体将被另一组分杀死,因为对所有杀虫剂都具有抗性的个体的可能性几乎是不存在的。此外,负交互抗性的药剂轮用、混用是病虫害抗性治理最理想的途径。但目前通过生产实践的验证具有负交互抗性的药剂较少。
同时杀虫剂混用时应遵循以下原则:混用的各组分之间作用机制应彼此不同;害虫对混用中的每一组分抗性机制应该是不同的;混用的各组分残效期近似相等,否则残效期过长的组分在后期形成单一药剂的选择作用,可能会造成选择压力不平衡失去混用的意义;抗性基因存在于种群中的不同个体中,一般要求混用在害虫种群形成抗性之前或初期使用,等到抗性产生以后再混配就已经晚了。
3.3 作用机制不同的药剂交替使用或轮用
杀虫剂轮用延缓抗性的理论基础是害虫种群中,抗性是作为在杀虫剂存在条件下“瞬间进化”的结果,由于抗性基因与生存上的劣势连锁在一起,所以一旦杀虫剂选择压力消失时,抗性个体的生存适应性要比敏感个体低,以至于抗性个体在种群中的频率下降,抗性水平下降。杀虫剂轮用对于治理抗性能否成功的关键是轮用的间隔期,一般要求在害虫种群对该药剂的抗性消失以后才能启用,抗性消失需要的时间,也就是轮用的间隔期。间隔期的长短与害虫种群对抗性的遗传有直接关系。杀虫剂轮用需要注意的事项有:轮用和混用,要求所用化合物彼此不受交互抗性影响;应选用不同作用机制类型的杀虫剂,以免形成交互抗性;药剂间轮用时间间隔问题;杀虫剂轮用也应该在早期就开始实行,以避免由于遗传重组使抗性基因与生存上的劣势发生分离。
此外,杀虫剂的轮用或混用还可以通过分区施药来实现,就是在一个防治区内分成不同的小区,各小区分别施用作用机制不同的药剂。假如有A和B两个区,如果施药以后,在A区不能杀死的害虫在当代迁移到B区,被B区的杀虫药剂杀死,或向其他区扩散,这时分区施药的作用在功能上相当于杀虫剂混用;如果在施药以后,在A区内存活下来的个体不在当代扩散,而是发育完一个世代后,在下一代再扩散到B区,被B区的药剂杀死,在这种情况下分区施药的功能与杀虫剂轮用相同。
3.4 用增效剂抑制害虫的解毒机制
增效剂是一类本身对害虫没有生物活性或活性较低的化合物,但增效剂进入虫体以后可以抑制与代谢抗性有关的解毒酶活性,因此可以消除因代谢抗性机制产生的抗性,从而达到提高药效,减少用药量的目的。例如抑制抗性蚜虫体内多功能氧化酶的胡椒基丁醚(PBO)。杀虫药剂中加入一定量的芝麻油可起到增效作用,因为芝麻油含有主要增效成分芝麻素可抑制抗性蚜虫体内的多功能氧化酶。
3.5 有害生物综合治理
有害生物综合治理的防治策略为减少农药的选择压力提供了极为有利的条件,因此蔬菜蚜虫的抗性治理应该遵循有害生物综合治理的原则和策略,通过充分发挥农业、生物、物理、机械等非化学防治方法的作用,尽可能地减少药剂的使用,在必要的时候,通过科学使用化学药剂,将虫害控制在经济允许水平之下。具体措施包括:(1)农业防治:栽培前清除田间地头杂草,加强肥水管理,蔬菜采收后及时清除田间残株败叶并集中带出田外销毁;(2)生物防治:利用和保护蚜茧蜂、蚜小蜂、跳小蜂等寄生性天敌及瓢虫、食蚜蝇等捕食性天敌进行防治;(3)物理防治:利用黄板诱蚜,利用银灰色驱蚜;(4)化学防治:科学选用化学药剂进行防治。
此外,由于蔬菜蚜虫具有生活史短、可营孤雌生殖、世代重叠严重、种群数量大等特点,使得蔬菜蚜虫极易接触到药剂,易形成抗药性。因此,在蔬菜蚜虫化学防治实践中,一定要坚持抗性治理原则:(1)尽可能地将目标种群的抗性基因频率控制在最低水平,以利于延缓或防止抗性的产生;(2)选择最佳药剂配套使用方案,包括各类药剂、混剂和增效剂的搭配使用,避免长期单一持续使用同一种药剂;(3)选择每种药剂的最佳使用方法和时间,严格控制施药次数,从而获得最好的防治效果和最低的选择压力;(4)实行综合防治,尽可能降低种群中抗性纯合子和杂合子个体的比率及其适合度;(5)尽可能减少对非靶标生物的影响,避免破坏生态平衡,造成害虫的再猖獗。
4 展望
目前,蔬菜蚜虫抗性治理中,最方便有效的措施仍然是更换新型杀虫剂。但开发一种新药需要大量的人力物力,且开发周期较长,然而抗药性的产生往往只需短短的几年时间。因此,在杀虫剂抗性治理的实践中,要充分利用现有的杀虫剂,以多样化的形式对蔬菜蚜虫进行防治,以防止或延缓蚜虫抗药性的产生。对于蚜虫的化学防治重要的是针对蚜虫种类以及对药剂敏感度选择正确的药剂品种、合适的施药剂量以及合适的施药时期。在蔬菜蚜虫抗性治理的过程中,除了要坚持抗性治理原则制定科学合理的用药计划外,还要制定针对不同蚜虫种类的抗性水平系统监测计划;同时,要结合农业防治、物理防治和生物防治等方法,使杀虫药剂对蔬菜蚜虫的选择压有所降低,从而延缓抗性的产生和发展,以达到生态环境的平衡和农业可持续发展。
[1] Dunn J A, Kempton D P. Non-stable resistance to demeton-methyl in a strain ofMyzuspersicae[J]. Entomologia Experimentalis et Applicata, 1966, 9: 67-73.
[2] Hamilton J T, Attia F I.Myzuspersicae(Sulzer)-strains resistant to demeton-S-methyl and dimethoate in australia [J]. Journal of the Australian Entomological Society, 1978, 17: 63-64.
[3] Harding J A. Green peach aphid homoptera-aphididae field trials with newer insecticides on cabbage and spinach [J]. Journal of Economic Entomology, 1973,66: 459-460.
[4] 高希武, 郑炳宗, 曹本钧. 北京地区桃蚜抗药性研究初报[J]. 农药, 1991, 30(2): 37-39.
[5] 高希武, 郑炳宗, 曹本钧. 桃蚜对有机磷和氨基甲酸酯抗性机制研究[J]. 植物保护学报, 1992, 19(4): 365-371.
[6] 吴世昌, 郑惠忠, 沈忠良,等.上海地区瓜蚜的抗药性和治理对策[J]. 上海农业学报, 1992, 8(4): 53-57.
[7] 陈根, 吴刚. 福州地区菜缢管蚜抗药性监测及其生化机制[J]. 福建农林大学学报(自然科学版), 2005, 34(2): 204-207.
[8] Ahmad M, Akhtar S. Development of insecticide resistance in field populations ofBrevicorynebrassicae(Hemiptera: Aphididae) in Pakistan [J]. Journal of Economic Entomology, 2013, 106: 954-958.
[9] Devonshire A L. The properties of a carboxylesterase from the peach-potato aphid,Myzuspersicae(Sulz.), and its role in conferring insecticide resistance[J]. Biochemical Journal, 1977, 167(3): 675-683.
[10]Sawicki R M, Rice A D. Response of susceptible and resistant peach-potato aphidsMyzuspersicae(Sulz.) to insecticides in leaf-dip bioassays [J]. Pesticide Science, 1978, 9: 513-516.
[11]Umina P A, Edwards O, Carson P, et al. High levels of resistance to carbamate and pyrethroid chemicals widespread in AustralianMyzuspersicae(Hemiptera: Aphididae) Populations [J]. Journal of Economic Entomology, 2014, 107: 1626-1638.
[12]张平艳, 周小毛. 华南地区桃蚜对7种杀虫剂的抗药性研究[J]. 广东农业科学, 2014(10): 81-84.
[13]闫彦萍,王海荣,韩巨才.山西甘蓝蚜对7种杀虫剂的抗性监测[J]. 安徽农业科学, 2006, 34(18): 4684-4685.
[14]梁彦, 张帅, 邵振润, 等. 棉蚜抗药性及其化学防治[J]. 植物保护, 2013, 39(5): 70-80.
[15]Choi S Y, Kim G H. Studies of insecticide resistance in the green peach aphid,Myzuspersicae(Sulzer). (4.) Oxydemeton-methyl resistance development, cross resistance and esterase isozymes[J]. Korean Journal of Plant Protection, 1986, 25: 151-157.
[16]高希武, 郑炳宗, 曹本钧. 北京及河北廊坊地区桃蚜对拟除虫菊酯类杀虫剂抗性研究[J]. 农药, 1993, 32(2): 8-9, 14.
[17]刘俊丽. 我国桃蚜抗药性机制及检测[D]. 北京:中国农业大学,2010.
[18]Criniti A, Mazzoni E, Cassanelli S, et al. Biochemical and molecular diagnosis of insecticide resistance conferred by esterase, MACE, kdr and super-kdr based mechanisms in Italian strains of the peach potato aphid,Myzuspersicae(Sulzer)[J]. Pesticide Biochemistry and Physiology, 2008, 90: 168-174.
[19]Fontaine S, Caddoux L, Brazier C, et al. Uncommon associations in target resistance among French populations ofMyzuspersicaefrom oilseed rape crops[J]. Pest Management Science, 2011,67: 881-885.
[20]Nauen R, Elbert A. European monitoring, of resistance to insecticides inMyzuspersicaeandAphisgossypii(Hemiptera: Aphididae) with special reference to imidacloprid [J]. Bulletin of Entomological Research, 2003, 93: 47-54.
[21]Philippou D, Field L, Moores G. Metabolic enzyme (s) confer imidacloprid resistance in a clone ofMyzuspersicae(Sulzer) (Hemiptera: Aphididae) from Greece[J]. Pest Management Science, 2010, 66: 390-395.
[22]Carletto J, Martin T, Vanlerberghe-Masutti F, et al. Insecticide resistance traits differ among and within host races inAphisgossypii[J]. Pest Management Science, 2010, 66: 301-307.
[23]Xi Jinghui, Pan Yiou, Bi Rui, et al. Elevated expression of esterase and cytochrome P450 are related with lambda-cyhalothrin resistance and lead to cross resistance inAphisglycinesMatsumura [J]. Pesticide Biochemistry and Physiology, 2015, 118: 77-81.
[24]陈青,卢芙萍.海南豇豆蚜对敌敌畏、三氟氯氰菊酯、辛硫磷和氰戊菊酯的敏感性测定[J].中国农学通报,2009,25(13):179-181.
[25]藤全利, 王海荣, 史晓晶, 等. 晋中地区甘蓝蚜对杀虫剂的敏感性变化及药剂混配的增效作用[J]. 山西农业大学学报(自然科学版), 2007, 27(2): 193-195.
[26]Nauen R, Strobel J, Tietjen K, et al. Aphicidal activity of imidacloprid against a tobacco feeding strain ofMyzuspersicae(Homoptera: Aphididae) from Japan closely related toMyzusnicotinateand highly resistant to carbamates and organophosphates [J]. Bulletin of Entomological Research, 1996, 86: 165-171.
[27]Srigiriraju L, Semtner P J, Bloomquist J R. Monitoring for imidacloprid resistance in the tobacco-adapted form of the green peach aphid,Myzuspersicae(Sulzer) (Hemiptera: Aphididae), in the eastern United States [J]. Pest Management Science, 2010, 66: 676-685.
[28]Slater R, Paul V L, Andrews M, et al. Identifying the presence of neonicotinoid resistant peach-potato aphid (Myzuspersicae) in the peach-growing regions of southern France and northern Spain[J]. Pest Management Science, 2012, 68: 634-638.
[29]柏建, 周小毛, 方勇. 桃蚜抗药性监测[J]. 农药研究与应用, 2009,13(6): 27-29.
[30]管嵩. 我国五省区桃蚜抗药性检测及对高效氯氰菊酯抗性研究[D]. 北京:中国农业大学, 2010.
[31]杨帅. 大豆蚜对吡虫啉的抗性监测及抗性机理研究[D]. 哈尔滨:东北农业大学, 2012.
[32]Wolfenbarger D O. Brief history of aphid control on potatoes in south Florida, 1946-59[J]. Journal of Economic Entomology, 1960, 53: 403-405.
[33]Attia F I, Hamilton J T. Insecticide resistance inMyzuspersicae(Homoptera: Aphididae) in Australia [J]. Journal of Economic Entomology, 1978, 71: 851-853.
[34]张平艳. 桃蚜抗药性监测及对噻虫嗪的抗性生化机制研究[D]. 长沙:湖南农业大学, 2014.
[35]Zuo Yayun, Wang Kang, Zhang Meng, et al. Regional susceptibilities ofRhopalosiphumpadi(Hemiptera: Aphididae) to ten insecticides [J]. Florida Entomologist, 2016, 99: 269-275.
[36]Devonshire A L, Field L M, Foster S P, et al. The evolution of insecticide resistance in the peach-potato aphid,Myzuspersicae[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 1998, 353: 1677-1684.
[37]Nabeshima T, Kozaki T, Tomita T, et al. An amino acid substitution on the second acetylcholinesterase in the pirimicarb-resistant strains of the peach potato aphid,Myzuspersicae[J]. Biochemical and Biophysical Research Communications, 2003, 307(1): 15-22.
[38]Bass C, Puinean A M, Zimmer C T, et al. The evolution of insecticide resistance in the peach potato aphid,Myzuspersicae[J]. Insect Biochemistry and Molecular Biology, 2014, 51(1376): 41-51.
[39]Martinez-Torres D, Devonshire A L, Williamson M S. Molecular studies of knockdown resistance to pyrethroids: Cloning of domain II sodium channel gene sequences from insects [J]. Pesticide Science, 1997, 51: 265-270.
[40]Martinez-Torres D, Foster S P, Field L M, et al. A sodium channel point mutation is associated with resistance to DDT and pyrethroid insecticides in the peach-potato aphid,Myzuspersicae(Sulzer) (Hemiptera: Aphididae) [J]. Insect Molecular Biology, 1999, 8: 339-346.
[41]Eleftherianos I G, Foster S P, Williamson M S, et al. Behavioural consequences of pyrethroid resistance in the peach-potato aphid,Myzuspersicae(Sulzer)[C]∥The BCPC Conference: Pests and diseases, Volumes 1 and 2. Proceedings of an international conference held at the Brighton Hilton Metropole Hotel, Brighton, UK, 18-21 November 2002. 2002: 745-748.
[42]Eleftherianos I, Foster S P, Williamson M S, et al. Characterization of the M918T sodium channel gene mutation associated with strong resistance to pyrethroid insecticides in the peach-potato aphid,Myzuspersicae(Sulzer)[J]. Bulletin of Entomological Research, 2008, 98(2): 183-191.
[43]Ffrench-constant R H, Anthony N, Aronstein K, et al. Cyclodiene insecticide resistance: from molecular to population genetics[J]. Annual Review of Entomology, 2000, 45(1): 449-466.
[44]Bass C, Puinean A M, Andrews M, et al. Mutation of a nicotinic acetylcholine receptor β subunit is associated with resistance to neonicotinoid insecticides in the aphidMyzuspersicae[J]. BMC Neuroscience, 2011, 12(1): 1-11.
[45]Puinean A M, Foster S P, Oliphant L, et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphidMyzuspersicae[J]. PLoS Genetics, 2010, 6(6): e1000999.
[46]Bass C, Zimmer C T, Riveron J M, et al. Gene amplification and microsatellite polymorphism underlie a recent insect host shift [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(48): 19460-19465.
[47]Cutler P, Slater R, Edmunds A J, et al. Investigating the mode of action of sulfoxaflor: a fourth-generation neonicotinoid[J]. Pest Management Science, 2013, 69(5): 607-619.
[48]帅霞, 王进军, 任艺, 等. 桃蚜的抗性选育及其两种解毒酶活性研究[J]. 西南农业学报, 2005, 18(3): 264-268.
[49]陈亮, 吴兴富, 陈若霞, 等. 桃蚜抗吡虫啉品系和敏感品系某些生物学特性比较[J]. 昆虫知识, 2006, 43(4): 504-508.
[50]Cao Chuanwang, Zhang Jing, Gao Xiwu, et al. Overexpression of carboxylesterase gene associated with organophosphorous insecticide resistance in cotton aphids,Aphisgossypii(Glover) [J]. Pesticide Biochemistry and Physiology, 2008, 90(3): 175-180.
[51]Pan Yiou, Guo Huilin, Gao Xiwu. Carboxylesterase activity, cDNA sequence, and gene expression in malathion susceptible and resistant strains of the cotton aphid,Aphisgossypii[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2009, 152(3): 266-270.
[52]潘文亮, 党志红, 高占林. 棉蚜抗吡虫啉品系和敏感品系主要解毒酶活性比较[J]. 昆虫学报, 2003, 46(6): 793-796.
[53]郭天凤, 史雪岩, 高希武,等. 棉蚜吡虫啉、啶虫脒不同品系解毒酶活性测定和增效剂作用的研究[J]. 环境昆虫学报, 2014, 36(3): 388-394.
[54]Moores G D, Gao X, Denholm I, et al. Characterisation of insensitive acetylcholinesterase in insecticide-resistant cotton aphids,AphisgossypiiGlover (Homoptera: Aphididae)[J]. Pesticide Biochemistry and Physiology, 1996, 56(2): 102-110.
[55]Li Fei, Han Zhaojun. Mutations in acetylcholinesterase associated with insecticide resistance in the cotton aphid,AphisgossypiiGlover [J]. Insect Biochemistry and Molecular Biology, 2004, 34(4): 397-405.
[56]Andrews M C, Callaghan A, Field L M, et al. Identification of mutations conferring insecticide-insensitive AChE in the cotton-melon aphid,AphisgossypiiGlover [J]. Insect Molecular Biology, 2004, 13(5): 555-561.
[57]Lokeshwari D, Krishna Kumar N K, Manjunatha H. Multiple mutations on the second acetylcholinesterase gene associated with dimethoate resistance in the melon aphid,Aphisgossypii(Hemiptera: Aphididae)[J]. Journal of Economic Entomology, 2016, 109: 887-897.
[58]Marshall K L, Moran C, Chen Y. Detection of kdr pyrethroid resistance in the cotton aphid,Aphisgossypii(Hemiptera: Aphididae), using a PCR-RFLP assay [J]. Journal of Pesticide Science, 2012, 37(2): 169-172.
[59]Koo H N, An J J, Park S E, et al. Regional susceptibilities to 12 insecticides of melon and cotton aphid,Aphisgossypii(Hemiptera: Aphididae) and a point mutation associated with imidacloprid resistance [J]. Crop Protection, 2014, 55(1): 91-97.
[60]Ju I K, Min K, Kim G H, et al. Two mutations in nAChR beta subunit is associated with imidacloprid resistance in theAphisgossypii[J]. Journal of Asia-Pacific Entomology, 2015, 18(2): 291-296.
[61]Peng Tianfei, Pan Yiou, Yang Chen, et al. Over-expression ofCYP6A2, is associated with spirotetramat resistance and cross-resistance in the resistant strain ofAphisgossypiiGlover [J]. Pesticide Biochemistry and Physiology, 2016, 126: 64-69.
[62]唐振华, 庄佩君, 韩启发,等. 上海地区菜缢管蚜对有机磷的抗药性及其生化检测[J]. 植物保护学报, 1988, 15(1): 63-66.
[63]张桦. 抗高效氯氟氰菊酯大豆蚜羧酸酯酶生化及分子机制研究[D]. 长春:吉林大学, 2013.
[64]Fouad E A, Abou-Yousef H M, Abdallah I S, et al. Resistance monitoring and enzyme activity in three field populations of cowpea aphid (Aphiscraccivora) from Egypt [J]. Crop Protection, 2016, 81: 163-167.
[65]Smirle M J, Zurowski C L, Lowery D T, et al. Relationship of insecticide tolerance to esterase enzyme activity inAphispomiandAphisspiraecola(Hemiptera: Aphididae)[J]. Journal of Economic Entomology, 2015, 103(2): 374-378.
[66]Chen Maohua, Han Zhaojun. Cloning and sequence analysis of 2 different acetylcholinesterase genes inRhopalosiphumpadiandSitobionavenae[J]. 2006, 49(3): 239-243.
[67]邱高辉, 姚远, 韩召军. 麦长管蚜对吡虫啉的抗性机理研究[J]. 南京农业大学学报, 2008, 31(2): 67-70.
[68]Lu Y, Gao X. Multiple mechanisms responsible for differential susceptibilities ofSitobionavenae(Fabricius) andRhopalosiphumpadi(Linnaeus) to pirimicarb [J]. Bulletin of Entomological Research, 2009, 99(6): 611-617.
[69]Lu Y H, He Y P, Gao X W. Comparative studies on acetylcholinesterase characteristics between the aphids,SitobionavenaeandRhopalosiphumpadi[J]. Journal of Insect Science, 2012, 13(9): 302-311.
[70]Foster S P, Paul V L, Slater R, et al. A mutation (L1014F) in the voltage-gated sodium channel of the grain aphid,Sitobionavenae, is associated with resistance to pyrethroid insecticides [J]. Pest Management Science, 2014, 70(8): 1249-1253.
[71]Chen Maohua, Han Zhaojun, Qiao Xianfeng, et al. Mutations in acetylcholinesterase genes ofRhopalosiphumpadiresistant to organophosphate and carbamate insecticides [J]. Genome, 2007, 50(2): 172-179.
[72]左亚运. 禾谷缢管蚜抗药性监测及其对高效氯氰菊酯的抗药性机理初步研究[D]. 杨凌:西北农林科技大学, 2015.
[73]张蒙. 禾谷缢管蚜对吡虫啉的抗性及其机理研究[D]. 杨凌:西北农林科技大学, 2016.
[74]Wang K, Peng X, Zuo Y, et al. Molecular cloning, expression pattern and polymorphisms of NADPH-cytochrome p450 reductase in the bird cherry-oat aphidRhopalosiphumpadi(L.)[J]. PLoS ONE, 2016, 11(4): e0154633.
[75]Scott J G. Cytochromes P450 and insecticide resistance [J]. Insect Biochemistry and Molecular Biology, 1999, 29: 757-777.
[76]Needham P H, Sawicki R M. Diagnosis of resistance to organophosphorus insecticides inMyzus-persicae(Sulz)[J]. Nature, 1971,230: 125-126.
[77]Devonshire A L, Sawicki R M. Insecticide-resistantMyzus-persicaeas an example of evolution by gene duplication [J]. Nature, 1979, 280: 140-141.
[78]Field L M, Devonshire A L, Forde B G. Molecular evidence that insecticide resistance in peach potato aphids (Myzus-persicaeSulz.) results from amplification of an esterase gene [J]. Biochemical Journal, 1988, 251: 309-312.
[79]郑炳宗, 高希武, 王政国, 等. 北京及河北省北部瓜-棉蚜对拟除虫菊酯抗药性的研究初报[J]. 植物保护学报, 1988, 15(1): 55-59.
[80]曹传旺, 史雪岩, 姜辉, 等. 运用α-氰代酯荧光底物检测抗性棉蚜羧酸酯酶代谢活性[J]. 昆虫学报, 2009, 52(3): 261-266.
[81]Moores G D, Devine G J, Devonshire A L. Insecticide-insensitive acetylcholinesterase can enhance esterase-based resistance inMyzuspersicaeandMyzusnicotiana[J]. Pesticide Biochemistry and Physiology, 1994, 49: 114-120.
[82]Foster S P. Knock-down resistance (kdr) to pyrethroids in peach-potato aphids (Myzuspersicae) in the UK: a cloud with a silver lining?[C]∥The BCPC Conference: Pests and diseases, Volume 1-3. Proceedings of an international conference held at the Brighton Hilton Metropole Hotel, Brighton, UK, 13-16 November 2000. 2000: 487-490.
[83]Anthony N, Unruh T, Ganser D, et al. Duplication of the Rdl GABA receptor subunit gene in an insecticide-resistant aphid,Myzuspersicae[J]. Molecular and General Genetics, 1998, 260: 165-175.
[84]Unruh T, Knight A, Bush M R. Green peach aphid (Homoptera: Aphididae) resistance to endosulfan in peach and nectarine orchards in Washington State [J]. Journal of Economic Entomology, 1996, 89: 1067-1073.
[85]Georghiou G P, Mellon R B. Pest resistance to pesticide [M]. New York: Plenum Press, 1983.
(责任编辑:田 喆)
Current status and management strategies of insecticide resistance in aphids on the vegetable crops
Tang Qiuling, Ma Kangsheng, Gao Xiwu
(Department of Entomology, China Agricultural University, Beijing 100193, China)
Vegetables are important economic crops and the aphids are a group of important insect pests that cause great losses in vegetable production. The application of insecticides is an important means for controlling the aphids on vegetable crops. However, because of irrational application of insecticides, many aphid species on vegetable crops have developed strong resistance to most of commonly used insecticides, such as organophosphate, pyrethroid, carbamate and neonicotinoid insecticides. In the present review, the current status of insecticide resistance and resistance mechanisms of aphids on vegetable crops were reviewed. In addition, the strategies for insecticides resistance management in these aphids were summarized. The review could provide useful information for the sustainable control of aphid pests on vegetable crops.
aphids; insecticide resistance; resistance mechanism; resistance management
2016-10-09
2016-10-18
国家自然科学基金重点项目(31330064)
S 481.4
A
10.3969/j.issn.0529-1542.2016.06.002
* 通信作者 E-mail:gaoxiwu@263.net.cn

