212例头颈部恶性肿瘤患者HTR3B基因多态性与化疗后出现恶心呕吐的关系
曹家燕,陈昌连,张瑞,李红,吴延升
(天津医科大学肿瘤医院,天津300060)
212例头颈部恶性肿瘤患者HTR3B基因多态性与化疗后出现恶心呕吐的关系
曹家燕,陈昌连,张瑞,李红,吴延升
(天津医科大学肿瘤医院,天津300060)
目的 探讨HTR3B基因多态性与头颈部恶性肿瘤患者化疗后出现恶心呕吐的关系。方法 采用方便抽样的方法,选择行TPF方案化疗的头颈部恶性肿瘤患者212例。从NCBI数据库或既往相关文献中筛选有临床意义的HTR3B基因rs3758987、rs1176744、rs12795805、rs2276305位点,化疗前采集患者外周静脉血3 mL,检测各位点的基因型。分析各位点基因型与化疗后出现恶心呕吐的关系。结果 212例患者化疗后出现恶心呕吐113例,出现恶心呕吐与rs3758987位点有关(P<0.05),与rs1176744、rs12795805、rs2276305位点无关(P均>0.05)。HTR3B基因rs3758987位点TT基因型者化疗后恶心呕吐的发生率明显低于CC+CT基因型者(P<0.05)。结论 HTR3B基因rs3758987位点与头颈部恶性肿瘤患者化疗后出现恶心呕吐有关,其CC、CT基因型者化疗后出现恶心呕吐的风险明显高于TT基因型者。
头颈部恶性肿瘤;HTR3B基因;多态性,单核苷酸;恶心呕吐
化疗是头颈部恶性肿瘤的重要治疗手段,TPF方案是临床常用的化疗方案,因其含高致吐性化疗药顺铂,化疗期间恶心呕吐的发生率较高[1,2]。严重的恶心呕吐不仅影响患者的生存质量,还可影响患者的化疗耐受性。Tremblay等[3]研究证实,HTR3B基因多态性与高加索人化疗所致的恶心呕吐有关。但国内相关报道较少。本研究探讨HTR3B基因多态性与头颈部恶性肿瘤患者化疗后出现恶心呕吐的关系。现报告如下。
1 资料与方法
1.1 临床资料 采用方便抽样的方法,选择我院2013年1~10月收治的头颈部恶性肿瘤患者212例,男166例、女46例,年龄(55.34±6.82)岁。肿瘤类型:口腔癌81例、喉癌72例、口咽癌39例、下咽癌11例、其他头颈部癌9例,吸烟(累计吸烟100支以上)者150例、饮酒(每周至少1次,持续半年以上)者137例,有晕动病史43例,化疗前服用止痛药者32例。纳入标准:①术前活检病理或术后组织病理检查确诊为头颈部恶性肿瘤;②初次接受化疗;③年龄大于18周岁;④能阅读和填写调查问卷;⑤汉族。排除标准:①首次化疗前24 h有恶心呕吐者;②有精神疾病史者;③意识障碍者;④语言沟通障碍者;⑤听力或视力障碍者;⑥合并胃肠道疾病者。本研究经医院伦理委员会批准,患者均知情同意。
1.2 治疗方法及治疗后出现恶心呕吐情况 所有患者接受新辅助化疗、手术、化疗等综合治疗,化疗方案均为TPF方案化疗:多西他赛75 mg/m2+顺铂75 mg/m2,第1天;氟尿嘧啶750 mg/m2,第1~5天;止吐方案为帕洛诺司琼0.25 mg(第1、3、5天)+地塞米松10 mg/d。新辅助化疗2~3个周期,术后化疗为2~6个周期,每个周期21天。化疗后出现恶心呕吐113例,无恶心呕吐99例。
1.3 HTR3B基因位点筛选及多态性检测 从NCBI数据库或既往相关文献[4]筛选具有临床意义的HTR3B基因多态性位点,共发现4个HTR3B基因多态性位点,即rs3758987、rs1176744、rs12795805、rs2276305。所有患者化疗前采集外周静脉血3 mL,送Life Technologies公司检测HTR3B基因4个位点的基因型。
1.4 统计学方法 采用SPSS18.0统计软件。计数资料比较采用χ2检验。单因素分析采用Log-rank检验,并将单因素分析中P<0.1的变量作为协变量,进行多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
所有患者HTR3B基因各位点基因型分布符合Hardy-Weinberg平衡。各位点基因型者恶心呕吐发生情况见表1。多因素Logistic回归分析显示,HTR3B基因rs3758987位点与化疗后出现恶心呕吐有关,CC+CT基因型者化疗后出现恶心呕吐的风险较TT基因型者显著增加(OR=2.192,95%CI为1.170~4.107,P<0.05)。见表2。
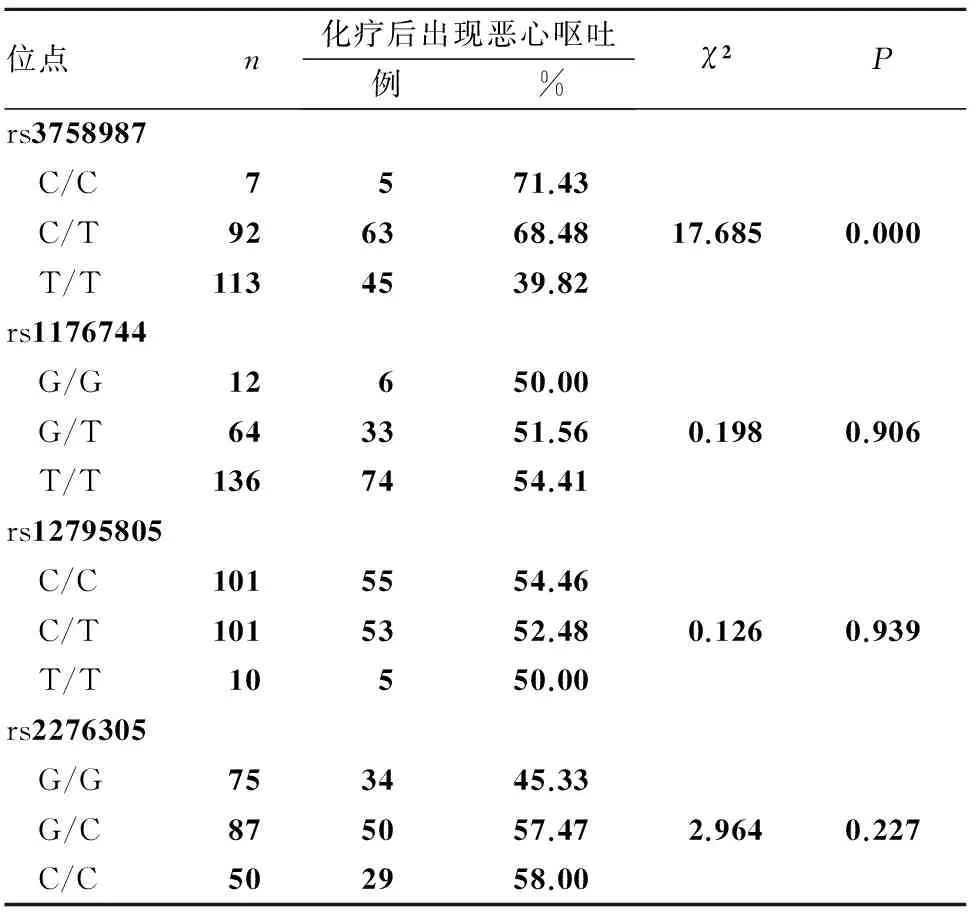
表1 HTR3B基因多态性与头颈部恶性肿瘤患者化疗后出现恶心呕吐的关系

表2 HTR3B基因多态性与头颈部恶性肿瘤化疗后出现恶心呕吐关系的多因素Logistic回归分析
3 讨论
头颈部恶性肿瘤年发病率约为14/10万,占全身恶性肿瘤的16%~40%。晚期头颈部恶性肿瘤常伴有颈部淋巴结转移、周围大血管侵犯等,患者预后较差[4]。目前,以铂类为主的化疗是其重要的治疗策略。恶心呕吐是肿瘤患者在化疗过程中最常见的不良反应[5]。据统计,70%~80%接受化疗患者会出现恶心呕吐反应[2]。严重的恶心呕吐不仅能在短期内导致患者营养缺乏、脱水和电解质紊乱,还会降低患者治疗的依从性[6]。临床针对化疗所致的恶心呕吐采用了大量的常规处理方案,包括多巴胺受体拮抗剂、皮质类固醇类、5-HT3拮抗剂等药物[7],但仍有部分患者出现严重的恶心呕吐反应。因此,阐明诱发化疗所致恶心呕吐的分子机理,寻找新的抑制化疗所致恶心呕吐的有效靶点日益受到关注。
已有研究表明,5-羟色胺3受体(HTR3)基因多态性在恶心呕吐的发生过程中具有重要作用[8]。HTR3是由A、B、C、D、E 5个亚基组成的复合体结构,其中HTR3B亚基在受体复合体的功能发挥中起决定性作用[9]。HTR3B广泛分布在中枢和外周神经系统中,可调节焦虑抑郁等精神情绪、呕吐反射的引发与协调等病理生理过程[10,11]。临床研究表明,化疗药物可刺激体内5-HT释放,并与HTR3结合,通过HTR3的介导将信号传至呕吐中枢从而导致恶心呕吐[12,13]。Rueffert等[14]研究发现,HTR3B基因多态性(c5+201_+202delCA,c6-137C>T)与术后呕吐的发生有关。Tremblay等[3]研究发现,HTR3B基因AAG缺失患者化疗后恶心呕吐的发生率明显升高。Laugsand等[15]研究发现,HTR3B的4个多态性位点与肿瘤患者化疗后发生恶心呕吐有关。以上研究均证实,HTR3B基因多态性与化疗后恶心呕吐的发生有关。本研究依据NCBI数据库,经确认的HTR3B基因序列信息,选择位于3′端、5′端或外显子区域的多态性位点,并且此等位基因频率在中国汉族人群中大于10%或既往相关文献研究资料表明具有临床意义的多态性位点;结果发现,HTR3B基因rs3758987位点突变型与头颈部恶性肿瘤患者化疗后出现恶心呕吐可能有关;多因素Logistic回归分析发现,HTR3B基因rs3758987位点突变是头颈部恶性肿瘤患者化疗后出现恶心呕吐的独立危险因素,且其CC+CT基因型者化疗后出现恶心呕吐的风险较TT基因型者显著增加。
综上所述,HTR3B基因rs3758987位点多态性与头颈部恶性肿瘤患者化疗后出现恶心呕吐有关,可作为化疗所致恶心呕吐的预测因子之一。这对指导患者合理给药、实现个体化治疗和护理具有重要的临床意义。
[1] Kris MG, Hesketh PJ, Somerfield MR, et al. American society of clinical oncology guideline for antiemetics in oncology: update 2006[J]. J Clin Oncol, 2006,24(18):2932-2947.
[2] 蒋贵兰,刘欣彤.化疗所致恶心、呕吐的防治及护理[J].山东医药,2004,44(29):66-67.
[3] Tremblay PB, Kaiser R, Sezer O, et al. Variations in the 5-hydroxytryptamine type 3B receptor gene as predictors of the efficacy of antiemetic treatment in cancer patients[J]. J Clin Oncol, 2003,21(11):2147-2155.
[4] Bello IO, Soini Y, Salo T. Prognostic evaluation of oral tongue cancer: means, markers and perspectives (I)[J]. Oral Oncol, 2010,46(9):630-635.
[5] Bertone P, Stolc V, Royce TE, et al. Global identification of human transcribed sequences with genome tiling arrays[J]. Science, 2004,306(5705):2242-2246.
[6] Navari RM, Aapro M. Antiemetic prophylaxis for chemotherapy-induced nausea and vomiting[J]. N Engl J Med, 2016,374(14):1356-1367.
[7] Shankar A, Roy S, Malik A, et al. Prevention of chemotherapy-induced nausea and vomiting in cancer patients[J]. Asian Pac J Cancer Prev, 2015,16(15):6207-6213.
[8] Janicki PK, Sugino S. Genetic factors associated with pharmacotherapy and background sensitivity to postoperative and chemotherapy-induced nausea and vomiting[J]. Exp Brain Res, 2014,232(8):2613-2625.
[9] Walstab J, Hammer C, Bonisch H, et al. Naturally occurring variants in the HTR3B gene significantly alter properties of human heteromeric 5-hydroxytryptamine-3A/B receptors[J]. Pharmacogenet Genomics, 2008,18(9):793-802.
[10] Tricco AC, Soobiah C, Blondal E, et al. Comparative efficacy of serotonin (5-HT3) receptor antagonists in patients undergoing surgery: a systematic review and network meta-analysis[J]. BMC Med, 2015(13):136.
[11] Tricco AC, Soobiah C, Hui W, et al. Interventions to decrease the risk of adverse cardiac events for patients receiving chemotherapy and serotonin (5-HT3) receptor antagonists: a systematic review[J]. BMC Pharmacol Toxicol, 2015(16):1.
[12] Tyers MB, Freeman AJ. Mechanism of the anti-emetic activity of 5-HT3 receptor antagonists[J]. Oncology, 1992,49(4):263-268.
[13] 谭欣.不同5-HT3受体拮抗剂预防腹腔镜手术后恶心呕吐的临床观察[J].医学与哲学,2014,35(22):34-35.
[14] Rueffert H, Thieme V, Wallenbom J, et al. Do variations in the 5-HT3A and 5-HT3B serotonin receptor genes (HTR3A and HTR3B) influence the occurrence of postoperative vomiting[J]. Anesth Analg, 2009,109(5):1442-1447.
[15] Laugsand EA, Fladvad T, Skorpen F, et al. Clinical and genetic factors associated with nausea and vomiting in cancer patients receiving opioids[J]. Eur J Cancer, 2011,47(11):1682-1691.
天津医科大学肿瘤医院科研项目(H1304)。
10.3969/j.issn.1002-266X.2016.40.030
R739.4
B
1002-266X(2016)40-0089-03
2015-03-27)

