水分胁迫和母树年龄对山东半岛黑松沿海防护林种子萌发的影响
, , , , , , , (.山东农业大学生态与环境重点实验室, 山东 泰安 2708;2.中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东 烟台 2600;.烟台大学, 山东 烟台 26005; . 山东省东营市科技局, 山东 东营 25709)
水分胁迫和母树年龄对山东半岛黑松沿海防护林种子萌发的影响
毛培利1,2,于晓3,曹帮华1,马向明4,瞿庆祥3,董建3,赵舒悦3,李修宇3
(1.山东农业大学生态与环境重点实验室, 山东 泰安 271018;2.中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东 烟台 264003;3.烟台大学, 山东 烟台 264005; 4. 山东省东营市科技局, 山东 东营 257091)
以山东半岛黑松沿海防护林种子为实验材料,研究了水分胁迫和母树年龄对黑松种子萌发的影响。结果表明,随水分胁迫程度增加,种子的发芽率、发芽指数和活力指数呈波浪形降低,而平均发芽时间增加,种子萌发受到显著抑制。随母树年龄增加,种子的发芽率、发芽指数和活力指数呈波浪形增加,种子质量明显提高。对于发芽率,水分胁迫和母树年龄有着显著交互作用。母树年龄的增加使得发芽率在水分胁迫下降低变缓,提高了种子耐水分胁迫能力。因此,母树特性与生态因子的共同作用是黑松海防林天然更新的重要决定因素。
水分胁迫; 母树年龄; 黑松; 沿海防护林; 种子萌发
黑松沿海防护林是山东省最重要的沿海防护林体系[1]。大部分黑松海防林是20世纪50—60年代营造,已有林分进入成熟、过熟阶段,防护功能受到严重影响,急需进行林分改造更新。天然更新是黑松海防林更新的重要方式[2-4]。但由于部分基干防护林带处于海岸风口地段,海风、海雾、干旱、土壤贫瘠等恶劣的生境条件造成黑松海防林更新极为困难[4]。种子能否萌发、产生正常苗是生态系统更新的关键阶段[5],受外界生态条件诸如水分、温度、光照、土壤盐分、埋深和生物等条件的综合影响,是各种生态因子互作的产物[6]。但生态因子如何影响黑松海防林种子萌发目前研究不够系统。韩广轩等研究了土壤盐分对黑松种子萌发的影响,认为土壤含盐量有着显著抑制作用,但其它生态因子研究较少[7]。除了环境因素,生物因素母树年龄对种子萌发也有显著影响[8-9],这在黑松海防林中也有相似发现[10]。但对于生态因子和母树年龄如何共同影响种子萌发研究较少。本实验通过研究水分胁迫和母树年龄对黑松种子萌发的影响及二者的交互作用,探讨黑松海防林的天然更新机制,为其管理提供理论依据。
1 材料与方法
1.1 研究区域概况
研究区域位于山东省烟台沿海防护林自然保护区。所处区域属暖温带东亚季风型大陆性气候,年平均温度11.5 ℃,降水量760 mm,无霜期200 d左右,年平均绝对湿度为71%,年平均日照时数为2 642.7 h,日照率为60%。土壤为滨海砂地土壤,机械组成以砂为主,有机质含量很低,一般不超过1%。黑松林栽植于20世纪50年代,大多为纯林。林下植被比较简单,灌木主要由紫穗槐(Amorphafruticosa)、单叶蔓荆(VitextrifoliaLinn.var.simplicifoliaCham.)、胡枝子(Lespedezabicolor)、野蔷薇(Rosamultiflora)等组成;草本植物主要为羊胡子草(Carexrigescens)、细苞虫实(Corispermumstenolepis)、刺沙蓬(Salsolaruthenicalljin var.ruthenica)、白茅(Imperatacylindricavar.major)、马齿苋(Portulacaoleracea)、肾叶打碗花(Calystegiasoldanella)、毛鸭嘴草(Ischaemumantephoroides)、茵陈蒿(ArtemisiacapillarisThunb.)、鸭跖草(Commelinacommunis)、西伯利亚滨藜(Atriplexsibirica)、龙葵(Solanumnigrum)等。
1.2 研究方法
1.2.1 种子采集
2013年9月,在中国科学院牟平海岸带环境综合试验站附近黑松海防林内随机采集了60株生境相近的黑松母树的球果(表1),通过D=21.37(1-e-0.1 A)2.638 9(D为胸径,A为年龄)计算年龄[1],根据母树年龄分成4个年龄梯度(表1)。通过自然风干待球果开裂后按照母树龄级分别收集,挑选饱满的种子用于实验。
表1 黑松球果和种子采集的母树大小特征
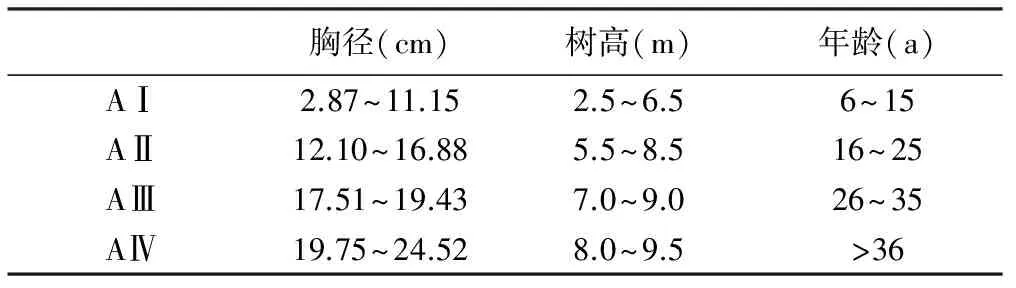
胸径(cm)树高(m)年龄(a)AⅠ2.87~11.152.5~6.56~15AⅡ12.10~16.885.5~8.516~25AⅢ17.51~19.437.0~9.026~35AⅣ19.75~24.528.0~9.5>36
1.2.2 种子萌发实验
用不同浓度的PEG 6000溶液模拟干旱胁迫,分别设置0,50,100,150,200 g/kg,其溶液渗透势分别为0,-0.05,-0.15,-0.30,-0.49 MPa[11]。将4个母树年龄梯度的种子用0.1%高锰酸钾液浸泡30 min消毒。消毒后的种子用蒸馏水洗涤3次后,将种子摆入直径9 cm的培养皿中。种子摆入前,培养皿内铺2层滤纸。每个培养皿摆无破损的种子20粒,5次重复。种子摆完后,用石蜡封口膜密封。培养皿置于恒温培养箱中(25±0.2)℃,培养21 d,萌发过程中每24 h观测1次。当胚根突破种皮时,即认为种子萌发,记录种子萌发起始时间和每日萌发种子数量。培养21 d后,将培养皿内萌发种子放于烘箱内(75 ℃,48 h)进行烘干,用万分之一天平称取干重。然后计算发芽率(GR)、平均发芽时间(MGT)、发芽指数(GI)和活力指数(VI)。
GR=G1/N×100%,式中:G1为萌发数;N为供试种子总数。
MGT=(∑D×n)/∑n,式中:n为相应各日正常发芽粒数,D为从种子置床起的天数。
GI=∑(Gt/Dt),式中:Gt为各日净发芽数;Dt为相应发芽日。
VI=S×GI,式中:S为幼苗干重;GI为发芽指数。
1.3 统计分析
所有数据采用SPSS 13.0软件进行分析。采用双因子方差分析(Two-Way ANOVA)比较不同数据组间的差异;如果差异显著,再用最小显著差异法(LSD)进行多重比较。分析时显著性差异检验水平为plt;0.05。
2 结果与分析
2.1 发芽率
随PEG 6000浓度的增加,发芽率呈波浪形降低;不同年龄之间,AⅠ和AⅢ最低,AⅣ最高(图1)。双因素方差分析结果表明,水分胁迫(F=39.35,plt;0.01)和母树年龄(F=25.40,plt;0.01)对发芽率有着极显著的影响,并且二者有着极显著的交互作用(F=2.49,plt;0.01)。不同水分胁迫梯度之间,5% PEG 6000的发芽率最高,并极显著高于10% PEG 6000和20% PEG 6000(plt;0.01);20% PEG 6000的发芽率最低,并极显著低于ck、5% PEG 6000和15% PEG 6000(plt;0.01)。这表明较低的水分胁迫不会抑制黑松种子萌发,而严重的水分胁迫则会显著抑制种子萌发。不同母树年龄之间,AⅠ与AⅢ差异不显著(p=0.10),极显著低于AⅡ和AⅣ(plt;0.01),AⅣ极显著高于其它母树年龄(plt;0.01)。随PEG 6000浓度的增加,AⅣ的发芽率下降速率显著低于其它母树年龄,有着显著的交互作用。
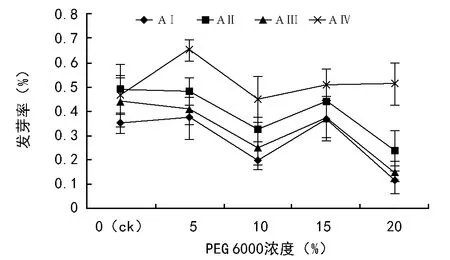
图1 水分胁迫和母树年龄对黑松种子发芽率的影响
2.2 平均发芽时间
随PEG 6000浓度的增加,不同母树年龄黑松种子平均发芽速呈波浪形增加(图2)。双因素方差分析结果表明,水分胁迫对平均发芽时间有着极显著的影响(F=3.98,plt;0.01),母树年龄影响不显著(F=1.74,p=0.17),而二者之间交互作用不显著(F=1.31,p=0.24)。不同水分胁迫梯度之间,5% PEG 6000的平均发芽速最短,显著低于10% PEG 6000(plt;0.05),极显著低于20% PEG 6000(plt;0.01);20% PEG 6000的平均发芽速最长,显著长于ck(plt;0.05),极显著长于5% PEG 6000和15% PEG 6000(plt;0.01)。

图2 水分胁迫和母树年龄对平均发芽时间的影响
2.3 发芽指数
随PEG 6000浓度的增加,黑松发芽指数呈波浪形降低;不同母树年龄之间,AⅠ最低,AⅣ最高(图3)。双因素方差分析结果表明,水分胁迫(F=29.03,plt;0.01)和母树年龄(F=39.27,plt;0.01)对发芽指数有着极显著的影响,二者交互作用不显著(F=1.43,p=0.18)。不同水分胁迫梯度之间,5% PEG 6000浓度发芽指数最大(plt;0.05),20% PEG 6000浓度显著低于ck、5% PEG 6000和15% PEG 6000(plt;0.05)。不同母树年龄之间,AⅠ与AⅢ差异不显著(p=0.07),极显著低于AⅡ和AⅣ(plt;0.01),AⅣ极显著高于其它母树年龄(plt;0.01)。
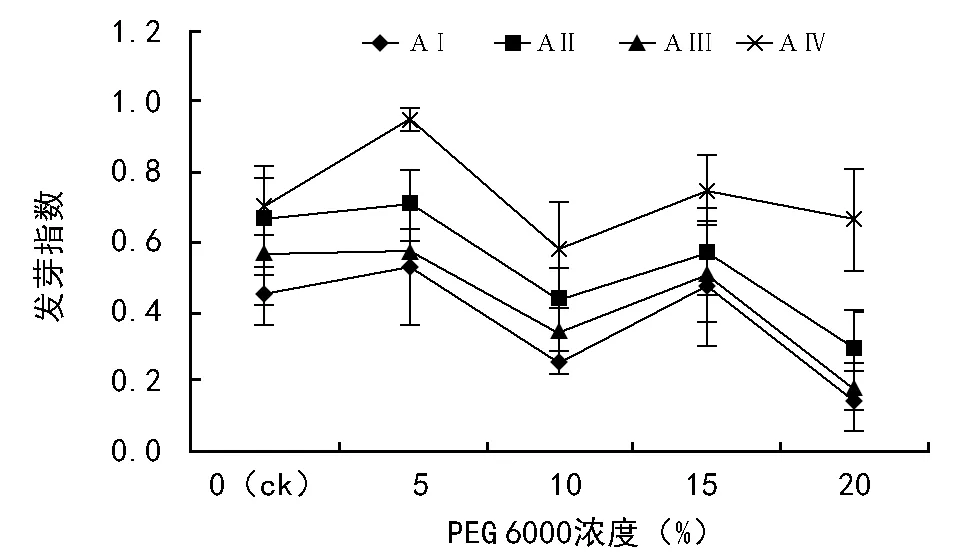
图3 水分胁迫和母树年龄对黑松发芽指数的影响
2.4 活力指数
随PEG 6000浓度的增加,黑松活力指数呈波浪形降低;不同母树年龄之间,AⅠ、AⅡ和AⅢ接近,AⅣ最高(图4)。双因素方差分析结果表明,水分胁迫(F=19.39,plt;0.01)和母树年龄(F=43.21,plt;0.01)对活力指数有着极显著的影响,二者交互作用不显著(F=1.70,p=0.09)。不同水分胁迫梯度之间,5%PEG 6000浓度活力指数最高,极显著高于10%PEG浓度和20%PEG浓度(plt;0.01),20% PEG 6000浓度最低,极显著低于ck、5% PEG 6000和15% PEG 6000(plt;0.01)。不同母树年龄之间,AⅠ极显著低于AⅡ(plt;0.01),与AⅢ差异不显著(p=0.06),AⅡ与AⅢ差异不显著(p=0.13),AⅣ极显著高于其它母树年龄(plt;0.01)。
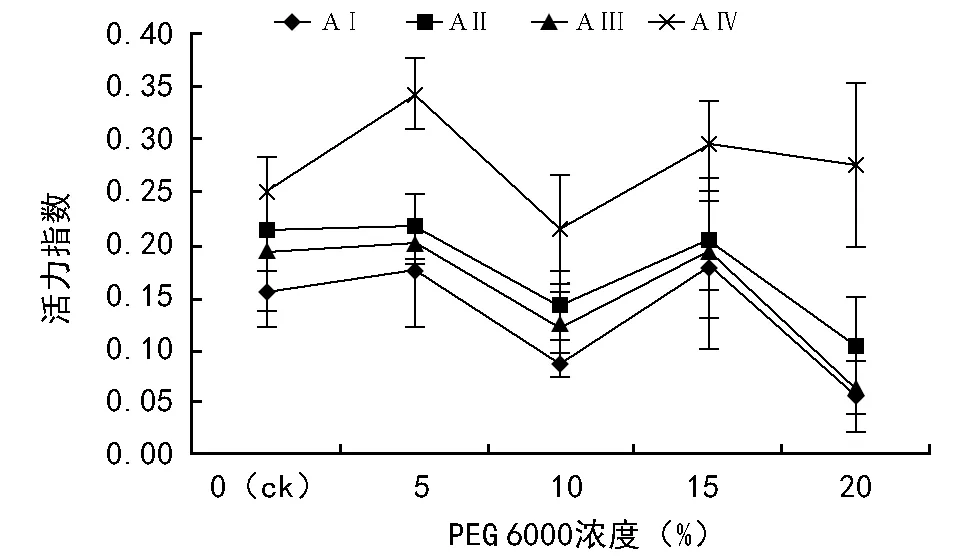
图4 水分胁迫和母树年龄对黑松种子活力指数的影响
3 讨 论
水分胁迫是沿海防护林天然更新重要的限制因子[4,12]。随着水分胁迫程度的增加,黑松种子发芽率、发芽指数和活力指数逐渐降低,表明水分胁迫显著抑制了种子萌发,这与华南沿海防护林主要树种木麻黄[12]、固沙造林树种樟子松[13]的研究结果相似。最优的发芽时间对幼苗的建立至关重要,是对多变外界环境的适应[14]。随着水分胁迫程度的增加,黑松种子平均发芽时间增加,延缓了发芽进程。延缓种子发芽进程是水分胁迫影响众多植物种子萌发的基本特征[13,15]。种子发芽进程延缓对幼苗的初期生长[15]和形态[12-13]有着重要影响,进而影响到了幼苗对生态因子的适应性[13]。
母树年龄对种子质量有重要影响,这在Sorbustorminalis[8]、Pinuspinea[16]、Pinusechinata[9]、Pinuspinaster[17]及黑松海防林[10]都有体现。随着母树年龄的增加,黑松种子的发芽率、发芽指数和活力指数呈波浪形变化,这与母树会通过调节球果胚珠败育率保障种子质量有关[18]。Müller et al.[19]认为,C.albidus种子质量随年龄增加不断降低除了与提高胚珠败育率相关外,还与种子内部维生素E和激素变化有关。本研究在进行种子分组时按照黑松母树年龄划分,与以前的研究按照母树胸径划分有所不同,本研究是随母树年龄增加种子质量波浪增加。这表明胸径与母树年龄对种子质量的影响有所差别[20]。同时,本研究还发现在发芽率上,母树年龄与水分胁迫有着显著交互作用,提高了黑松种子在水分胁迫下的发芽率。这表明母树年龄影响黑松种子萌发过程中对生态因子的适应能力。
种子萌发是黑松沿海防护林天然更新的一个关键环节。对种子萌发的研究多集中在生态因子对萌发的影响,对母树特性研究较少,尤其是二者之间的交互影响。在黑松沿海防护林天然更新过程中种子来源于不同树龄的母树,而不同树龄母树产生种子的质量差异对种子在不同生境下的萌发将会产生重要影响,进而影响幼苗建立。因此,在今后的研究中,深入研究种子质量的母树年龄效应,探讨母树年龄与生态因子之间的作用方式,是阐明黑松海防林的天然更新机制的重要研究内容。
[1]许景伟,李琪,王卫东,等.沙岸黑松海防林防护成熟期及更新年龄的研究[J].林业科学,2003,39(2):91-97.
[2]张志东,韩广轩,毛培利,等.成年个体密度、距海远近及下层植被对烟台黑松海防林天然更新的影响[J].自然资源学报,2009,24(5):782-790.
[3]朱教君,李凤芹,松崎健,等.间伐对日本黑松海岸林更新的影响[J].应用生态学报,2002,13(11):1 361-1 367.
[4]许景伟,王卫东,乔勇进.沿海沙质岸基干林带黑松防护林的更新方式[J].东北林业大学学报,2003,31(5):4-6.
[5]González-Rodríguez V,Villar R,Casado R,et al.Spatio-temporal heterogeneity effects on seedling growth and establishment in fourQuercusspecies[J].Annals of Forest Science,2011,68:1 217-1 232.
[6]鱼小军,师尚礼,龙瑞军,等.生态条件对种子萌发影响研究进展[J].草业科学,2006,23(10):44-49.
[7]韩广轩,毛培利,刘苏静,等.盐分和母树大小对黑松海防林种子萌发和幼苗早期生长的影响[J].生态学杂志,2009,28(11):2 171-2 176.
[8]Espahbodi K,Hosseini S M,Mirzaie-Nodoushan H,et al.Tree age effects on seed germination inSorbustorminalis[J].Gen and Appl Plant Physiology,2007,33(1-2):107-119.
[9]Grayson K J,Wittwer R F,Shelton M G.Cone characteristics and seed quality 10 years after an uneven-aged regeneration cut in shortleaf pine stands [C]//Proceedings of the eleventh biennial southern silvicultural research conference.Gen Tech Rep,SRS-48. Ashville,NC:U.S.Department of Agriculture.Foreste Service,Southern Research Station,2002:310-314.
[10]Mao P L,Han G X,Wang G M,et al.Effects of age and stand density of mother trees on earlyPinusthunbergiiseedling establishment in the coastal zone,China[J].Sci World J,2014.
[11]Michel B E,Kaufmann M R.The osmotic potential of polyethylene glycol 6000[J].Plant Physiol,1973,51:914-916.
[12]武冲,仲崇禄,张勇,等.聚乙二醇模拟干旱对三种木麻黄种子萌发的影响[J].中南林业科技大学学报,2011,31(2):22-26.
[13]朱教君,李智辉,康宏樟,等.聚乙二醇模拟水分胁迫对沙地樟子松种子萌发影响研究[J].应用生态学报,2005,16(5):801-804.
[14]Cendán C,Sampedro L,Zas R.The maternal environment determines the timing of germination inPinuspinaster[J].Environ Exp Bot,2013,94:66-72.
[15]胡红,曹昀,王颖.水分胁迫对狗牙根种子萌发及幼苗生长的影响[J].草业科学,2013,30(1):63-68.
[16]Ganatsas P,Tsakaldimi M,Thanos C.Seed and cone diversity and seed germination ofPinuspineain Strofylia Site of the Natura 2000 Network[J].Biodivers Conserv,2008,17:2 427-2 439.
[17]Alvarez R,Valbuena L,Calvo L.Influence of tree age on seed germination response to environmental factors and inhibitory substances inPinuspinaster[J].Int J Wildland Fire,2005,14:277-284.
[18]毛培利,韩广轩,张志东,等.黑松海岸防护林径级分布及其与球果和种子特性的关系[J].东北林业大学学报,2010,38(11):21-23.
[19]Mülle M,Siles L,Cela J,et al.Perennially young:seed production and quality in controlled and natural populations ofCistusalbidusreveal compensatory mechanisms that prevent senescence in terms of seed yield and viability[J].J Exp Bot,2014,65:287-297.
[20]Gross K L.Predictions of fate from rosette size in four “biennial” plant species:Verbascumthapsus,Oenothera biennis,Daucus carota,andTragopogondubius[J].Oecologia,1981,48:209-213.
Effects of Water Stress and Mother Tree Age on Seed Germination of the CoastalPinusthunbergiiProtection Forest in Northern Shandong Peninsula
MAOPeili1,2,YUXiao3,CAOBanghua1,MAXiangming4,QUQingxiang3,DONGJian3,ZHAOShuyue3,LIXiuyu3
(1.Key Laboratory of Agricultural Ecology and Environment, Shandong AgriculturalUniversity,Taian Shandong 271018,China;2.Key Laboratory of Coastal Environmental Processes and Ecological Remediation,Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences,Yantai Shandong 264003, China;3.Yantai University,Yantai Shandong 264005,China;4.Bureau of Science and Technology,Dongying Shandong 257091,China)
In this paper,Pinusthunbergiiseeds of different mother tree age were collected from the coast protection forest in northern Shandong Peninsula.The effects of water stress and mother tree age on seed germination were tested.As water stress aggravated,germination rate (GR),germination index (GI) and vigor index (VI) showed an undulating decrease, whereas mean germination time increased,which suggested seed germination was inhibited by water stress.With increasing mother tree age,GR,GI and VI increased undulatingly,which indicated seed quality enhanced significantly.There was significant interaction on Gi between water stress and mother tree age.The decrease velocity of GR deriving from water stress became slowly due to the increase of mother tree age,which suggested mother tree age enhanced seed water stress resistance.The combination of mother tree age and ecological factors was a vital determinant on the natural regeneration of the coastalP.thunbergiiprotection forest.
water stress; mother tree age;pinusthunbergii; coast protection forest; seed germination
2015-12-11
山东省重点研发计划(编号:2015 GNC 111026);烟台市科技支撑项目(编号:2012017)。
毛培利(1979—),男,讲师,博士,主要从事植物生理生态学研究;E-mail:maopl1979@163.com。
曹帮华,E-mail:caobanghua@126.com。
10.16590/j.cnki.1001-4705.2016.07.010
S 791.256
A
1001-4705(2016)07-0010-05

