陕西卫矛无菌萌发技术的研究
, , , , (河南红枫种苗股份有限公司, 郑州 450008)
陕西卫矛无菌萌发技术的研究
张家勋,张丹,孟伟芳,王东超,何甜甜
(河南红枫种苗股份有限公司, 郑州 450008)
在无菌条件下观察不同激素配比、接种时间、胚乳体积对陕西卫矛种子生长情况的影响,研究种子无菌萌发的诱导因素。结果表明:培养基为MS+KT 1.0 mg/L+NAA 0.1 mg/L 时,生长情况最好;接种时间为9月10日、9月30日时,发芽率达95%以上;胚乳远端切除1/4、1/3体积时,出苗顺利;转接到MS无激素培养基中,成活率最高,生长最快。
陕西卫矛; 种子; 组培; 激素; 接种时间; 胚乳
陕西卫矛(EuonymusschensianusMaxim)又名金丝吊蝴蝶,是卫矛科卫矛属翅果系,果实具翅4~5,成熟后为红色,翅长可达2.5~3 cm,宽1.5~2 cm,吊在绿叶之间,犹如振翅欲飞的蝴蝶,是观赏价值极高的园林树种[1-3]。然而,陕西卫矛种子在自然条件下萌发率极低,经常规播种试验,证明其萌发率几乎为0,而经过一定浓度的赤霉素、细胞分裂素等激素处理之后发芽率依然很低,现在陕西卫矛快繁技术多是以带芽茎段作为外植体[ 4-6]。目前,园林上多采用丝棉木嫁接的方式进行繁殖[7],虽然可以实现陕西卫矛的规模化繁殖,但嫁接属于无性繁殖,无法实现陕西卫矛的基因重组和品种改良。因此,必须清楚陕西卫矛的萌发机制,实现种苗的高出芽率,只有这样,才能实现陕西卫矛的杂交育种和品种改良的目的。在对温室播种1个月未发芽的陕西卫矛种子进行解剖后发现,一半以上的种子被霉菌侵染腐烂,其余未腐烂的种子既不腐烂也不萌发,直到半年后才开始有少量的种子萌发,发芽率不足千分之一。说明霉菌侵袭和种子休眠是导致陕西卫矛发芽率低的两大原因。因此,针对陕西卫矛种子的表现,拟在添加不同激素配比的培养基中进行无菌播种,一方面杜绝霉菌的侵袭,另一方面观察激素是否能打破陕西卫矛的休眠机制,使其顺利萌发。
表1 激素对种子生长情况的影响
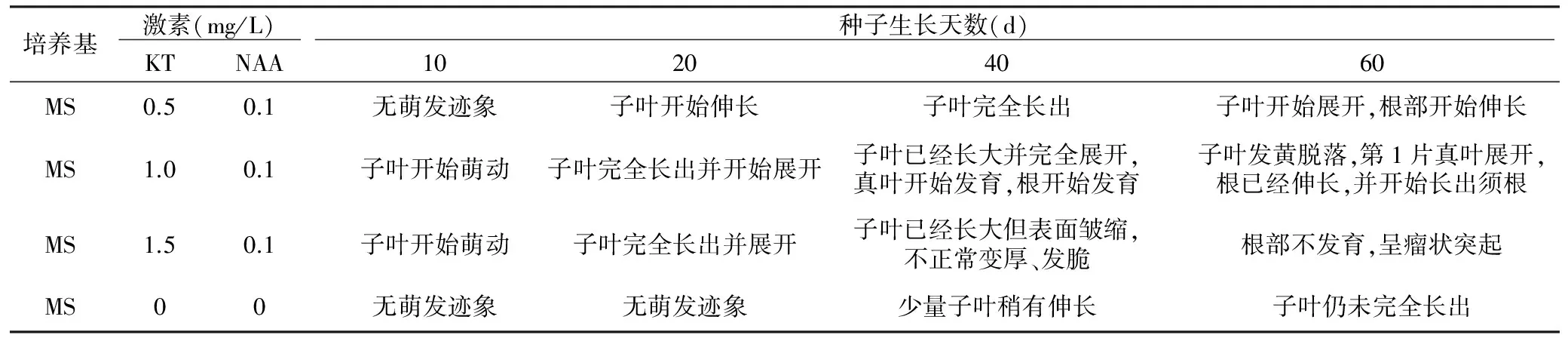
培养基 激素(mg/L) 种子生长天数(d) KTNAA10204060MS0.50.1无萌发迹象子叶开始伸长子叶完全长出子叶开始展开,根部开始伸长MS1.00.1子叶开始萌动子叶完全长出并开始展开子叶已经长大并完全展开,真叶开始发育,根开始发育子叶发黄脱落,第1片真叶展开,根已经伸长,并开始长出须根MS1.50.1子叶开始萌动子叶完全长出并展开子叶已经长大但表面皱缩,不正常变厚、发脆根部不发育,呈瘤状突起MS00无萌发迹象无萌发迹象少量子叶稍有伸长子叶仍未完全长出
1 材料与方法
1.1 材 料
试验所用种子采自河南红枫种苗股份有限公司的黄河滩基地,此地的陕西卫矛长势良好、无病虫害。
1.2 方 法
采集外观完整、无病虫害的果实带回实验室,先用加有洗涤剂的清水浸泡0.5 h,去除果皮上残留的污渍等,再用流水冲洗2 h后,晾干。用刀片切去果翅及上部的果蒂和下部的脐(注意不要伤到内部的种子)。切好后放入0.1% HClO中浸泡10 min。在超净工作台上依次用75%酒精和0.1% HgCl各消毒5 min。消毒完成后,用无菌水冲洗5~6遍,每次浸泡时间3 min以上。
清洗完成后,在超净工作台上用手术刀和镊子把果实剥开,取出种子,并将种子外面的红色假种皮剥离干净,放入1% H2O2中待用。
1.2.1 激素水平对照试验
将陕西卫矛种子接种于配方分别为MS、MS+KT 0.5 mg/L+NAA 0.1 mg/L、MS+KT 1.0 mg/L+NAA 0.1 mg/L、MS+KT 1.5 mg/L+NAA 0.1 mg/L的培养基中,每瓶接3颗种子,每个处理40瓶。根据生长情况选出适合陕西卫矛种子生长的培养基配方,进行以下试验。
1.2.2 接种时间对照试验
试验从2014年8月份开始进行,分别于8月1日、8月21日、9月10日、9月30日、10月20日、11月9日对采收的6批果实进行无菌接种,接种的培养基配方根据1.2.1结果选取,每瓶接3颗种子,每个处理40瓶。
1.2.3 胚乳切除对照试验
将陕西卫矛种子按照不同部位和不同大小对种子进行切除。在种脐的远端位置,分别切除1/5、1/4、1/3、1/2体积的胚乳,在种脐一端,切除1/5体积,切好后进行接种,种脐一端朝下,插入培养基内一半,培养基配方同1.2.2,每瓶接3颗种子,每个处理40瓶。
1.2.4 转接对照试验
根据1.2.1试验结果,选取60 d后生长最佳的培养基配方中的陕西卫矛苗,分别转接到MS、MS+KT 0.1 mg/L+NAA 0.1 mg/L、MS+KT 0.5 mg/L+NAA 0.1 mg/L、MS+KT 1.0 mg/L+NAA 0.1 mg/L 4种培养基中,每瓶接种1棵苗,每个处理40瓶。
1.2.5 炼 苗
选取生长健壮的瓶苗,先开瓶炼苗2 d,使幼苗适应外界环境后,将苗取出,不要伤到根系,流水冲净植株上附着的培养基,后将苗栽到准备好的已灭菌培养土中,培养土按照蛭石∶泥炭=1∶1的体积比进行配制。移栽后喷洒多菌灵溶液,并覆膜放置阴凉处1个月左右,待新叶、新根长出后放置向阳处培养,注意保持湿度,温度保持在15~25 ℃,逐步加强通风,待1个月之后幼苗长势健壮再进行露天栽植。
2 试验结果
2.1 激素对种子生长情况的影响
如表1,在MS培养基中,陕西卫矛种子培养60 d时,子叶未完全长出;添加KT 0.5 mg/L和NAA 0.1 mg/L时,60 d时根部开始生长;随着KT浓度的上升,当KT 1.0 mg/L时,60 d时真叶展开且开始长出须根;当KT 1.5 mg/L时,60 d时根部出现瘤状突起。可见,MS+KT 1.0 mg/L+NAA 0.1 mg/L 的培养基作为接种培养基表现最好,激素浓度过低胚发育缓慢,激素浓度过高则导致幼苗发育不正常,根部不发育。
2.2 接种时间对种子生长状况的影响
由表2可以看出,陕西卫矛种子的最佳接种时间为9月10日、9月30日,此时果实饱满,果皮黄绿色,胚发育完全,10 d后发芽率可达95%以上。8月1日、8月21日接种后,种胚死亡或出苗后表现为白化苗;10月20日、11月9日,此时果实变红后炸开,种子和外界接触,接种后染菌率极高。
经过6个时间点的接种试验发现,后期成熟的种子在果皮裂开与外界接触后,染菌率极高,说明霉菌可能是导致种子播种后失活的主要原因。
表2 接种时间对种子生长状况的影响

接种时间果实、种子发育情况接种后生长状况8月1日果实青色,假种皮未变红,种子幼嫩。生长缓慢,不出苗或者为白化苗。8月21日果实青色,假种皮稍微变红,种子较大但仍较嫩。少数发育成正常苗,其余多为白化苗。9月10日果实青黄色,假种皮红色,种子饱满。发芽很快,10d发芽率可达95%以上。9月30日果实黄色,少数开始变红,种子饱满。发芽很快,10d发芽率95%以上。10月20日果实多为红色,少数开始炸裂,种子饱满,种皮较硬。发芽很快,10d发芽率45%,剩余染菌死亡。11月9日果实鲜红,开始皱缩,多数开始炸裂,种皮极硬。接种10d后,80%染菌死亡。
表3 胚乳对种子萌发情况的影响

胚乳切除体积切面形态种子萌发情况种脐远端切除1/5切面很小,几乎看不到子叶。10d后子叶萌动但未顶出,60d后仍未萌发。种脐远端切除1/4切面较大,可见长约3mm线状的子叶横切面。10d后子叶萌动,顺利萌发。种脐远端切除1/3切面较大,可见长约4mm线状的子叶横切面。10d后子叶萌动,顺利萌发。种脐远端切除1/2切面最大,可见长约4mm线状的子叶横切面。10d后子叶萌动,顺利萌发,后期生长缓慢、瘦弱,最终死亡。种脐一端切除1/5切面很小,几乎看不到子叶。无萌发
表4 转接后激素对种子生长情况的影响
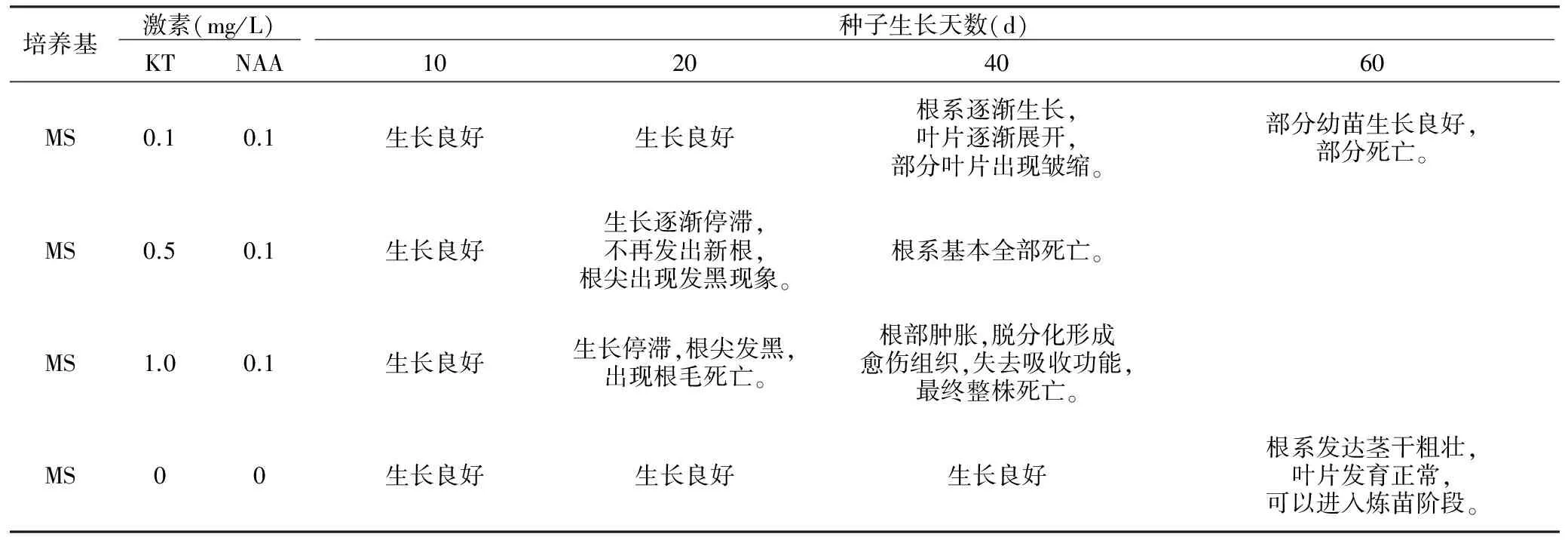
培养基 激素(mg/L) 种子生长天数(d) KTNAA10204060MS0.10.1生长良好生长良好根系逐渐生长,叶片逐渐展开,部分叶片出现皱缩。部分幼苗生长良好,部分死亡。MS0.50.1生长良好生长逐渐停滞,不再发出新根,根尖出现发黑现象。根系基本全部死亡。MS1.00.1生长良好生长停滞,根尖发黑,出现根毛死亡。根部肿胀,脱分化形成愈伤组织,失去吸收功能,最终整株死亡。MS00生长良好生长良好生长良好根系发达茎干粗壮,叶片发育正常,可以进入炼苗阶段。
2.3 胚乳对种子萌发情况的影响
在种脐的远端位置,切除1/5体积,未萌发;切除1/4、1/3,出苗顺利;切除1/2,顺利萌发,后生长缓慢、瘦弱,最终死亡,可能是由于胚乳切除过多造成;种脐一端,切除1/5,无萌发,可能伤到胚芽生长点,种子已失去活性。
2.4 转接后激素对种子生长情况的影响
无激素培养基前40 d生长较慢,40 d后进入生长旺盛期,成苗率在95%以上。幼苗死亡率随激素浓度升高而升高,可能是因为幼苗内源性激素水平较高,已经不需要外源性激素进行调节。因此,在无菌苗长出后转入无激素培养基中培养最好,成活率最高,生长最快。
3 结论分析
有研究表明,陕西卫矛种子萌发是多因素共同作用的结果[8]。无菌条件、接种时间、切除胚乳的体积和激素刺激是必不可少的。
从结果来看,接种时间不同,主要是种子的发育情况不同对后期生长的影响[9],在9月10日、9月30日接种时,种胚发育完整,又未与外界接触,此时是最佳接种时间。切除部分胚乳后可以促进种子萌发,可能有两方面的原因,一是破除了坚硬种皮的包裹,二是胚乳作为储存养分的“源”,当其收到损伤刺激时,养分向作为“库”的子叶流动,促进了下一步各器官的发育,这在张荣萍[10]对小麦的研究中有提到,所以当切除陕西卫矛种子1/4、1/3体积胚乳时,出苗顺利。此外,适当的外源激素可加速这一过程,在NAA 0.1 mg/L浓度一定的情况下,KT浓度是1 mg/L,种子发育最好。但是当子叶完成形态建成,各部分发育完全,能够自主进行光合作用时,内源性激素水平开始升高,此时的外源性激素就显得多余,并会对幼苗造成毒害,因此,在幼苗发育完成时必须将其转入无激素培养基中。
[1]胡丽娟,郭军战,王文君,等.陕西卫矛的组织培养及植株再生[J].植物生理学通讯,2010,46(2):153-154.
[2]刘亚芬,郭甲科.“蝴蝶树”陕西卫矛[J].中国花卉园艺,2010(4):37.
[3]尚爱芹,孙振元,赵梁军.爬行卫矛下胚轴高频离体再生体系的建立(英文)[J].林业科学,2009,45(2):136-141,175.
[4]袁云香.陕西卫矛愈伤组织诱导的初步研究[J].北方园艺,2011(23):119-120.
[5]袁云香.陕西卫矛再生植株生根的影响研究[J].科学技术与工程,2012,12(27):7 048-7 050.
[6]袁云香,勾雪娇,冯辽辽,等.陕西卫矛组织培养再生体系的建立[J].贵州农业科学,2012,40(4):17-19.
[7]王军涛,郭建喜,查振道,等.陕西卫矛夏季嫁接试验[J].陕西林业科技,2008(3):35-36.
[8]袁云香.陕西卫矛组织培养的影响因素探析[J].湖北农业科学,2012,51(6):1 265-1 267.
[9]吴琰,郭宝林,鲁韧强,等.卫矛属植物组织培养无菌苗的方法研究[J].河北林果研究,2007,22(2):140-142.
[10]张荣萍,王长发,张嵩午,等.小麦胚乳充实特性研究初报[J].麦类作物学报,2002,22(4):54-57.
(本栏目责任编辑:申 晓)
Study on Aseptic Germination Technique ofEuonymusschensianus
ZHANGJiaxun,ZHANGDan,MENGWeifang,WANGDongchao,HETiantian
2016-07-26
张家勋(1944—),男,河南驻马店人;高级绿化工程师,主要从事植物分类学研究。
10.16590/j.cnki.1001-4705.2016.10.129
S 68
A
1001-4705(2016)10-0129-04

