结晶纤维素的降解
谌恩华,吴华伟,李相前
(1.长江大学生命科学学院,湖北 荆州 434025; 2.淮阴工学院生命科学与化学工程学院,江苏 淮安 223003)
结晶纤维素的降解
谌恩华1,吴华伟1,李相前2
(1.长江大学生命科学学院,湖北 荆州 434025; 2.淮阴工学院生命科学与化学工程学院,江苏 淮安 223003)
随着化石能源的日益消耗及其对环境的污染加重,寻求可再生的清洁能源已成为各国关注的焦点。木质纤维素是地球上最多的有机聚合物,对于解决能源危机具有巨大的潜力,但没有得到有效的利用,纤维素结晶区的存在是阻碍其降解的重大难题。本文介绍了结晶纤维素的结构、解结晶方法及优良的降解菌种;纤维素酶的结构和功能;降解结晶纤维素的机制;纤维素酶的基因工程和酶工程改造。突出应加大对耐热、高效的结晶纤维素降解菌株的挖掘,并深入探究碳水化合物结合结构域的相关作用机理,这对结晶纤维素的高效降解具有重要意义。
结晶纤维素;纤维素酶;降解机制;碳水化合物结合结构域;纤维小体;膨胀因子;可再生能源
随着全球经济的飞速发展,全球能源消耗量基本处于上升态势。中国作为世界上人口最多的国家,能源的消耗量逐年增加[1]。化石燃料是不可再生能源,但是目前消耗的能源以及塑料材料大多来自化石燃料,石油、天然气和煤炭等化石燃料储量分别仅够全球使用42、60和113年[2],使得其价格也逐渐上升。另外,化石燃料燃烧释放的CO2、SO2等气体可引发全球气候变暖、酸雨、生物多样性降低、臭氧圈破坏、生物圈碳平衡破坏等环境危害。相比化石能源,生物质能源具有清洁、安全、可再生等优点,对能源的可持续发展具有促进作用[3]。生物质是地球上最丰富的可再生资源,其中木质纤维素含量最多、成本低廉并且来源广泛(如农作物秸秆、森林凋落物、草类和一些生活垃圾等)。据推测,生物质世界年产总量为1 700亿t,将其作为能源开发有着很好的前景[4-5]。
植物细胞壁中的天然纤维素多是以结晶纤维素的形式存在,结构整齐致密,形成了天然的抗降解屏障[6-7],水分子、化学试剂和纤维素水解酶根本无法进入到纤维素内部,即使再多的酶和再高的酶活也难以发挥催化作用[8-9]。因此,有效降解、转化天然纤维素的关键在于尽量快速破坏天然纤维素的这种致密的结晶结构,暴露出纤维素多糖链、纤维素酶等起水解作用的成分才能发挥作用。近些年,国内外对于结晶纤维素降解的研究已取得了巨大的进展,本文就结晶纤维素的结构、纤维素酶的降解机制、基因工程和酶工程改造等方面进行综述,以期对其发展作出展望。
1 纤维素的结晶结构及其降解菌
1.1 纤维素的结晶结构
纤维素是地球上含量最多的有机聚合物,是葡萄糖单位通过β-1,4-糖苷键连接而成的线形长链分子,每个分子通常含数千个葡萄糖单位,构成纤维素糖链的葡萄糖残基含有多个羟基,加上纤维素多糖链是无分支的直线形分子,这就使得纤维素多糖链上的羟基趋于整齐、有序排列,羟基中的氢易与葡萄糖残基中的氧形成氢键,这种氢键不但存在于同一纤维素多糖链内部,也存在于相邻的纤维素多糖链之间,就这样大量氢键形成的有序网络结构使得天然纤维素纤维中的多糖链紧密、有序地结合在一起,并进一步形成纤维素致密、稳定、抗分解的结晶结构。与纤维素内形成结晶结构的纤维素结晶区相对,不能形成有序结晶结构的部分就是纤维素的非结晶区,或称为无定形区。结晶区内的纤维素多糖链稳定性较强,难于被分解,甚至水和分解酶等分子都不能与结晶区内的多糖链接触。而非结晶区的多糖链易与其它分子接触,易于被分解,其被分解的速度远高于纤维素结晶区[10-12]。
1.2 纤维素的结晶度和解结晶
纤维素的结晶度是指纤维素中的结晶区占其总体积的百分比,与纤维素的物理化学性质密切相关,是描述纤维素超分子结构的重要参数[13]。结晶区阻止了酶的可及性,温度升高能增加纤维素酶的吸附[14],但高温可以使酶活性降低甚至失活。有研究[15]发现,相比提高温度,解结晶更能增加酶的吸附率。这说明降低纤维素结晶度是提高酶吸附率的一个较好的方法,从而更好地促进结晶纤维素的降解。纤维素结晶度的测试方法主要有X-射线衍射法、红外光谱法、CP/MAS13C-NMR方法等[12-13],解结晶方法有:机械粉碎、蒸汽爆破以及微波、超声波、酸、碱和生物处理等[12,16]。据最新研究[17],超声与Fenton试剂联合对微晶纤维素预处理后进行酶解,还原糖的产量高达22.9 g·100 g-1。对纤维素预处理的方法很多,寻求更好的生物方法或者最优的联合处理方法对纤维素进行预处理破坏其结晶结构,这对于结晶纤维素的酶解有重要意义。
1.3 结晶纤维素的降解菌
结晶纤维素降解菌种类繁多,以产游离纤维素酶的Caldicellulosiruptor属、产纤维小体的热纤梭菌属(Clostridium)、产膨胀因子的木霉属(Trichoderma)和以细胞结合型降解机制的哈氏噬纤维菌(Cytophagahutchinsonii)等最为典型。由于嗜热菌和极端嗜热菌的纤维素酶具有稳定性好、半衰期长,并且对结晶纤维素有很强的降解能力等优良特性[18],加之高温能提高降解菌的生长和代谢速率、降低杂菌污染概率,并且便于乙醇分馏等[19],使得这类菌种在木质纤维素转化为乙醇燃料的统合加工过程中具有明显的优势,引发了国内外对这类菌的广泛研究。表1中为近5年来国内外对耐热纤维素降解菌株的研究成果,这些菌株主要来自温泉、牲畜肠胃及粪便、腐殖质土壤、生物堆肥及污泥中,并且以细菌居多。
2 结晶纤维素的降解机理
2.1 纤维素酶分子的结构和功能
绝大多数纤维素酶由三大部分组成:月球状的催化结构域(catalytic domain,CD)和没有催化作用的碳水化合物结合结构域(carbohydrate binding module,CBM)和连接肽(Linker);少数纤维素酶不具备CBM结构,如分别来自A.acidocaldarius、T.maritima的内切纤维素酶Cel9A和Cel5A[32]。
2.1.1 催化结构域 CD对纤维素水解具有催化活性,对底物具有特异性。利用X光衍射法分析Clostridiumthermocellum的纤维素酶CD[33]时发现,纤维素酶复合物的外切酶活性位点位于一个长环所形成的隧道里,它只能从纤维素的非还原性末端切下纤维二糖,内切酶的活性位点位于开放的裂缝中,可与纤维素链的任何部位结合并将其切断。这种特殊的隧道结构可以连续催化完成多个糖苷键的断裂[34]。

表1 近5年来国内外对耐热纤维素降解菌的挖掘Table 1 Excavation of thermostable cellulose-degratdaion strains in recent five years all over the world
2.1.2 碳水化合物结合结构域 CBM是没有催化活力,但有识别多糖能力并可以调节催化结构域酶活的蛋白质单位,是纤维素酶最重要的模块之一,位于酶肽链的N端或C端,少数位于中间,通过连接肽与CD相连[35-36]。最初发现附在细胞壁水解酶上的CBM能极大地提高酶对不可溶底物的催化活性[37-39],其提高纤维素酶活性的机制主要有邻近效应、靶向作用、松解功能[40]。随后一些研究者提出CBM是一种膨胀因素,通过破坏氢键来分离结晶纤维素的葡聚糖链使其逐层降解[41-42]。通过不同菌株来源的CBM删除和替代试验[43]发现CBM既能提高纤维素酶酶活,也能抑制酶活,说明CBM具有酶和底物特异性。Reyes-Ortiz等[32]将CBM融入到不含CBM的内切纤维素酶中发现酶活提高了3倍,CBM不仅能够提高纤维素酶在纤维素的表面吸附,还能提高酶对纤维素的贯穿能力从而提高CD的催化效率。相比促进纤维素酶与底物的吸附,CBM提高纤维素酶酶活的机制更加复杂需进一步研究。
2.1.3 连接肽 纤维素酶的CD与CBM之间通过一段相当长、高度糖基化的连接肽(Linker)连接,真菌纤维素酶的Linker主要由大量的Pro、Ser和Thr重复组成,细菌的Linker则富含Pro和Thr[44],细菌Linker的Pro含量是真核生物的两倍多,但是有更少的O-糖链。尽管Linker修饰可以改变纤维素酶活,但是Linker的功能作用还需要进一步研究[45]。
2.2 降解机制
对纤维素的降解机制研究得比较透彻的有两种,即好氧菌的游离纤维素酶的协同降解机制和厌氧菌的纤维小体(纤维素多酶复合体)降解机制,此外有研究显示,存在一种细胞结合型非纤维小体的纤维素降解机制[46]。
2.2.1 游离纤维素酶降解机制 游离的纤维素酶降解机制是利用真菌和细菌产生大量胞外酶对纤维素进行降解。纤维素酶协同降解是指3类纤维素酶之间的协同作用,即内切-β-1,4-葡聚糖酶(endo-β-1,4-glucanase,EG)、外切-β-1,4-葡聚糖酶(exo-β-1,4-glucanase,CBH)和β-葡萄糖苷酶(β-glucosidases,BG)之间的协同,纤维素酶与CBM之间也存在协同作用[47]。
2.2.2 纤维小体降解机制 纤维小体是水解结晶纤维素和植物细胞壁多糖的高活性的多酶复合体。这种多酶复合体内含有各种纤维素和半纤维素降解酶,并以一种连续有序的方式排列,因而在纤维素及半纤维素的降解中具有高度的协同作用[48]。纤维小体主要由两部分组成,一部分为无催化活性的支架蛋白(scaffoldin),上面有多个粘连模块(cohesin),能够与酶分子的对接模块(dockerin)特异性结合;另一部分为有催化活性的各种酶。纤维小体复合酶中的CD通过粘连模块和对接模块的相互作用形成超分子复合物(图1),复合物中的不同CD间协同作用完成对结晶纤维素的高效降解[49-50],但各组分如何协同发挥作用仍不明确。
2.2.3 细胞结合型非纤维小体的纤维素降解机制 Wilson[46]发现,好氧的哈氏噬纤维菌和厌氧的产琥珀酸丝状杆菌(F.succinogenes)对纤维素的降解机制与上述两种均不相同。这两种菌对纤维素的降解依赖于对纤维素的直接接触,且胞外几乎没有还原糖的产生,但都可以对结晶纤维素进行高效降解。两种细菌既不分泌胞外游离的纤维素酶也不产生纤维小体,但它们的纤维素酶与细胞密切相关,推测可能存在一种新的纤维素降解机制,有待进一步的研究[47]。
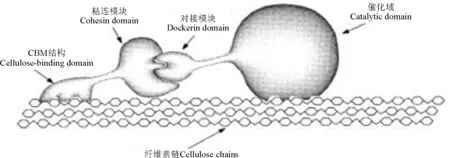
图1 纤维小体对纤维素的催化机制[38]Fig.1 Catalytic mechanism of cellosome acting on cellulose[38]
2.2.4 膨胀因子的辅助降解 膨胀因子(swollenin)最初由Saloheimo在纤维素降解真菌瑞氏木霉(Trichodermareesei)中发现[34],其序列和功能都与植物膨胀素(expansin)相近。在swollenin蛋白质结构的N-端是一个能与纤维素可逆性结合的真菌CBM结构,而C-端结构与植物膨胀素蛋白结构域类似。研究表明,swollenin能降低滤纸的强度,能造成纤维结构的局部破坏,且不产生还原糖。因此说明,swollenin可能破坏结晶纤维素的氢键网络结构,打开纤维素纤维的交连耦合[34]。研究还发现,swollenin还可以与内切纤维素酶协同作用降解结晶纤维素,通过检测产生的还原糖的释放量来定量分析swollenin的非水解性松解活力[51-52]。最近研究发现,swollenin对纤维素底物有类似于内切纤维素酶和纤维二糖水解酶的水解活性[53]。
2.2.5 纤维素氧化降解机制 早在1965年,Halliwell[54]发现,Fenton反应产生的羟基自由基对纤维素有很强的降解能力,并得到了王蔚等[55]的验证。国内有研究[56]表明,羟基自由基能使纤维素产生大量的还原性末端,并在一定程度上破坏纤维素分子间的氢键结构,在生物反应体系中羟基自由基氧化降解机制更加复杂,需要进一步的研究。
3 结晶纤维素酶的基因工程和酶工程
天然纤维素酶普遍活性不高并且产量低,随着分子生物学和基因工程技术的发展,为纤维素酶的研究开创了新前景。降解纤维素的微生物中,相对细菌而言,真菌有能大量合成纤维素酶、发酵时间长、培养困难等特点,因此可将真菌的纤维素酶基因在细菌中进行异源表达,如黄时海等[57]成功克隆到康氏木霉纤维二糖水解酶I(cbhI)基因,实现了在大肠杆菌中的表达。纤维素酶的酿酒酵母表达系统可以将纤维素最终转化为酒精,在纤维素乙醇燃料的生产过程中,简化了工艺流程,降低了水解和发酵成本[58]。如Tang等[59]在酿酒酵母中表达了分别来自S.fibuligera、A.nigerNip35和T.reeseiQM9414的BG,结果来自S.fibuligera的BG可以分泌到胞外,培养72 h酶活达到5.2 U·mL-1,比之前报道过的的酶活要高很多。同时基因敲除以及定点突变等技术手段能够确定纤维素酶中的特定基因的功能,如张聪[47]利用同源双交换的方式将C.hutchinsonii的chu-2103敲除,与野生型菌株对比检测发现chu-2103是C.hutchinsonii降解纤维素过程中主要的内切纤维素酶,但是并非关键或者必需的纤维素酶,并且分析出chu-2103极可能分布于C.hutchinsonii的菌体表面。
蛋白质工程是结晶纤维素降解酶走向工业化生产的一条重要途径,它主要包括:1)定点突变技术确定催化过程中的功能性氨基酸,如张聪[47]通过构建chu-2103氨基酸定点突变体发现chu-2103吸附纤维素以及持续性降解的关键氨基酸为W197;2)研究酶的稳定性,如王坤[60]通过分子改良技术有效提高了木聚糖酶XynAS9的热稳定性;3)增减或修饰酶分子的某些结构,如Reyes-Ortiz等[32]和Crouch等[43]的CBM的融入、删除和替代试验以及Sammond等[45]的Linker修饰试验等都能改变纤维素酶的活性。
4 结晶纤维素降解的研究展望
结晶纤维素的致密结构形成了抗降解的天然屏障,阻碍了酶的可及性,导致酶解效率低下,使其难以被降解。因此,降解结晶纤维素的关键在于提高酶的可及性,即提高酶在纤维素链上的吸附量,从而达到提高酶解效率的目的。提高酶的吸附量有两种方式,一是降低木质纤维素的结晶度,二是提高温度。在降低结晶度的方法中,物理法往往涉及到能量损耗问题,化学方法可能造成污染以及对后期的酶解产生抑制作用,而生物方法可以弥补这些不足。生物方法中纤维素酶的CBM结构、木霉产生的swollenin以及褐腐菌通过Gt因子产生的羟基自由基都能破坏纤维素的氢键结构,使得纤维素的结晶度或聚合度下降。提高温度可以提高酶的吸附量,但高温可以使酶失活,因此,对于耐高温的纤维素酶及其产生菌株的挖掘尤为重要。通过最好的生物法或者联合处理方法来降低木质纤维素的结晶度,并且通过对产酶条件优化以及构建工程菌种来提高酶的活性和热稳定性,从而达到高效降解结晶纤维素的目的。CBM结构具有增加纤维素酶在纤维素链上的吸附、提高相关纤维素酶的酶活以及破坏木质纤维素的结晶结构等功能,对结晶纤维素的降解十分重要,并且具有CBM结构的swollenin特别是纤维小体对于结晶纤维素具有很强的降解作用。因此应该研究透彻CBM与纤维素酶的协同作用、CBM如何提高相关纤维素酶的活性以及纤维小体内的各酶组分如何发挥协同作用,并利用蛋白质组学分析鉴定在木质纤维素降解中起关键作用的蛋白质,这对于通过蛋白质工程手段构建具有高效降解结晶纤维素的酶系具有重要意义。
References:
[1] British Petroleum Company.Statistical Review of World Energy 2016.London:British Petroleum,2016.
[2] Balat M,Balat H.Recent trends in global production and utilization of bio-ethanol fuel.Applied Energy,2009,86(11):2273-2282.
[3] 师静,林占熺,林东梅,苏德伟,罗海凌,林兴生,林占森,郑丹,陈锦华,姚俊新.巨菌草纤维素的酶解条件.草业科学,2014,31(4):760-765.
Shi J,Lin Z X,Lin D M,Su D W,Luo H L,Lin X S,Lin Z S,Zheng D,Chen J H,Yao J X.Enzymolysis conditions ofPennisetumsp. cellulose.Pratacultural Science,2014,31(4):760-765.(in Chinese)
[4] Perlack R D.Biomass as feedstock for a bioenergy and bioproducts industry:The technical feasibility of a billion-ton annual supply.Petroleum,2005,12(4):ix.
[5] 王钱钱.木质纤维素底物对纤维素酶吸附脱附规律及预处理同步制备纳米纤维素的研究.广州:华南理工大学博士学位论文,2012.
Wang Q Q.Study on cellulose adsorption desorption behavior onto lignocellulosic substrates and pretreatments for simultauous nanocellulose preparation.PhD Thesis.Guangzhou:South China University of Technology,2012.(in Chinese)
[6] Rabinovichml M L,Maelnick M S,Bolobova A V.Microbial cellulases(review).Applied Biochemistry and Microbiology,2002,38(4):305-322.
[7] Himmel M E,Ding S Y,Johnson D K,Adney W S,Nimlos M R,Brady J W,Foust T D.Biomass recalcitrance:Engineering plants and enzymes for biofuels production.Science,2007,315:804-807.
[8] NishiyamaY,Sugiyama J,Chanzy H,Langan P.Crystal structure and hydrogen bonding system in cellulose Iα from synchrotron X-ray and neutron fiber diffraction.Journal of the Amerrican Chemical Society,2003,125(47):14300-14306.
[9] NishiyamaY,Langan P.Chanzy H.Crystal structur eand hydrogen-bonding system in cellulose Iβ from synchrotron X-ray and neutron fiber diffraction.Journal of the Amerrican Chemical Society,2002,124(31):9074-9082.
[10] Jagtap S,Rao M.Purification and properties of a low molecular weight 1,4-β-D-glucan glucohydrolase having one active site for carboxymethyl cellulose and xylan from an alkalothermophilicThermomonosporasp.Biochemical and Biophysical Research Communications,2005,329(1):111-116.
[11] Klemm D,Heublein B,Fink H P,Bohn A.Cellulose:Fascinating biopolymer and sustainable raw material.Angewandte Chemie,2005,44(22):3358-3393.
[12] 陈明凤.纤维素的去结晶.广州:华南理工大学硕士学位论文,2011.
Chen M F.Decrystalization of cellulose.Master Thesis.Guangzhou:South China University of Technology,2012.(in Chinese)
[13] 马小娟,黄六莲,陈礼辉,曹石林.纤维素结晶度的测定方法.造纸科学与技术,2012,31(2):75-78.
Ma X J,Huang L L,Chen L H,Cao S L.Determination methods for crystallinity of cellulose.Paper Science and Technology,2012,31(2):75-78.(in Chinese)
[14] Wyk J P.Cellulase adsorption-desorption and cellulose saccharification during enzymatic hydrolysis of cellulose materials.Biotechnology Letters,1997,19(8):775-778.
[15] 张景强,李清春,林鹿.解结晶对纤维素吸附纤维素酶的影响.林产化学与工业,2016,36(1):105-111.
Zhang J Q,Li Q C,Lin L.Effect of decrystallization of cellulose on adsorbing cellulose.Chemical and Industry of Forest Products,2016,36(1):105-111.(in Chinese)
[16] 张振,臧中盛,刘苹,常秀莲,温少红.木质纤维素预处理方法的研究进展.湖北农业科学,2012,51(1):1306-1309.
Zhang Z,Zang Z S,Liu P,Chang X L,Wen S H.Research advance of pretreatment technology of lignocelluloses.Hubei Agricutural Science,2012,51(1):1306-1309.(in Chinese)
[17] Zhang M F,Qin Y H,Ma J Y,Yang L,Wu Z K,Wang T L,Wang W G,Wang C W.Depolymerization of microcrystalline cellulose by the combination of ultrasound and Fenton reagent.Ultrasonics Sonochemistry,2016,31:404-408.
[18] 孟冬冬,张坤迪,英瑜,陈晓华,李福利.极端嗜热厌氧菌Caldicellulosiruptor木质纤维素降解研究.生物加工过程,2014,12(1):37-45.
Meng D D,Zhang K D,Ying Y,Chen X H,Li F L.Research progress in lignocelluloses degradation by genusCaldicellulosiruptor.Chinese Journal of Bioprocess Engineering,2014,12(1):37-45.(in Chinese)
[19] 赵银瓶,马诗淳,孙颖杰,黄艳,邓宇.嗜热厌氧纤维素分解菌的分离鉴定及其酶学特性.微生物学报,2012,52(9):1160-1166.
Zhao Y P,Ma S C,Sun Y J,Huang Y,Deng Y.Isolation,identification and enzyme characterization of a thermophilic cellulolytic anaerobic bacterium.Acta Microbiologica Sinica,2012,52(9):1160-1166.(in Chinese)
[20] 蒋芳,刘松青,甄阳光,谢光美.一株产高温纤维素酶菌株的分离筛选.纤维素科学与技术,2015,23(2):50-54.
Jiang F,Liu Q S,Zhen Y G,Xie G M.Isolation and screening of a thermophilic cellulose bacterial strain.Journal of Cellulose Science and Technology,2015,23(2):50-54.(in Chinese)
[21] 梅凡,林白雪,赵超,刘斌.温泉中降解纤维素嗜热细菌的分离与鉴定.湖北农业科学,2014,53(7):1516-1519.
Mei F,Lin B X,Zhao C,Liu B.Isolation and identification of thermophiles degrading cellulose in hot spring.Hubei Agricultural Sciences,2014,53(7):1516-1519.(in Chinese)
[22] 严芬,李源涛,李丽莎,林娟.一株产高温纤维素酶真菌的筛选、鉴定及酶学性质研究.福州大学学报:自然科学版,2013,41(3):397-402.
Yan F,Li Y T,Li L S,Lin J.Isolation and identification of hot-resisitant cellulase fungus and study on enzymic properties.Journal of Fuzhou University:Natural Science Edition,2013,41(3):397-402.(in Chinese)
[23] 韩铭,袁月祥,闫志英,贺蓉娜,刘晓风,廖银章.一株产耐热纤维素酶菌株的筛选及酶学性质.应用与环境生物学报,2012,18(1):75-79.
Han M,Yuan Y X,Yan Z Y,He R N,Liu X F,Liao Y Z.Screening of a thermostable cellulase-producing strain and its enzymatic properties.Chinese Journal of Applied and Environmental Biology,2012,18(1):75-79.(in Chinese)
[24] 杨丽娜,杨明明,龚月生.产耐热性纤维素酶菌株的分离·鉴定及其酶学性质研究.安徽农业科学,2012,40(14):8103-8105.
Yang L N,Yang M M,Gong Y S.Isolation and identification of a strain producing thermostable cellulose and its enzymatic charateristic.Journal of Anhui Agricutural Science,2012,40(14):8103-8105.(in Chinese)
[25] Ma L,Yang W P,Meng F X,Ji S Y,Xin H Y,Cao B Y.Characterization of an acidic cellulose produced byBacillussubtilisBY-4 isolated from gastrointestinal tract of Tibetan pig.Journal of the Taiwan Institute of Chemical Engineers,2015,56:67-72.
[26] Meng F X,Ma L,Ji S Y,Yang W P,Cao B Y.Isolation and characterization ofBcillussubtilisstrain BY-3,a thermophilic and efficient cellulose-producing bacterium on untreated plant biomass.Letters in Applied Microbionology,2014,59(3):306-312.
[27] Lyu W,Yu Z T.Isolation and characterization of two thermophilic cellulolytic strains ofClostridiumthermocellumfrom a compost sample.Journal of Applied Microbiology,2013,114(4):1001-1007.
[28] Blume L R,Noronha E F,Leite J,Queiroz R M L,Ricart C A O,Sousa M V D,Felix C R.Characterization ofClostridiumthermocellum,isolates grown on cellulose and sugarcane bagasse.Bioenergy Research,2013,6(2):763-775.
[29] Asha B M,Revathi M,Yadav A,Sakthivel N.Purification and characterization of a thermophilic cellulase from a novel cellulolytic strain,Paenibacillusbarcinonensis.Journal of Microbiology and Biotechnology,2012,22(11):1501-1509.
[30] Tachaapaikoon C,Kosugi A,Pason P,Waeonukul R,Ratanakhanokchai K,Kyu K L,Arai T,Murata Y,Mori Y.Isolation and characterization of a new cellulosome-producingClostridiumthermocellumstrain.Biodegradation,2012,23(1):57-68.
[31] Svetlitchnyi V A,Kensch O,Falkenhan D A,Prinz M,Sasssi J,Schickor A,Curves S.Single-step ethanol production from lignocellulose using novel extremely thermophilic bacteria.Biotechnology for Biofuels,2013,6(1):1-15.
[32] Reyes-Ortiz V,Heins R A,Cheng G,Kim E Y,Vernon B C,Elandt R B,Adams P D,Sale K L,Hadi M Z,Simmons B A,Kent M S,Tullman E D.Addition of a carbohydrate-binding module enhances cellulase penetration into cellulose substrates.Biotechnol Biofuels,2013,6(1):93.
[33] Joliff G,Béguin P,Juy M,Millet J,Ryter A,Poljak R,Aubert J P.Isolation,crystallization and properties of a new cellulase ofClostridiumthermocellumoverproduced inEscherichiacoli.Nature Biotechnology,1986,10(4):896-900.
[34] 周庆新.木霉纤维素膨胀因子Swollenin与β-葡萄糖苷酶的功能研究.济南:山东大学博士学位论文,2011.
Zhou Q X.Functional analysis of cellulose degradation factor swallenin and β-glucodidase inTrichodermareesei.PhD Thesis.Ji’nan:Shandong University,2011.(in Chinese)
[35] 张婧.极端微生物资源的发掘及相关新型糖苷水解酶基因的克隆分析研究.成都:四川大学博士学位论文,2012.
Zhang J.Research of extreme microbiology sources and cloning and analysis of some novel genes encoding glucoside hydrolase.PhD Thesis.Chengdou:Sichuan University,2012.(in Chinese)
[36] Díaz M,Fernández-balos G M,Soliveri M,Soliveri J,Copa-Patio J L,Santamaría R I.Post-translational processing of modular xylanases fromStreptomycesis dependent on the carbohydrate-binding module.Journal of Industrial Microbiology and Biotechnology,2011,38(9):1419-1426.
[37] Bolam D N,Ciruela A,McQueen-Mason S,Simpson P,Williamson M P,Rixon J E,Boraston A,Hazlewood G P,Gibert H J.Pseudomonas cellulose-binding domains mediate their effects by increasing enzyme substrate proximity.Biochemical Journal,1998,331(3):775-781.
[38] Gérrard G,Koivula A,Söderlund H,Béguin P.Cellulose-binding domains promote hydrolysis of different sites on crystalline cellulose.Proceeding National Academy of Sciences of the United States of America.2000,97(19):10342-10347.
[39] Black G W,Rixon J E,Clarke,Hazlewood G P,Theodorou M K,Morris P,Gilbert H J.Evidence that linker sequences and cellulose-binding domains enhance the activity of hemicellulases against complex substrates.Biochemical Journal,1996,319(2):515-520.
[40] Boraston A B,Bolam D N,Gilbert H J,Davies G J.Carbohydrate-binding modules:Fine-tuning polysaccharide recognition.Biochemical Journal,2004,382(3):769-781.
[41] Wang L S,Zhang Y Z,Gao P J.A novel function for the cellulose binding module of cellobiohydrolase Ⅰ.Science in China,2008,51(7):620-629.
[42] Lee I,Evans B R,Woodward J.The mechanism of cellulase action on cotton fibers:Evidence from atomic force microscopy.Ultramicroscopy,2008,82:213-221.
[43] Crouch L I,Labourel A,Walton P H,Davies G J,Gilbert H J.The contribution of non-catalytic carbohydrate binding modules to the activity of lytic polysaccharide monooxygenases.The Journal of Biological Chemistry,2016,291(14):7439-7449.
[44] Yaniv O,Frolow F,Levy-Assraf M,Lamed R,Bayer E A.Interactions between family 3 carbohydrate binding modules (CBMs) and cellulosomal linker peptides.Methods in Enzymology,2012,510:247-259.
[45] Sammond D W,Payne C M,Brunecky B,Himmel M E,Crowley M F,Beckham G T.Cellulase linkers are optimized based on domain type and function:Insights from sequence analysis,biophysical measurements,and molecular simulation.PLoS One,2012,7(11):e48615.
[46] Wilson D B.Three microbial strategies for plant cell wall degradation.Annals of the New York Academy of Sciences,2008,1125(1):289-297.
[47] 张聪.Cytophagahutchinsoni纤维素酶系研究.济南:山东大学硕士学位论文,2015.
Zhang C.Reseach on function of crystal cellulose degradation related gene inCytophagahutchinsonii.Master Thesis.Ji’nan:Shandong University,2015.(in Chinese)
[48] Fontes C M,Gilbert H J.Cellulosomes:Highly efficient nanomachines designed to deconstruct plant cell wall complex carbohydrates.Annual Review of Biochemistry,2010,79(1):655-681.
[49] 孟凡辉.热纤梭菌及纤维小体降解结晶纤维素超微结构分析.济南:山东大学硕士学位论文,2015.
Meng F H.Ultrastructural analysis of crystalline cellulose degraded byClostridiumthermocellumand cellulosome.Master Thesis.Ji’nan:Shandong University,2015.(in Chinese)
[50] Fan L H,Zhang Z J,Yu X Y,Xue Y X,Tan T W.Self-surface assembly of cellulosomes with two miniscaffoldins onSaccharomycescerevisiaefor cellulosic ethanol production.Proceeding National Academy of Sciences of the United Statesof America,2012,109(33):13260-13265.
[51] 唐仁陶.溶胀素与内切纤维素酶协同水解结晶纤维素的研究.长春:吉林大学硕士学位论文,2010.
Tang R T.Synergistic effcts of swollenin and endouglucanase on the degradation of crystalline cellulose.Master Thesis.Changchun:Jilin University,2010.(in Chinese)
[52] Wang Y G,Tang R T,Tao J,Gao G,Wang X N,Mu Y,Feng Y.Quantitative investigation of non-hydrolytic disruptive activity on crystalline cellulose and application to recombinant swollenin.Applied Microbiology and Biotechnology,2011,91(5):1353-1363.
[53] Andberg M,Penttilä M,Saloheimo M.Swollenin fromTrichodermareeseiexhibits hydrolytic activity against cellulosic substrates with features of both endoglucanases and cellobiohydrolases.Bioresource Technology,2015,181:105-113.
[54] Halliwell G.Catalytic decomposition of cellulose under biological condition.Biochemical Journal,1965,95:35-40.
[55] 王蔚,段星源,孙彩云,高培基.褐腐真菌产生的羟基自由HO·对纤维素作用的研究.菌物系统,2002,21(3):400-405.
Wang W,Duan X Y,Sun C Y,Gao P J.Effects of hydroxyl ranical HO· on cellulose degradation by brown-rot fungi.Mycosytema,2002,21(3):400-405.(in Chinese)
[56] 吴映宝,刘淑艳,卢雪梅,高培基.Fenton试剂预处理对纤维素酶解的作用.纤维素科学与技术,2004,12(3):9-16.
Wu Y B,Liu S Y,Lu X M,Gao P J.The effect of pretreatment by fenton reagents on the biodegradation of cellulose.Journal of Cellulose Science and Technology,2004,12(3):9-16.(in Chinese)
[57] 黄时海,康超,黄飞,曹喜秀,何鑫平,汪晟,吴孔阳,曹普美,梁智群,李湘萍.康氏木霉纤维素酶CBHI基因克隆及在大肠杆菌中的表达.中国酿酒,2011(2):76-80.
Huang S H,Kang C,Huang F,Cao X X,He X P,Wang S,Wu K Y,Cao P M,Liang Z Q,Li X P.Cloning ofCBHIgene ofTrichodermakoningiicellulase and expression inEscherichiacoli.Brewing,2011(2):76-80.(in Chinese)
[58] 徐丽丽,沈煜,鲍晓明.酿酒酵母纤维素乙醇统合加工过程(CBP)的策略及研究进展.生物工程学报,2010,26(7):870-879.
Xu L L,Shen Y,Bao X M.Progress and strategies on bioethanol production from lignocelluloses by consolidated bioprocessing(CBP) usingSaccharomycescerevisiae.Chinese Journal of Biotechnology,2010,26(7):870-879.(in Chinese)
[59] Tang H,Hou J,Shen Y,Xu L,Yang H,Fang X,Bao X.High β-glucosidase secretion inSaccharomycescerevisiaeimproves the efficiency of cellulose hydrolysis and ethanol production in simultaneous saccharification and fermentation.Journal of Microbiology and Biotechnology,2013,23(11):1577-1585.
[60] 王坤.嗜热纤维素酶基因的克隆表达及链霉菌S9来源的木聚糖酶XynAS9热稳定性改良研究.北京:中国农业科学院硕士学位论文,2014.
Wang K.Gene cloning and heterologous expression of thermophiilic cellulose and thermostablility improvement of aStreptomycessp. S9 xylanase XynAS9.Master Thesis.Beijing:Chinese Academy of Agricultural Sciences,2014.(in Chinese)
(责任编辑 王芳)
2016年10月国内市场主要畜产品与饲料价格分析
2016年10月畜产品价格整体呈现下降趋势。受终端鲜销市场需求端的掣肘和全国生猪存栏量继续偏弱的影响,猪价上涨的动力略显不足,自6月份猪价持续下降。鸡肉和鸡蛋价格下降的原因:一是目前中秋、国庆两节已过,市场购买力明显下降;二是天气转凉,蛋鸡产量有所增加,市场供应充足。随着消费需求的减弱,牛肉价格自5月份连续5个月上涨之后首次出现下降;养羊生产环节抗风险能力差、进口羊肉冲击着产业发展、全国羊肉价格降低等诸多综合因素导致羊肉价格从2月份持续下降。玉米、大豆、棉粕和菜粕价格均下降,玉米、大豆和菜粕从7月份持续下降;豆粕和DDGS价格小幅度上涨。纵然收储消息强劲,收储价格也较为理想,但收储规模非常有限,同时东北大量新玉米上市还未上量,供应压力并未完全释放,压制玉米价格。进口大豆价格对国内生产造成了挤压和抑制,使国内生产不但没有随需求增长而增长,反而大幅度减少;新豆滞销导致贸易商收购热情减退,农民因为市场价与心理预期价格落差过大有惜售情绪,购销双方僵持导致大豆价格涨跌受限。菜粕现货价格继续追随盘面及豆粕窄幅震荡下跌为主,后期随着进口菜籽到港增多、豆粕性价比提高及水产养殖全面进入淡季;新季棉粕集中上市后,棉粕性价比劣势愈发突出,一定程度上拉低棉粕现货价格。受美豆价格低位反弹,进口大豆压榨利润有所下降,油厂压榨开机率较小,这导致豆粕现货连续下跌2个月后依旧凭借供应偏紧出现不同程度上涨。美国进口DDGS因“双反”案件成立,国内进口者需恢复缴纳增值税,这对DDGS的价格形成支撑。与2015年同期相比,猪肉、豆粕和棉粕价格分别上涨0.12%、15.85%和17.49%,牛肉、羊肉、鸡肉、鸡蛋、玉米和大豆价格分别下降5.10%、9.46%、6.94%、8.70%、9.08%和1.14%。
一、畜产品价格均下降,耗粮型畜产品价格下降幅度较大且均为西部地区最高
10月份,猪肉、牛肉、羊肉、鸡肉和鸡蛋价格分别为23.46、52.85、43.52、14.50和7.46元·kg-1,环比分别下降5.90%、0.83%、0.53%、1.56%和9.02%;从区域分析,鸡肉价格区域差异最大,牛肉价格区域差异最小,猪肉价格西部地区分别高于东部和中部3.64%和6.70%,牛肉价格中部地区分别高于东部和西部4.41%和4.23%,羊肉价格东部地区分别高于中部和西部7.03%和8.62%,鸡肉价格西部地区分别高于东部和中部22.09%和39.35%,鸡蛋价格西部地区分别高于东部和中部5.89%和5.61%。
二、豆粕和DDGS价格小幅度上涨、其它饲料价格均小幅度下降,豆粕和棉粕区域差异较小
10月份,豆粕和DDGS价格分别为3 380.35和1 911.55元·t-1,环比分别上涨1.35%和1.51%;从区域分析,豆粕价格从西向东逐渐降低,豆粕价格西部地区分别高于东部和中部2.79%和1.57%,DDGS东部地区高于中部15.02%。玉米、大豆、棉粕和菜粕价格分别为1 856.90、4 003.62、2 572.91和2 288.00元·t-1,环比分别下降4.02%、0.31%、2.63%和0.20%;从区域分析,玉米价格西部地区分别高于东部和中部2.72%和8.04%,大豆价格东部地区分别高于中部和西部7.15%和12.48%,棉粕价格中部地区分别高于东部和西部0.07%和5.46%,菜粕价格东部地区分别高于中部和西部17.23%和9.13%。
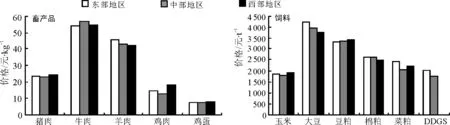
图1 2016年10月国内市场主要畜产品与饲料价格
数据来源:猪肉、牛肉、羊肉、鸡肉和鸡蛋http://pfscnew.agri.gov.cn/;大豆、大豆和豆粕http://www.zhuwang.cc/,http://www.pigol.cn/;棉粕、菜粕和DDGS http://www.feedtrade.com.cn/,http://www.chinafeed.org.cn/。东部、中部和西部的划分依据国家统计局将全国的划分标准,东部包括北京、天津、河北、辽宁、上海、福建、浙江、江苏、山东、广东,中部包括山西、吉林、黑龙江、安徽、江西、湖北、湖南、河南,西部包括内蒙古、贵州、云南、西藏、陕西、甘肃、青海、宁夏、新疆、广西、重庆。
(兰州大学草地农业科技学院 王春梅 整理)
Advance in research on degradation of crystalline cellulose
Shen En-hua1, Wu Hua-wei1, Li Xiang-qian2
(1.College of Life Science, Yangtze University, Jingzhou 434025, China;2.Faculty of Life Science &Chemical Engineering, Huaiyin Institute of Technology, Huai’an 223003, China)
Due to increased consumption of fossil energy and its pollution to the environment seeking renewable and clean energy has become the focus of attention in many countries. Lignocellulose is the most organic polymer on the earth, which has great potential for solving the energy crisis, but it has not been effectively used, the existence of the crystalline region of cellulose is a major problem hindering its degradation. This paper introduces the structure of crystalline cellulose, decrystallization method and potent degradation strain; the structure and function of cellulase; degradation mechanism of crystalline cellulose; genetic engineering and enzyme engineering modification of cellulase. It is underlined that should increase to excavate for the excellent, thermostable cellulose-degratdaion strains and thorough study of related function mechanism of carbohydrate binding module, it is of great significance for the efficient degradation of crystalline cellulose.
crystalline cellulose; cellulase; mechanism of degradation; carbohydrate binding module; cellulosome; swollenin; renewable energy
Wu Hua-wei E-mail:wuhuawei-2000@163.com
10.11829/j.issn.1001-0629.2016-0310
2016-06-08 接受日期:2016-08-30
国家自然科学基金(21576110);生物质转化与过程集成工程实验室开放课题(JPELBCPL2014007)
谌恩华(1990-),男,湖北麻城人,在读硕士生,主要从事纤维素酶基因的发掘以及工程改造。E-mail:1135384059@qq.com
吴华伟(1977-),男,湖北荆州人,副教授,博士,主要从事微生物工业酶基因资源发掘及利用研究。E-mail:wuhuawei-2000@163.com
X172;Q949.9
A
1001-0629(2016)11-2367-08*
谌恩华,吴华伟,李相前.结晶纤维素的降解.草业科学,2016,33(11):2367-2374.
Shen E H,Wu H W,Li X Q.Advance in research on degradation of crystalline cellulose.Pratacultural Science,2016,33(11):2367-2374.

