吡虫啉对蜜蜂幼虫的室内毒性研究
谭丽超,卜元卿,程燕,周军英,单正军
1. 环境保护部南京环境科学研究所,南京 210042 2. 南京信息工程大学 江苏省大气环境与装备技术协同创新中心,南京 210044
吡虫啉对蜜蜂幼虫的室内毒性研究
谭丽超1,*,卜元卿1,2,程燕1,周军英1,2,单正军1,2
1. 环境保护部南京环境科学研究所,南京 210042 2. 南京信息工程大学 江苏省大气环境与装备技术协同创新中心,南京 210044
吡虫啉是目前使用最广泛的新烟碱类农药,其不合理使用破坏蜜蜂的嗅觉记忆能力,影响采集行为,导致多种亚致死效应。利用室内人工饲养蜜蜂幼虫技术,选取意大利蜜蜂幼虫为研究对象,经3 d适应性饲养后,连续3 d喂食含不同浓度的吡虫啉日粮,测定蜜蜂幼虫的存活率、化蛹率和羽化率,评估吡虫啉对蜜蜂幼虫生长发育影响。结果表明,吡虫啉处理剂量为15 ng·幼虫-1时,并不影响蜜蜂幼虫存活率、化蛹率和羽化率;当处理剂量达到150 ng·幼虫-1时,蜜蜂幼虫羽化率下降,但不影响蜜蜂幼虫的存活率和化蛹率;幼虫7 d半数致死剂量为2 300 ng·幼虫-1。高剂量吡虫啉对蜜蜂幼虫存活率、化蛹率和羽化率均存在影响,处理剂量越高,存活率、化蛹率和羽化率越低,呈高度负相关(r=-0.99,-0.94,-0.89),同时蜜蜂幼虫的羽化时间延长。研究可为吡虫啉的合理使用提供科学参考。
吡虫啉;蜜蜂幼虫;室内毒性
蜜蜂是自然界授粉昆虫中种类最多、数量最大的类群,全球约87.5%的开花植物依靠蜜蜂等昆虫授粉[1],其中87种为主要粮食作物,占世界粮食总产量的35%[2-3]。无论是人工饲养还是野生存在的蜜蜂,都在作物授粉方面发挥着巨大作用[4-5]。最近,西方蜜蜂数量全球性骤减,这引起了社会各界的极大关注。Farooqui[6]在调查蜂群崩溃综合症(colony collapse disorder,CCD)时,系统科学地分析了各种假设,再次指出蜜蜂胁迫因子很多,其中化学农药的滥用是重要因素之一,并且强调了新烟碱类杀虫剂潜在风险。特别是当欧盟委员会决定自2013年12月1日起,2年之内禁止3种新烟碱类杀虫剂在蜜蜂喜好的开花作物上使用,引发了新一轮关于新烟碱类杀虫剂与蜜蜂健康之间的讨论。
吡虫啉是新烟碱类杀虫剂的代表品种,自1991年上市以来,连续多年成为全球销售额最大的杀虫剂[7-8]。其杀虫机制为通过阻断昆虫中枢神经系统的正常传导使其出现麻痹甚至死亡现象,被广泛用作种衣剂,可随植物生长扩散到植物各个组织,包括花粉和花蜜,引起蜜蜂的慢性中毒,导致学习记忆能力等降低并引起行为改变,比如采集积极性下降、迷失方向等[9-11]。吡虫啉的不合理利用,不仅对采集蜂的采集行为和健康产生严重影响,还将对蜜蜂幼虫的生长发育产生影响。吡虫啉对蜜蜂幼虫的影响主要来自受污染的蜂蜜、花粉以及巢脾中蓄积的吡虫啉。幼虫的成活率对蜂群的发展壮大至关重要,一个蜂群中幼蜂的数量越多,发展壮群的可能性越大,采集能力越强,从这个层面说,幼蜂比老蜂更重要。
吡虫啉对蜜蜂幼虫的影响研究较少,仅个别研究者开展了蜂巢内吡虫啉对蜜蜂幼虫的影响研究,然而蜜蜂是典型的真社会性昆虫,具有明确而细致的劳动分工,蜂群中的幼虫食物由专职哺育蜂来提供,而人工对幼虫进行操作,幼虫往往会被工蜂遗弃,自然蜂群中添加杀虫剂易存储于巢脾上影响蜂群繁殖,同时外界蜜源冲淡杀虫剂剂量,存在试验误差。开展室内吡虫啉对蜜蜂幼虫毒性影响研究,可人为控制幼虫食物成分,排除哺育蜂以及外界蜜源的影响,结果更为准确。
本文参照国际经济合作与发展组织(OECD)有关蜜蜂幼虫毒性试验准则,利用可行的蜜蜂幼虫的室内饲养模式,以蜜蜂幼虫存活率、化蛹率和蛹羽化率为评价指标,开展吡虫啉对蜜蜂幼虫室内毒性试验,科学的评价吡虫啉对蜜蜂幼虫的影响,为养蜂区域吡虫啉的合理使用提供科学依据,为评价新烟碱类杀虫剂对蜜蜂的风险性评估做数据支持。
1 材料与方法(Materials and methods)
1.1 试验器材
供试昆虫:健康成年的意大利蜜蜂蜂群,来源于环境保护部南京环境科学研究所国家环境保护农药环境评价与污染控制重点实验室蜂场。
供试药剂:98%吡虫啉原药。
供试材料:移虫针、48孔细胞培养板、24孔细胞培养板、无菌水、鲜蜂王浆、D-果糖、葡萄糖、酵母提出物等,购自南京荣华试剂有限公司。
所需仪器:恒温培养箱(CTHI-250B,中国,上海施都凯)、烘箱(DHG-9146A,中国,上海百典仪器设备有限公司)、电子天平(PB203-N,中国,上海世义精密仪器有限公司)。
1.2 试验方法
试验在蜂王产卵期内进行,试验开始前的4周内禁止用药。分别从3个不同的健康蜂群中选取1 d龄后期幼虫。
幼虫基础日粮为50%的新鲜蜂王浆和50%的含1%的酵母提取物、6%的葡萄糖和6%果糖的水溶液。
试验第1天,从3个蜂群上选取1 d龄后期幼虫,置于48孔板上,喂食等量的基础日粮,经3 d适应性饲养(温度34~35 ℃,湿度95%),试验开始后的第4天进行健康检查,剔除异常、生病、受伤的幼虫,再分配到各处理组中。试验设置1个空白对照组(C1,始终喂基础日粮),1个溶剂对照组(C2,始终喂基础日粮)及5,50,500,1 000,2 000和3 000 mg·L-16个浓度处理组(于试验开始后的第4天、第5天和第6天每天分别添加1 μL药液于基础日粮中喂食),每组12只幼虫,3个重复。试验开始后的第7天,将幼虫转移至铺有灭菌纸的24孔细胞培养板中准备化蛹,每孔1只。培养板置于34 ℃避光恒温培养箱。此后不再移动虫体,观察幼虫在孔中完成排便、吐丝、化蛹和羽化的过程。试验流程图见图1。
1.3 试验指标
分别于试验的第5天,第6天和第7天记录死亡数,用转移工具碰触幼虫,幼虫不动或没反应则认为死亡,将死亡的个体及时移出,直至未死亡的蛹全部羽化出房为止,统计幼虫存活率、化蛹率和蛹羽化率。
1.4 数据处理
应用SPSS 16.0对试验数据做方差分析,处理组与对照组之间的差异采用t检验进行分析,P<0.05为差异显著。
2 结果(Results)
2.1 室内人工培育蜜蜂幼虫的技术
建立实验室内人工饲养蜜蜂幼虫的技术,是蜜蜂幼虫作为模式生物研究的基础,是开展农药对蜜蜂幼虫毒性试验的前提。需要探索可行的蜜蜂幼虫的饲养模式,优化关键因素,如环境条件、日粮配方、虫龄、化蛹条件等,提高幼虫存活率、蛹化率和羽化率。本研究通过筛选,获得了比较理想的蜜蜂幼虫日粮营养配方(50%的新鲜蜂王浆和50%的含1%的酵母提取物、6%的葡萄糖和6%果糖的水溶液),同时发现1 d龄后期幼虫饲喂效果明显优于1 d龄前期幼虫,垫干燥的无菌擦镜纸的化蛹板更有利于幼虫的发育,其中幼虫存活率、蛹化率和羽化率均可达到90%以上。
2.2 吡虫啉对蜜蜂幼虫存活率影响
2.3 吡虫啉对蜜蜂幼虫化蛹率影响
化蛹是完全变态昆虫在幼虫和成虫之间的一个发育阶段,蛹期主要是把内部器官加以改造和分化,形成成蜂的各种器官。逐渐呈现出头、胸、腹3部分,附肢也显露出来,颜色由乳白色逐步变深,是幼虫转变成为虫过程的过渡时期。化蛹率表示蜜蜂幼虫生长到一定阶段转化成蛹的能力,用蛹化数占7 d存活幼虫的比例表示。统计分析试验结果(图3)可知,当处理剂量小于等于150 ng·幼虫-1时,处理组幼虫化蛹率与对照组间无明显差异,当处理剂量大于等于1 500 ng·幼虫-1时,处理组幼虫化蛹率与对照组间存在显著性差异(P<0.05)。
2.4 吡虫啉对蜜蜂幼虫羽化率影响
发育成熟的蛹,脱下蛹壳,咬破巢房封盖,羽化为成蜂。用羽化为成蜂数占7 d存活幼虫的比例表示。统计分析试验结果(图4)可知,当处理剂量小于等于15 ng·幼虫-1时,处理组幼虫羽化率与对照组间无明显差异,当处理剂量大于等于150 ng·幼虫-1时,处理组幼虫羽化率与对照组间存在显著性差异(P<0.05)。

图1 蜜蜂幼虫毒性试验流程注:A,基础日粮;B,基础日粮+1 μL处理药液。Fig. 1 The process of honeybee larvae toxicity testNote: A, basal diet; B, basal diet + 1 μL test solution.

图2 吡虫啉对蜜蜂幼虫存活率影响注:a,b,c,d,e,f表示各组间差异,相同字母代表差异不显著,显著水平P<0.05;C1,空白对照;C2,溶剂对照。Fig. 2 The impact of imidacloprid on survival rate of honeybee larvaeNote: a, b, c, d, e, f show the difference between each group, the same letter represent no significant difference, significant level P<0.05; C1, blank control; C2, solvent control.

图3 吡虫啉对蜜蜂幼虫化蛹率影响注:a,b,c,d,e,f表示各组间差异,相同字母代表差异不显著,显著水平P<0.05。Fig. 3 The impact of imidacloprid on pupation rate of honeybee larvaeNote: a, b, c, d, e, f show the difference between each group, the same letter represent no significant difference, significant level P<0.05.
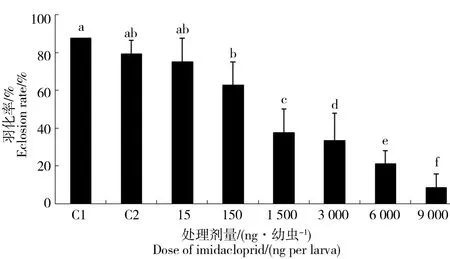
图4 吡虫啉对蜜蜂幼虫羽化率影响注:a,b,c,d,e,f表示各组间差异,相同字母代表差异不显著,显著水平P<0.05。Fig. 4 The impact of imidacloprid on eclosion rate of honeybee larvaeNote: a, b, c, d, e, f show the difference between each group, the same letter represent no significant difference, significant level P<0.05.
3 讨论(Discussion)
根据OECD试验准则的要求,空白对照组存活率不低于80%,通过对试验环境条件、日粮配方、虫龄以及化蛹板的优化,本试验空白对照组存活率为91.67%,符合试验的质控要求,试验方法有效、可行。
Yang等[10]通过研究蜂巢中不同剂量的吡虫啉对蜜蜂幼虫的影响发现:当吡虫啉剂量达到24 ng·蜂-1时,不影响蜜蜂幼虫的化蛹率和羽化率,当处理剂量越高,化蛹率和羽化率越低。本试验结果表明15 ng·幼虫-1的吡虫啉处理剂量不影响存活率、化蛹率和羽化率;当处理剂量越高,存活率、化蛹率和羽化率越低,呈高度负相关,研究结果与前人结果较为吻合。
试验结果发现,当处理剂量大于等于1 500 ng·幼虫-1时,处理组幼虫存活率和化蛹率与对照组间存在显著性差异(P<0.05),而当处理剂量大于等于150 ng·幼虫-1时,处理组幼虫羽化率与对照组间存在显著性差异(P<0.05),可见吡虫啉对蜜蜂幼虫羽化抑制作用明显。Wu等[11]研究了巢脾中残留剂量的吡虫啉对蜜蜂幼虫和成年工蜂寿命的影响,结果表明:蜂巢中残留剂量的农药使蜜蜂幼虫的羽化时间增长。Abbott等[12]用30~300 μg·kg-1的吡虫啉饲喂蜜蜂得出了相同的结论。可见吡虫啉延长蜜蜂幼虫的羽化时间,对种群发育产生不良影响。
Li课题组设计合成了一种比率型的汞离子探针BT(见图4)。当加入汞离子后,缩硫醛与汞离子作用恢复成醛基,使探针的发射波长从530 nm蓝移至454 nm。在含有2%DMSO溶液中,探针对汞离子的检测限为7.6 nmol/L。在pH=5~9范围内,对汞离子的响应较好,探针具有较好的选择性,响应时间约为35 min,将该探针成功应用于细胞成像。
统计以往吡虫啉对蜜蜂急性毒性试验结果,发现蜜蜂半数致死剂量为3~81 ng·蜂-1[13-14]。本试验中当吡虫啉处理剂量低于150 ng·幼虫-1时,幼虫存活率没有影响,计算得到幼虫半数致死剂量为2 300 ng·幼虫-1,可见蜜蜂幼虫对吡虫啉的耐受性高于成蜂。吡虫啉作为乙酰胆碱受体的抑制剂,能够结合乙酰胆碱受体而阻碍乙酰胆碱与受体的结合。乙酰胆碱在蜜蜂脑中的分布非常广泛,在蜜蜂头部,尤其是复眼和单眼,有大量乙酰胆碱酯酶分布,在蜜蜂的触角叶、蘑菇体的蕈体冠和α叶都有乙酰胆碱酯酶(AChE)和乙酰胆碱受体(nAChR)存在。蜜蜂幼虫缺失许多乙酰胆碱酯酶,例如蘑菇体内的内源神经细胞肯扬细胞,即吡虫啉的靶细胞[15],这可能是蜜蜂幼虫对吡虫啉的耐受性高于成蜂的原因。Gregorc等[16]研究发现饲喂浓度为400 mg·kg-1的吡虫啉对蜜蜂幼虫中肠细胞凋亡有显著影响。因此蜜蜂幼虫时期接受高剂量的吡虫啉导致死亡,归因于细胞凋亡,而不是神经毒性。
综上,蜜蜂幼虫对吡虫啉的耐受性高于成蜂,但高剂量吡虫啉对蜜蜂幼虫存活率、化蛹率和羽化率均存在影响,延长蜜蜂幼虫的羽化时间,从而影响整个群体的生存状态。试验结果只能作为吡虫啉对蜜蜂幼虫生长发育影响的初步研究,可为吡虫啉的合理利用提供数据支撑,全面评价吡虫啉对蜜蜂蜂群的影响还需要进一步实验。
[1] Ollerton J, Winfree R, Tarrant S. How many flowering plants are pollinated by animals [J]. Oikos, 2011, 120(3): 321-326
[2] Klein A M, Vaissière B E, Cane J H, et al. Importance of pollinators in changing landscapes for world crops [J]. Proceedings of the Royal Society of London B: Biological Sciences, 2007, 274(1608): 303-313
[3] Velthuis H H W, van Doorn A. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination [J]. Apidologie, 2006, 37(4): 421-451
[4] Garibaldi L A, Steffan-Dewenter I, Winfree R, et al. Wild pollinators enhance fruit set of crops regardless of honey bee abundance [J]. Science, 2013, 339(6127): 1608-1611
[5] Gill R J, Ramos-Rodriguez O, Raine N E. Combined pesticide exposure severely affects individual- and colony-level traits in bees [J]. Nature, 2012, 491(7422): 105-108
[6] Farooqui T. A potential link among biogenic amines-based pesticides, learning and memory, and colony collapse disorder: A unique hypothesis [J]. Neurochemistry International, 2013, 62(1): 122-136
[7] 段丽芳, 李贤宾, 柯昌杰, 等. 欧盟新烟碱类农药限用政策对我国农药相关产业的风险分析[J]. 农药科学与管理, 2013, 34(9): 15-20
Duan L, Li X B, Ke C J, et al. Risk evaluation of implications of EU’s policy on the restriction of use of neonicotioids to domestic pesticide industry [J]. Pesticide Science and Administration, 2013, 34(9): 15-20 (in Chinese)
[8] 蔺哲广, 孟飞, 郑火青, 等. 新烟碱类杀虫剂对蜜蜂健康的影响[J]. 昆虫学报, 2014, 57(5): 607-615
Lin Z G, Meng F, Zheng H Q, et al. Effects of neonicotinoid insecticides on honeybee health [J]. Acta Entomologica Sinica, 2014, 57(5): 607-615 (in Chinese)
[9] Decourtye A, Armengaud C, Renou M, et al. Imidacloprid impairs memory and brain metabolism in the honeybee (Apis mellifera L.) [J]. Pesticide Biochemistry and Physiology, 2004, 78(2): 83-92
[10] Yang E C, Chang H C, Wu W Y, et al. Impaired olfactory associative behavior of honeybee workers due to contamination of imidacloprid in the larval stage [J]. PLOS One, 2012, 7(11): e49472
[11] Wu J Y, Aneli C M. Sublethal effects of pesticide residues in brood clomb on worker honey bee (Apis mellifera) development and longevity [J]. PLOS One, 2011, 6(2): e14720
[12] Abbott V, Nadeau J, Higo H, et al. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: Megachilidae) [J]. Journal of Economic Entomology, 2008, 101(3): 784-796
[13] Decourtye A, Lacassie E, Pham-Dele`gue M-H. Learning performances of honeybees (Apis mellifera L) are differentially affected by imidacloprid according to the season [J]. Pest Management Science, 2003, 59(3): 269-278
[14] Decourtye A, Devillers J. Ecotoxicity of Neonicotinoid Insecticides to Bees [M]// Insect Nicotinic Acetylcholine Receptors (1st ed). New York: Springer, 2010: 85-95
[15] Jones A K, Raymond-Delpech V, Thany S H, et al. The nicotinic acetylcholine receptor gene family of the honey bee, Apis mellifera [J]. Genome Research, 2006, 16: 1422-1430
[16] Gregorc A, Ellis J D. Cell death localization in situ in laboratory reared honey bee (Apis mellifera L.) larvae treated with pesticides [J]. Pesticide Biochemistry and Physiology, 2011, 99(2): 200-207
Indoor Toxicity Research of Imidacloprid on Honeybee Larvae
Tan Lichao1,*, Bu Yuanqing1,2, Cheng Yan1, Zhou Junying1,2, Shan Zhengjun1,2
1. Nanjing Institute of Environmental Science,Ministry of Environmental Protection of the People's Republic of China, Nanjing 210042, China 2. Jiangsu Collaborative Innovation Center of Atmospheric Environment and Equipment Technology (CICAEET), Nanjing University of Information Science & Technology, Nanjing 210044, China
Received 10 March 2016 accepted 11 April 2016
Imidacloprid is the most widely used neonicotinoids in the world. Researches showed that it could destroy the olfactory memory ability of bees, influence their acquisition behavior and cause a variety of sublethal effects. In this paper, the Apis mellifera larvae was selected as test organisms and indoor artificial feeding technique was adopted to evaluate the impact of imidacloprid on the development of honeybee larvae. After three days of adaptive breeding, larvae were fed with diet with different concentrations of imidacloprid for 3 days. Then the survival rate, pupation rate and eclosion rate were determined. Results showed that: no significant effects of survival rate, pupation rate and eclosion rate were observed under the dose of 15 ng imidacloprid per larva, but when treated with imidacloprid of 150 ng per larva, the eclosion rate significantly decreased, while the survival rate and pupation rate did not change obviously. The calculated 7 d-LD50of imidacloprid is 2 300 ng per larva. High doses of imidacloprid could influence the survival rate, pupation rate and eclosion rate of bee larvae. The higher the dose, the lower the survival rate, pupation rate and eclosion rate, with the r coefficients of -0.99, -0.94 and -0.89 respectively. Meanwhile, the delay of feather was also observed under high dose. The results could provide reference for the reasonable use of imidacloprid.
imidacloprid; honeybee larvae; indoor toxicity
2015年中央级公益性科研院所基本科研业务专项(农药对蜜蜂慢性毒性、幼虫毒性试验方法及配套技术研究)
谭丽超(1985-),女,硕士,助理研究员,研究方向为农药生态毒理学,Email: tcldemengxiang@163.com;
*通讯作者(Corresponding author), E-mail: tcldemengxiang@163.com
10.7524/AJE.1673-5897.20160310007
2016-03-10 录用日期:2016-04-11
1673-5897(2016)4-253-05
X171.5
A
简介:谭丽超(1985-),女,环境工程硕士,助理研究员,主要从事农药生态毒理学研究,发表学术论文数十篇。
谭丽超, 卜元卿, 程燕, 等. 吡虫啉对蜜蜂幼虫的室内毒性研究[J]. 生态毒理学报,2016, 11(4): 253-257
Tan L C, Bu Y Q, Cheng Y, et al. Indoor toxicity research of imidacloprid on honeybee larvae [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 253-257 (in Chinese)

