纳豆激酶高产菌的快速筛选及其发酵纳豆特性
刘梦洁,陈守文,魏雪团,2,*
(1.华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
纳豆激酶高产菌的快速筛选及其发酵纳豆特性
刘梦洁1,陈守文1,魏雪团1,2,*
(1.华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
通过纤溶活性筛选法和纳豆激酶基因筛选法,快速、准确筛选到一株纳豆激酶高产菌株MJ-1,经16S rRNA基因序列分析,该菌株被鉴定为枯草芽孢杆菌。以黄豆为原料进行固体发酵制备纳豆食品,考察了纳豆食品的纳豆激酶活力、抗凝活性和抗氧化活性。在初始含水量60%、发酵温度37℃的条件下,纳豆激酶发酵活力在20 h达到最大值(90.18 FU/g,以干质量计),达到了商业化纳豆的酶活力水平。抗凝活性分析显示该菌株可合成抗凝成分,赋予纳豆食品抗凝活性,在提取物质量浓度为3 mg/mL时,抗凝效率达91%。同时,与未发酵黄豆相比,发酵过程显著提高了其抗氧化活性。
纳豆激酶;枯草芽孢杆菌;基因筛选法;抗凝活性;抗氧化活性
纳豆食品是大豆经枯草芽孢杆菌纳豆亚种(Bacillus subtilis natto)发酵而成的传统发酵豆制品,是我国豆豉流传到日本,经改造而成的纯种发酵产品[1-2]。纳豆富含蛋白质、多肽、氨基酸、维生素和大豆异黄酮等各类成分,赋予其良好的营养性和功能性[3-5]。其中,纳豆激酶可高效溶解血栓,作为纳豆标志性成分备受关注,基于纳豆激酶的保健品和食品已成为我国近年来的研究热点[6-7]。
相比纳豆类保健品,纳豆食品价格低廉,具有更广泛的潜在消费者。然而,目前商业化的纳豆食品中纳豆激酶活力一般为20~40 FU/g[8],纳豆激酶活力普遍较低,且臭味严重[9],制约纳豆食品在我国的进一步推广。2015年,Lee等[10]对比分析了4 株枯草芽孢杆菌的纳豆发酵效果,其中,纳豆激酶产量最高的菌株为B. subtilis 14715,其纳豆激酶产量达48 FU/g。纳豆激酶产生菌决定纳豆品质,快速准确筛选纳豆激酶高产菌株至关重要。
目前常采用的筛选方法为:先通过纤溶活性筛选法获得纤溶酶产生菌,再通过16S rRNA技术鉴定枯草芽孢杆菌[11-12]。然而,解淀粉芽孢杆菌可产生纤溶酶[13-16],同时其16S rRNA基因序列同枯草芽孢杆菌相似性达97%以上,采用目前的方法常误筛到解淀粉芽孢杆菌。对比分析纤溶酶基因序列,纳豆激酶基因序列具有高度的特异性[13,17-18],同解淀粉芽孢杆菌纤溶酶基因序列相似性仅为80%左右。因此,将纤溶活性筛选法和纳豆激酶基因鉴定相结合,可快速、准确筛选到纳豆激酶产生菌,本研究拟将活性筛选法同纳豆激酶基因鉴定法相结合,以期快速筛选到纳豆激酶高产菌株。
1 材料与方法
1.1 材料、试剂与培养基
菌株筛选材料:豆豉、豆酱,购于武汉各大农贸市场及超市。
DNA聚合酶、dNTPs、DNA Marker 宝生物工程(大连)有限公司;凝血酶、纤维蛋白原 美国S i g m a-A l d r i c h公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海源叶生物科技有限公司;蛋白胨、酵母抽提物 英国Oxoid公司;其他试剂 国药集团化学试剂有限公司。
液体及固体LB培养基;奶粉固体培养基(g/L):蛋白胨10、酵母浸粉5、氯化钠10、脱脂奶粉10、琼脂粉15。
1.2 仪器与设备
CR21G高速冷冻离心机 日本日立公司;电热恒温隔水式培养箱 黄石市恒丰医疗器械有限公司;HQL300B柜式恒温冷冻摇床 武汉中科科仪技术发展有限责任公司;722型可见分光光度计 上海奥谱勒仪器有限公司;SW-CJ-2F洁净工作台 苏净集团苏州安泰空气技术有限公司;电热恒温水浴锅 上海医用恒温设备厂;高压蒸汽灭菌锅 山东新华医疗器械股份有限公司。
1.3 方法
1.3.1 纳豆芽孢杆菌筛选
取各类发酵豆制品1 g于9 mL无菌水中,37 ℃,180 r/min处理5 min,取上清液涂布到奶粉固体培养基平皿,37 ℃培养24 h,将水解圈较大的单菌落转移至液体LB培养基中,37 ℃,180 r/min培养12 h作为种子液。取1 mL种子液移接至25 g蒸煮黄豆中,37 ℃固体发酵48 h,每隔12 h搅拌一次,通过纤维蛋白溶解法检测发酵产物的纤溶酶活力。选取酶活力较高的菌株进行纳豆激酶基因检测:通过细菌基因组抽提试剂盒抽提待测菌株的总DNA,以aprNF(5’-CCGTGAGAAGCAAAAA ATTGTGGATCA-3’)和aprNR(5’-ATTTATTGTGCAG CTGCTTGTACGTTG-3’)为引物,经预变性(94 ℃,5 min)、变性(94 ℃,30 s)、退火(52 ℃,30 s)、延伸(72 ℃,1 min),30 个循环;72 ℃延伸10 min,聚合酶链式反应(polymerase chain reaction,PCR)产物最终保藏于4 ℃。PCR产物测序由北京擎科新业生物技术有限公司完成,通过BLAST程序进行序列相似性分析。
1.3.2 菌种鉴定
通过1 6 S r R N A基因序列分析法进一步进行菌种鉴定[19]。16S rRNA基因扩增引物为:27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。PCR程序为:预变性(94 ℃,5 min);变性(94 ℃,30 s);退火(52 ℃,30 s);延伸(72 ℃,1 min),28个循环;72 ℃延伸10 min,4 ℃保藏。PCR产物测序由北京擎科新业生物技术有限公司完成,序列相似性分析通过BLAST程序完成的,系统进化树通过MEGA 5.0软件进行构建。
1.3.3 纳豆食品发酵
将甘油管保藏的菌株MJ-1的菌液划线于固体LB培养基上,37 ℃培养24 h;挑取单菌落接种至液体LB培养基,37 ℃,180 r/min培养12 h即为发酵种子液。取1 mL种子液移接至25 g蒸煮并灭菌后的黄豆中,37 ℃固体发酵48 h,每隔12 h搅拌一次。
1.3.4 生物量分析
在固体发酵期间,每隔4 h取发酵样品,稀释涂布固体LB培养基平板,37 ℃静置培养12 h,统计单菌落个数,计算生物量。
1.3.5 纳豆激酶活力分析
以1∶5(m/V)的比例向发酵黄豆中添加蒸馏水,200 r/min处理1 h抽提纳豆激酶,10 000 r/min离心20 min,上清液作为待测样品用于纳豆激酶活力分析:依次向试管中加入1.4 mL Tris-HCl(50 mmol/L,pH 7.8)缓冲液、0.4 mL 7.2 mg/mL纤维蛋白原溶液,37 ℃温浴5 min,再加入0.1 mL凝血酶溶液(20 U/mL),37 ℃温浴10 min形成人工血栓,加入0.1 mL的待测样品,37 ℃温浴60 min,然后加入2 mL 0.2 mol/L三氯乙酸溶液静止20 min终止反应,10 000 r/min 离心10 min,取上清液于275 nm波长处测定吸光度,每分钟275 nm处吸光度增加0.01所需要的酶量定义为1个单位的纤维蛋白降解酶活力(FU)[20]。
1.3.6 抗凝活性分析
将发酵黄豆充分破碎,以1∶10(m/V)的比例加入蒸馏水,180 r/min振荡提取12 h,提取液经12 000 r/min离心10 min,上清液经冷冻干燥得固体粉末,通过0.05 mol/L Tris-HCl(pH 7.2)缓冲液溶解,用于抗凝活性分析:将1.0 mL待测样品和1.5 mL 0.1%纤维蛋白原溶液加入比色皿中混合均匀,加入0.1 mL 20 U/mL凝血酶溶液,37 ℃温浴20 min,检测405 nm波长处的吸光度为样品吸光度,以1 mL 0.05 mol/L Tris-HCl缓冲液作为对照。抗凝活性(抗凝效率)按照公式(1)[13]计算。

1.3.7 抗氧化活性测定
发酵黄豆和未发酵黄豆的抗氧化能力通过DPPH自由基清除活性来检测[13]。将待测样品充分破碎,以1∶10(m/V)的比例加入80%甲醇溶液,180 r/min振荡提取12 h,提取液经12 000 r/min离心10 min,上清液经冷冻干燥得到水提物粉末,将粉末配制成不同质量浓度的待测样品(0.5、1.5、2.5、3.5、5.0、10.0、15.0、20.0、25.0、30.0、35.0、40.0、45.0 mg/mL)。将0.5 mL待测样品加入到2.5 mL 75 µmol/L DPPH-甲醇溶液中,室温反应90 min,于波长517 nm处检测吸光度,以等体积的甲醇作为对照。抗氧化活性(DPPH自由基清除率)通过公式(2)[21]评价。
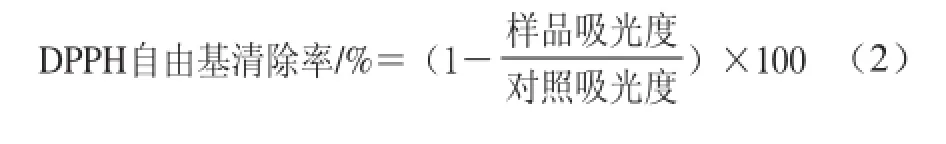
2 结果与分析
2.1 纳豆激酶产生菌筛选
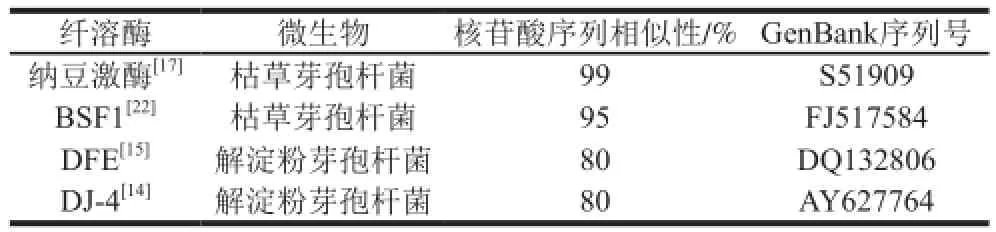
表1 MJ-1合成的纤溶酶基因序列同已报道纤溶酶基因序列相似性分析Table 1 Gene sequence similarity analysis of fibrinolytic enzyme from strain MJ-1 with the reported genes
经奶粉平板初筛,获得24 株透明圈较大的菌株,进一步进行固体发酵,选取纤溶酶活力较高的7 株菌进行纳豆激酶基因筛选鉴定。其中菌株MJ-1扩增出目的条带,测序结果显示该条带长度为1 070 bp,同已报道的典型纤溶酶基因序列相似性,如表1所示,同典型的纳豆激酶基因相似性达到99%[17],同典型的解淀粉芽孢杆菌纤溶酶DFE、DJ-4相似性仅为80%[14-15],说明该菌株合成的纤溶酶属于纳豆激酶。通过纤溶活性筛选和纳豆激酶基因筛选鉴定,快速准确筛选到了纳豆激酶生产菌株。
2.2 菌株鉴定
枯草芽孢杆菌和解淀粉芽孢杆菌的纤溶酶基因具有高度的差异性,通过纤溶酶基因分析基本可以准确地区分这两种菌。为了进一步验证鉴定结果,本研究进行了16S rRNA基因序列分析。菌株MJ-1的部分16S rRNA基因序列同Bacillus subtilis HYM11的16S rRNA(GenBank注册号KT961123.1)相似性达98%。同时,系统进化树显示菌株MJ-1同B. subtilis的亲缘关系最近(图1),进一步证明菌株MJ-1属于枯草芽孢杆菌。

图1 基于16S rRNA基因序列的系统进化树Fig. 1 Phylogenetic tree based on 16S rRNA gene sequences
2.3 纳豆激酶发酵过程曲线
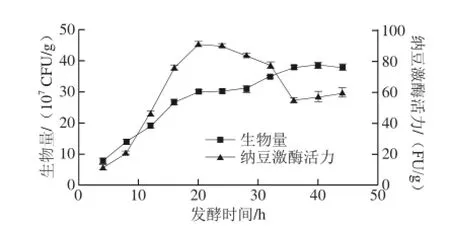
图2 纳豆发酵中菌体生长和纳豆激酶合成的过程曲线Fig. 2 Time courses of cell growth and nattokinase biosynthesis during natto fermentation
在初始含水量60%、发酵温度37℃条件下,绘制了菌体生长和纳豆激酶合成过程曲线(图2)。随着菌体生长,纳豆激酶逐渐合成。20 h时,纳豆激酶发酵活力达到最大值,为90.18 FU/g(以干质量计),此时生物量达3.02×108CFU/g。此后,随着生物量的增加,纳豆激酶活力逐渐降低,这可能是由于纳豆激酶降解所致,由此可见,纳豆激酶的合成与菌体的生长并不是完全耦合。目前,常见的商业化纳豆产品中纳豆激酶活力一般在20~40 FU/g[8],本研究所制备纳豆产品中纳豆激酶活力显著高于商业化纳豆的活性水平,且发酵周期较短,具有良好的工业化应用前景。
2.4 抗凝活性分析
纤溶活性和抗凝活性是评价血栓预防和治疗的2 个重要指标。凝血酶在纤维蛋白原形成纤维蛋白(血栓)中起关键作用,是纤维蛋白形成的限速酶[23],本研究通过考察发酵提取物抑制纤维蛋白形成的能力来评价其抗凝活性。经检测发现,未经发酵的黄豆提取物无抗凝活性,发酵黄豆提取物具有强烈的抗凝活性,在提取物质量浓度为3 mg/mL时,抗凝效率达91%(图3)。同时,进行了LB培养基发酵并分析提取物的抗凝活性,发现经LB培养也可产生抗凝物质,且相同剂量的发酵黄豆提取物的抗凝活性明显高于用LB培养提取物。研究结果表明抗凝物质是菌株自身合成的,以黄豆为底物做固体发酵产生的抗凝效果比单纯用LB发酵产生的抗凝效果要好。先前报道发现部分芽孢杆菌可分泌抗凝活性物质[13,24],本实验所筛选菌株也具有这种特性,具有潜在的应用价值。
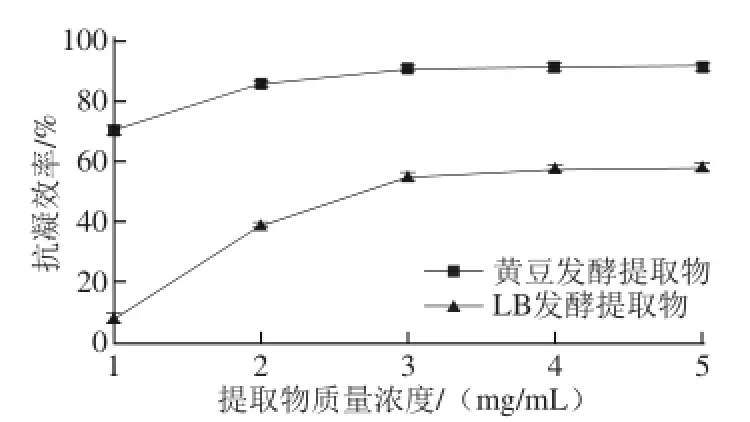
图3 发酵提取物的抗凝活性分析Fig. 3 Anticoagulant activity of extracts from natto fermentation products
2.5 抗氧化活性分析

图4 发酵前后黄豆提取物的DPPH自由基清除活性对比Fig. 4 DPPH radical-scavenging effect of extracts from non-fermented and fermented soybean at various concentrations
通过DPPH自由基清除活性对比分析了发酵黄豆和未发酵黄豆的抗氧化活性。如图4所示,随着2 种提取物质量浓度的增加,抗氧化活性能力逐渐增强,提取物在一定质量浓度范围内呈现一定的剂量-效应关系。发酵黄豆提取物质量浓度在25 mg/mL时,其DPPH自由基清除率达到最大(95%),而未发酵黄豆的提取物在35 mg/mL的质量浓度下才达到最高值85%。在同等提取物质量浓度下,发酵黄豆的抗氧化活性明显高于未发酵的黄豆。由此可见,通过菌株B. subtilis MJ-1发酵,显著提高了黄豆的抗氧化活性,相似的结论也出现在先前报道的豆制品发酵过程中[13,21,25]。据报道,发酵过程提高了豆类的总酚和总黄酮类物质的含量,进而导致其抗氧化活性提高[13,21]。
3 结 论
本研究结合纤溶活性筛选法和纳豆激酶基因筛选法,快速、准确地筛到了一株高产纳豆激酶的枯草芽孢杆菌MJ-1,避免了解淀粉芽孢杆菌的干扰。菌株MJ-1具有高效的纳豆激酶合成能力,在黄豆基质上纳豆激酶活力达到商业化纳豆产品的酶活力水平。同时,该菌株可合成抗凝成分,使所制备纳豆食品富含抗凝活性。另外,通过该菌株的发酵作用,纳豆中抗氧化活性显著高于未发酵的黄豆。本研究所制备纳豆食品富含纤溶活性、抗凝活性和抗氧化活性,在心血管疾病的预防中具有潜在应用价值。
[1] XU Jianping, DU Ming, YANG Xiulin, et al. Thrmbolytic effects in vivo of nattokinase in a carrageenan-induced rat model of thrombosis[J]. Acta Haematologica, 2014, 132(2): 247-253. DOI:10.1159/000360360.
[2] MITSUI N, MURASAWA H, SEKIGUCHI J. Development of natto with germination-defective mutants of Bacillus subtilis (natto)[J]. Applied Microbiology and Biotechnology, 2009, 82(4): 741-748. DOI:10.1007/s00253-009-1894-y.
[3] YOSHIKAWA Y, CHEN Pengyin, ZHANG Bo, et al. Evaluation of seed chemical quality traits and sensory properties of natto soybean[J]. Food Chemistry, 2014, 153: 186-192. DOI:10.1016/ j.foodchem.2013.12.027.
[4] KUBO Y, ROONEY A P, TSUKAKOSHI Y, et al. Phylogenetic analysis of Bacillus subtilis strains applicable to natto (fermented soybean) production[J]. Applied and Environmental Microbiology, 2011, 77(18): 6463-6469. DOI:10.1128/AEM.00448-11.
[5] 彭亮, 覃光球. 纳豆的特异性保健功效因子研究进展[J].中国食物与营养, 2013, 19(10): 65-69. DOI:10.3969/ j.issn.1006-9577.2013.10.017.
[6] MURAKAMI K, YAMANAKA N, OHNISHI K, et al. Inhibition of angiotensin I converting enzyme by subtilisin nat (nattokinase) in natto, a Japanese traditional fermented food[J]. Food & Function, 2012, 3(6): 674-678. DOI:10.1039/c2fo10245e.
[7] LIU Junguo, XING Jianmin, CHANG Tianshi, et al. Optimization of nutritional conditions for nattokinase production by Bacillus natto NLSSE using statistical experimental methods[J]. Process Biochemistry, 2005, 40(8): 2757-2762. DOI:10.1016/ j.procbio.2004.12.025.
[8] TAKOAKA S. Bacillus natto culture extract: 20060263865[P]. 2006-11-23.
[9] TAKEMURA H, ANDO N, TSUKAMOTO Y. Breeding of branched short-chain fatty acids non-producing natto bacteria and its application to production of natto with light smells[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2000, 47(10): 773-779. DOI:10.3136/nskkk.47.773.
[10] LEE B H, LAI Y S, WU S C. Antioxidation, angiotensin converting enzyme inhibition activity, nattokinase, and antihypertension of Bacillus subtilis (natto)-fermented pigeon pea[J]. Journal of Food and Drug Analysis, 2015, 23(4): 750-757. DOI:10.1016/j.jfda.2015.06.008.
[11] KWON E Y, KIM K M, KIM M K, et al. Production of nattokinase by high cell density fed-batch culture of Bacillus subtilis[J]. Bioprocess and Biosystems Engineering, 2011, 34(7): 789-793. DOI:10.1007/ s00449-011-0527-x.
[12] KU T W, TSAI R L, PAN T M. A simple and cost-saving approach to optimize the production of subtilisin NAT by submerged cultivation of Bacillus subtilis natto[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 292-296. DOI:10.1021/jf8024198.
[13] WEI Xuetuan, LUO Mingfang, XU Lin, et al. Production of fibrinolytic enzyme from Bacillus amyloliquefaciens by fermentation of chickpeas, with the evaluation of the anticoagulant and antioxidant properties of chickpeas[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8): 3957-3963. DOI:10.1021/jf1049535.
[14] CHOI N S, CHANG K T, MAENG P J, et al. Cloning, expression, and fibrin (ogen)olytic properties of a subtilisin DJ-4 gene from Bacillus sp. DJ-4[J]. FEMS Microbiology Letters, 2004, 236: 325-331. DOI:10.1111/j.1574-6968.2004.tb09665.x.
[15] PENG Yong, YANG Xiaojuan, XIAO Lu, et al. Cloning and expression of a fibrinolytic enzyme (subtilisin DFE) gene from Bacillus amyloliquefaciens DC-4 in Bacillus subtilis[J]. Research in Microbiology, 2004, 155(3): 167-173. DOI:10.1016/ j.resmic.2003.10.004.
[16] KIM G M, LEE A R, LEE K W, et al. Characterization of a 27 kDa fibrinolytic enzyme from Bacillus amyloliquefaciens CH51 isolated from cheonggukjang[J]. Journal of Microbiology and Biotechnology, 2009, 19(9): 997-1004. DOI:10.4014/jmb.0811.600.
[17] NAKAMURA T, YAMAGATA Y, ICHISHIMA E. Nucleotide sequence of the subtilisin NAT gene, aprN, of Bacillus subtilis (natto)[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(11): 1869-1871. DOI:10.1271/bbb.56.1869.
[18] WEI Xuetuan, LUO Mingfang, XIE Yuchun, et al. Strain screening, fermentation, separation, and encapsulation for production of nattokinase functional food[J]. Applied Biochemistry and Biotechnology, 2012, 168: 1753-1764. DOI:10.1007/s12010-012-9894-2.
[19] WEI Xuetuan, DENG Xiaowu, CAI Dongbo, et al. Decreased tobacco-specific nitrosamines by microbial treatment with Bacillus amyloliquefaciens DA9 during the air-curing process of burley tobacco[J]. Journal of Agricultural and Food Chemistry, 2014, 62(52): 12701-12706. DOI:10.1021/jf504084z.
[20] WEI Xuetuan, LUO Mingfang, LIU Huizhou. Preparation of the antithrombotic and antimicrobial coating through layer-by-layer selfassembly of nattokinase-nanosilver complex and polyethylenimine[J]. Colloids and Surfaces B: Biointerfaces, 2014, 116(1): 418-423. DOI:10.1016/j.colsurfb.2014.01.034.
[21] JUAN M Y, CHOU C C. Enhancement of antioxidant activity, total phenolic and flavonoid content of black soybeans by solid state fermentation with Bacillus subtilis BCRC 14715[J]. Food Microbiology, 2010, 27(5): 586-591. DOI:10.1016/j.fm.2009.11.002.
[22] AGREBI R, HADDAR A, HMIDET N, et al. BSF1 fibrinolytic enzyme from a marine bacterium Bacillus subtilis A26: purification, biochemical and molecular characterization[J]. Process Biochemistry, 2009, 44(11): 1252-1259. DOI:10.1016/j.procbio.2009.06.024.
[23] SCHERAGA H A. The thrombin-fibrinogen interaction[J]. Biophysical Chemistry, 2004, 112(2/3): 117-130. DOI:10.1111/j.1749-6632.1958. tb36865.x.
[24] OMURA K, HITOSUGI M, ZHU Xia, et al. A newly derived protein from Bacillus subtilis natto with both antithrombotic and fibrinolytic effects[J]. Journal of Pharmacological Sciences, 2005, 99(3): 247-251. DOI:10.1254/jphs.FP0050408.
[25] LEE I H, HUNG Y H, CHOU C C. Solid-state fermentation with fungi to enhance the antioxidative activity, total phenolic and anthocyanin contents of black bean[J]. International Journal of Food Microbiology, 2008, 121(2): 150-156. DOI:10.1016/j.ijfoodmicro.2007.09.008.
Rapid Isolation of a Strain with High Nattokinase Activity and Characterization of As-Fermented Natto Food
LIU Mengjie1, CHEN Shouwen1, WEI Xuetuan1,2,*
(1. State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070, China; 2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Using the screening method based on fibrinolytic activity and nattokinase gene, a strain named MJ-1 with nattokinase-producing capacity was obtained and identified as Bacillus subtilis by 16S rRNA gene sequence analysis. A natto functional food was prepared by fermentation of soybean with MJ-1, and its nattokinase activity, and anticoagulant and antioxidant activity were evaluated. Under the conditions of 60% initial moisture content and 37 ℃, the maximum nattokinase activity of 90.18 FU/g dry weight was obtained after 20 h fermentation, which reached the activity level of commercial natto. The strain MJ-1 could secret anticoagulant components, resulting in rich anticoagulant activity in natto foods, and the anticoagulant activity of natto water extract at 3 mg/mL reached 91%. Moreover, fermentation with MJ-1 improved the antioxidant activity of soybean significantly.
nattokinase; Bacillus subtilis; gene-based screening method; anticoagulant activity; antioxidant activity
10.7506/spkx1002-6630-201621023
Q815
A
1002-6630(2016)21-0131-05
刘梦洁, 陈守文, 魏雪团. 纳豆激酶高产菌的快速筛选及其发酵纳豆特性[J]. 食品科学, 2016, 37(21): 131-135.
DOI:10.7506/spkx1002-6630-201621023. http://www.spkx.net.cn
LIU Mengjie, CHEN Shouwen, WEI Xuetuan. Rapid isolation of a strain with high nattokinase activity and characterization of as-fermented natto food[J]. Food Science, 2016, 37(21): 131-135. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201621023. http://www.spkx.net.cn
2016-01-13
国家自然科学基金青年科学基金项目(31501468);湖北省自然科学基金项目(2014CFB943)
刘梦洁(1990—),男,硕士研究生,研究方向为食品微生物学。E-mail:940475942@qq.com
*通信作者:魏雪团(1984—),男,副教授,博士,研究方向为食品微生物学。E-mail:weixuetuan@mail.hzau.edu.cn

