间歇热处理对血橙变温物流保鲜品质的影响
程玉娇,秦文霞,赵霞,靳苗苗,张敏
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆,400715)
间歇热处理对血橙变温物流保鲜品质的影响
程玉娇,秦文霞,赵霞,靳苗苗,张敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆,400715)
为了明确间歇热处理技术对变温物流血橙的保鲜作用,以‘塔罗科’血橙为试材,经56 ℃热水处理不同时间后将其放入20 ℃的水中进行回温,分为连续组120 s(H)、间歇组60 s(Ia)、间歇组40 s(Ib)和间歇组20 s(Ic)四个处理,其总有效的热处理时间为120 s,处理后经历贮藏(2 ℃、RH 90%~95%条件下21 d)、模拟运输(10 ℃、RH 60%~70%条件下7 d)和货架(20 ℃、RH 60%~70%条件下7 d)3 个常见物流变温环节,研究不同处理在变温物流期间血橙热损伤及品质的变化规律。结果表明:Ia、Ib 组降低了热损伤和腐烂率,提高果蔬表皮的PPO、POD、SOD、CAT的活性;同时Ib组可以维持较高的血橙硬度、花色苷、总酸、可溶性固形物含量。然而 H、Ic 组促进了热损伤和腐烂率的发生。综合分析,Ib 间歇热处理组的血橙保鲜效果最佳。
间歇热处理;‘塔罗科’血橙;热损伤;保鲜品质;物流
‘塔罗科’血橙肉质脆嫩、酸甜可口、具有玫瑰香味,且富含有花色苷、VC等营养物质,深受消费者喜爱[1-2]。然而,塔罗科血橙皮薄,在采摘、搬运过程中容易受到机械损伤,导致病菌(主要为青霉菌、绿霉菌)侵染[1],引起果实腐烂变质,缩短了货架期,极大地制约了血橙相关产业的经济发展。同时,由于我国冷库日渐普及,而冷藏车和冷藏销售柜相对匮乏,我国很多食品流通无法做到全程冷链,在物流过程中不可避免地出现温度升高的状况,给食品保鲜带来很大的挑战[3]。
热处理[4]是一种有效的果蔬采后保鲜方式,其安全、无毒的特点受到越来越多研究者的关注,在防治病原菌、抑制果蔬冷害、提高果蔬贮藏品质等方面具有较好的作用。同时热处理过程中果蔬体内剧烈的温度变化和较大的温度梯度是热激效应产生的主要原因[5]。然而,温度过高或者时间过长的热处理使果蔬所受热应力不断增加积累,最终会导致果皮变色、异常软化、失水和损伤等热损伤现象,此处理技术所产生的热损伤是制约该技术发展的重要因素。而间歇热处理过程采取中断高温后回温再升温再回温的方式,不仅可以中断果蔬体内热应力的不断积累,避免热损伤的发生,同时可以使果蔬体内反复发生剧烈的温度变化,促进果蔬热激效应多次产生,使果蔬取得更好保鲜效果。ZHANG等[6]发现采取间歇热处理避免了黄瓜热损伤的产生,同样具有良好的保鲜品质。目前国内外研究连续热处理对柑橘品质及生理影响的文献较多,而间歇热处理研究甚少。本文以‘塔罗科’血橙为试材,分别对其进行连续和间歇热处理,测量热处理过程中的中心温度的变化及‘塔罗科’血橙在贮藏期、运输期及货架期3个阶段的生理变化,为‘塔罗科’血橙减轻热伤害,提高物流保鲜品质提供理论指导。
1 材料与方法
1.1 材料与试剂
血橙品种为‘塔罗科’血橙,当果实七、八成熟时(根据GBT10547-1989柑橘贮藏标准,甜橙果面着色三分之二时),在不同树上进行随机采收,采摘后放入塑料周转筐中在36 h内运至重庆北碚。挑选无病害,表面无损伤,大小均匀,成熟度一致的果实清水清洗后进行晾干备用。
EDTA(分析纯)、二硫苏糖醇(生化试剂)、福林酚(生物试剂),成都科龙化工试剂厂;愈创木酚(TritonX-100,PEG6000,分析纯),重庆北碚化学试剂厂;L-蛋氨酸、核黄素,生化试剂,氯化硝基氮蓝四唑(生物染色剂),重庆川东化工试剂公司。
1.2 仪器与设备
RXZ-8000智能人工气候箱,宁波东南仪器有限公司;UltraScan® PRO测色仪,美国HunterLab公司;H1650R台式高速冷冻离心机,湖南湘仪;UV-2450PC 紫外可见分光光度计,日本岛津公司。
1.3 方法
1.3.1 样品处理
将晾干的血橙随机分为4组:连续组(H),56 ℃热水连续浸泡120 s;间歇组(Ia),56 ℃/60 s+20℃/80 min+56 ℃/60 s+20 ℃/80 min;间歇组(Ib),56 ℃/40 s+20 ℃/70 min+56 ℃/40 s+20 ℃/70 min +56 ℃/40 s+20 ℃/70 min;间歇组(Ic),56 ℃/20 s+20 ℃/60 min+56 ℃/20 s+20 ℃/60 min +56 ℃/20 s+20 ℃/60 min +56 ℃/20 s+20 ℃/60 min +56 ℃/20 s+20 ℃/60 min +56 ℃/20 s+20 ℃/60 min;其中,56 ℃热水浸泡总有效时间为120 s,回温时间的选取是基于预试验结果:在56 ℃热水中处理后转移到20 ℃常温水中进行回温处理的时间是根据血橙的中心温度达到20 ℃的初始温度所需要的时间。热处理后将各个处理组放置室温下进行晾干,并冷却至室温。随后采用OPP柑橘自粘袋进行单果包装,在2 ℃ RH 90%~95%人工气候箱中贮藏21 d,放入10 ℃ RH 60%~70%人工气候箱中7 d来模拟物流运输,最后放入20 ℃ RH 60%~70%中7 d来模拟货架期。每隔7 d随机取样1次,每组取10个血橙,进行各项指标测定,指标测定重复3次,结果取其平均值。
1.3.2 中心温度
采用热电偶测量每次热处理10 min内血橙组织径向中心R的温度变化,R为半径(cm),10 min是根预试验的结果选取的:每次热处理后果实的中心温度在10 min左右达到最大值。
1.3.3 腐烂率的测定
在货架期后统计各个处理组的烂果数,血橙腐烂率采用式(1)进行计算:

(1)
1.3.4 热损伤发生率和热损伤发生指数
热损伤就是果蔬表面有轻微的水渍状或褐变失色凹陷区域,并且在贮藏期间区域面积不会扩大。热损伤发生程度可以划分为4 个级别:0级:无热损伤;1级:热损伤发生面积≤5%;2级:热损伤发生面积≤25%;3级:热损伤发生面积≤50%;4级:热损伤发生面积≥50%。在货架后期进行统计,血橙热损伤发生率和血橙热损伤发生指数采用式(2)和式(3)进行计算:
(2)
(3)
1.3.5 质量损失率的计算

(4)
1.3.6 色差测定
在柑橘果实赤道部位均匀取4 点,根据CIEL*、a*、b*颜色标准采用UltraScan®PRO色差仪于室温条件下测得。参考CHEN等[7]采用柑橘色泽指数(citrus color index,CCI)和色相(Hue)表示柑橘颜色变化的方法。其中,CCI是反应柑橘颜色变化的综合指标,正值代表红色,负值代表蓝绿色,0值是红,黄和蓝绿的复合色;Hue值变化范围是从0°~360°,0°代表紫红色,90°代表黄色,180°代表蓝绿色。CCI和Hue计算如式(5)、(6)所示:
(5)
(6)
1.3.7 硬度的测定
果实硬度由GY-1硬度计进行测定,探头直径为35 mm。在柑橘果实赤道部位均匀取4点,削去果皮及内部白皮层,保留完整囊衣,不损伤内果皮进行测定,取平均值。
1.3.8 花色苷含量的测定
采用pH差示法[8]。
1.3.9 总酸(total acid,TA)含量和可溶性固形物含量(soluble solids content,SSC)的测定
TA含量测定采用酸碱滴定法[9],SSC测定采用手持糖度计法[9]。
1.3.10 酶活性的测定
1.3.10.1 多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性测定
称取0.5 g血橙果皮样品,置于研钵中,加入5 mL提取缓冲液(1 mmol 聚乙二醇(polyethylene glycol, PEG)、4% 交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidon,PVPP)和1% Triton X-100),在冰浴条件下研磨成匀浆,于4 ℃、12 000 r/min 离心30 min,收集上清液,即为PPO和POD提取液,4 ℃低温保存备用。
PPO活性测定:参考ZHOU等[10]方法,往试管中加入4.0 mL 0.1 mol/L、pH 5.5乙酸钠缓冲液和1.0 mL 50 mmol/L邻苯二酚溶液和100 μL酶提取液,在420 nm波长处测吸光度。以每克果蔬样品在420 nm波长处每分钟吸光度变化值增加0.01为1 个PPO活性单位。
POD活性测定:参考CHANCE等[11]方法,往试管中加入3 mL 25 mmol/L愈创木酚溶液、0.2 mL酶提取液、200 μL 0.5 mol/L H2O2溶液后开始计时,在470 nm波长处测吸光度。以每克果蔬样品在470 nm波长处每分钟吸光度变化值增加0.01为1 个POD活性单位。
1.3.10.2 超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(cactalase,CAT)活性测定
称取0.5 g血橙果皮样品,置于研钵中,加入5 mL提取缓冲液(5 mmol/L二硫苏糖醇(dl-dithiothreitol,DTT),5%聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),pH 7.5磷酸钠缓冲液),在冰浴条件下研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液,即为SOD和CAT提取液,4 ℃低温保存备用。
SOD活性测定:参考ZHANG等[12]方法,取一指形玻璃管,分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3 mL 130 mmol/LL-蛋氨酸、0.3 mL 750 μmol/L氮蓝四唑溶液、0.3 mL 100 μmol/L EDTA-Na2溶液,最后加入0.3 mL 20 μmol/L核黄素溶液和0.1 mL酶提取液。2支对照管中加入50 mmol/L PH 7.8磷酸缓冲液,一支置于暗处,另一支和其他管置于30 W日光灯下反应30 min后立即取出,放于暗处终止反应。以不照光管为参比调零,于560 nm波长处测吸光度。每克果蔬样品在560 nm波长处每分钟的反应体系对氮蓝四唑光化还原的抑制为50%为1个SOD活性单位。
CAT活性测定:参考BASSAL等[13]方法,往试管中加入0.2 mL酶液、2.9 mL H2O2,在240 nm波长处测吸光度。以每克果蔬样品在240 nm波长处每分钟吸光度变化值减少0.01为1 个CAT活性单位。
1.4 数据处理与分析
采用Origin 8.0软件绘图和SPSS 13.0软件进行单因素方差分析及Duncan多重比较,显著性水平为0.05。
2 结果与分析
2.1 热处理过程中‘塔罗科’血橙中心温度的变化
图1 为连续热处理和间歇热处理‘塔罗科’血橙内部组织中心温度随有效的热应力发生时间的分布情况。在热处理开始阶段,血橙的中心温度基本没有发生变化,随后血橙的中心温度逐渐升高,这与生物滞后效应有关。在有效的热应力发生10 min时,H组,Ia组,Ib组,Ic组的中心温度分别达到22.2、21.5、21.3、20.7 ℃. 每进行1次热处理,便产生1次有效热应力。在热处理过程中H组,Ia组,Ib组,Ic组产生有效的热应力次数分别为1、2、3、6次。
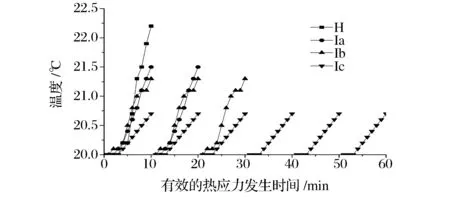
图1 不同热处理对‘塔罗科’血橙组织中心温度动态分布的影响Fig.1 Effects of different heat treatment methods on dynamic center temperature of ‘Tarocco’ orange注:热处理所选的血橙半径R为35 mm。
2.2 热处理对‘塔罗科’血橙腐烂率的影响
腐烂率是衡量果蔬保鲜效果的重要指标,而果蔬的腐烂主要是由病原菌和果蔬自身物质变化共同造成的。如表1所示,在货架期末期,H组腐烂率高达(24.67±3.21)%,与 Ic组差异不显著(P>0.05);Ic组中的腐烂率最高,高达(27.67±3.21)%,与Ib组和 Ic组之间差异显著(P<0.05)。然而,Ib组腐烂率最低,且与各个组差异显著(P<0.05)。
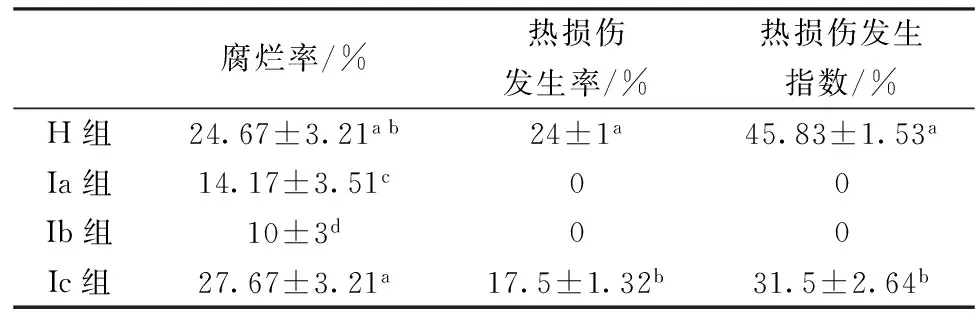
表1 热处理对‘塔罗科’血橙腐烂率和热损伤的影响
注:每一列中的字母不同表示在P< 0.05范围内有显著性差异。
2.3 热处理对塔罗科血橙保鲜过程中热损伤的影响
每种果蔬都存在一个热处理安全阈值,然而,根据每个果蔬自身的差异,热处理安全阈值也会发生一定的变化。当热处理的温度和时间超过安全阈值时,不仅会减弱热激效应,而且会造成果蔬无法修复的破坏,从而产生热损伤现象。如表1所示,在货架期末期,H组和 Ic组发生热损伤现象且差异显著 (P<0.05),其中,热损伤发生率分别为(24±1)%,(17.5±1.32)% ;热损伤发生指数分别为(45.83±1.53)%,(31.5±2.64)%。
2.4 热处理对‘塔罗科’血橙失重率的影响
由图2可知,各个热处理组的失重率均呈上升趋势。在整个物流期间,Ic组的失重率较高,且与各个热处理组之间差异极显著 (P<0.01),其中,在贮藏末期失重率高达1.05%,在模拟运输期和货架期,失重率的变化速率加大,最终 Ic组失重率高达4.27%。而其他热处理在贮藏期和模拟运输期,失重率差异不显著(P>0.05),在货架期末期,H组的失重率高达1.67%,与其他热处理组之间差异极显著 (P< 0.01)。

图2 热处理对‘塔罗科’血橙失重率的影响Fig.2 The effect of hot watertreatment on loss weight of ‘Tarocco’ orange
2.5 热处理对‘塔罗科’血橙色差的影响
‘塔罗科’血橙保鲜过程中色差的变化主要通过CCI和H0的大小来表现(图3)。在整个物流保鲜时期,各个热处理组之间的CCI值呈现上升趋势。在贮藏期末期,Ib组的CCI值较小,且与各个处理组之间差异显著(P<0.05);在模拟运输期时,H组与Ib组差异显著,但与其他处理组差异不显著(P>0.05);在货架末期,Ib组与 Ic组差异显著(P<0.05),可能与间歇热处理造成Ic组热损伤有关。然而,各个热处理组之间的H0值基本呈现下降趋势。H组和 Ia组下降较快,Ic组和Ib组维持了较高的H0值。在货架期末期,Ib组与其他热处理组之间差异不显著(P>0.05),而 Ic组与 H、Ia组之间差异显著(P<0.05)。

图3 热处理对 ‘塔罗科’血橙保鲜过程中CCI(a)和 H0(b)的影响Fig.3 The effect of heat treatment on CCI(a) and H0 (b) of ‘Tarocco’ orange
2.6 热处理对‘塔罗科’血橙硬度的影响
果蔬的硬度与纤维素、果胶和半纤维素形成的交联结构密切相关。在果蔬成熟衰老过程中,此交联结构在内切-1,4-β-葡聚糖酶(Endo-1,4-β-D-glucanohydrolase, EGase)、葡萄糖苷酶(Glucosidase, β-Glu)、多聚半乳糖醛酸酶(Polygalacturonase, PG)和果胶甲酯酶(Petin methylesterase, PME)作用下发生水解,从而导致果蔬软化[14-15]。果蔬软化是一个复杂的生理变化过程,也是决定其采后腐烂变质的一个关键因素。如图4所示,在整个物流保鲜期间,各个热处理组之间的硬度值基本呈现下降趋势,其中,Ib组保持了较高的硬度值。在贮藏期末期,Ic组硬度值最低,且与各个热处理组之间差异极显著(P<0.01);在模拟运输期,Ib组硬度较高,且与各个热处理组之间差异极显著(P<0.01),而H组和Ia组之间差异不显著(P>0.05);在货架期末期,Ia组和Ib组之间差异不显著(P>0.05),而与其他处理组之间差异显著(P<0.05)。
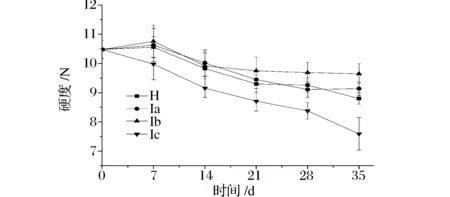
图4 热处理对‘塔罗科’血橙保鲜过程硬度的影响Fig.4 The effect of heat treatment on firmness of ‘Tarocco’ orange
2.7 热处理对‘塔罗科’血橙花色苷的影响
花色苷是‘塔罗科’血橙的重要品质指标。如图5所示,在整个物流保鲜期,各个热处理组的花色苷含量基本呈上升趋势。在贮藏期末期,H组的花色苷含量较高,且与各个热处理组之间差异极显著(P<0.01);在模拟运输期和货架期,间歇热处理组的花色苷含量升高幅度变大,且在货架期末期,Ib组具有较高的花色苷含量,且与各个热处理组之间的差异极显著(P<0.01)。

图5 热处理对‘塔罗科’血橙保鲜过程花色苷的影响Fig.5 The effect of heattreatment on anthocyanins of ‘Tarocco’orange
2.8 热处理对‘塔罗科’血橙总酸含量的影响
总酸、可溶性固形物是柑橘的重要品质指标,其含量的高低决定了柑橘的风味变化。如图6所示,在整个物流保鲜期间,血橙的TA呈下降趋势,Ia组和Ib组TA含量下降缓慢。在货架期末期,Ic组TA含量最低,且与各个热处理组之间差异极显著(P<0.01)。在整个物流保鲜期间,可固含量呈现先升高后下降趋势,且在14 d 时SSC含量达到最大值。在14 d后,H组和 Ic组SSC含量下降幅度较大;在货架期末期,Ia组和 Ib组维持了较高的SSC含量,且与 H组和 Ic组差异显著(P<0.05)。
果蔬中SSC/TA的大小代表着果蔬的成熟度指数,在整个物流保鲜期间,血橙的SSC/TA呈上升趋势,在前7 d,Ib组和 Ic组的SSC/TA的上升幅度较小,7 d后,Ic组SSC/TA上升幅度加快,在贮藏末期,Ic组的SSC/TA值处于较高,且与各个热处理组之间差异显著(P<0.05);在货架期末期,Ib组和 Ia组的SSC/TA值较低,且与H组和Ia组之间差异显著(P<0.05)。
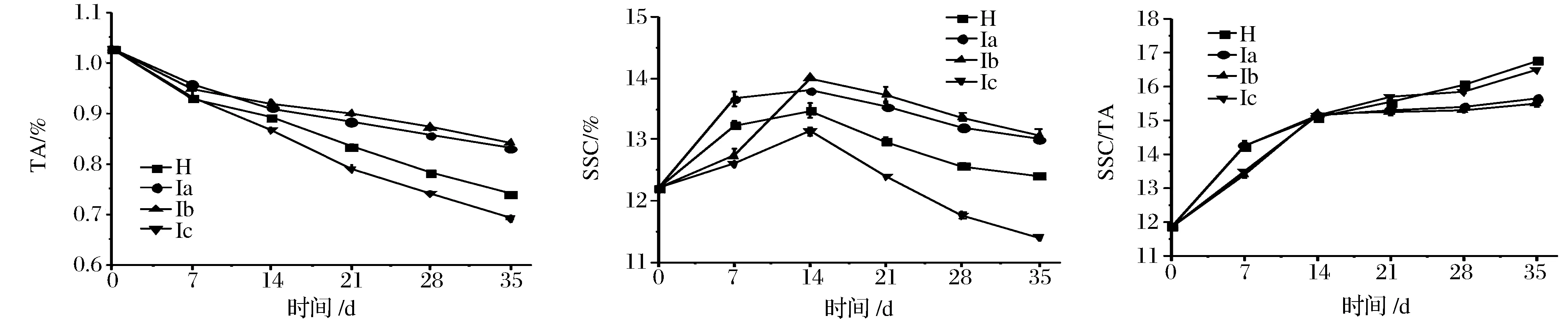
图6 热处理对‘塔罗科’血橙TA、SSC含量和SSC/TA的影响Fig.6 The effect of heattreatment on the total acid, the soluble solids content (SSC) and SSC/TA of ‘Tarocco’ orange
2.9 酶活分析
如图7所示,H组的PPO酶活性呈现先升高再下降的趋势,在28 d是达到最大值,且与间歇热处理组之间差异显著(P<0.05);在整个物流保鲜期间,间歇热处理组PPO酶活性呈现上升趋势,在模拟运输期,Ic组的PPO活性最大,且与各个处理组之间差异显著(P<0.05);在货架期末期,各个间歇热处理组的PPO活性继续增大,其中Ib组的PPO活性最大,且与各个热处理组之间的差异极显著(P<0.01)。
如图7所示,在整个物流保鲜期间,各个热处理组之间的POD活性呈现先升高再下降再升高的趋势,且在贮藏末期,POD活性达到最大值,H组的POD值较小,且与间歇热处理组之间差异极显著(P<0.01),Ia组的POD活性最大,与Ib组和Ic组之间差异不显著(P> 0.05);在模拟货架期,各个处理组之间的POD活性下降,在间歇热处理组中,Ib组的POD活性下降幅度最小,POD值最大,与各个热处理之间差异极显著(P<0.01);在货架期末期,各个处理组之间的POD活性升高,且差异极显著(P<0.01)。
如图7所示,在整个物流保鲜期间,H组的SOD活性先升高再下降,而间歇热处理组的SOD活性一直呈升高趋势。在贮藏末期,H组达到最大值,与Ia组差异极显著(P<0.01),与其他处理组差异不显著(P>0.05);在模拟运输期,Ib组维持较高的SOD活性,与其他处理组之间差异极显著(P<0.01);在货架期间,Ia组的SOD 活性升高幅度最大,在货架期末期,Ia与Ib组维持了较高的SOD活性,与其他处理组差异极显著(P<0.01)。
如图7所示,在整个物流保鲜期间,各个热处理组的CAT活性先升高再下降再升高的趋势。在14 d时,Ic组的CAT活性先达到峰值,且与其他处理组之间差异极显著(P<0.01);H组,Ia组和Ib组,在贮藏末期达到第一个峰值,其中,H组的CAT活性最大,与其他处理组之间差异极显著(P<0.01);在模拟运输期,Ib组达到最大值,且与其他处理组之间差异极显著(P<0.01),在货架末期,Ia与Ib组维持了较高的SOD活性,与各个处理组之间相互差异显著(P<0.05)。
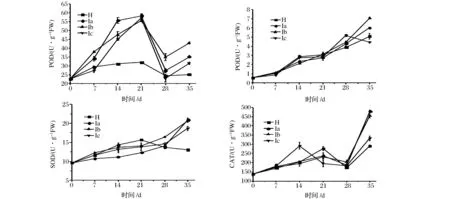
图7 热处理对‘塔罗科’血橙PPO、POD、SOD、CAT酶活性的影响Fig.7 The effect of heattreatment on the PPO,POD,SOD,CAT activity of ‘Tarocco’ orange
3 结论与讨论
果蔬是一个高度有序的生物有机体,当受到高温胁迫时,就会通过自身的防御体系产生一系列生理生化变化来适应不利的环境;然而,若热处理的温度过低或时间过短,则不会达到理想的保鲜效果,若热处理的温度过高或者热处理时间过长,则会导致果皮变色、软化、失水等不可逆的热损伤[16]。如表1所示,连续热处理的H组热损伤发生率(24±1)%,主要是因为在连续热处理中,血橙组织中心温度随着处理时间的逐渐升高,血橙受到的热应力不断增加,累积,造成了热伤害;间歇热处理中Ia组和Ib组无热损伤发生,可能与常温水的回温过程中断了热应力的积累有关;然而Ic组也存在热损伤现象,可能与血橙表面存在多个微孔,常温水的回温过程中长时间浸泡,水分子通过微孔进入血橙细胞,使血橙表皮细胞发生涨破,降低了血橙自身的防御体系而无法应及高温胁迫造成热损伤。热损伤会进一步降低果蔬自身的防御能力和促进了病原菌的侵入,造成了H组和Ic组的高腐烂率。同时,Ic组具有较高的失重率,主要是由于热损伤提高了血橙自身的蒸腾作用,使其代谢紊乱而导致失重率升高。
在整个物流保鲜期间,相比H组,Ib组CCI值和H值变化缓慢,同时保持了较高的硬度、TA、SSC和花色苷含量,这主要与间歇热处理过程中多次的温度变化所产生的热激效应调节血橙的生理代谢有关。这与热处理可以保持芒果[17]的硬度、苹果[18]的TA、枇杷[19]的SSC含量的研究一致。
PPO是苯丙烷代谢路径中的终端酶,有利于木质素和酚类物质的合成,同时也能催化醌类化合物形成,为果蔬提供一道保护性屏障[20]。SOD、POD、CAT作为活性氧清除剂,其活性水平的高低决定了膜脂氧化反应的程度,果蔬中超氧阴离子自由基由SOD、POD、CAT依次降解,从而减轻超氧阴离子自由基对果蔬细胞的伤害作用。如图7所示,在贮藏期,H组和Ic组的高PPO活性可能是因为热处理条件超过了血橙的安全阈值从而造成血橙产生热损伤,受伤基因的诱导激活了PPO基因的表达,提高了果蔬体内的PPO活性[21]。在模拟运输期和货架期,间歇热处理的Ia组和Ib组的PPO活性逐渐升高,这与Zhou等[10]研究发现热处理可以提高柑橘中PPO活性一致。在货架期末期,Ia组和Ib组的SOD、POD、CAT活性显著高于H组和Ic组,这与番茄[22]、黄瓜[23]试验结果一致。说明Ia组和Ib组的间歇热处理能够有效提高血橙的抗氧化能力,这为Ia组和Ib组较好的品质指标提供保证。
剧烈温度变化及组织间较大的温度梯度可能是果蔬对冷热激处理产生生物学应激效应的根本原因[5]。本试验中连续热处理可以产生高温胁迫的温度差异,同时加快了热应力的积累;适宜的间歇热处理可以产生应激反应所需的温度差异,同时可以中断热应力的积累,避免热损伤的产生。本文中常温水回温对血橙进行3次叠加的56 ℃ 40 s连续热处理,取得较佳的保鲜效果,而预实验表明56 ℃ 40 s的连续热处理并没有对血橙具有保鲜效果,所以3系叠加效果可能与较快温度变化有关,也可能与不断的短时叠加产生的某些应激反应有关[6]。适宜的间歇热处理可以避免热损伤,对温度较敏感的果蔬热处理方面具有较大的应用前景。然而目前间歇热处理尚处于起步阶段,相关的间歇处理时间、回温温度、回温次数等参数的选取需要深入研究。
[1] 何建, 陈克玲, 刘建军, 等. 几种保鲜处理对塔罗科血橙贮藏效果的影响[J]. 中国南方果树, 2013(3): 37-39.
[2] 袁久坤, 周英. 万州塔罗科血橙果实花色苷的影响因素分析[J]. 中国园艺文摘, 2014(7): 4-5+165.
[3] 邹俐宏. 温度对易腐果蔬贮运质量的影响及控制[J]. 长沙铁道学院学报, 2002(2): 62-65.
[4] AGHDAM MS, BODBODAK S. Postharvest Heat Treatment for Mitigation of Chilling Injury in Fruits and Vegetables[J]. Food and Bioprocess Technology, 2014,7(1): 37-53.
[5] 尹海蛟. 果蔬采后温度激化处理的理论与试验研究[D]. 天津:天津大学, 2012.
[6] ZHANG Na, YANG Zhao, CHEN Aiqiang, et al. Effects of intermittent heat treatment on sensory quality and antioxidant enzymes of cucumber[J]. Scientia Horticulturae, 2014,170(3): 39-44.
[7] CHEN Ming, JIANG Qian, YIN XueRen, et al. Effect of hot air treatment on organic acid- and sugar-metabolism in Ponkan (Citrus reticulata) fruit[J]. Scientia Horticulturae, 2012,147(4): 118-125.
[8] HONDA C, BESSHO H, MURAI M, et al. Effect of temperature on anthocyanin synthesis and ethylene production in the fruit of early- and medium-maturing apple cultivars during ripening stages[J]. Hortscience, 2014,49(12): 1 510-1 517.
[9] SHAO Xingfeng, TU Kang. air treatment improved the chilling resistance of loquat fruit under cold storage[J]. Journal of Food Processing and Preservation, 2014,38(2): 694-703.
[10] ZHOU Yahan, DENG Lili, ZENG Kaifang. Enhancement of biocontrol efficacy of Pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J]. Crop Protection, 2014,63(5): 89-96.
[11] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases[J]. Methods in Enzymology, 1955,2: 764-775.
[12] ZHANG Xinhua, SHEN Lin, LI Fujun, et al. Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J]. Postharvest Biology and Technology, 2013,79: 1-8.
[13] BASSAL M, EL-HAMAHMY M. Hot water dip and preconditioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J]. Postharvest Biology and Technology, 2011,60(3): 186-191.
[14] YUAN Li, BI Yang, GE Yonghong,et al. Postharvest hot water dipping reduces decay by inducing disease resistance and maintaining firmness in muskmelon (Cucumis melo L.) fruit[J]. Scientia Horticulturae, 2013,161(2): 101-110.
[15] 朱赛赛, 张敏. 温度激化处理对采后果蔬贮藏品质的研究进展[J]. 食品科学,2016,37(5):230-238.
[16] 杨乐. 采后球形果实热处理过程中的热物理研究[D]. 上海:上海海洋大学, 2010.
[17] ZHANG Zhengke, GAO Zhaoyin, LI Min, et al. Hot water treatment maintains normal ripening and cell wall metabolism in mango (MangiferaindicaL.) fruit[J]. Hortscience, 2012,47(10): 1 466-1 471.
[18] SHAO X F, T U K, TU S, et al. A Combination of heat treatment and chitosan coating delays ripening and reduces decay in "gala" apple fruit[J]. Journal of Food Quality, 2012,35(2): 83-92.
[19] SHAO Xingfeng, ZHU Yong, CAO Shifeng, et al. Soluble sugar content and metabolism as related to the heat-induced chilling tolerance of loquat fruit during cold storage[J]. Food and Bioprocess Technology, 2013,6(12): 3 490-3 498.
[20] MOHAMMADI M, KAZEMI H. Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated with Fusarium graminearum and induced resistance[J]. Plant Science, 2002,162(4): 491-498.
[21] 王曼玲,胡中立,周明全,等.<植物多酚氧化酶的研究进展[J]. 植物学通报, 2005(2):215-222.
[22] SOTO-ZAMORA G, YAHIA E M, BRECHT J K, et al. Effects of postharvest hot air treatments on the quality and antioxidant levels in tomato fruit[J]. Lwt-Food Science and Technology, 2005,38(6): 657-663.
[23] 张娜, 杨昭, 陈爱强, 等. 间歇热处理抑制热伤害提高黄瓜贮藏品质[J]. 农业工程学报, 2014(9): 256-261.
Preservation properties of ‘Tarocco’ oranges with intermittent heating treatment on temperature-shift transportation
CHENG Yu-jiao,QIN Wen-xia,ZHAO Xia,JIN Miao-miao,ZHANG Min*
(Laboratory of Quality & Safety Risk Assessment for Argo-products on Storage and Preservation (Chongqing),Mimnistry of Agriculture, Chongqing Special Food Programme and Technology Research Center, College of Food Science, Southwest University, Chongqing 400715, China)
‘Tarocco’ orange was treated in hot water 56 ℃ intermittently, then moved to 20℃ at different conditions, continuously for 120s, intermittently at 60 s(Ia)、40 s(Ib)、30 s(Ic), the total treatment was 120s. The oranges was then stored at different cold temperature (at 2 ℃ RH 90%~95% for 21 days), subsequent simulated transport (at 10 ℃ RH 60%~70% for 7 days) and shelf life (at 20 ℃ RH 60%~70% for 7 days). The results showed that Ia, Ib decreased the heat damage and decay index and improved PPO、POD、SOD、CAT enzyme activity. What’s more, Ib can retain the firmness, anthocyanins content, total acid and soluble solids content. However, H and Ic increased heat damage and decay index. By comprehensive analysis, the effect of Ib was the best on the preservation properties of ‘tarocco’ oranges.
intermittent heat treatment; ‘Tarocco’ orange; heat injury; postharvest quality; logistics
10.13995/j.cnki.11-1802/ts.201610032
硕士研究生(张敏教授为通讯作者,E-mail:zmqx123@163.com)。
重庆市科委社会事业与民生保障科技创新专项(cstc ̄2015shmszx80036);中央高校基本科研业务费专项(XDJK2013C130)
2016-03-09,改回日期:2016-03-28

