糙米的体外肠道益生菌调节及抗氧化活性
倪香艳,钟葵,佟立涛,刘丽娅,周闲容,周素梅
(中国农业科学院 农产品加工研究所,农业部农产品加工综合性重点实验室,北京,100193)
糙米的体外肠道益生菌调节及抗氧化活性
倪香艳,钟葵,佟立涛,刘丽娅,周闲容,周素梅
(中国农业科学院 农产品加工研究所,农业部农产品加工综合性重点实验室,北京,100193)
以糙米为研究对象,围绕其体外消化物的肠道益生菌调节功效和抗氧化活性开展研究。研究结果表明:相对精白米,糙米体外消化物中膳食纤维含量高(约11%),体外模拟肠道菌群培养实验中能更好促进益生菌——双歧杆菌(9.69个对数)和乳酸杆菌(7.30个对数)增殖,总短链脂肪酸含量提高约12%。铁离子还原/抗氧化能力(ferric-reducing antioxidant power,FRAP)和氧自由基清除能力(oxygen radical absorbance capacity,ORAC)实验结果表明,糙米体外消化物具有较好抗氧化活性,活性大小与所含酚类物质含量趋势较为一致。糙米消化物具有良好的维护肠道微生态和健康的功效。
糙米;体外;肠道益生菌;抗氧化
全谷物含有丰富的营养物质,能够有效预防慢性病及代谢性疾病发生。研究发现,增加膳食中全谷物的摄入量可减少心血管疾病、Ⅱ型糖尿病、肥胖和某些癌症的发病率[1]。因此,近年来全谷物成为备受人们喜爱的谷类食物。
糙米作为最常见的全谷物原料,营养价值高,含有人体所需要的多种维生素、脂类和矿物质,膳食纤维含量丰富,较高程度实现稻谷的全营养保留[2],营养丰富均衡,同时具有降血压[3]、降血脂、预防过敏、脚气病[4]和多种炎症等功效。流行病学研究表明[5],谷物的抗氧化活性可有效预防慢性疾病发生。肠道菌群是维护宿主肠道机能稳定和正常免疫功能的基础,糙米的某些生理功效可能与其潜在的肠道菌群调节作用有关[6],因此,对于糙米生理功效调节机制的研究成为近年来研究热点。目前,关于糙米生理功效的研究大部分集中在原料上或直接将功能成分提出后开展生物活性的相关研究[7],但糙米类谷物通常需热处理熟化后才食用,同时熟化的糙米经过胃肠消化后产物组成与原料差异较大,目前关于糙米消化物的生理活性研究文献相对较少。
本文以籼米农香18作为试验材料,对原料进行熟化和体外消化处理后,分析糙米消化物的主要组成,探讨消化物体外模拟肠道发酵时对肠道益生菌数量及短链脂肪酸含量影响,研究其体外抗氧化活性。
1 材料与方法
1.1 试验材料
原料籼米“农香18”,由湖南省农科院提供;α-淀粉酶(15 U/mg)、胃蛋白酶(474 U/mg)、胰酶(4×USP),均由Sigma公司提供;NaOH、KCl、NaCl等均为分析纯,由国药集团提供。
1.2 试验方法
1.2.1 样品基本成分测定
参照GB5009.3—2010测定水分;参照GB/T 14772—2008测定粗脂肪含量;参照GB/T5009.5—2003测定蛋白质含量;参照Association of Official Analytical Chemists (AOAC) 996.11、AOAC Method 76.13测定总淀粉含量;参照GB/T 5009.88—2008测定总膳食纤维含量;采用福林酚法[8]测定总酚含量;采用氯化铝法[9]测定总黄酮含量。
1.2.2 体外消化
体外消化过程参照CONNOLLY[10]和DUODU等人[11]的方法,并略作修改。准确称取12.00 g粉碎样品置于三角烧瓶中,缓慢加入200 mL去离子水,搅拌均匀后,加入10.00 mg溶解在1.25 mL CaCl2(1 mmol/L, pH 7.0)溶液中的α-淀粉酶,在37 ℃振荡水浴30 min;然后用6 mol/L HCl 将酶解液pH调节至2.00,加入溶解在0.1 mol/L HCl中的胃蛋白酶0.24 g,并在37 ℃水浴振荡2 h;结束后用6 mol/L的NaOH将pH调节至6.80,加入溶解在Na2CO3溶液(0.5 mol/L,10 mL)中的胰酶(0.22 g)和胆汁(0.70 g), 37 ℃水浴振荡4 h,混匀后,将溶液转移至1 kDa透析袋中透析过夜,最后将样品冷冻干燥,保存用于体外模拟肠道发酵实验。
1.2.3 模拟肠道发酵
培养基的配制参考RAMNANI等[12]报道的方法。培养基组成:蛋白胨3 g/L、酵母膏4.5 g/L、胰蛋白胨3 g/L、NaCl 4.5 g/L、KCl 2.5 g/L、K2HPO40.04 g/L 、KH2PO40.04 g/L、MgSO4·7H2O 0.01 g/L、CaCl2·6H2O 0.01 g/L、NaHCO32 g/L、L-半胱氨酸盐 0.5 g/L、胆盐 0.5 g/L、吐温80 2 mL/L、氯化血红素 0.05 g/L。
模拟肠道发酵参照OLANO-MARTIN等[13]的方法,并略作修改。无菌发酵瓶中加入72 mL基础培养基,调节其pH值至7.0,收集2名健康志愿者的新鲜粪便,志愿均为23~24岁的健康男性,3个月内未接受抗生素治疗,取样前未摄入益生元或益生素,并且无肠道疾病史,收集过程尽量保持无菌状态。粪便收集后立即用预还原的磷酸盐缓冲液(PBS,1 mmol/L,pH 7.0)按照20%比例稀释。
取8 mL粪浆加入到基础培养基前,按照2%的比例加入体外消化后的冻干样品,将样品加入混匀后在37 ℃厌氧工作站中发酵,空白组中仅加入相同体积粪浆。在发酵的第24 h取样检测肠道菌群数量和短链脂肪酸含量。从粪便采集至样品加入在30 min内完成,每个样品重复2次。
1.2.4 Real-time qPCR检测细菌数量
采用Real-time qPCR技术检测发酵液样品中总细菌、双歧杆菌和乳酸杆菌的数量。发酵液样品采用冷冻离心机离心(11 000 r/min,20 min),上清液备用检测total short-chain fatty acid (SCFA),沉淀物用于检测细菌数量。按照细菌基因组DNA快速提取试剂盒说明书提取发酵液沉淀物DNA和标准菌株DNA,-20 ℃储存备用。参照文献报道,根据双歧杆菌、乳酸杆菌16S rDNA基因序列设计菌属特异性PCR引物。取标准菌株DNA和发酵液样品DNA进行常规PCR反应,检测引物特异性。
1.2.5 短链脂肪酸测定
采用离子色谱法检测发酵液短链脂肪酸含量。将发酵液离心后的上清液进行适度稀释,过0.2 μm滤膜,滤液进样检测。离子色谱条件:分析柱型号为IonPac AS11-HC分离柱(4 mm×250 mm),保护柱为IonPac AG11-HC guard(4 mm×50 mm),流速1.0 mL/min,进样体积25 μL,柱温30 ℃,洗脱条件为0.8 mmol/L KOH等度洗脱36 min,检测器为电导检测器。配制乳酸、乙酸、丙酸、丁酸、戊酸混标,梯度稀释,绘制标准曲线。根据保留时间和峰面积进行定性定量分析。
1.2.6 活性成分提取
水溶性活性物质提取[14]:称取1 g样品加入15 mL 4 ℃酸化甲醇提取10 min,离心取上清液,重复3次合并上清液,于45 ℃下旋转蒸发,并用酸化甲醇定容至10 mL,放置-20 ℃保存;提取后所得残渣中,加入20 mL 2 mol/L NaOH,在氮气保护下搅拌1 h后,调pH至1.5~2.0,按体积分数50%(终浓度)加入正己烷除脂,按体积分数50%(终浓度)加入乙酸乙酯萃取5次,合并提取液于45 ℃旋转蒸发至干,用50%甲醇定容至10 mL,-20 ℃保存。
脂溶性活性物质提取[15]:称取1 g样品加入10 mL体积分数为60%的正己烷-异丙醇溶液,150 r/min 条件下振荡提取5 h,收集上清液。残渣中加入10 mL正己烷,并用上述相同方法重复提取2次至溶液无色。合并上清液氮气吹干,溶解在1 mL质量分数为7%的甲基化β-环糊精的丙酮-水(体积分数50%)溶液,过0.2 μm滤膜,-20 ℃保存。
1.2.7 抗氧化活性测定
铁离子还原/抗氧化能力(ferric-reducing antioxidant power,FRAP)[15]:制备FRAP试剂,在96孔板中加入20 μL提取液和260 μL FRAP试剂,反应30 min后在593 nm下测定吸光值。以不同浓度的Trolox溶液绘制标准曲线,根据吸光值计算样品的FRAP值,测定结果以μmol Trolox/g DW表示。
氧自由基清除能力(oxygen radical absorbance capacity,ORAC)[15]:96孔板中加入20 μL的提取液和260 μL荧光素钠盐溶液(0.086 8 nmol/L),然后将96孔板放入荧光酶标仪中在37 ℃预热30 min,迅速加入20 μL的二盐酸盐(2,2-Azobis(2-methylpropionamidine)dihydrochloride,AAPH)溶液 (153 mmol/L),振荡摇匀,立即在激发波长485 nm,发射波长525 nm下进行测定,初始荧光强度值记为f0,每隔2 min自动测定荧光强度,测定2 h,荧光强度分别记为f0,f1,f2,…f58,f59,f60,根据公式荧光强度=1+f1/f0+f2/f0+f3/f0+f4/f0…+f59/f0+f60/f0统计荧光强度值。测定结果以μmol Trolox/g DW表示。
2 结果与分析
2.1 糙米消化物基本成分分析
消化物基本成分分析如表1。经过体外消化后,糙米和精白米的消化率分别为67.89%和73.97%。糙米消化物中粗脂肪和总膳食纤维的含量分别为6.62%和11.83%,显著高于精白米消化物(P<0.05),精白米消化物中粗脂肪和总膳食纤维的含量仅为1.48%和6.17%,该研究结果与LEBET等[16]对不同谷物样品消化物基本化学组成结论相近;糙米消化物中总淀粉的含量低于2%,由于谷物中抗性淀粉的含量大约为2%~10%[17],证明经过消化,样品中可消化淀粉基本消化完全,该研究结果与YANG等[18]对不同谷物经过消化其总淀粉含量显著降低的结论相近。体外消化过程,使糙米中总淀粉、粗蛋白等成分被消化,而膳食纤维等易于被肠道微生物所利用的成分保留。

表1 消化物基本成分分析
注:以上各测定指标均以干基计。相同字母表示差异不显著,不同字母表示差异显著(P<0.05)。
2.2 糙米消化物的肠道益生菌调节功效分析
益生菌是指能够对宿主健康发挥有益作用的活体微生物,主要包括双歧杆菌、乳酸杆菌等。本试验分析了糙米消化物对肠道益生菌数量的调节功效。对发酵24 h的样品发酵液进行肠道益生菌的测序分析,评价其对肠道益生功效的影响。
模拟肠道发酵24 h,不同消化物对肠道菌群数量影响分析如图1。经过体外发酵,精白米和糙米消化物发酵液中总细菌数量的对数值分别为10.14和10.00,两者不存在显著性差异(P>0.05);双歧杆菌在肠道菌群的平衡方面发挥重要作用,其状态影响肠道菌群的代谢,乳酸杆菌可以产生有机酸,降低肠道pH,抑制腐败菌的增殖,维持肠道菌群的平衡。糙米消化物发酵液中乳酸杆菌和双歧杆菌数量显著增加(P<0.05),其对数值分别为7.30和9.69,且糙米消化物发酵液中有益菌群数量显著高于精白米消化物发酵液(P<0.05),精白米消化物发酵液中乳酸杆菌和双歧杆菌数量的对数值分别为6.14和9.34,KATAOKA 等[19]报道过糙米具有促进双歧杆菌生长的作用,林永华等[6]也研究报道过糙米食疗能显著提高小鼠肠道中乳酸菌比例,有利于肠道健康,并能有效缓解高糖高脂膳食对肠道微生态健康的破坏作用,与本研究得到的结果具有一致性。该研究表明糙米经过体外消化和肠道发酵过程,可有效提高肠道中有益菌的数量,维持肠道健康。这可能是由于糙米中含有丰富的膳食纤维,膳食纤维在消化过程中不易被胃肠道中的消化酶消化,可以最终到达结肠中被肠道微生物利用,从而提高了肠道中有益菌群的数量。
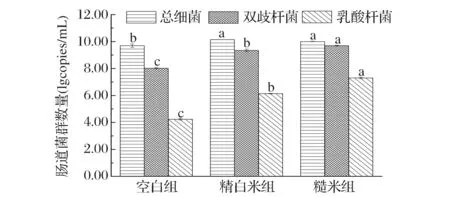
图1 消化物对肠道菌群数量影响Fig.1 Analysis of intestinal flora from different digestion products 相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
2.3 糙米消化物对短链脂肪酸含量影响分析
益生元被肠道菌群发酵,会产生代谢终产物短链脂肪酸[20]。本试验分析了糙米消化物体外发酵终产物SCFAs的产生情况。图2表示发酵24 h消化物发酵液中各短链脂肪酸含量,总短链脂肪酸酸含量如表2。对发酵液中短链脂肪酸含量进行对比,评价其产生短链脂肪酸的能力。
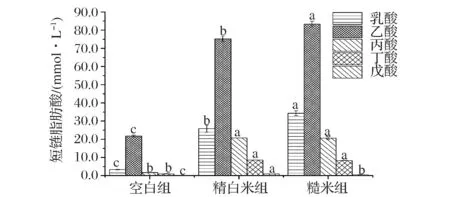
图2 消化物对短链脂肪酸含量影响分析Fig.2 Analysis of SCFA production from different digestion products相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
经过体外发酵,糙米消化物发酵液中总短链脂肪酸含量显著增加,且含量显著高于精白米消化物发酵液(P<0.05),其含量提高12% 左右,这可能是由于消化产物中的膳食纤维可以被肠道菌群发酵利用,产生代谢终产物短链脂肪酸,而糙米消化产物中膳食纤维的含量显著高于精白米消化产物,短链脂肪酸的生成量更多,该研究结果与赵兰涛[21]等对不同谷物样品在发酵过程中总短链脂肪酸生成量显著提高结果相似;乙酸是结肠菌群产生的最丰富的短链脂肪酸[22],糙米消化物发酵液中乙酸含量显著性增加(P<0.05),其占总短链脂肪酸含量的比例为56.64%,大于50%,CONNOLLY等[10]在一项研究中将不同焙烤程度的全谷物经过体外发酵后,发酵液中乙酸的含量显著性增加,与表中的结果具有一致性;体外发酵后,糙米和精白米消化物发酵液中丙酸和丁酸的含量显著性增加(P<0.05),但2者产生的丙酸和丁酸在含量上不存在显著性差异(P>0.05);不同消化物发酵液中戊酸含量较少,均低于1 mmol/L。

表2 消化物对总短链脂肪酸含量影响分析
2.4 糙米消化物水溶性提取物体外抗氧化活性分析
酚类物质是糙米中主要的亲水性抗氧化活性物质,主要包括游离型总酚和结合型总酚2种。本实验采用有机试剂和碱解过程提取消化物中的水溶性活性物质,同时采用FRAP和ORAC两种方法测定消化物中水溶性提取物的体外抗氧化能力,分析结果如图3。
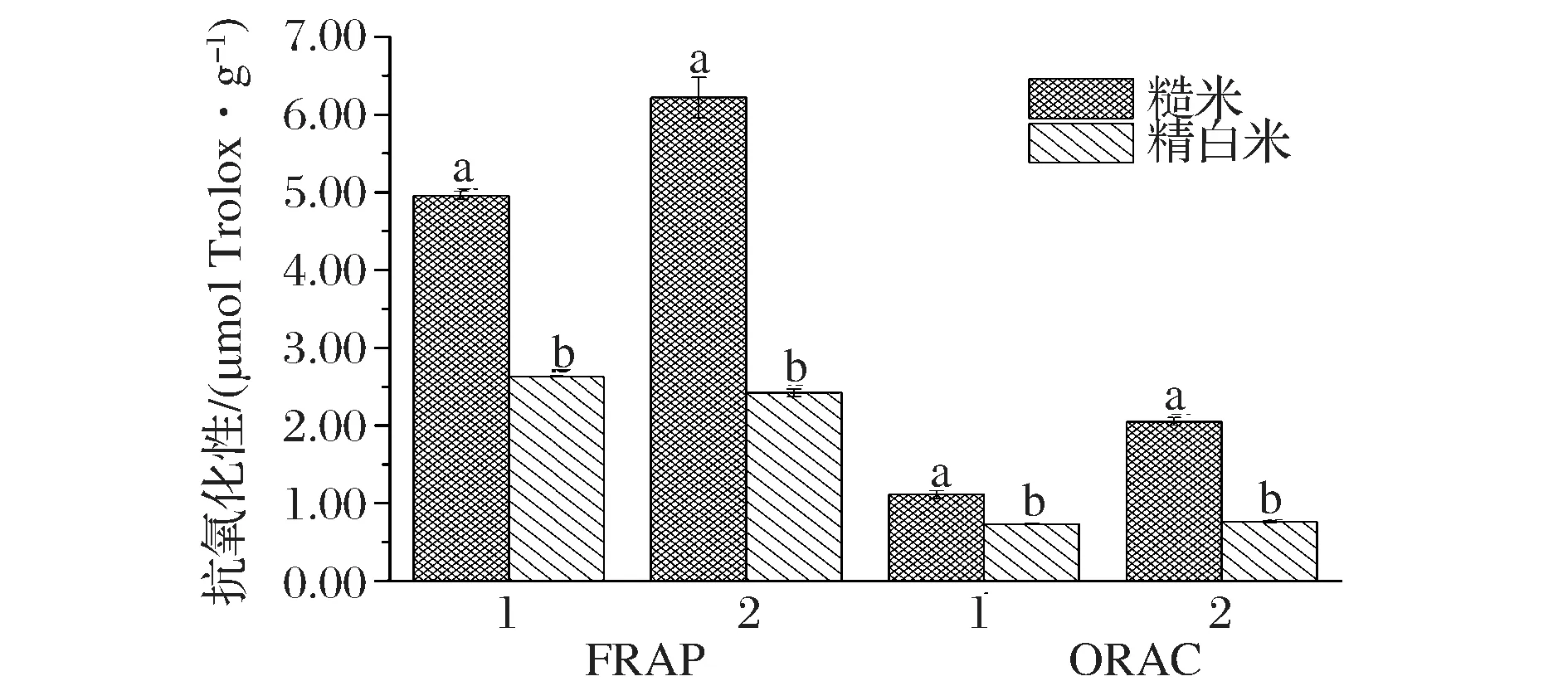
图3 消化物水溶性提取物体外抗氧化活性分析Fig.3 Analysis of antioxidant activity in vitro of water soluble extracts from different digestion products注:1、2分别为游离型酚类提取物和结合型酚类提取物相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
多酚可以清除自由基或者螯合金属离子,还可以抑制氧自由基产生过程中的相关酶类的活性,激活抗氧化酶系的活性或者调节内源抗氧化剂的合成[23]等。FRAP测定糙米消化物游离型和结合型酚类提取物的总还原能力为4.96 μmol Trolox/g DW和6.22 μmol Trolox/g DW,其抗氧化能力分别为精白米消化物的1.89 倍和2.57倍;ORAC测定糙米和精白米消化物游离型酚类提取物抗氧化活性为1.11 μmol Trolox/gDW和0.73 μmol Trolox/g DW,结合型酚类提取物抗氧化活性为2.05 μmol Trolox/gDW和1.76 μmol Trolox/g DW。研究结果表明糙米消化产物仍具有抗氧化活性,且其抗氧化能力显著高于精白米消化产物(P<0.05)。
消化物游离型、结合型总酚和游离型、结合型黄酮含量分析如图4。经过体外消化,糙米消化物中游离型和结合型总酚的含量分别为175.24 mg/100g和144.43 mg/100g,其含量显著高于精白米消化物,分别为精白米消化物的1.44倍和5.88倍,糙米消化物中游离型和结合型总黄酮的含量分别为精白米消化物的1.94倍和2.71倍。研究结果表明糙米消化产物中仍具有活性成分。
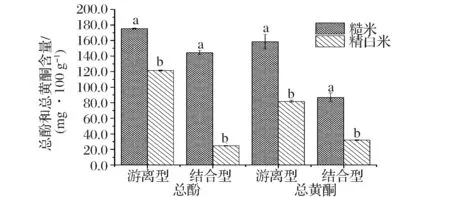
图4 消化物总酚和总黄酮含量分析Fig.4 Analysis of total phenols and flavonoids after in vitro digestion注:相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
比较分析消化物水溶性提取物的抗氧化能力和消化物水溶性提取物的含量,表明通过FRAP和ORAC两种方法测定的不同消化物中水溶性提取物的体外抗氧化能力趋势一致,糙米消化物水溶性提取物体外抗氧化能力显著高于精白米消化物(P<0.05),且抗氧化活性的变化趋势均与其所含酚含量变化趋势一致。
2.5 糙米消化物脂溶性提取物体外抗氧化活性分析
本实验同时采用FRAP和ORAC两种方法测定消化物中脂溶性提取物的体外抗氧化能力。消化物脂溶性提取物体外抗氧化活性分析如图5。
谷物的脂溶性提取物中主要抗氧化成分包括维生素E、类胡萝卜素和γ-谷维素等[15]。维生素E中的活性羟基基团能够释放活泼氢,清除自由基,从而抑制自由基的链式反应,发挥抗氧化活性;类胡萝卜素多个共轭双键和功能性羟基,能够抑制活性氧自由基,淬灭单线态氧;γ-谷维素[24]中的阿魏酸集团能和羟自由基形成共振稳定的自由基而终止自由基的链式反应,同时可以螯合金属离子。FRAP测定糙米和精白米消化物脂溶性提取物总还原能力分别为1.08 μmol Trolox/gDW和0.34 μmol Trolox/g DW,其2者抗氧化活性存在显著性差异(P<0.05);ORAC测定其抗氧化活性分别为0.11 μmol Trolox/g DW和 0.10 μmol Trolox/g DW;其抗氧化活性之间不存在显著性差异(P>0.05)。不同消化物其抗氧化活性的不同可能与消化物所含脂溶性物质的含量存在差异有关,FRAP和ORAC测定不同消化物抗氧化活性显著性的差异,可能是由于2种方法中抗氧化测定机理的差异所造成的。FRAP的反应涉及电子转移,反映的不是抗氧化剂对某一种自由基的清除能力,而是其总的还原能力,而ORAC的测定反应过程中主要涉及氢原子的转移,测定过程涉及活性氧,该研究结果与LEE[25]和马玉荣[26]等得到的结论相类似。
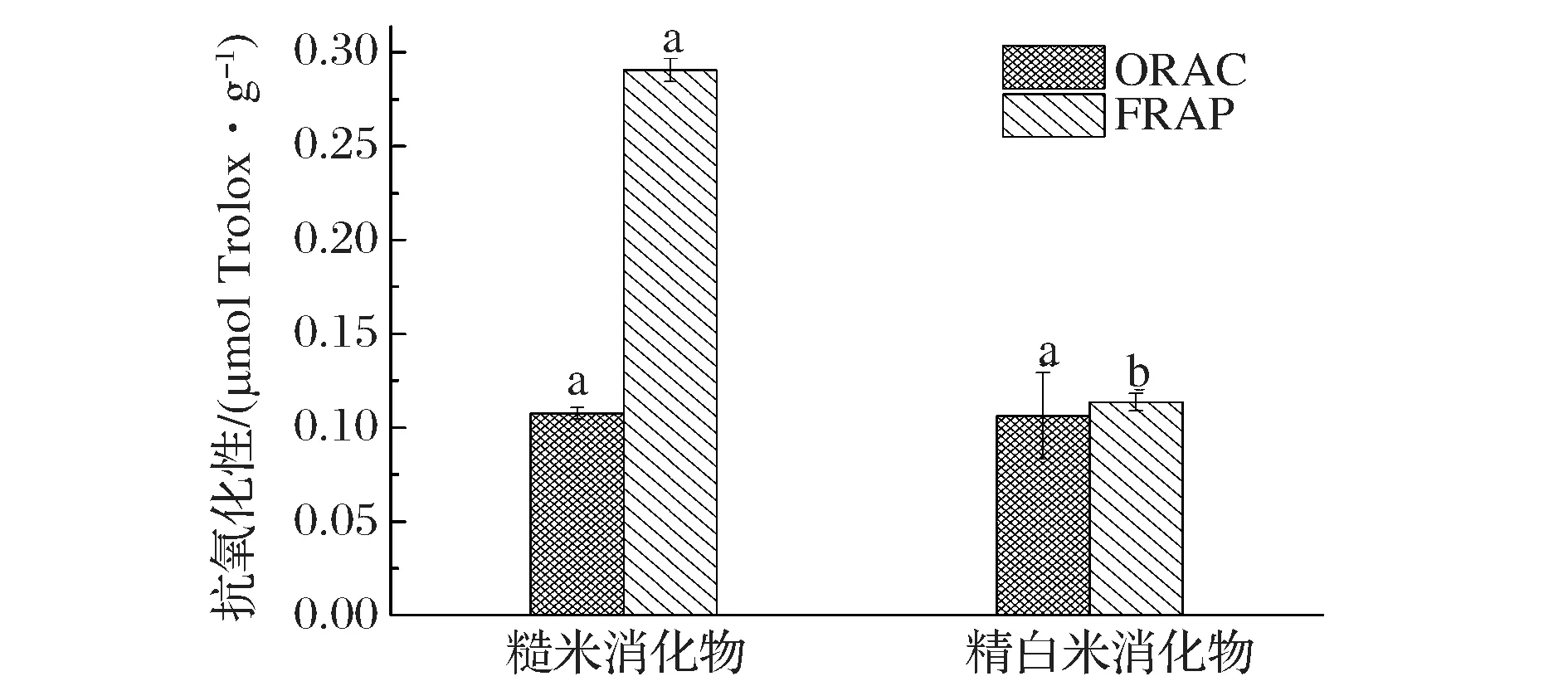
图5 消化物脂溶性提取物体外抗氧化活性分析Fig.5 Analysis of antioxidant activity in vitro of lipophilic extracts from different digestion products相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
3 结论
(1)体外模拟消化后,糙米总消化率约为70%左右,消化产物中总膳食纤维和脂质含量分别约为12%和7%,约为精白米中膳食纤维和脂质含量的2倍和5.5倍。
(2)糙米消化物在体外模拟肠道发酵试验中能更好的促进肠道益生菌(乳酸杆菌、双歧杆菌)的增殖和短链脂肪酸生成,糙米消化物发酵后乳酸杆菌和双歧杆菌数量的对数值分别为7.30和9.69,显著高于精白米消化物(其对数值仅为6.14和9.34),且短链脂肪酸的生成量比精白米消化物提高12%左右,表明糙米具有更好的维护肠道微生态和健康功效。
(3)FRAP和ORAC试验结果表明糙米消化物仍然具有较好的抗氧化活性,为精白米消化物抗氧化活性的2倍左右,且活性大小与所含酚类物质含量趋势较为一致。
[1] SUSAN S C, LU Q, GEORGE C F, et al. Consumption of cereal fiber, mixtures of whole grains and bran, and whole grains and risk reduction in type 2 diabetes, obesity, and cardiovascular disease[J]. The American Journal of Clinical Nutrition,2013(6):1-3.
[2] 周惠明. 糙米中功能性成分的研究[J]. 食品科技, 2002(5):17-18.
[3] 谭斌, 谭洪卓, 刘明, 等. 粮食(全谷物)的营养与健康[J]. 中国粮油学报, 2010,25(4):100-105.
[4] 张珺. 糙米中植物活性物质的研究进展[J]. 粮食与饲料工业, 2014(5):20-2.
[5] 张蓉. 抗氧化低聚糖对肠道氧化还原状态与菌群的影响[D]. 无锡:江南大学, 2009:3-4.
[6] 林永华. 糙米食疗米饭的工艺优化及其降血糖、降血脂机理的初步探究[D]. 杭州:浙江大学, 2015:20-21.
[7] 赵兰涛, 程李琳, 张晖, 等. 全谷物体外对肠道菌群影响的研究[J]. 粮食与食品工业, 2014,21(1):24-25.
[8] PINELO M, ZEUNER B, MEYER A S. Juice clarification by protease and pectinase treatments indicates new roles of pectin and protein in cherry juice turbidity[J]. Food and Bioproducts Processing, 2010,88(2): 259-265.
[9] ZHANG B, DENG Z Y, RAMDATH D D, et al. Phenolic profiles of 20Canadianlentilcultivars and their contribution to antioxidant activity and inhibitory effects on α-glucosidase and pancreatic lipase[J]. Food Chemistry, 2015, 172: 862-872.
[10] CONNOLLY M L, LOVEGROVE J A, TUOHY K M.invitrofermentation characteristics of whole grain wheat flakes and the effect of toasting on prebiotic potential[J]. Journal of Medicinal Food, 2012,15(1): 33-43.
[11] APEA-BAH F B, MINNAAR A, BESTER M J, et al. Sorghum-cowpea composite porridge as a functional food, Part II:Antioxidant properties as affected by simulatedinvitrogastointestinal digestion[J]. Food Chemistry, 2016,197: 307-315.
[12] RAMNANI P, CHITARRARI R, TUOHY K, et al.invitrofermentation and prebiotic potential of novel low molecular weight polysaccharides derived from agar and alginate seaweeds[J]. Anaerobe, 2012, 18(1): 1-6.
[13] OLANO M E, MOUNTZOURIS K C, GIBSON G R, et al.invitrofermentability of dextran, oligodextran and maltodextrin by human gut bacteria[J]. British Journal of Nutrition, 2000, 83(3): 247-255.
[14] TI H, LI Q, ZHANG R, et al. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in southern China[J]. Food Chemistry, 2014,159: 166-174.
[15] 张兵. 小扁豆植物化学物组成极其抗氧化、抗炎活性研究[D]. 南昌:南昌大学,2014:39-40.
[16] LEBET V, ARRIGONI E, AMADO R. Digestion procedure using mammalian enzymes to obtain substrates forinvitrofermentation studies[J]. Academic Press, 1998,31:509-515.
[17] ENGLYST K, LIU S, ENGLYST H. Nutritional characterization and measurement of dietary carbohydrates[J]. European Journal of Clinical Nutrition, 2007,61:19-39.
[18] YANG J Y, KESHAVARZIAN A, ROSE D J. Impact of dietary fiber fermentation from cereal grains on metabolite production by the fecal microbiota from normal weight and obese individuals[J]. Journal of Medicinal Food, 2013,16(9):862-867.
[19] KATAOKA K, KIBE R, KUWAHARA T, et al. Modifying effects of fermented brown rice on fecal microbiota in rats[J]. Anaerobe, 2007, 13(5):220-227.
[20] 许勤. 短链脂肪酸的代谢及其在肠道外科中的应用[J]. 肠外与肠内营养, 1999, 6(4):218-223.
[21] 赵兰涛. 全谷物对肠道菌群益生作用的研究[D]. 无锡:江南大学, 2013:19-21.
[22] CONNOLLY M L, LOVEGROVE J A, TUOHY K M.invitroevaluation of the microbiota modulation abilities of different sized whole oat grain flakes[J]. Anaerobe, 2010,16: 483-488.
[23] 龚二生, 罗舜菁, 刘成梅. 全谷物抗氧化活性研究进展[J]. 食品工业科技, 2013,34(2):364-367.
[24] 蒋维维, 易金娥, 谭柱良. γ-谷维素的生物活性研究进展[J]. 食品与发酵工业, 2015,41(6):253-257.
[25] LEE C H, YANG L, XU J Z, et al. Relative antioxidant activity of soybean isoflavones and their glycosides [J]. Food Chemistry, 2005, 90(4): 735-741.
[26] 马玉荣. 加热及模拟胃肠道消化处理对豆浆活性成分和抗氧化能力的影响[D]. 广州:华南理工大学, 2014:42-46.
Intestinal probiotic bacteria and antioxidant activity in vitro of brown rice
NI Xiang-yan,ZHONG Kui,TONG Li-tao,LIU Li-ya,ZHOU Xian-rong,ZHOU Su-mei*
(Institute of Agro-products Processing Science and Technology,Chinese Academy of Agricultural Sciences/ Comprehensive Key Laboratory of Agro-products Processing, Ministry of Agriculture,Beijing 100193, China)
Whole grains have high nutritional and functional benefits. In this study, the intestinal probiotic bacteria proliferation and antioxidant capacity of brown rice were studied. Brown rice after in-vitro gastrointestinal digestion had high content of dietary fiber (about 11%), and stimulated the proliferation of bifidobacteria (9.69 lg copies/mL) and lactobacillus (7.30 lg copies/mL) and production of total short-chain fatty acid (SCFA) in comparison with milled rice. Results of ferric-reducing antioxidant power (FRAP) and oxygen radical absorbance capacity (ORAC) showed that digested product of brown rice still had great antioxidant activity. Therefore, digested product of brown rice was beneficial for intestinal health.
brown rice;invitro;intestinal probiotic bacteria; antioxidant activity
10.13995/j.cnki.11-1802/ts.201610009
硕士研究生(周素梅博士为通讯作者,E-mail:zhousumei@yahoo.com.cn)。
公益性行业(农业)科研专项经费项目“活性稻米、杂粮等食品加工及装备研究与示范”课题“活性复合稻米杂粮营养食品关键生产技术应用示范”(201403063-3 )
2016-04-29,改回日期:2016-06-07

