库尔勒香梨果实发育成熟的糖代谢和呼吸代谢响应特征
潘 俨,孟新涛,车凤斌,薛素琳,张 婷,赵世荣,廖 康
(1新疆农业大学林学与园艺学院,乌鲁木齐 830052;2新疆农业科学院农产品贮藏加工研究所,乌鲁木齐 830091)
库尔勒香梨果实发育成熟的糖代谢和呼吸代谢响应特征
潘 俨1,2,孟新涛2,车凤斌2,薛素琳2,张 婷2,赵世荣1,廖 康1
(1新疆农业大学林学与园艺学院,乌鲁木齐 830052;2新疆农业科学院农产品贮藏加工研究所,乌鲁木齐 830091)
【目的】通过对库尔勒香梨果实发育及成熟过程果实糖代谢和呼吸代谢响应特征的研究,以探讨代谢互作对果实糖分动态积累的作用。【方法】花后60—150 d,每隔10 d取香梨样果,测定果肉、果心和果皮的质量,纵横径,淀粉及4种可溶性糖组分含量,不同途径呼吸速率,12种糖代谢酶与9种呼吸代谢酶活性的变化。通过回归分析、分阶聚类和主成分分析,确定果实发育及成熟不同阶段的质量与糖分的关系,呼吸主路径、代谢酶聚类关系对糖分构成的影响,以此讨论和构建香梨果实糖代谢和呼吸代谢的关联路径及不同部位的代谢特征。【结果】果心以糖酵解为呼吸主路径,果肉的糖酵解与三羧酸循环交替构成呼吸主路径,果皮呼吸主路径由糖酵解和三羧酸循环共同构成。果心和果肉的糖代谢与呼吸代谢可从花后90 d分为两种不同的响应模式,果皮的代谢响应在花后120 d变化明显。成熟期果心的淀粉、蔗糖、山梨醇代谢酶与糖酵解、磷酸戊糖途径、细胞色素途径代谢酶关联聚类;果肉的淀粉、蔗糖代谢酶与糖酵解、三羧酸循环、交替途径、细胞色素途径代谢酶关联;果皮的蔗糖、山梨醇代谢酶与糖酵解、三羧酸循环、交替途径、细胞色素途径代谢酶存在较高的聚类相关。聚类关联酶活性升高或达到峰值,与果心和果肉的果糖、葡萄糖积累,果皮山梨醇转化和果糖、葡萄糖含量升高显著关联。【结论】库尔勒香梨果实以果糖和葡萄糖为主成分的糖分积累构成典型的内在品质,存在果实成熟时糖分构成与甜度的部位异质,是发育与成熟不同阶段糖代谢与呼吸代谢不同动态响应累积的结果。磷酸己糖异构酶与细胞色素氧化酶是香梨果实3个部位同时在成熟阶段交联呼吸代谢与糖代谢的关键酶。
库尔勒香梨;果实发育;糖代谢;呼吸代谢;响应特征
0 引言
【研究意义】库尔勒香梨(Pyrus sinkiangensis Yu)属于新疆梨系统句句梨类型中选育的芽变品种[1],在新疆巴音郭楞蒙古自治州和阿克苏地区集中栽培约6.9×104hm2,正常年份总产量约7.0×105t。新疆梨有3个主要品种类型——句句梨、乃西普特和阿木特,以香梨等句句梨类型品种与白梨(Pyrus bretschneideri Rehd.)的亲缘关系较近[2-3],香梨属于果糖与葡萄糖含量高、糖酸比高的类型[4-5],生理成熟时果皮依然呈绿色,跃变后熟转为黄色[6],兼具西洋梨(Pyrus communis Linn.)的部分品质特征。成熟果实表皮绿色、肉质细脆、甜度高,是库尔勒香梨区别于其他品种的典型品质特征。目前,糖分低、含酸量高[7]的青顶果、粗皮果类等外果比例增加和“抢青”采收,导致商品率下降和商品果采后耐贮性下降,是困扰库尔勒香梨产业增值的原因之一。研究香梨果实发育成熟过程中基本的糖积累动态和糖代谢机理,对确定库尔勒香梨商品果的适贮采收时间和品质评价标准,确定等外果品质劣变与调控的途径,研究相关应用技术具有重要意义。【前人研究进展】糖分作为果实基本的品质构成物质,在糖代谢调控淀粉、蔗糖、己糖、糖醇等物质转化与合成的机制,以及糖代谢关键酶的动力学特性、基因克隆与功能鉴定方面,已有较为广泛和深入的研究[8-20]。近年来已在作物与果实上发现,糖酵解、三羧酸循环、电子传递链调控淀粉、可溶性糖、有机酸、氨基酸等重要的初生代谢以及黄酮与色素等物质的次生代谢,对不同发育时期的代谢产物在不同细胞分区积累的时序和水平具有重要的作用[21-23]。【本研究切入点】库尔勒香梨果实的成熟品质以糖分构成为主,但果实的结构存在明显的分化,有关果实不同部位品质分化的时期、代谢互作调控的差异、等外果的果皮与果肉组织发育异常及品质劣质化等机理的研究未见报道。【拟解决的关键问题】本研究通过分析库尔勒香梨果实发育成熟过程糖代谢与呼吸代谢的响应协调关系,以明确不同糖组分变化与积累的时序和果实的部位间差异;了解运转糖和贮备糖动态平衡的生理意义;探索不同途径的呼吸代谢对不同糖组分转化、合成利用的作用,糖分品质不同部位异质化的大致代谢机理及调控关键位点,为库尔勒香梨果实品质调控和等外果发育品质的改善提供理论依据。
1 材料与方法
试验于2013—2015年在新疆农业科学院农产品贮藏加工研究所进行。
1.1 试验材料
果实取样地点为新疆巴音郭楞蒙古自治州轮台县国家果树资源圃的3.5 hm2香梨果园(84.22°67′ E、41.78°36′ N)。香梨树龄15年,株行距4 m×6 m,园内无任何间作,树形均为三主枝中干型,授粉树为鸭梨,无人工疏花疏果;果园土质为壤土,壤土层深度约100—120 cm;120 cm以下土层为黏土和砂石层。梨树生长季内共沟灌浇水6次,包括3月中,4月底,5月、6月、7月及8月的中旬各浇水1次。6月中旬追肥一次,沟施氮肥约0.80 kg/株、磷钾肥(磷酸二铵∶硫酸钾=2.5∶1)约1.6 kg/株;10月底前施入羊粪厩肥约50 kg/株。于2013年6月15日至9月25日(花后60—150 d),在园内选取树势与负载量(年均单产30 kg/棵)相对一致、集中在同一小区的香梨树35株,每10 d摘取样果一次,共取样10次。每次清晨采收样果,采收时选择着生于树冠中部的外层结果枝果实。选留无损伤、无虫斑、带有完好果柄的果实约15 kg,苯板箱加冰袋包装后公路运输。12 h内运至实验室,当天完成鲜样检测分析;剩余样品切分后液氮速冻,-80℃保存备用。
1.2 试验方法
1.2.1 试验设计 将各次取样果实剖分出果皮、果肉和果心3个部位材料,通过糖组分(蔗糖、山梨醇、葡萄糖、淀粉)、不同途径(EMP糖酵解、PPP磷酸戊糖途径、TCAC三羧酸循环、CP细胞色素途径、AP交替途径)呼吸速率的测定,确定果实发育成熟过程中3个部位糖分构成特征和呼吸途径的强弱差异。选择香梨果实单糖和多糖代谢的路径节点关键酶,包括蔗糖代谢(SPS蔗糖磷酸合酶、SuSy蔗糖合酶的合成方向与分解方向、AI酸性转化酶、NI中性转化酶)、山梨醇代谢(NAD-SDH、NADP-SDH山梨醇脱氢酶、SO山梨醇氧化酶)、淀粉代谢(AGPase腺苷二磷酸葡萄糖焦磷酸化酶、UGPase尿苷二磷酸葡萄糖焦磷酸化酶、α-淀粉酶、β-淀粉酶)共12种代谢酶,测定发育成熟过程中酶活性;选择呼吸与电子传递链的代谢路径节点关键酶,包括糖酵解(GPI磷酸己糖异构酶、PK丙酮酸激酶)、磷酸戊糖途径(G-6-PDH葡萄糖-6-磷酸脱氢酶和6-PGDH 6-磷酸葡萄糖酸脱氢酶的联酶)、三羧酸循环(Sdh琥珀酸脱氢酶、PDC丙酮酸脱氢酶、NAD-MDH苹果酸脱氢酶、NADP-ME苹果酸酶)、细胞色素电子传递链(COX细胞色素氧化酶)、交替电子传递链(AOX交替氧化酶)共9种代谢酶,测定发育成熟过程中酶活性。通过分阶聚类分析,探明果实发育成熟过程中糖代谢与呼吸代谢21种酶活性峰值出现时间与代谢节点的二向聚类关系;结合代谢酶活性与糖组分含量的主成分分析结果,确定果实发育成熟过程不同部位糖和呼吸的代谢响应特征。
1.2.2 测定方法 单果、果皮、果肉、心室的质量及比例,单果与心室的纵横经,每次测定约40个果实。香梨果肉、心室和果皮的蔗糖、葡萄糖、果糖、山梨醇、淀粉的含量的液相色谱测定方法和甜度计算方法,参考姚改芳[4]的方法,重复3次。参考史青纯[24]的方法,使用氧电极测定和计算样果果肉、心室和果皮的总呼吸和不同途径的呼吸速率,每次测定重复5次。糖代谢12种酶的活性测定重复3次,提取和测定方法包括:SPS、SuSy、AI、NI、SO、SDH酶提取方法参考许让伟[18]和赵智中[25]的方法,略作修改;AI活性测定参考魏建梅[20]的方法,略作修改;NI、SuSy-s(合成方向)和SuSy-c(分解方向)酶活性测定参考许让伟[18]和HAYATA[26]的方法,略作修改;SO、NAD-SDH、NADP-SDH活性测定参考YAMAGUCHI[27]的方法;AGPase和UGPase酶提取与活性测定使用试剂盒(上海江莱生物科技公司);淀粉酶液提取、活性测定及计算(总酶、α-淀粉酶、β-淀粉酶)参考张迟[28]的方法 。呼吸代谢9种酶活性测定重复3次,提取和测定方法包括:GPI、PK、G-6-PDH和6-PGDH联酶、Sdh、PDC、COX和AOX酶液提取参考史青纯[24]与何亚辉[29]的方法,略作修改;GPI活性测定参考BROWN[30]和韩蓓[31]的方法修改;PK活性测定使用试剂盒(南京建成生物科技公司,A076-1型);G-6-PDH和6-PGDH联酶活性测定参考BROWN[30]的方法;Sdh活性测定参考史青纯[24]的方法,略作修改;PDC活性测定参考何亚辉[29]的方法(DCPIP法),略作修改;NAD-MDH和NADP-ME活性测定参考HIRAI[32]和WEDDING[33]的方法,略作修改;COX活性测定参考史青纯[24]、田美华[34]和陈京京等[35]的方法,略作修改;AOX活性测定参考VANLERBERGHE[36-37]、胡文海[38]和JARMUSZKIEWICZA[39]的方法调整,以氧电极法测得耗氧速率表示AOX活性。糖组分与淀粉含量、糖代谢酶活性和呼吸代谢酶活性每批次测定使用的样果量不同,其中花后60—70 d样果的测定用量为400—600个果;花后80—90 d样果的测定用量为160—260个果;花后100—150 d样果的测定用量为80—100个果。果肉材料选用果实赤道线部位约2.0 cm3的去皮组织;心室材料选用去除种子、心室隔膜内的组织;果皮材料剔除红晕着色部位。
1.2.3 试验仪器 质量测定使用电子天平(赛多利斯,ALC-2100型),单果与心室的纵横经测定使用游标卡尺测量(杭州力创,150D型)。果皮剥取使用削皮机(RS,NC-3447型),去皮厚度0.5—1.0 mm。液相色谱条件包括高效液相色谱仪(安捷伦,1260型),钙离子交换柱(安捷伦 Hi-Plex Ca 8.0 μm,7.7 mm×300 mm);超声波脱气和0.45 μm膜过滤的纯水(18 MΩ·cm)为流动相,流速0.60 mL·min-1,20 μL进样量,80℃柱温,示差检测器(G1362A RID)设置0.05 AUFS灵敏度。呼吸速率测定使用Clark 液相氧电极仪(Hansatech,Oxygtherm型)。酶提取和活性测定过程,材料液氮研磨(IKA,T18型)再冰浴匀浆(IKA,T10型主机、10 G型刀头);梯度离心使用低温高速离心机(Eppendorf,Centrifuge2510R型)和(Hettich Mikko22R型);分光光度计使用岛津UV2600型。超低温冰箱(海尔,DW-86L490型)-80℃保存样品。
1.3 数据统计
使用Sigma Plot 13.0软件制图,回归方程的拟合使用分类回归方法。分阶聚类前,使用SPSS 20.0软件的描述性检验工具Z-Score对21种酶活性的测定数值处理为标准化数值,再转换为TDMS格式文件,导入MeV Version 4.9.0软件(软件来源www.tm4.org);以分阶聚类(Hierarchical Clustering)方法制作HCL Tree热图,自动建立分阶聚类树,分析糖代谢和呼吸代谢的关联时间和关联节点。使用SPSS 20.0软件的降维分析方法(最优尺度)工具进行主成分分析(PCA),选择香梨果心、果肉和果皮的质量为标示变量,21种酶活性为分析变量,5种糖组分为补充变量;对标示变量、分析变量和补充变量回归后获得载荷图和双标图;根据载荷系数分析香梨果实发育成熟过程不同部位的质量、糖分构成和代谢酶的关系。以上述HCL和PCA计算结果为依据划分果实不同部位的发育成熟阶段,依据KEGG(Kyoto Encyclopedia of Genes and Genomes,http:// www.genome.jp/kegg/)公布的碳水化合物代谢路径(Central carbohydrate metabolism:EC00500,M00001,M00009,M00010,M00011),结合YAMAKI等[9]对果实山梨醇和蔗糖运转与代谢的研究总结,补充山梨醇代谢节点;参考BIAIS等[40]的代谢分析和构图方法,构建果实发育成熟过程糖代谢和呼吸代谢的关联路径;以HCL聚类分组的结果,讨论果实不同部位代谢酶之间的时序关联。
2 结果
2.1 成熟过程中质量和果径的变化
花后60—150 d库尔勒香梨的单果质量、果肉质量、果皮质量和果心质量增加4.26—5.67倍(图1-A、B)。果肉质量、果皮质量和心室质量约占单果质量70.85%—81.74%、12.25%—16.12%和6.91%—11.37%(图1-C)。花后60—110 d是果肉、心室和果皮的速生期,质量增长速率分别为13.32、1.26和2.19 g/(10 d)。发育至成熟,果实的纵径和横径分别增加70.72%和85.68%,心室纵径和横径分别增加46.11%和78.52%(图1-D、E)。花后60—90 d心室的纵径和横径增长最快,平均每10 d增长1.25—2.05 mm;花后60—110 d果实的纵径和横径增长最快,平均每10 d增长4.18—4.91 mm。
2.2 成熟过程中不同部位糖分含量和比例变化
2.2.1 果心糖分含量和比例变化 图2-A和图3-A显示,库尔勒香梨果实发育成熟过程,果心的果糖、葡萄糖、山梨醇含量持续积累升高,其中山梨醇含量在花后90 d达到峰值21.15 mg·g-1FW;果糖与葡萄糖含量于花后120—130 d达到峰值,分别为64.78 mg·g-1FW和33.63 mg·g-1FW。蔗糖含量相对最低,为2.60—6.03 mg·g-1FW,发育成熟过程中未见明显变化。淀粉含量为10.32—11.85 mg·g-1FW,未见明显变化。果糖和葡萄糖是果心的主要糖组分,至果实成熟分别占果心4种可溶性糖分的42.63%—54.67%和22.31%— 30.85%。山梨醇占果心可溶性糖分的比例由28.05%线性降至10.22%。
2.2.2 果肉糖分含量和比例变化 图2-B和图3-B显示,库尔勒香梨花后80—150 d,果肉的可溶性糖分以果糖含量相对最高,果实成熟时最高,达54.24 mg·g-1FW。山梨醇和葡萄糖的含量分别在花后120 d、140 d升至峰值25.81、23.25 mg·g-1FW,蔗糖在花后150 d含量最高,约4.28 mg·g-1FW。淀粉含量在花后120—150 d快速降至8.36—8.77 mg·g-1FW。香梨花后80 d之后,果糖占果肉可溶性糖分的比例逐渐增至54.88%,相对最高;而山梨醇的比例呈线性下降,最低至27.75%;葡萄糖和蔗糖的比例未见明显变化。
2.2.3 果皮糖分含量和比例变化 图2-C和图3-C显示,库尔勒香梨花后120 d以前,果皮的可溶性糖分以山梨醇含量相对最高,花后100 d达到峰值27.85 mg·g-1FW;花后120 d后,以果糖含量相对最高,花后140 d达到峰值33.79 mg·g-1FW。果皮的葡萄糖含量至花后150 d增至最高,约19.65 mg·g-1FW。果实发育至成熟,果皮的淀粉含量约10.59—12.09 mg·g-1FW,蔗糖含量约1.03—2.79 mg·g-1FW,均未出现明显变化。花后120 d之前,山梨醇占果皮4种可溶性糖分的比例相对最大,约38.57%—55.07%。此后山梨醇比例持续下降,果糖比例增至36.99%—47.81%,果皮可溶性糖分以果糖为主。
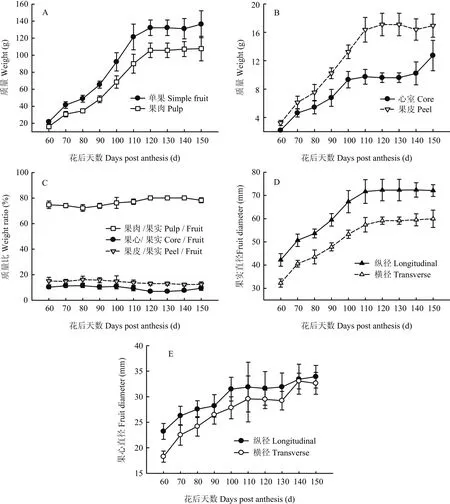
图1 库尔勒香梨果实发育与成熟过程不同部位质量和果径变化Fig. 1 Different parts weights and diameters of Korla pear throughout the fruit development and ripening
2.2.4 质量与糖组分含量及甜度的关系 表1显示,花后60—150 d,果肉、果心和果皮的质量增长量均与果糖和葡萄糖的积累以及甜度的增加存在极显著的正相关(Sig<0.01),香梨果实发育是各个部位质量与果糖、葡萄糖和甜度同步提高的过程。果肉与果心的质量均与淀粉含量的变化显著负相关(Sig<0.01),说明两个部位的质量增长伴有明显的淀粉降解。
2.3 成熟过程中不同部位的不同途径呼吸速率变化
2.3.1 果心不同途径呼吸速率变化 库尔勒香梨花后80 d之前,果心总呼吸速率持续降低约53.06%(图4-A);花后80 d之后总呼吸速率回升,在花后100 d达到峰值131.43 nmol(O2)·mg-1·min-1。果心EMP呼吸速率与总呼吸速率变化趋于平行,在花后100 d同步回升,达到峰值76.38 nmol(O2)·mg-1·min-1。果心的PPP、TCAC、CP和AP呼吸速率从花后60 d均持续减弱,均未出现呼吸峰;CP和AP呼吸速率在花后140—150 d回升,与果心总呼吸在果实成熟末期变化相近。果实发育成熟过程,果心总呼吸与各途径呼吸速率的分类回归结果显示(表2),EMP途径呼吸对总呼吸的贡献最大,是果心的呼吸主途径(Beta=1.270,Sig=0.00)。
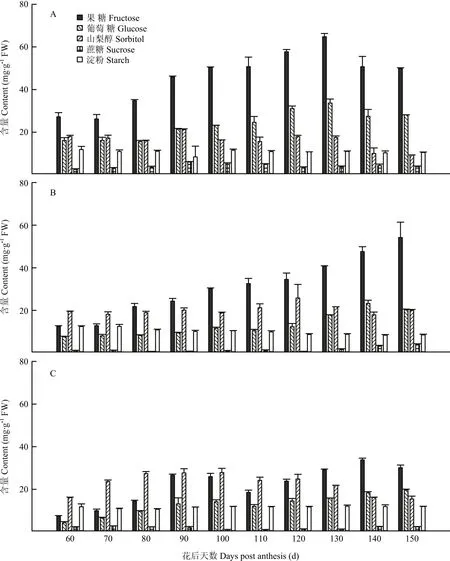
图2 库尔勒香梨果实发育成熟过程果心、果肉和果皮糖分含量的变化Fig. 2 Sugar contents of core, pulp and peel in Korla pear throughout the fruit development and ripening
2.3.2 果肉不同途径呼吸速率变化 香梨果肉的总呼吸与EMP呼吸速率均在花后90 d快速回升(图4-B),与TCAC同在花后110 d出现呼吸峰;总呼吸、EMP和TCAC的呼吸速率峰值分别为30.36、12.83、14.15 nmol(O2)·mg-1·min-1。PPP呼吸速率相对最低、未见明显变化。CP和AP呼吸速率平缓下降,至花后140 d回升。果肉的总呼吸与各途径呼吸速率分类回归结果显示(表2),果肉的EMP途径(Beta=0.790, Sig=0.000)和TCAC途径(Beta=0.337,Sig=0.002)呼吸均对总呼吸具有显著的贡献,果实发育过程两个途径轮换构成果肉呼吸的主途径;轮动切换时间大致为花后90 d左右,TCAC呼吸强度略高于EMP。
2.3.3 果皮不同途径呼吸速率变化 果皮的总呼吸速率与EMP、TCAC、CP、PPP变化趋于平行(图4-C),均在香梨花后110 d同步出现呼吸峰,峰值分别为151.01、59.48、42.76、38.81、14.30 nmol(O2)·mg-1·min-1。果皮AP呼吸速率相对较低,未见明显变化。果皮的总呼吸与各途径呼吸速率分类回归结果显示(表2),EMP途径(Beta=0.741,Sig=0.000)和TCAC途径(Beta=0.557,Sig=0.000)呼吸同时对总呼吸具有显著的贡献,为果实发育成熟过程果皮呼吸的主途径。
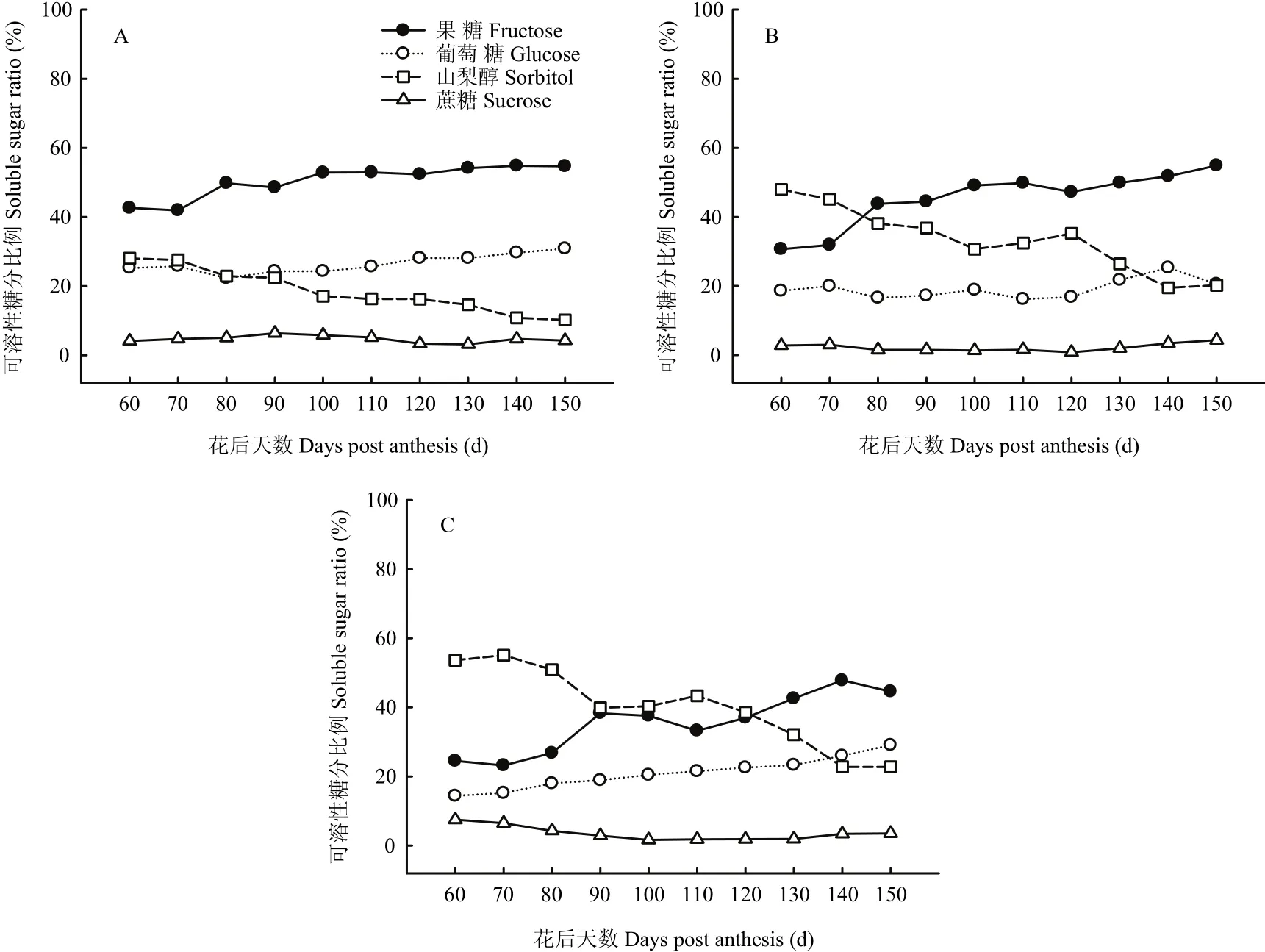
图3 库尔勒香梨果实发育成熟过程果心、果肉和果皮可溶性糖分比例的变化Fig. 3 Soluble sugar ratios of core, pulp and peel in Korla pear throughout the fruit development and ripening
2.4 成熟过程中不同部位的糖代谢酶活性变化
2.4.1 蔗糖代谢酶活性变化 香梨果实发育成熟过程,果心与果肉AI活性变化趋于平行,花后60—100 d活性下降较为明显。花后100—150 d果皮AI活性逐渐增强。果实AI活性以果心相对最高,约72.44—143.70 μmol·g-1·min-1,比果肉和果皮AI活性平均高约1.71倍和6.90倍(图5-A)。
香梨果实NI活性以果心相对最高、约84.98—97.16 μmol·g-1·min-1,比果肉和果皮平均偏高约2.25和6.74倍(图5-B),但未见果心NI活性出现明显变化。花后60—80 d果肉NI活性明显减弱,此后再无明显变化;果皮NI活性仅在花后110—150 d略有升高。香梨发育成熟过程果心、果肉和果皮的NI活性变化均不明显。
花后100—120 d果肉、果心和果皮SPS活性先后出现峰值51.28、109.70、101.70 μmol·g-1·min-1(图5-C);果实趋于成熟,果心SPS活性呈线性下降。香梨果实SPS活性以果肉相对最低,比果肉和果皮平均低约54.20%—59.17%。
花后120 d之前,果心SuSy-c活性呈指数下降;花后120 d之后,果皮SuSy-c活性呈指数升高;果肉SuSy-c活性在花后110 d出现峰值,约24.61 μmol·g-1·min-1(图5-D)。香梨果实SuSy-c活性以果皮相对最高,比果心和果肉平均高约1.51倍和1.62倍。

图4 库尔勒香梨果实发育成熟过程果心、果肉、果皮不同途径呼吸速率的差异Fig. 4 Difference of respiration rate from different respiratory pathways between core, pulp and peel in Korla pear throughout the fruit development and ripening
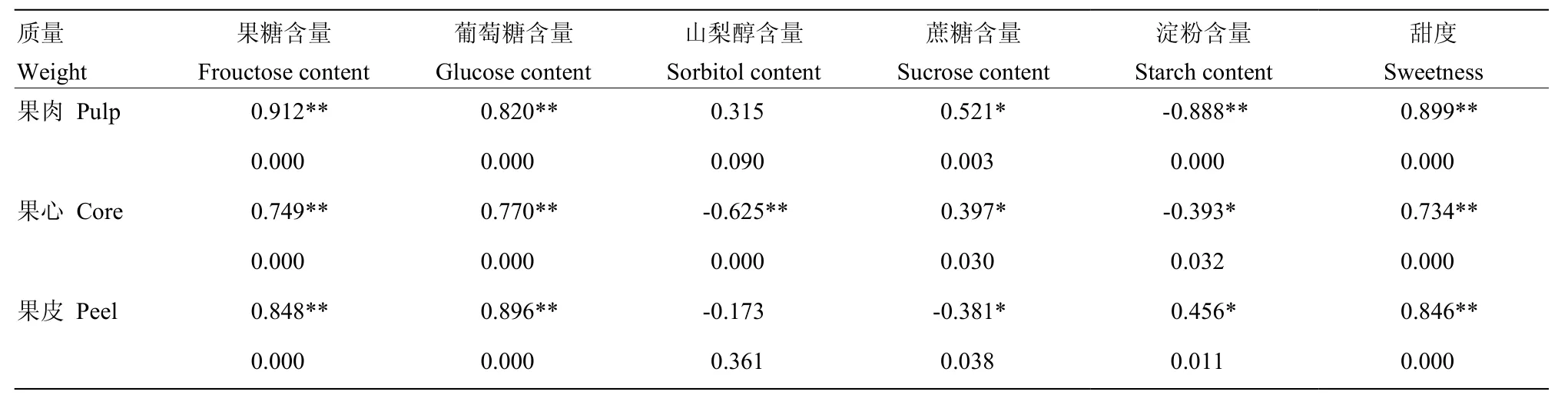
表1 库尔勒香梨果实发育成熟过程不同部位质量与糖分及甜度的相关性Table 1 Correlations between weight, sugar contents and sweetness of core, pulp and peel in Korla pear throughout the fruit development and ripening
果肉SuSy-s活性在花后100 d升至峰值140.09 μmol·g-1·min-1(图5-E);此后至果实成熟活性呈线性下降。果心SuSy-s仅在花后150 d活性升高,此前并无明显变化。果皮SuSy-s活性在花后80—110 d活性偏低,约33.91—51.40 μmol·g-1·min-1。香梨果实SuSy-s活性以果肉相对最高,比果心和果皮平均高26.06%—108.82%。
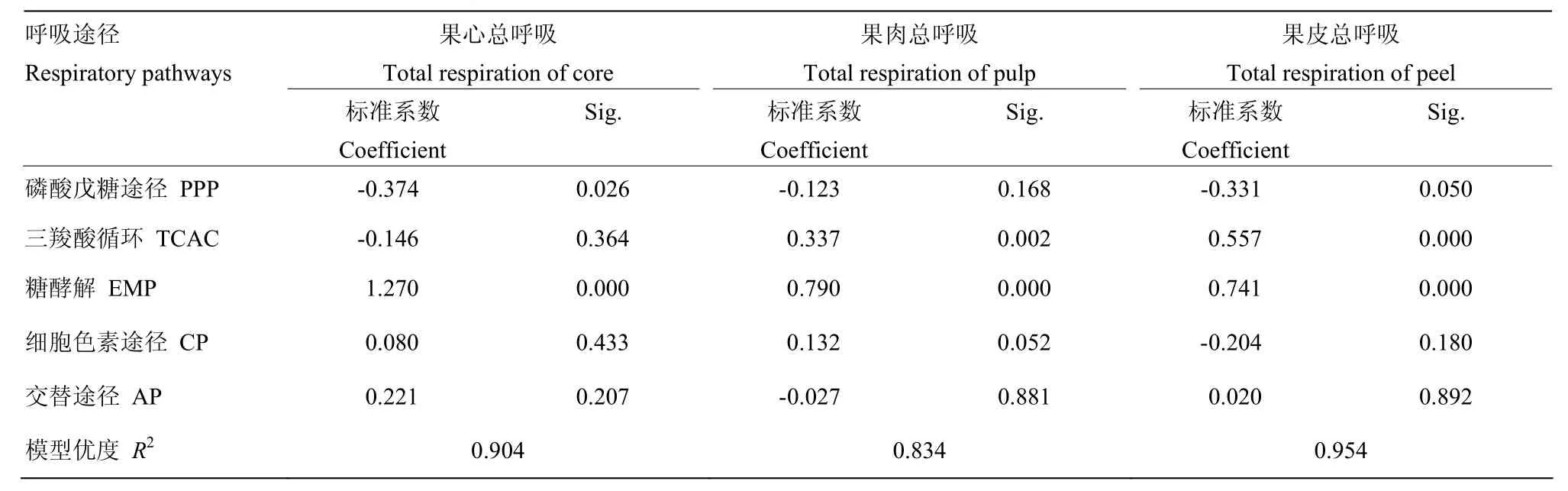
表2 库尔勒香梨果实发育成熟过程不同部位总呼吸与EMP、TCAC、PPP、AP、CP途径呼吸速率分类回归结果Table 2 Category regressions between total respiration rate and respiration rates corresponding to EMP, TCAC, PPP, AP, CP of core, pulp and peel of Korla pear
2.4.2 山梨醇代谢酶活性变化 果实各个部位的SO、NAD-SDH、NADP-SDH活性均以果肉相对最高,平均约29.57、29.20、15.75 μmol·g-1·min-1,比果心和果皮的SO活性平均高26.11倍和20.70倍;比果心和果皮的NAD-SDH活性平均高6.30和4.99倍;比果心和果皮的NADP-SDH活性平均高5.37和3.04倍。果实发育成熟过程,果肉的山梨醇代谢3种酶活性均呈指数下降、变化幅度相对最大(图5-F、G、H)。果心和果皮的SO、NAD-SDH、NADP-SDH活性较弱、未见明显变化。
2.4.3 淀粉代谢酶活性变化 果实发育成熟过程中,果皮AGPase活性由128.03 μmol·g-1·min-1线性降至74.66 μmol·g-1·min-1(图5-I);果心和果肉AGPase活性在花后100—110 d出现峰值81.95 μmol·g-1·min-1和116.02 μmol·g-1·min-1,但果实AGPase活性均值以果心相对最低。
果皮、果肉和果心UGPase分别在花后90 d、120 d、140 d出现活性峰值,约1 730.93、1 828.68、1 426.27 μmol·g-1·min-1(图5-J);果实UGPase活性以果心相对最低,比果肉和果皮平均低16.25%—23.59%。
果肉的α-淀粉酶和β-淀粉酶的活性呈指数降低,约827.64 μmol·g-1·min-1和267.62 μmol·g-1·min-1,变化幅度相对最大(图5-K、L)。果心和果皮α-淀粉酶活性的均值相对较高,分别为204.83 μmol·g-1·min-1和345.42 μmol·g-1·min-1,但发育成熟过程未见明显变化。花后130—150 d果皮和果心β-淀粉酶活性平行升至最高;花后90 d之后,果实β-淀粉酶活性始终以果皮相对最高。
2.5 成熟过程中呼吸代谢酶活性变化
2.5.1 磷酸戊糖途径代谢酶活性变化 果皮G-6-PDH与6-PGDH联酶的活性从花后70 d由峰值295.90 μmol·g-1·min-1呈线性降低,下降幅度约89.65%(图6-A)。果心的联酶活性在花后100 d升至峰值166.80 μmol·g-1·min-1,果肉的联酶活性平缓升高,在成熟末期达到最高,约113.58 μmol·g-1·min-1。
2.5.2 糖酵解代谢酶活性变化 果皮PK活性从花后70 d由峰值99.90 μmol·g-1·min-1呈线性降低,下降幅度约56.84%(图6-B)。果肉PK在花后100 d活性升至峰值79.41 μmol·g-1·min-1;果心PK活性仅从花后120 d之后略有上升,此前未见明显变化。果实发育成熟过程以果心PK活性相对最低,比果肉和果皮平均低41.37%—45.29%。
果肉和果心GPI活性均呈线性升高,至花后150 d升至最高,分别约88.36 μmol·g-1·min-1和93.53 μmol·g-1·min-1(图6-C)。果皮GPI活性为60.36—71.61 μmol·g-1·min-1,未见明显变化;香梨花后110—150 d果实GPI活性以果肉相对最高,果皮最低。
2.5.3 三羧酸循环代谢酶活性变化 果心PDC活性从花后60 d约82.94 μmol·g-1·min-1呈指数平缓下降(图6-D),果皮和果肉PDC活性均在花后130 d达到峰值、约65.59 μmol·g-1·min-1和46.85 μmol·g-1·min-1。发育成熟过程果实PDC活性以果肉相对最低、比果心和果肉平均偏低61.02%—78.53%。
果皮和果肉Sdh活性分别在花后90 d、100 d降至最低,均在花后120 d回升至峰值,分别为15.90 μmol·g-1·min-1和20.54 μmol g-1min-1(图6-E)。果心Sdh活性约10.90—14.02 μmol·g-1·min-1,未见明显变化。发育成熟过程果实Sdh活性以果肉相对最高,比果皮和果心平均高40.18%—42.36%。
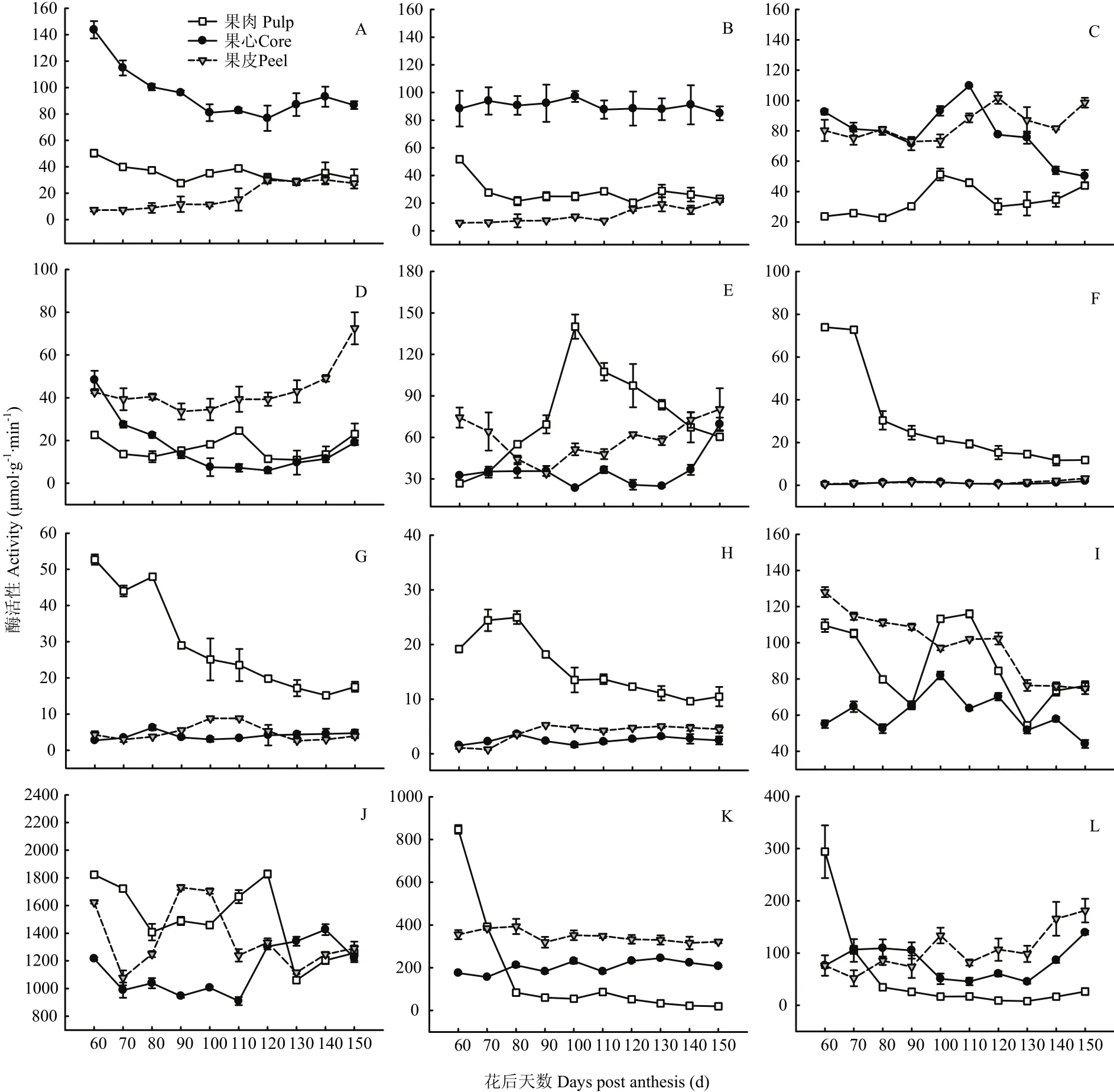
图5 库尔勒香梨果实发育成熟过程果心、果肉、果皮的糖代谢酶活性变化Fig. 5 Enzyme activities of sugar metabolism of core, pulp and peel in Korla pear throughout the fruit development and ripening
果心NAD-MDH活性从花后70 d由峰值1 770.42 μmol·g-1·min-1呈指数快速衰减(图6-F),果皮NAD-MDH活性在花后100 d出现峰值1 027.50 μmol·g-1·min-1,果肉NAD-MDH活性均值约366.87 μmol·g-1·min-1,未见明显变化。发育成熟过程果实NAD-MDH活性以果肉相对最低,比果心和果皮平均低50.46%和56.51%。果皮NADP-ME活性在花后110 d升至峰值786.67 μmol·g-1·min-1(图6-G),果心NADP-ME活性从花后60 d呈指数下降至115.83 μmol·g-1·min-1。果肉NADP-ME活性为249.44—281.11 μmol·g-1·min-1,未见明显变化。发育成熟过程果实NADP-ME活性以果皮相对最高,比果肉和果心活性平均高约1.18倍和5.14倍。
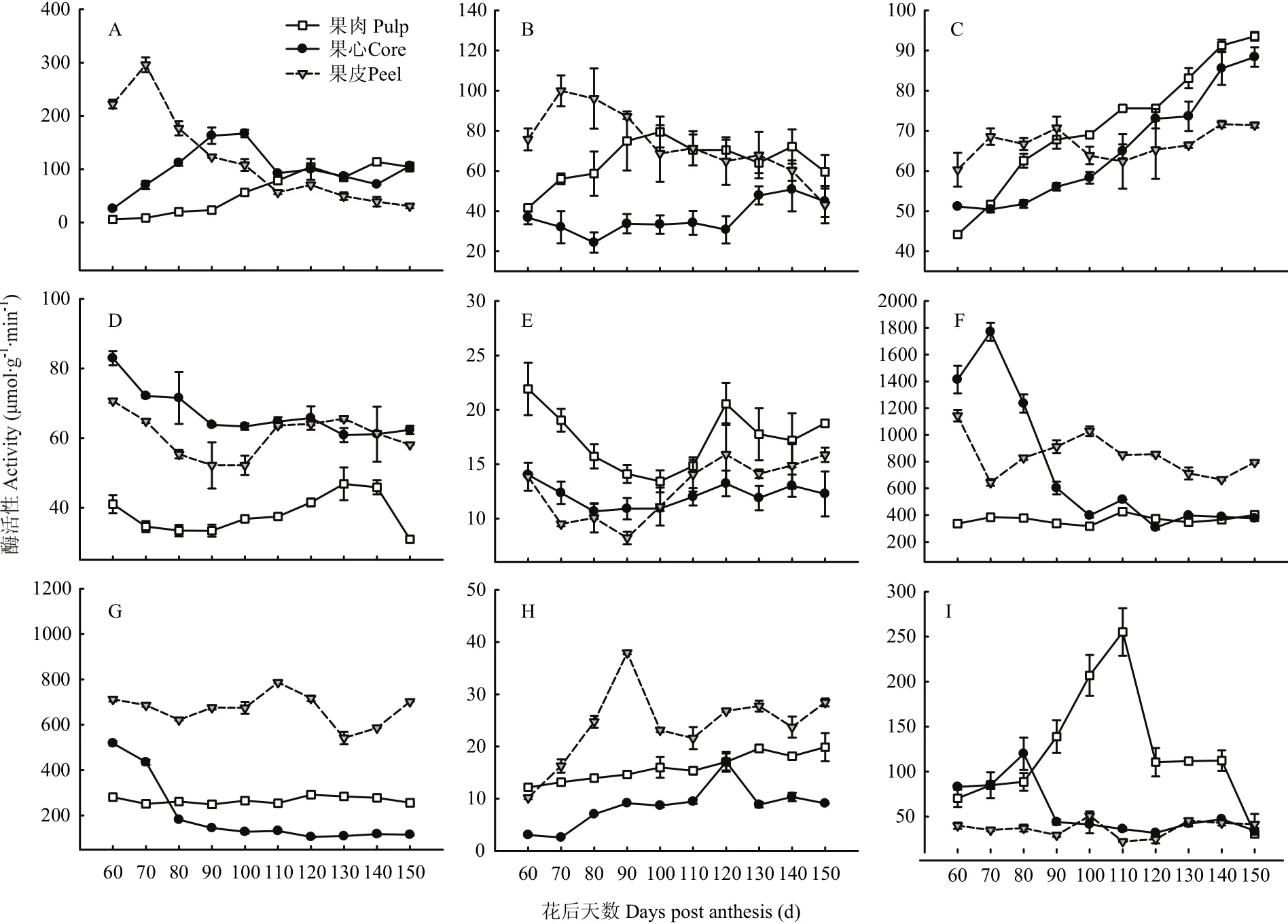
图6 库尔勒香梨果实发育成熟过程果心、果肉和果皮呼吸代谢的酶活性变化Fig. 6 Enzyme activities of respiratory metabolism of core, pulp and peel in Korla pear throughout the fruit development and ripening
2.5.4 电子传递链代谢酶活性变化 果皮COX活性在花后90 d升至峰值37.95 μmol·g-1·min-1(图6-H),果肉COX活性呈线性升高,最高至19.88 μmol·g-1·min-1,果心COX活性为2.58—10.33 μmol·g-1·min-1,仅在花后120 d略有升高。发育成熟过程果实COX活性以果皮相对最高,比果肉和果心平均高约50.16%和2.27倍。
果肉AOX活性在花后110 d升至峰值255.10 nmol·(O2)mg-1·min-1,果心AOX活性在花后80 d出现峰值119.88 nmol·(O2)mg-1·min-1,果皮AOX活性为22.43—51.02 nmol·(O2)mg-1·min-1,未见明显变化(图6-I)。发育成熟过程中果实AOX活性以果肉相对最高,比果心和果皮平均高约1.14倍和2.27倍。
2.6 成熟过程中糖代谢和呼吸代谢的响应关系
2.6.1 果心糖代谢和呼吸代谢的响应关系 分阶聚类分析结果显示,果心发育成熟过程被分为2个阶段。第一个阶段为花后60—80 d,可归为果心发育初期,以果心TCAC与山梨醇、蔗糖的代谢的增强和响应关联为主(图7-A,绿色条码),聚类酶包括:TCAC反应的启动节点PDC、苹果酸代谢NADP-ME与NAD-MDH、TCAC与电子传递的联结位点Sdh、交替呼吸电子传递AOX;将蔗糖和蔗糖-6磷酸分解为果糖、葡萄糖、6磷酸-葡萄糖、ADP-葡萄糖的AI和SuSy-c,均在该阶段出现活性峰值。第二个阶段为花后90—150 d。其中,花后90—110 d的聚类分支属于果心质量增加最快的时期,可归为果心速生期,基本以糖代谢为主。聚类代谢酶包括:调控蔗糖-6磷酸合成与分解的SPS和NI,以及催化蔗糖/淀粉代谢、合成ADP-葡萄糖及高水平磷酸的AGPase均出现活性峰值、被聚为一个分支(图7-A,黄绿色条码);氧化山梨醇为葡萄糖的SO、水解淀粉转化为单糖的β-amylase,与G-6-PDH/6-PGDH联酶的聚类分支(图7-A,黄色条码),与花后120—150 d的聚类分组关联。花后120—150 d的聚类分支可归为果心的成熟阶段,以EMP、淀粉、山梨醇的代谢响应为主,聚类代谢酶包括:转化山梨醇、促进果糖和葡萄糖积累的SDH;催化淀粉水解为单糖的α-amylase、催化磷酸-葡萄糖转化为蔗糖合成底物的UGPase,可逆转化葡萄糖-6磷酸和果糖-6磷酸的GPI,提供TCAC反应底物丙酮酸,同时转化ADP为ATP的PK,以及参与ATP合成的细胞色素电子传递链COX,均在该阶段活性增强、出现峰值(图7-A,红色条码)。
根据果心糖分含量和代谢酶活性的主成分分析结果,发育成熟过程果心糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为51.10%(图8-A-1)。随着果心质量增加、组织发育成熟,果心糖分的主成分转变顺序为:淀粉→蔗糖→山梨醇→葡萄糖→果糖;主成分的载荷维度(0.0—1.0)与果心质量7.0—12.0 g(质量标示变量系数-2.0—2.0)的维度基本对称(图8-A-2)。代谢酶中以GPI、SO、NADP-SDH、UGPase的载荷系数相对较高(0.817、0.714、0.681、0.672),并与蔗糖含量变化的关联度较高;而果心含量最高的糖分——葡萄糖和果糖的含量,与COX、PK和α-amylase的活性关联度相对较高。
2.6.2 果肉糖代谢和呼吸代谢的响应关系 分阶聚类将果肉发育成熟过程分为2个阶段。第一个阶段为花后60—80 d,可归为果肉的发育初期,以山梨醇、蔗糖、淀粉代谢的增强与响应关联为主;山梨醇代谢酶SO、SDH(NADP型和NAD型),蔗糖代谢酶AI、NI、SuSy-c,蔗糖/淀粉代谢酶α-amylase、β-amylase、AGPase、UGPase,共11种活性较强的糖代谢酶被聚为一组(图7-B,绿色条码);有7种酶的活性出现峰值。该阶段的糖代谢特点为:催化山梨醇和蔗糖两种运转糖转化为单糖的反应较为活跃,淀粉降解的代谢强度相对最高。第二个阶段为花后90—150 d,其中花后90—110 d的聚类分支属于果肉质量快速增加的时期,可归为果肉速生期,以TCAC(图7-B,黄色条码)代谢为主(PDC、NADP-ME、Sdh)。花后120—150 d的聚类分支可归为果肉成熟阶段,以EMP和蔗糖代谢关联为主(图7-B,红色条码),EMP调控ATP合成的节点PK,逸失多余电子、减少ATP合成的AOX均在该阶段出现活性峰值;调控磷酸化蔗糖与单糖转化的SPS,平衡蔗糖与单糖动态消长的SuSy-s与SuSy-c,促进淀粉水解产物向蔗糖转化的AGPase和UGPase,同步出现酶活性的增强。
主成分分析结果显示,香梨果实发育成熟过程果肉糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为63.93%(图8-B-1)。对照果肉的质量标示图(图8-B-2),发育成熟过程果肉糖分的主成分转变顺序为:淀粉→山梨醇→蔗糖、葡萄糖、果糖。其中,果肉质量缓慢增长的过程(维度2载荷系数-4.0—0.0),淀粉和山梨醇代谢关联性较高,与分阶聚类分析结果一致。果肉质量50.0—100.0 g快速增长过程(质量标示维度2载荷系数0.0—6.0)以山梨醇积累为主;果肉质量大于100.0 g后,以蔗糖、葡萄糖和果糖积累为主;SPS(0.822)、SuSy-s(0.775),与EMP代谢GPI(0.807)、调控ATP合成的PK(0.730)与COX(0.874),以及PPP呼吸支路G-6-PDH/6-GPDH联酶(0.936)的载荷系数和关联度较高。
2.6.3 果皮糖代谢和呼吸代谢的响应关系 分阶聚类将果皮发育成熟过程分为2个阶段。第一阶段为花后60—120 d(图7-C,绿色、黄绿和黄色条码),可归为果皮的发育期,支路呼吸途径PPP的G-6-PDH/ 6-GPDH联酶,呼吸主路径EMP的产能节点PK及TCAC启动节点PDC,淀粉降解、转化ADP-葡萄糖以及合成蔗糖的α-amylase、AGPase、SuSy-s存在较高活性的响应关联;TCAC苹果酸代谢NAD-MDH与NAD-ME,与山梨醇转化果糖SDH(NAD型与NADP型)、淀粉水解转化UDP-葡萄糖UGPase,均在该阶段出现酶活性峰值。第二个阶段为花后130—150 d,可归为果皮的成熟期。该阶段SO、SuSy-c、NI、β-amylase糖代谢在同步出现酶活性峰值的响应;蔗糖代谢AI与SPS、TCAC与电子传递联结节点Sdh,两个电子传递链关键酶AOX和COX,均具有较强活性、被关联聚类(图7-C,红色条码)。
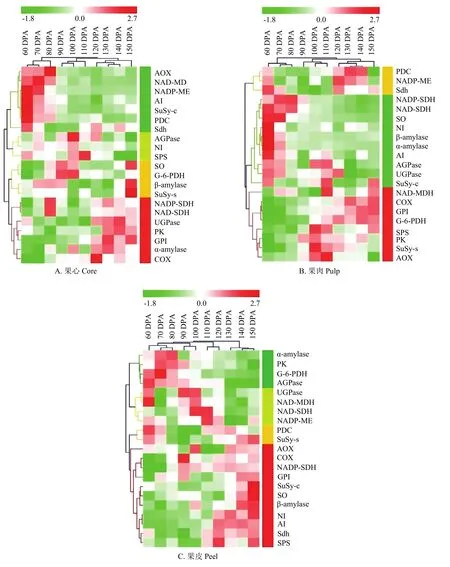
图7 库尔勒香梨果实发育成熟过程糖与呼吸代谢酶的分阶聚类Fig. 7 Hierarchical clustering analysis of 21 enzyme activities profiles of sugar metabolism and respiratory metabolism of Korla pear throughout the fruit development and ripening

图8 库尔勒香梨果实发育成熟过程糖分与21种代谢酶活性的主成分分析Fig. 8 Principal component analysises of combined set of 5 sugars content with 21 metabolic enzyme activities Korla pear throughout the fruit development and ripening
主成分分析结果显示,果实发育成熟过程果皮糖代谢与呼吸代谢的动态关联被分成2个维度,对分析变量和补充变量的方差解释为55.54%(图8-C-1)。对照果皮质量标示图(图8-C-2),发育成熟过程果皮糖分的主成分转变顺序为:山梨醇、蔗糖→淀粉→葡萄糖、果糖。其中,果皮质量10.0—17.0 g(维度1系数0.0—6.0)快速增长的时期,果皮糖分以山梨醇和蔗糖两个运转糖为主要组分;糖代谢AI、NI、NAD-SDH、SuSy-s,与呼吸代谢Sdh、AOX的活性关联度较高,以Sdh(0.825)、NI(0.948)和AI(0.923)的载荷系数最高。果皮质量增至17.0—22.0 g的时期,糖分以淀粉、葡萄糖和果糖为主要组分;呼吸代谢中仅有COX与糖代谢SO、β-amylase、SPS、SuSy-c的活性关联度较高;以SO(0.823)和β-amylase(0.894)的载荷系数相对最高。
3 讨论
香梨果实发育和成熟过程中,果心、果肉和果皮的山梨醇含量都较为丰富,比蔗糖含量高6.0%—48.0%,叶片合成并运至果实的糖分,尤其在发育前期可能以山梨醇为主。山梨醇代谢转化的产物之一果糖可直接参与EMP;其转化的葡萄糖由EMP关键酶GPI调控、选择性的参与EMP或PPP[31,41]。图9显示,果肉、果心和果皮的GPI代谢热点均出现于成熟期,表示成熟期各部位GPI活性的升高有利于引导更多的6磷酸-葡萄糖转化为6磷酸-果糖进入EMP,以减少果糖的消耗而留存和积累。山梨醇代谢和蔗糖转化可能是香梨果实的糖代谢基本途径,作为代谢产物的调节枢纽与呼吸代谢关联。
果实各部位的蔗糖比例虽然比山梨醇明显偏低,但发育成熟过程依然具有关键的作用。一方面,蔗糖可能是果实发育前期淀粉合成与积累的来源[42-46]。蔗糖运转、卸载至果实[9]、被SuSy-c分解为ADP-葡萄糖后[18,20],再由淀粉合成酶或分支酶转化为支链淀粉和淀粉[47-49];其次,蔗糖作为代谢调控的信号[8,50],可能在SuSy合成和分解过程起到转换和反馈调节UDP-葡萄糖或ADP-葡萄糖的转化率的作用,从而调控蔗糖/淀粉代谢转化方向和强度。因此,香梨果实的糖代谢没有蔗糖的明显积累,可能与低含量的蔗糖仅作为单糖/多糖代谢之间的路径连接信号作用有关。SuSy两个代谢转化方向的产物和底物均存在果糖,作为香梨果实中含量最为丰富的糖组分,果糖含量的高低可能直接影响SuSy的转化方向和活性强弱。跃变型果实成熟过程中,多发生组织淀粉水解、转化[51-54]为单糖被用于呼吸代谢。代谢路径(图9)显示,淀粉降解代谢趋于3个方向[55]:(1)淀粉由α-amylase水解为糊精。(2)淀粉由淀粉磷酸化酶分解为1磷酸-葡萄糖后,通过UGPase转化为UDP-葡萄糖,或通过SuSy-s与果糖合成蔗糖;或通过SPS与6-磷酸果糖合成6磷酸-蔗糖。(3)淀粉通过β-amylase外切为麦芽糖,麦芽糖磷酸化酶水解麦芽糖为葡萄糖和磷酸-葡萄糖[56]。UGPase和AGPase作为淀粉代谢与蔗糖代谢路径连接的节点[13]转化磷酸-葡萄糖为UDP-葡萄糖或ADP-葡萄糖[19],香梨果实中2个酶活性同时或前后交替升高,与淀粉含量的同步下降有关;而果实各部位的磷酸-葡萄糖被合成蔗糖或6磷酸-蔗糖,葡萄糖被转化为6-磷酸葡萄糖后,由GPI和G-6-PDH竞争性的选择进入EMP或PPP,同样在马铃薯低温糖化过程被发现[57]。香梨花后100 d果实趋于成熟,果心和果肉的蔗糖转化为单糖的积累过程,与蔗糖积累同时存在;依靠淀粉水解产物转化和蔗糖不断分解,葡萄糖和果糖积累明显、甜度升高;通过GPI促进糖分流向EMP底物转化,由PDC、Sdh、COX保持TCAC代谢通路的流程,NAD-MDH与NADP-ME通过有机酸回填和产物平衡,调控TCAC物质合成与电子传递的代谢速度;PPP代谢增强表示该阶段在糖分富集和GPI异构反应负荷过高条件下,可能通过呼吸支路代谢增强、主动分流糖代谢供应过量的6磷酸-葡萄糖。因此,代谢强度较高的EMP或PPP与蔗糖/淀粉代谢关联,是促进果心和果肉糖代谢、单糖持续积累的有利条件。
SPS合成6-磷酸蔗糖的过程必须以6磷酸-果糖为底物,相关功能鉴定的研究结果说明果糖含量的高低与磷酸蔗糖合成的启动和持续有关[10]。香梨果实的果糖聚寡同时受蔗糖和山梨醇代谢的多个位点调控,例如果肉和果皮的AI、NI、SO和SDH在同一时期形成关联热点。SO属于束缚型调控酶,以SDH催化山梨醇生成果糖的能力较强,对果糖积累的贡献可能相对更高[58]。果心SPS在花后60—110 d较为活跃,果肉和果皮活性从花后100 d升高,说明磷酸蔗糖的合成是果心发育期和速生期的重要事件;此时的果心果糖含量明显高于果肉和果皮,已达到果实内源多聚糖代谢的条件。果肉和果皮SPS启动时,果肉的果糖和果皮的山梨醇含量均大于30 mg·g-1;此时果肉和果皮的呼吸代谢同步升高,加快内源聚糖的转化以维持代谢通路。蔗糖转化酶的催化反应仅发生在酸性或中性环境[59],有机酸在TCAC过程合成并运至胞质,为转化酶提供了酸性环境;TCAC生成的质子在线粒体内被“质子泵”用于合成ATP,而SDH在催化山梨醇转化为果糖或葡萄糖时亦释放质子,有利于TCAC保持代谢强度、持续合成有机酸。香梨花后90 d出现果肉和EMP转换构成呼吸主路径,与番茄相关研究结果一致;BIAIS等[40]认为TCAC代谢增强提高ATP合成,是果实发育细胞分裂的必要条件,此后细胞膨大的速生过程需要EMP参与完成。

图9 库尔勒香梨果实发育成熟过程果心、果肉和果皮糖代谢与呼吸代谢的关联差异Fig. 9 Simplified drawing of sugar metabolism and respiratory metabolism responding difference between core, pulp and peel of Korla pear throughout the fruit development and ripening
花后120—150 d,果心、果肉和果皮COX,以及果肉和果皮的AOX活性升高,与GPI和Sdh(果肉和果皮)形成关联热点。CP高强度的电子传递推动能量合成与AP放热耗能过程[60-61]同时存在,必然导致底物的消耗过量。交替呼吸途径虽然表现为“无效”的散热和能量损失过程,但交替途径参与果实跃变成熟的调控[62-65]。该阶段山梨醇含量下降明显,表示代谢底物可能来源于山梨醇,代谢消耗大于运转供给造成山梨醇含量下降;而果肉NADPME活性升高,表示通过有机酸回填反应补充代谢底物的亏缺。
综上所述,香梨果实发育成熟过程:(1)花后60—80 d的果心发育期,果心的糖代谢以蔗糖代谢为主,与TCAC的苹果酸代谢、Sdh、交替电子传递形成代谢的关联热点;花后90—150 d的果心速生期与成熟期,糖代谢以淀粉和山梨醇代谢为主,以蔗糖代谢作为多糖和单糖转化的连接路径,与EMP、PPP和细胞色素途径形成关联热点。(2)花后60—80 d果肉发育初期基本以糖代谢为主,淀粉酶、蔗糖转化酶和山梨醇酶为代谢热点,未见呼吸代谢热点的明显关联;花后90—150 d果肉速生期和成熟期以呼吸代谢为主,EMP、TCAC、CP、AP相关酶与SPS、SuSy-s形成关联热点。(3)花后60—120 d的果皮发育期,淀粉酶、NAD-SDH与PK、苹果酸代谢酶和PPP呼吸形成代谢热点;花后120—150 d果皮成熟期的糖代谢以蔗糖代谢和山梨醇代谢(SO和NADP-SDH)为主,与GPI、Sdh、AOX、COX形成关联热点。从本试验结果来看,香梨果实发育成熟的过程存在果实3个部位糖代谢和呼吸代谢的异质化,果心成熟相对较早,当果肉果糖和葡萄糖含量升至峰值之前,果心已达到生理成熟,果糖和葡萄糖停止积累,以呼吸代谢消耗单糖为主要生理过程;果皮成熟相对最晚。因此,适宜在果心糖分达到峰值的时期采收香梨,即新疆巴州主产区的9月上旬。
花后130 d之前香梨果实的果皮存在强度较高的PPP代谢和苹果酸代谢,表示果皮的部分糖代谢产物用于次生代谢,有机酸大量TCAC代谢被消耗。香梨等外果在发育期果皮增厚,近果皮组织石细胞比例和有机酸含量偏高,可能与苹果酸代谢异常,有机酸未被大量消耗,TCAC与EMP代谢减弱,果皮组织糖代谢产物集中流向木质素代谢有关。库尔勒香梨作为梨属植物中与西洋梨(Pyrus communis Linn.)存在亲缘关系的品种[2,66],具有后熟跃变过程果皮色泽转黄和皮层油脂增厚特性[67],可能与果皮成熟后期高强度电子传递的产能与放热代谢带动TCAC,以完成氨基酸、脂肪酸及香气呈味组分的转化合成[68]有关。从呼吸跃变的强弱差异来看,香梨属于内(果心)、外(果皮)强,中心(果肉)弱的“夹心”模式,与厚皮甜瓜呼吸代谢“内强外弱”的渐变模式有所不同[69]。呼吸代谢较强的部位,均存在与外界环境交换气体的通道,以维持高强度的有氧呼吸[70],香梨果皮可直接与环境交换气体,而果心存在的中空腔体与花萼的萼孔相通,具有与环境气体交换的结构条件;其心室隔膜又能有效的避免种籽与空气接触,有利于维持种籽成熟后的休眠状态,从而满足不同组织休眠或代谢活跃的需要。
4 结论
4.1 香梨花后60—80 d的果心发育期,蔗糖、三羧酸循环、交替途径的代谢酶关联,促进蔗糖转化为单糖,用于放热耗能的呼吸代谢;花后90—150 d果心速生期和成熟期,果心质量增至7.0 g以上,淀粉/蔗糖、山梨醇、糖酵解、磷酸戊糖途径、细胞色素途径的代谢酶关联,以糖酵解为呼吸主路径,促进果糖、葡萄糖积累比例升高,与质量和甜度的增长显著相关。4.2 香梨花后60—80 d的果肉发育期,淀粉/蔗糖与山梨醇代谢酶关联,促进淀粉、山梨醇和蔗糖转化为单糖,果糖含量快速升高;花后90—150 d果肉速生期和成熟期,果肉的糖酵解、三羧酸循环、交替途径、细胞色素途径、淀粉/蔗糖的代谢酶关联;糖酵解和三羧酸循环在花后约90 d切换,相继成为呼吸主路径;果肉质量增至50.0—100.0 g,以淀粉降解和山梨醇积累为主;质量增至100.0 g以上则以果糖、葡萄糖和蔗糖积累,均与质量和甜度的增长显著相关。
4.3 香梨花后60—120 d的果皮发育期,淀粉、山梨醇、磷酸戊糖途径、糖酵解、三羧酸循环的代谢酶关联,以糖酵解和三羧酸循环共同构成呼吸主路径,山梨醇积累和蔗糖转化较快。花后130—150 d果皮成熟期,果皮质量增至17.0 g以上,蔗糖、山梨醇、糖酵解、三羧酸循环、交替途径、细胞色素途径的代谢酶关联,促进山梨醇转化和果糖、葡萄糖的积累。
4.4 香梨果实以糖分积累构成典型的内在品质,存在果实成熟时糖分构成与甜度的部位异质,是发育与成熟不同阶段糖代谢与呼吸代谢不同动态响应累积的结果。磷酸已糖异构酶与细胞色素氧化酶是果实3个部位成熟期呼吸代谢与糖代谢的交联节点。
[1] 新疆地方志编委会. 新疆通志·第33卷: 瓜果志. 乌鲁木齐: 新疆人民出版社, 2000: 114-118. Board Xinjiang Local History Editorial. Annals of Xinjiang·Vol. 33: Melon and Fruit. Urumqi: Xinjiang People’s Publishing House, 2000: 114-118. (in Chinese)
[2] 滕元文, 柴明良, 李秀根. 梨属植物分类的历史回顾及新进展. 果树学报, 2004, 21(3): 252-257. (in Chinese) TENG Y W, CHAI M L, LI X G. A historic retrospect and the progress in the Taxonomy of the genus Pyrus. Journal of Fruit Science, 2004, 21(3): 252-257. (in Chinese)
[3] SATO Y, YAMAGUCHI M, CONG H, HAJI T, WANG B K, PAN Y, WANG H F, MASE N, UEDA E, TSUKUNI T, YAMAMOTO T, LU C S, SHIRATA K. Collaborative research project on conservation of fruit tree genetic resources in Xinjiang Uygur autonomous district of China. Annual Report on Exploration and Introduction of Plant Genetic Resources, 2007, 24: 137-151.
[4] 姚改芳, 张绍铃, 曹玉芬, 刘军, 吴俊, 袁江, 张虎平, 肖长城. 不同栽培种梨果实中可溶性糖组分及含量特征. 中国农业科学, 2010, 44(20): 4229-4237. YAO G F, ZHANG S L, CAO Y F, LIU J, WU J, YUAN J, ZHANG H P, XIAO C C. Characteristics of components and contents of soluble sugars in pear fruits from different species. Scientia Agricultura Sinica, 2010, 44(20): 4229-4237. (in Chinese)
[5] 姚改芳, 张绍铃, 吴俊, 曹玉芬, 刘军, 韩凯, 杨志军. 10个不同系统梨品种的可溶性糖与有机酸组分含量分析. 南京农业大学学报, 2011, 34(5): 25-31. YAO G F, ZHANG S L, WU J, CAO Y F, LIU J, HAN K, YANG Z J. Analysis of components and contents of soluble sugars and organic acids in ten cultivars of pear by high performance liquid chromatography. Journal of Nanjing Agricultural University, 2011, 34(5): 25-31. (in Chinese)
[6] 李学文, 张辉, 逄焕明, 朱璇, 孙丽, 张梦远. 库尔勒香梨采后特征品质的研究. 中国农学通报, 2010, 26(15): 100-102. LI X W, ZHANG H, PANG H M, ZHU X, SUN L, ZHANG M Y. Study on characteristic quality of postharvest fragrant pears. Chinese Agricultural Science Bulletin, 2010, 26(15): 100-102. (in Chinese)
[7] 贾晓辉, 王文辉, 李世强, 杜艳民, 张峰, 佟伟, 王志华. 库尔勒香梨粗皮果发生原因初步分析. 中国南方果树, 2014, 43(2): 92-94. JIA X H, WANG W H, LI S Q, DU Y M, ZHANG F, TONG W, WANG Z H. Initial analysis on the bark fruit occurrence reason of Korla fragrant pear. South China Fruits, 2014, 43(2): 92-94. (in Chinese)
[8] 贾海锋. 蔗糖及茉莉酸信号在草莓果实发育中的作用及其机理分析[D]. 北京: 中国农业大学, 2013. JIA H F. Roles and mechanmisms of sucrose and jasmonic acid signals in the regulation of strawberry fruit development [D]. Beijing: China Agricultural University, 2013. (in Chinese)
[9] YAMAKI S. Metabolism and accumulation of sugars translocated to fruit and their regulation. Journal of the Japanese Society for Horticultural Science, 2010, 79(1): 1-15.
[10] 田红梅. 甜瓜蔗糖磷酸合成酶基因的功能鉴定与分析[D]. 泰安:山东农业大学, 2011. TIAN H M. Function analysis of muskmelon sucrose phosphate synthase ecoding gene [D]. Tai’an: Shandong Agricultural University, 2011. (in Chinese)
[11] 闻小霞. 甜瓜果实蔗糖合成酶基因(SS)的克隆、表达分析及遗传转化[D]. 泰安: 山东农业大学, 2010. WEN X X. Cloning and characterization of the sucrose synthase encoding gene from muskmelon fruit and transformation [D]. Tai’an: Shandong Agricultural University, 2010. (in Chinese)
[12] 陈俊伟, 秦巧平, 谢鸣,蒋桂华, 徐红霞, 程建徽, 吴江, 孙崇波.草莓果实蔗糖和己糖的代谢特性及其与糖积累的关系. 果树学报, 2007, 24(1): 49-54. CHEN J W, QIN Q P, XIE M, JIANG G H, XU H X, CHENG J H, WU J, SUN C B. Characteristics of sucrose and hexose metabolism in relation to sugar accumulation in developing strawberry fruit. Journal of Fruit Science, 2007, 24(1): 49-54. (in Chinese)
[13] 张慧琴, 谢鸣, 张琛, 杨鲁琼, 章镇, 肖金平, 周利秋. 猕猴桃果实发育过程中淀粉积累差异及其糖代谢特性. 中国农业科学. 2014, 47(17): 3453-3464. ZHANG H Q, XIE M, ZHANG C, YANG L Q, ZHANG Z, XIAO J P, ZHOU L Q. Difference in starch accumulation and characterization of sugar metabolism during fruit development of Kiwi fruit. Scientia Agricultura Sinica, 2014, 47(17): 3453-3464. (in Chinese)
[14] 蒋黎. 枇杷己糖激酶调控糖积累的分子机制研究[D]. 临安: 浙江农林大学, 2013. JIANG L. Study on HXK molecular mechanism in the regulation of loquat sugar accumulation [D]. Lin’an: Zhejiang A&F University, 2013. (in Chinese)
[15] 伍涛. 丰水、鸭梨果实发育过程中糖积累特性及其与果实大小关系研究[D]. 南京: 南京农业大学, 2011. WU T. The characteristics of sugar accumulation and its relationship with fruit size during the fruit development in ‘Hosui’ and ‘Yali’ pear [D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
[16] 叶成荣, 刘更森, 王永章, 李培环, 刘成连, 原永兵. 外源糖对苹果果实山梨醇代谢相关酶活性的影响. 天津农业科学, 2011, 17(3): 5-8. YE C R, LIU G S, WANG Y Z, LI P H, LIU C L, YUAN Y B. Effects of soluble sugars on related enzyme activities of sorbitol metabolism in developing apple fruit. Tianjin Agricultural Sciences, 2011, 17(3): 5-8. (in Chinese)
[17] DESNOUES E, GIBON Y, BALDAZZI V, SIGNORET V, GENARD M, QUILOT T B. Profiling sugar metabolism during fruit development in a peach progeny with different fructose-to-glucose ratios. BMC Plant Biology, 2014, 14: 336.
[18] 许让伟. 砂梨果实和叶片中糖积累及代谢相关酶活性变化研究[D].武汉: 华中农业大学, 2009. XU R W. Studies on changes of sugar accumulation and related enzymes activities in sand pear fruits and leaves [D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese)
[19] KLECZLOWSKI L A, DECKER D, WILCZYNSKA M. UDP-sugar pyrophosphorylase: A new old mechanism for sugar activation. Plant Physiology, 2011, 156(1): 3-10.
[20] 魏建梅. 苹果(Malus domestica Borkh.)果实质地品质发育及采后调控的生理和分子基础[D]. 杨凌: 西北农林科技大学, 2009. WEI J M. Study on the physiological and melecular mechanism of fruit texture development and post-harvest regulation of apple (Malus domestica Borkh.) [D]. Yangling: Northwest A&F University, 2009. (in Chinese)
[21] STEINHAUSER M, STEINHAUSER D, KOEHL K, CARRARI F, GIBON Y, FERNIE A R, STITT M. Enzyme activity profiles during fruit development in tomato cultivars and Solanum pennellii. Plant Physiology, 2010, 153(1): 80-98.
[22] TOHGE T, RAMOS M S, NUNES-NESI A, MUTWIL M, GIAVALISCO P, STEINHAUSER D, SCHELLENBERG M, WILLMITZER L, PERSSON S, MARTINOIA E, FERNIE A R. Toward the storage metabolome: profiling the barley vacuole. Plant Physiology, 2011, 157(3): 1469-1482.
[23] CHIHIRO K. WATANABE T H K T, UCHIMIYA H, UESONO Y, TERASHIMA I, NOGUCHI K. Effects of AOX 1a deficiency on plant growth, gene expression of respiratory components and metabolic profile under low-nitrogen stress in Arabidopsis thaliana. Plant and Cell Physiology, 2010, 51(5): 810-822.
[24] 史青纯. 外源水杨酸处理对采后黄冠梨果实呼吸途径的影响[D].保定: 河北农业大学, 2009. SHI Q C. Effects of salicylic acid on respiratory pathway of postharvest Huang-guan pear (Pyrus brestschneideri Rehd.) [D]. Baoding: Agricultural University of Hebei, 2009. (in Chinese)
[25] 赵智中. 柑橘果实糖积累的生理基础研究[D]. 杭州: 浙江大学, 2001. ZHAO Z Z. Studies on physiological mechanism of sugar accumulation in citrus fruit [D]. Hangzhou: Zhejiang University, 2001. (in Chinese)
[26] HAYATA Y, Li X, OSAJIMA Y. Sucrose accumulation and related metabolizing enzyme activities in seeded and induced parthenocarpic muskmelons. Journal of the American Society for Horticultural Science, 2001, 126(6): 676-680.
[27] YAMAGUCHI H, KANAYAMA Y, SOEJIMA J, YAMAKI S. Changes in the amounts of the NAD-dependent sorbitol dehydrogenase and its involvement in the development of apple fruit. Journal of the American Society for Horticultural Science, 1996, 121(5): 848-852.
[28] 张迟. 抑制马铃薯Acid Invertase基因表达对块茎淀粉-糖代谢的影响研究[D]. 武汉: 华中农业大学, 2007. ZHANG C. Regulation of starch-sugar metabolism via repression of acid invertase in potato (Solanum tuberosum L.) tubers [D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[29] 何亚辉. 丙酮酸脱氢酶系测活方法的比较研究与创新[D]. 武汉:华中师范大学, 2007. HE Y H. Comparison and development of measuring methods for pyruvate dehydrogenase complex [D]. Wuhan: Central China Normal University, 2007. (in Chinese)
[30] BROWN A P, WRAY J L. Correlated changes of some enzyme activities and cofactor and substrate contents of pea cotyledon tissue during germination. Biochemical Journal, 1968, 108(3): 437-444.
[31] 韩蓓. 球形芽胞杆菌糖酵解途径及其相关酶的研究[D]. 武汉: 中国科学院武汉病毒研究所, 2007. HAN B. Glyeolysis and the involved enzymes in Bacillus sphaericus [D]. Wuhan: Wuhan Institute of Virology, Chinses Academy of Science, 2007. (in Chinese)
[32] HIRAI M, UENO I. Development of citrus fruits: fruit developmentand enzymatic changes in juice vesicle tissue. Plant & Cell Physiology, 1977, 18(4): 791-799.
[33] WEDDING R T, BLACK M K, PAP D. Malate dehydrogenase and NAD malic enzyme in the oxidation of malate by sweet potato mitochondria. Plant Physiology, 1976, 58(6): 740-743.
[34] 田美华. 种子线粒体呼吸和抗氧化酶的活性在脱水过程中的变化[D]. 勐腊: 中国科学院西双版纳热带植物园, 2007. TIAN M H. Changes in seed mitochondial respiration and scavenging enzymes activities of reactive oxygen species during dehydration [D]. Mengla: Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, 2007. (in Chinese)
[35] 陈京京, 金鹏, 李会会, 蔡玉婷, 赵颖颖, 郑永华. 低温贮藏对桃果实冷害和能量水平的影响. 农业工程学报, 2012, 28(4): 275-281. CHEN J J, JIN P, LI H H, CAI Y T, ZHAO Y Y, ZHENG Y H. Effects of low temperature storage on chilling injury and energy status in peach fruit. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(4): 275-281. (in Chinese)
[36] VANLERBERGHE C C, PARONS H L, YIP J. In organello and in vivo evidence of the importance of the regulatory sulfhydry l/ disulfide system and pyruvate for alternative oxidase activity in tobacco. Plant Physiology, 1999, 121(3): 793-803.
[37] VANLERBERGHE C C, DA D A, WISKICH J T, VANLERBERGHE A E, MCLNTOSH L. Alternative oxidase activity in tobacco leaf mitochondria (dependence on tricarboxylic acid cycle-mediated redox regulation and pyruvate activation). Plant Physiology, 1995, 109(2): 353-361.
[38] 胡文海. 果菜类蔬菜交替呼吸的温度响应变化及其与抗性的关系[D]. 杭州: 浙江大学, 2007. HU W H. The response of alternative respiration to temperature and its relation to tolerance in fruit vegetable crops [D]. Hangzhou: Zhejiang University, 2007. (in Chinese)
[39] JARMUSZKIEWICZA W, CZARNA M, SLUSE F E. Substrate kinetics of the Acanthamoeba castellanii alternative oxidase and the effects of GMP. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2005, 1708(1): 71-78.
[40] BIAIS B, BENARD C, BEAUVOIT B, COLOMBIE S, PRODHOMME D, MENARD G, BERNILLON S, GEHL B, GAUTIER H, BALLIAS P, MAZAT J, SWEETLOVE L, GENARD M, GIBON Y. Remarkable reproducibility of enzyme activity profiles in tomato fruits grown under contrasting environments provides a roadmap for studies of fruit metabolism. Plant Physiology, 2014, 164(3): 1204-1221.
[41] 罗磊. 甜杨PPP途径关键调控酶G6PDH的理化特性及抗冻机制[D]. 北京: 北京林业大学, 2007. LUO L. The properties and anti-freezing mechanism of key regulatory enzyme G6PDH involved in PPP of Populous suaveolens [D]. Beijing: Beijing Forestry University, 2007. (in Chinese)
[42] 张红. 风味甜瓜果实酸味形成机理及糖酸遗传和积累模拟研究[D].杨凌: 西北农林科技大学, 2009. ZHANG H. Mechanism of organic acid formation and genetics of sugar and acid and simulation of Accumulation in flavor melon fruit [D]. Yangling: Northwest A&F University, 2009. (in Chinese)
[43] 郝敬虹, 李天来, 孟思达, 赵博, 孙利萍. 夜间低温对薄皮甜瓜果实糖积累及代谢相关酶活性的影响. 中国农业科学, 2009, 42(10): 3592-3599. HAO J H, LI T L, MENG S D, ZHAO B, SUN L P. Effects of night low temperature on sugar accumulation and sugar-metabolizing enzyme activities in melon fruit. Scientia Agticultura Sinica, 2009, 42(10): 3592-3599. (in Chinese)
[44] 魏敏, 齐红岩, 张多娇, 佟伶伶, 谢德利. 嫁接对薄皮甜瓜糖含量及蔗糖代谢相关酶活性的影响. 沈阳农业大学学报, 2007, 38(6): 788-791. WEI M, QI H Y, ZHANG D J, TONG L L, XIE D L. Effects of grafting on carbohydrate content and sucrose-metabolizing enzyme activities of melon fruit. Journal of Shenyang Agricultural University, 2007, 38(6): 788-791. (in Chinese)
[45] 吕双双. 钙调控乙烯诱导网纹甜瓜果实软化效果及其作用机制研究[D]. 沈阳: 沈阳农业大学, 2009. LV S S. Study on regulation and mechanism of calcium on ethylene-induced muskmelon softening [D]. Shenyang: Shenyang Agriculture University, 2009. (in Chinese)
[46] 徐胜利, 陈青云, 李绍华, 张利莉, 高疆生, 王合理. 糖代谢相关酶和GA3、ABA在嫁接伽师瓜果实糖分积累中的作用. 果树学报. 2005, 22(5): 514-518. XU S L, CHEN Q Y, LI S H, ZHANG L L, GAO J S, WANG H L. Roles of sugar-metabolizing enzymes and GA3, ABA in sugars accumulation in grafted muskmelon fruit. Journal of Fruit Science, 2005, 22(5): 514-518. (in Chinese)
[47] SCHULTZ J A, JUVIK J A. Current models for starch synthesis and the sugary enhancer 1 (se1) mutation in Zea mays. Plant Physiology & Biochemistry, 2004, 42(6): 457-464.
[48] 吴沙沙. 东方百合‘索邦’鳞茎源-库转换规律研究[D]. 北京: 北京林业大学, 2012. WU S S. Rules of source-sink exchange of the bulb of oriental lily‘Sorbonne’ [D]. Beijing: Beijing Forestry University, 2012. (in Chinese)
[49] 黄斌全. 玉米淀粉合成关键酶: AGPase和isoamylase的功能研究[D]. 成都: 四川农业大学, 2012. HUANG B Q. Functions of key enzymes: AGPase and isoamylase involved in maize starch biosynthesis [D]. Chengdu: Sichuan Agricultural University, 2012. (in Chinese)
[50] 陈俊伟, 张上隆, 张良诚. 果实中糖的运输、代谢与积累及其调控.植物生理与分子生物学学报, 2004, 30(1): 1-10. CHEN J W, ZHANG S L, ZHANG L C. Sugar transport, metabolism, accumulation and their regulation in fruits. Journal of Plant Physiology and Molecular Biology, 2004, 30(1): 1-10. (in Chinese)
[51] 候美玲. 番木瓜采后生理及呼吸特性研究[D]. 广州: 暨南大学, 2011. HOU M L. Postharvest physiology and respiratory characteristics of papaya [D]. Guangzhou: Jinan University, 2011. (in Chinese)
[52] 贾晓辉, 李振茹, 王文辉, 付占国, 佟伟, 夏玉静, 王荣华. 不同采收成熟度对阿巴特梨后熟过程中品质变化的影响. 保鲜与加工, 2011, 11(5): 24-27. JIA X H, LI Z R, WANG W H, FU Z G, TONG W, XIA Y J, WANG R H. Effects of different harvest dates on physiology of ‘Abate Fetel’pears during ripening process. Storage and Process, 2011, 11(5): 24-27. (in Chinese)
[53] 王俊宁, 邓科禹, 李润唐, 李洪波. 采收期对火龙果果实品质及贮藏特性的影响. 贵州农业科学, 2011, 39(4): 170-173. WANG J N, DENG K Y, LI R T, LI H B. Effect of harvest time on quality and storage property of dragon fruit. Guizhou Agricultural Sciences, 2011, 39(4): 170-173. (in Chinese)
[54] 周慧娟, 乔勇进, 张绍铃, 王海宏, 陈召亮. 不同成熟度大团蜜露水蜜桃货架期间品质与代谢差异性研究. 果树学报, 2010, 27(2): 244-250. ZHOU H J, QIAO Y J, ZHANG S L, WANG H H, CHEN Z L. Study on the effects of different maturity on the fruit shelf-qualities and difference in metabolism of Datuanmilu honey peach cultivar. Journal of Fruit Science, 2010, 27(2): 244-250. (in Chinese)
[55] MEYER K, STECCA K L, EWELL-HICKS K, ALLEN S M, EVERARD J D. Oil and protein accumulation in developing seeds is influenced by the expression of a cytosolic pyrophosphatase in Arabidopsis. Plant Physiology, 2012, 159(3): 1221-1234.
[56] 刘旭东. Bacillus sp.YX-1中温酸性α-淀粉酶的分离纯化及基因克隆和表达的研究[D]. 无锡: 江南大学, 2008. LIU X D. Purification and gene expression of a novel intermediately-thermostable α-amylase from Bacillus sp.YX-1 [D]. Wuxi: Jiangnan University, 2008. (in Chinese)
[57] 方辉. StGAPC和StEnolase在马铃薯块茎低温贮藏过程中的作用[D]. 武汉: 华中农业大学, 2013. FANG H. Functions of StGAPC and StEnolase genes in the cold storage of potato tubers [D]. Wuhan: Huzhong Agriculture University, 2013. (in Chinese)
[58] 梁东. 苹果山梨醇代谢相关基因的分子特性研究[D]. 杨凌: 西北农林科技大学, 2010. LIANG D. Molecular characteristics of genes involved in sorbitol metabolism in apple [D]. Yangling: Northwest A&F University, 2010. (in Chinese)
[59] 张燕子. 不同苹果糖酸组成及苹果酸转运体功能研究[D]. 杨凌:西北农林科技大学, 2010. ZHANG Y Z. Carbohydrates and organic acids composition of different apple genotypes & the role of malate transporter [D]. Yangling: Northwest A&F University, 2010. (in Chinese)
[60] 王雅英, 田惠桥. 高等植物的交替氧化酶研究进展. 云南植物研究. 2007, 29(4): 447-456. WANG Y Y, TIAN H Q. The study progress of alterative oxidase in higher plant. Acta Botanica Yunnanica, 2007, 29(4): 447-456. (in Chinese)
[61] LAMBERS H. Respiration in intact plants and tissues:its regulation and dependence on environmenttal factors, metabolism, and invaded organnisms. Encyclopedia of Plant Physiology, 1985, 18: 418-473.
[62] XU F, YUAN S, ZHANG D, LV X, LIN H. The role of alternative oxidase in tomato fruit ripening and its regulatory interaction with ethylene. Journal of Experimental Botany, 2012, 63(15): 5705-5716.
[63] DUQUE P, ARRABACA J D. Respiratory metabolism during cold storage of apple fruit. II. Alternative oxidase is induced at the climacteric. Physiologia Plantarum, 1999, 107(1): 24-31.
[64] MICHAEL J C, DANIEL O D, JAMES W. The expression of alternative oxidase and uncoupling protein during fruit ripening in mango. Plant Physiology, 2001, 126(4): 1619-1629.
[65] RAYMOND W M F, CHIEN Y W, DAVID L S, KENNETH C G, YANG T, MEISHENG T. Characterization of alternative oxidase (AOX) gene expression in response to methyl salicylate and methyl jasmonate pre-treatment and low temperature in tomatoes. Journal of Plant Physiology, 2006, 163(10): 1049-1060.
[66] 鲍露. 基于SSR,AFLP及ITS标记在梨和胡柚系统演化上的研究[D]. 杭州: 浙江大学, 2006. BAO L. Phylogenetic analysis of pear and Huyou based on SSR, AFLP and ITS markers [D]. Hangzhou: Zhejiang Uiniversity, 2006. (in Chinese)
[67] 赵晓敏, 杨玉荣, 李建鲲, 袁峰, 程俊嘉, 李学文. 1-MCP处理对库尔勒香梨采后果皮蜡质变化的影响. 食品科学, 2015, 36(18):262-266. ZHAO X M, YANG Y R, LI J K, YUAN F, CHENG J J, LI X W. Effect of 1-methylcyclopropene treatment on postharvest changes in epicuticular wax of Korle fragrant pear fruits during ambient temperature storage. Food Science, 2015, 36(18): 262-266. (in Chinese)
[68] 陈计峦. 梨香气成分分析、变化及理化特征指标的研究[D]. 北京:中国农业大学, 2005. CHEN J L. Study on aroma components analysis, changes and indicators of physical and chemical characteristics of pear [D]. Beijing: China Agricultural University, 2005. (in Chinese)
[69] 潘俨, 张婷, 车凤斌, 吴斌. 不同预冷终温对厚皮甜瓜常温货架期生理和商品率的影响. 新疆农业科学. 2013, 50(10): 1814-1819. PAN Y, ZHANG T, CHE F B, WU B. Effect of cooling end temperatures on physiology and commodity rate of muskmelon in shelf life at normal temperature. Xinjiang Agricultural Sciences, 2013, 50(10): 1814-1819. (in Chinese)
[70] 赵梅霞. 几种水果不同部位呼吸量及机械损伤后呼吸反应的研究[D]. 北京: 中国农业大学, 2005. ZHAO M X. Study on respiration volumes and mechanical post damage respiratory reactions of different parts of several fruit [D]. Beijing: China Agricultural University, 2005. (in Chinese)
(责任编辑 赵伶俐)
Metabolic Profiles of Sugar Metabolism and Respiratory Metabolism of Korla Pear (Pyrus sinkiangensis Yu) Throughout Fruit Development and Ripening
PAN Yan1,2, MENG Xin-tao2, CHE Feng-bin2, XUE Su-lin2, ZHANG Ting2, ZHAO Shi-rong1, LIAO Kang1
(1College of Forestry and Horticulture Xinjiang Agricultural University, Urumqi 830052;2Institute of Agro-production Storage and Processing, Xinjiang Academy of Agricultural Sciences, Urumqi 830091)
【Objective】The responding relationship of sugar metabolism and respiratory metabolism throughout the fruit development and ripening of Korla pear (Pyrus sinkiangensis Yu) was analyzed with an attempt to assess the effect of metabolic interaction on fruit sugar accumulation.【Method】Korla pears were sampled at 10-day intervals from 60-150 DPA days post anthesis and were sliced into pulps, cores and peels, then the 12 enzyme activities of sugar metabolism and 9 enzyme activities of respiratory metabolism as well as the quality, vertical and horizontal diameter, contents of starch and 4 soluble sugars, and respiration rates of different respiratory pathways were measured. The relationship between quality and sugar components, respiratory main pathway and the effect of clustered metabolic enzymes interaction on the sugars composition at different stages of fruit development and ripening were determined from the results of regression analysis, hierarchical clustering and principal component analysis for discussion and profile of the metabolic pathways and features of different fruit parts in Korla pear.【Result】EMP (Embden-Meyerhof-Parnas) is therespiratory main path of core. EMP and TCAC (Tricarboxyficacid cycle) alternately compose the respiratory main path of pulp. EMP is integrated with TCAC in the respiratory main path of fruit peel. Either core or pulp, the metabolic interaction between sugar metabolism and respiratory metabolism differs in 2 patterns at 90 DPA before and after, and differs at 120 DPA of peel, respectively. The enzymes of core involved in metabolism of starch, sucrose and sorbitol were clustered with the enzymes involved in metabolism of EMP, PPP (phosphopentose pathway) and CP (Cytochrome pathway) at maturation, as well as the hierarchical cluster of pulp grouped the enzymes involved in metabolism of starch, sucrose, EMP, TCAC, CP and AP (alternative pathway), and the cluster of peel grouped the enzymes involved in metabolism of sucrose, sorbitl, EMP, TCAC, CP and AP. The clustered enzyme activities increased dramatically or peaked that was relating significantly to the fructose and glucose accumulations of core and pulp, and relating to the increase of fructose and glucose with sorbitol conversion of fruit peel also.【Conclusion】Korla pear forms typical internal quality by sugar accumulation composed of principal components with fructose and glucose, which has a heterostructure presence of sugar composition and sweetness, that is the result of different metabolic profiles between sugar metabolism and respiratory metabolism respond progressively in different structures at different stages throughout the fruit development and ripening. GPI (glucose phosphate isomerase) and COX (Cytochrome oxidase) are key enzymes of common crosslink in sugar metabolism and respiratory metabolism at fruit maturation in three parts of Korla pear.
Korla pear; fruit development; sugar metabolism; respiratory metabolism; metabolic profiles
2016-03-08;接受日期:2016-06-28
新疆维吾尔自治区自然科学基金(2013211B25)
联系方式:潘俨,E-mail:panyan1509@163.com。通信作者廖康,Tel:0991-8757998;E-mail:liaokang01@163.com

