总状毛霉对17α-羟基孕甾-4-烯-3,20-二肟的生物转化
谢春清,佟国军,葛文中
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.黑龙江八一农垦大学动物科技学院)
总状毛霉对17α-羟基孕甾-4-烯-3,20-二肟的生物转化
谢春清1,佟国军2,葛文中1
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.黑龙江八一农垦大学动物科技学院)
为了获得具有较强生物学活性或结构新颖的羟基甾体肟衍生物,利用总状毛霉对合成的17α-羟基孕甾-4-烯-3,20-二肟进行转化研究。转化产物经柱层析分离纯化后鉴定为7α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(3)和11α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(4)。目前微生物转化甾体研究领域对于甾体肟的转化研究少见报道,研究结果为甾体肟衍生物的发展奠定了基础。
生物转化;合成;甾体肟;羟基化;总状毛霉
随着甾体药物的发展,人们发现在甾体母核上引入杂原子后有更广泛的生理活性[1]。甾体酮肟类化合物除了具有抗增殖、抗着床、抗早孕等活性外,还具有抗肿瘤、抗病毒、抗菌等活性[2-3]。Krstic N M等[4-5]合成的胆甾-6-酮肟对子宫癌(HeLa)细胞和慢性骨髓白血病(K-562)细胞具有较好的抑制作用。
甾体生物转化研究中,细菌、放线菌和真菌等对甾体进行的生物转化均有报道[6]。总状毛霉可以分泌蛋白酶,用于腐乳的生产,在工业生产上具有重要的应用价值[7]。Faramarzi M A等[8]利用总状毛霉对雄甾-4-烯-3,17-二酮进行微生物转化,并采用波谱学方法对转化产物结构进行鉴定,生物转化主要发生6β-、7α-、7β-、11α-、4α-羟基化以及17-羰基还原反应。总状毛霉对甾体化合物具有较好的羟基化能力,但目前没有发现利用总状毛霉对甾体酮肟类化合物进行生物转化的报道。
研究利用总状毛霉对化学合成的17α-OH-孕甾-4-烯-3,20-二肟进行转化,是对含肟甾体研究的一个新探索,将为系统研究甾体微生物转化和药物开发提供参考。
1 材料与方法
1.1 菌种与培养基
总状毛霉(Mucor racemosus CICC 3161),购买于中国工业微生物菌种保藏管理中心(CICC)。
斜面培养基:水1 000 mL,土豆200 g,葡萄糖20 g,琼脂20 g,pH自然。
发酵培养液:水1 000 mL,蛋白胨12 g,葡萄糖30 g,磷酸二氢钾1.3 g,酵母膏1.0 g,用1 mol·L-1的盐酸溶液调pH至4.5。
1.2 底物
利用甾体原料17α-羟基黄体酮(1)与盐酸羟胺反应(乙酸钠做催化剂)合成17α-OH-孕甾-4-烯-3,20-二肟化合物。将0.75 g17α-羟基黄体酮溶于75 mL的95%的乙醇中,置于100 mL的圆底烧瓶中,在磁力搅拌器上搅拌加热至55℃,加入1.20 g的乙酸钠和0.52 g的盐酸羟胺,一锅法反应8 h,TLC监测反应进程。反应完全后加入蒸馏水100 mL,充分搅拌,静置冷却,待白色物质完全析出后,进行抽滤,真空干燥得到粗品。
将粗品用石油醚:乙酸乙酯=2.5∶1作淋洗剂进行柱层析分离,甲醇重结晶得到产物17α-OH-孕甾-4-烯-3,20-二肟(2),化合物2收率为45.2%。合成路线如图1所示。
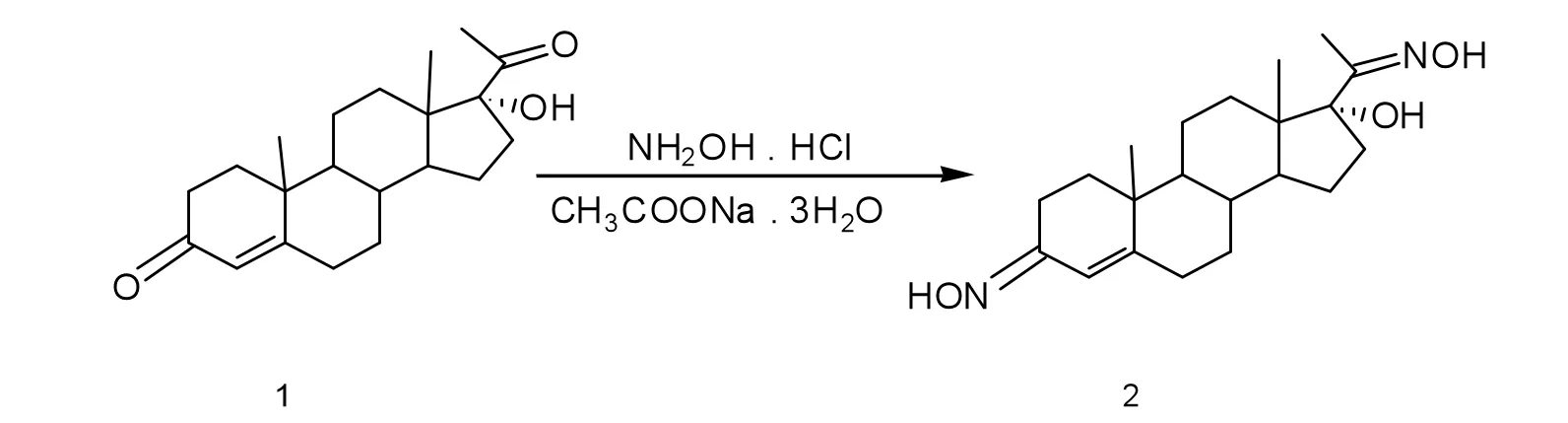
图1 甾体二肟的合成Fig.1Synthesis of steroidal dioximes
1.3 微生物转化及产物提取
在超净工作台中,接种总状毛霉菌株到已灭菌的装有120 mL发酵液的500 mL锥形瓶中。28℃,180 r·min-1条件下振荡培养40 h后,每瓶加入溶有17α-羟基孕甾-4-烯-3,20-二肟底物的95%乙醇2 mL,继续振荡培养4 d后终止发酵。
过滤发酵液,用乙酸乙酯分别萃取发酵液和菌丝体各5次,合并有机层。50℃减压浓缩,旋至一定体积。依次用饱和NaHCO3溶液、饱和NaCl溶液洗3次后,再用蒸馏水洗1次,加无水Na2SO4干燥后,将有机层减压蒸干。置于50℃真空干燥箱中干燥,得到转化产物粗品。总状毛霉对17α-羟基孕甾-4-烯-3,20-二肟的生物转化产物结构如图2所示。

图2 总状毛霉对17α-羟基孕甾-4-烯-3,20-二肟的生物转化Fig.2Biotransformation of 17α-hydroxy-pregane-4-ene-3,20-dioxime by mucor racemosus
1.4 转化产物的分离纯化
转化产物先采用石油醚:二氯甲烷:乙酸乙酯= 1∶1∶2洗脱分离,用丙酮结晶纯化后,得到产(3),收率12.1%。进一步用石油醚:二氯甲烷:乙酸乙酯=1∶1∶2.5为淋洗剂洗脱,分离得到产物用丙酮结晶纯化后得到产(4)。
2 结果与讨论
2.1 结果
2.1.1 转化产物的结构鉴定
化合物3和4经波谱学手段鉴定后结构分别为:(1)7α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(3),收率12.1%。IR(KBr)v·cm-1:3 420,2 960,1 735,1 640,927.1HNMRδ(ppm):0.56(3H,s,C18-CH3),1.58(3H,s,C19-CH3),1.98(3H,s,C21-CH3),2.18(2H,d,C6-CH2),3.59(s,7α-H),5.61(1H,s,C4-CH);13CNMRδ(ppm):196.9(C-3),170.9(C-5),156.8(C-20),124.9(C-4),84.9(C-17),67.4(C-7),52.6(C-9),46.9(C-14),42.5(C-13),41.4(C-6),40.2(C-10),39.1(C-8),35.1(C-1),33.4(C-2),33.4(C-12),32.6(C-16),21.1(C-15),21.0(C-11),17.7(C-19),15.0(C-18),12.3(C-21);MS m·z-1:345[M+Na]+。
(2)11α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(4),收率11.9%。IR(KBr)v·cm-1:3 430(OH),2 935,1 710(3C=O),1 630,1 600,930;1HNMRδ(ppm):1.24(3H,s,C19-CH3),1.76/0.94(2H,d,C7-CH2),2.36(2H,d,C6-CH2),5.61(1H,s,C4-H),1.74(3H,s,C21-CH3),3.77(s,11α-H);13CNMRδ(ppm):198.7(C-3),171.8(C-5),157.7(C-20),123.5(C-4),84(C-17),67.8(C-11),58.3(C-9),48.6(C-14),46.9(C-13),42.6(C-12),38.8(C-10),37.0(C-1),34.6(C-8),33.8(C-2),33.0(C-6),32.4(C-16),31.6(C-7),22.9(C-15),17.9(C-19),16.2(C-18),11.0(C-21);MS m·z-1:345[M+Na]+。
2.2 讨论
2.2.1 甾体二肟的化学合成
甾体二肟要通过对反应温度、反应时间以及反应物之间摩尔比的严格控制来合成的。实验发现:经TLC检测,反应温度太高(高于80℃),副产物的种类会增多,造成产物分离困难,产率降低;反应温度太低(低于45℃)时,反应需要长时间的进行,而且反应不完全。实验结果确定反应温度在65℃最佳。
以17α-羟基黄体酮为底物,反应时间应该控制在12 h以上,3位、17位的两个酮基都发生肟化反应,反应不足12 h,产物是单肟(两个酮基选择性的发生肟化)和二肟甾体的混合物。反应物之间的摩尔比对反应起到关键作用,当n(NH2OH·HCl):n(底物)=2∶1时,由于NH2OH·HCl不能被完全利用,所以有部分底物反应不完全,有甾体单肟生成,n(NH2OH·HCl):n(底物)=3∶1底物中的两个酮基都能被肟化。
在此肟化过程中,反应环境要求是弱碱性,催化剂对反应影响较大,一般以NaHCO3、Na2CO3、吡啶或乙酸钠作催化剂。以NaHCO3或Na2CO3为催化剂时,因CO32-和HCO3-不够稳定,在反应中,其量不能很好的控制,而且后处理操作繁杂。吡啶能与水互溶,呈碱性,但吡啶易燃,而且恶臭,有强烈的刺激性,能麻痹中枢神经系统。乙酸钠用量容易控制,反应效果好,后处理简单,实验采用乙酸钠做催化剂。
2.2.2 甾体二肟的生物转化
利用总状毛霉对17α-羟基孕甾-4-烯-3,20-二肟进行生物转化研究。研究结果表明,底物主要发生7α-羟基化、11α-羟基化反应,同时伴有C-3位肟基的水解反应。
在17α-羟基孕甾-4-烯-3,20-二肟(2)进行生物转化过程中,经TLC检测,在加入底物9 h后有新物质的出现,该物质极性介于17α-羟基孕甾-4-烯-3,20-二肟与17α-羟基孕甾-4-烯-3,20-二酮之间,在后续的发酵过程中,在9~18 h时,含量有所增加,在18 h后明显的下降直至发酵结束消失。在发酵至18 h时,化合物3出现,在27 h后有化合物4出现,到发酵进行到第5 d时,化合物3和4含量不再明显增加。
化合物2的生物转化历程可能为:化合物2经总状毛霉转化先发生3-肟基的水解反应,接着进行7α-羟基化反应生成化合物3,最后3-肟基的水解产物发生11α-羟基化反应得到化合物4。
葛文中等[9]利用该总状毛霉菌株对4-烯-3-酮类甾体衍生物进行生物转化,4-雄烯二酮的转化产物是14α-羟基-雄甾-4-烯-3,17-二酮、14α,17β-二羟基雄甾-4-烯-3-酮和6 α,17 β-二羟基雄甾-4-烯-3-酮。黄体酮生物转化得到的产物是14 α-羟基-4-孕甾烯-3,20-二酮和7 α,14 α-二羟基-4-孕甾烯-3,20-二酮;显示总状毛霉对4-烯-3-酮类甾体生物转化主要是14 α-羟基化[10-11],此外还发生6 β、7 α、7 β及11 α-羟基化。研究中,总状毛霉对17 α-羟基孕甾-4-烯-3,20-二肟底物生物转化发生的羟基化反应是7 α-羟基化,还伴随有11 α-羟基化反应。可能是因为17 α-羟基孕甾-4-烯-3,20-二肟中3-酮、20-酮基团改变为极性较大的肟基,结构发生改变,对各原子的影响发生改变,对总状毛霉中酶的诱导发生变化,因此,生物转化的方式也不同,转化过程中主要发生了7 α-羟基化,伴随有11 α-羟基化,没有14 α-羟基化反应发生,说明17 α-羟基孕甾-4-烯-3,20-二肟底物主要受总状毛霉产生的7 α-羟基化酶,以及少量11 α-羟基化酶作用。在此生物转化过程中,发生的水解反应是3-肟基水解反应,其中3-肟基可能受底物中4-烯基团的影响,相比20-肟基更容易水解。在生物转化过程,20-肟基没有发生水解,可能与甾体肟的结构有关,17 α-羟基可能与20-肟基生成氢键,构成六元环,增加了稳定性,使得20-肟基不易发生水解。
7α-羟基-甾体具有重要的生理活性,研究发现在肝脏中7α-OH-DHEA的抗氧化作用优于DHEA[12],DHEA的7-羟基衍生物,已被证实对治疗癌症和阿尔茨海默病有一定疗效,同时还具能增强机体免疫、增加抗糖皮质激素和促进减肥的功效[13]。Faramarzi M A等[14]利用Neurospora crassa转化得到的化合物7α-羟基-雄甾-4-烯-3,17-二酮可作为利尿剂。
11α-羟基是皮质激素发挥抗炎作用及糖代谢作用的必需官能团,C-11位羟基甾体具有实际应用价值[15]。甾体的11α-羟基化对于甾体药物的合成及结构改造具有重要意义,通过11α-羟基化后甾体可以引入高生理活性基团,从而大大增加疗效,减少副作用[16]。
3 结论
研究通过乙酸钠做催化剂合成甾体二肟,利用总状毛霉对合成的17α-OH-孕甾-4-烯-3,20-二肟转化获得转化产物7α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(3)和11α,17α-二羟基-20-肟-孕甾-4-烯-3-酮(4),表现出总状毛霉特异羟基化活性。研究结果为甾体肟衍生物的发展奠定了基础。同时通过使用化学合成与生物转化相结合的方式为甾体肟的获得提供新的思路。
[1]徐向伟,林雪梅,葛文中.3β-羟基-孕甾-5-烯-20R-胺的合成与结构归属[J].黑龙江八一农垦大学学报,2014,26(6):77-80.
[2]Jianguo Cui,Lei Fan,Liliang Huang,et al.Synthesis and evaluation of some steroidal oximes as cytotoxic agents:Structure/activity studies(I)[J].Streoids,2009,74:62-72.
[3]Jianguo Cui,Lei Fan,Yanmin Huang,et al.Synthesis and evaluation of some steroidal oximes as cytotoxic agents:structure/activity studies(II)[J].Steroids,2009,74:989-995.
[4]Ktstic N M,Bjelakovic M S,Zizak Z,et al.Synthesis of some steroidal oximes,lactams,thiolactams and their antitumor activities[J].Steroids,2007,72:406-414.
[5]Ktstic N M,Bjelakovic M S,Milan M D,et al.Photochemical and Beckmann rearrangement of(Z)-cholest-4-en-6-one oxime[J].J Serb Chem Soc,2004,69(6):413-420.
[6]Haq Nawaz B,Rasheed A K.Biological transformations of steroid compounds:A review[J].Steroid,2012,76:1267-1290.
[7]Mathew P L,Bertrand L,Simon P N,et al.Anti-cancer activities of novel D-ring modified 2-substituted estrogen-3-O-sulfamates.J[J].Steroid Biochem.Mol.Bio,2005,94:239-251.
[8]Faramarzi M A,Badiee M,Yazdi M T,et al.Formation of hydroxysteroid derivatives from androst-4-en-3,17-dione by the filamentous fungus Mucor racemosus[J].J.Mol Cat B:Enzym,2008,50:7-12.
[9]葛文中,李楠,单丽红,等.总状毛霉对4-烯-3酮甾体的生物转化研究[J].微生物学报,2007(3):540-543.
[10]Torshabi M,Badice M,Faramarzi M A.Biotransformation of methyltestosterone by the filamentous fungus Mucor racemosus[J].Chemistry of Nanture Compounds,2011(47):59-62.
[11]Roopesh K,Ramachandran S,Nampoothiri K M,et al. Comparison of phytase production on wheat bran and oilcakes in solid-state fermentation by Mucor racemosus[J]. Bioresour Technol,2006,97(3):506-511.
[12]Lapcik O,Hampl R,Hill M,et al.Immunoassay of 7-hydroxysteroids:2.Radioimmunoassay of 7α-hydroxy-dehydroepiandrosterone[J].J.Steroid Biochem,1999,71(5-6):231-237.
[13]Morn R,Courchay G.Pregnenolone and dehydroepiandrosterone as precursors of native 7-hydroxylated metabolites which increase the immune responseinmice[J].J. Steroid Biochem.Mol.Bio,1994,50:91-100.
[14]Faramarzi M A,Aghelnejad M,Yazdi M T,et al.Metabolism of androst-4-en-3,17-dione by the filamentous fungus Neurospora crassa[J].Steroids,2008,73:13-18.
[15]张小燕,阮晖,何国庆.微生物降解植物甾醇侧链生产雄甾烯二酮的研究进展[J].中国食品学报,2012,12(7):162-170.
[16]茅燕勇,沈珈琦,范伟平.葡枝根霉NG0305酶催化甾体C11α-羟基化的研究[J].生物加工过程,2004(2):46-51.
Biotransformation of 17α-hydroxy-pregane-4-ene-3,20-dioxime by Mucor racemosus
Xie Chunqing1,Tong Guojun2,Ge Wenzhong1
(1.College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University)
In order to get strong biological activity or novel structure of oxime-steroids,the biotransformation of 17α-hydroxypregane-4-ene-3,20-dioxime by mucor racemosus was studied.The transformation products were purified with column chromatography and determined as 7α,17α-dihydroxy-20-oxime-4-en-3-one(3)and 11α,17α-dihydroxy-20-oxime-4-en-3-one(4).The transformation of oxime-steroids rarely occured in microbial transformations of steroid,based on the best of our knowledge,the results lay a foundation for rich diversities of oxime-steroids.
biotransformation;synthesize;oxime-steroids;hydroxylation;mucor racemosus
Q939.5
A
1002-2090(2016)04-0075-04
10.3969/j.issn.1002-2090.2016.04.017
2015-10-24
黑龙江省教育厅项目(12521384)。
谢春清,女,黑龙江八一农垦大学生命科学技术学院2013级硕士研究生。
葛文中,男,教授,硕士研究生导师,E-mail:wenzhongg@126.com。

