人参总皂苷在实验性肺纤维化小鼠中的抗氧化损伤作用
罗 敏,舒 磊,李映莹,肖江滔,石京山,邓 江
(遵义医学院1.基础药理省部共建教育部重点实验室,2.药学院药物制剂系,贵州遵义563006)
人参总皂苷在实验性肺纤维化小鼠中的抗氧化损伤作用
罗 敏1,2,舒 磊1,2,李映莹1,肖江滔1,2,石京山1,邓 江1
(遵义医学院1.基础药理省部共建教育部重点实验室,2.药学院药物制剂系,贵州遵义563006)
目的探讨人参总皂苷(TG)对小鼠肺纤维化的保护作用,并初步探讨其作用机制。方法60只昆明种小鼠随机分为假手术组、模型组、TG 40,80和160 mg·kg-1组及阳性药醋酸泼尼松5 mg·kg-1组。气管内灌注博来霉素(BLM)5 mg·kg-1建立肺纤维化小鼠模型。制模次日ig给药,每天1次,连续28 d,计算小鼠肺系数、HE染色及Masson染色观察肺组织病理形态改变、实时荧光定量PCR法检测α平滑肌肌动蛋白(α-SMA)mRNA的表达;试剂盒检测小鼠肺组织羟脯氨酸(HYP)、谷胱甘肽(GSH)含量、一氧化氮合酶(NOS)和髓过氧化物酶(MPO)活性、总抗氧化能力(T-AOC)和羟自由基(·OH)的水平。结果与假手术组比较,模型组小鼠肺系数显著升高(P<0.05),肺泡炎及肺纤维化明显,α-SMA mRNA的表达明显升高(P<0.01),小鼠肺组织HYP,·OH,NOS和MPO活性升高(P<0.05),但GSH和T-AOC水平下降(P<0.05);TG和醋酸泼尼松给药后能显著降低模型小鼠的肺系数(P<0.05),减轻肺纤维化程度;TG可使模型小鼠肺组织匀浆中·OH,NOS,MPO和HYP活性降低(P<0.05),GSH和T-AOC的水平显著升高(P<0.05)。结论TG能改善博来霉素所致小鼠肺纤维化,其作用机制可能与其增加机体的抗氧化能力,减轻氧化损伤有关。
人参总皂苷;肺纤维化;α平滑肌肌动蛋白;氧化损伤
肺纤维化(pulmonary fibrosis,PF)是多种弥漫性肺间充质疾病的最终转归,其发病机制仍不十分明确,目前尚无特效药物治疗,临床预后差。气管内注入博来霉素(bleomycin,BLM)诱导的小鼠PF模型是国际上普遍采用的一种方法,与人类PF性质相近[1]。肺间充质纤维化、肺损伤的形成过程中,氧自由基活跃。近年来,越来越多的证据表明,体内氧化与抗氧化作用失衡(氧化作用占优势)可导致中性粒细胞的聚集浸润,分泌蛋白酶增加,产生许多氧化中间产物,造成氧化损伤,也称氧化应激。特发性PF的形成和发展与氧化损伤过程密切相关[2]。
人参总皂苷(totalginsenosides,TG)是中药人参(Panax ginseng C.A.Meyer)茎叶的主要有效成分,生物活性广泛,对多器官系统等均有调节功能[3],且具有抗氧化,清除氧自由基、抗病毒、抗肿瘤[4-5]和抗高脂血症等作用[6-7]。有研究表明,TG对急性肺损伤有较好的保护作用[8-9]。本研究通过BLM诱导小鼠PF模型,观察TG对小鼠PF的保护作用,并初步探讨其作用机制,为其治疗PF提供基础药理学实验依据。
1 材料与方法
1.1 实验动物、试剂和主要仪器
SPF级昆明种小鼠60只,雌雄各半,体质量18~22 g,购于第三医科大学大坪医院医学实验动物中心,许可证号SCXK(渝)2012-0005。小鼠分笼颗粒饲料喂养,自由进食、饮水,适应环境1周。TG,北京天然药物研究院(纯度98%,批号:120916);BLM,浙江海正药业股份有限公司(批号:120901);醋酸泼尼松(prednisone),天津药业集团新郑股份有限公司(批号:120406);谷胱甘肽(gluta⁃thione,GSH)试剂盒、总抗氧化能力(totalantioxi⁃dantcapacity,T-AOC)试剂盒、羟自由基(hydroxy radical,·OH)试剂盒、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒、髓过氧化物酶(myeloper⁃oxidase,MPO)试剂盒和羟脯氨酸(hydroxypro⁃linc,HYP)试剂盒,南京建成生物工程研究所;α平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)和β肌动蛋白引物、逆转录和实时荧光定量PCR试剂盒(TaKaRa生物工程公司);Mastercycler Gradient PCR仪(德国Eppendorf公司);iCycler iQ Real-Time PCR仪(美国Bio-Rad公司);超微量分光光度计和全波长酶标仪(美国Thermo公司);Olympus光学显微镜及图像分析系统(日本Olympus公司)。
1.2 模型动物的制备及分组给药
称小鼠体质量后,以3.5%水合氯醛350 mg·kg-1腹腔注射麻醉,仰卧固定,颈部常规消毒,无菌条件下行颈正中切口,钝性分离暴露气管,于气管软骨环间隙向心方向穿刺缓慢注入BLM 5 mg·kg-1,注药后立即将小鼠直立沿身体纵轴左右旋转3~5 min,使药液在双肺内均匀分布,缝合皮肤、消毒,待小鼠清醒后送SPF级观察室常规饲养。假手术组小鼠在相同条件下经气管注入等体积生理盐水。所有小鼠术后肌内注射苄星青霉素(benzathinebenzyl penicillin)预防感染。饲养和实验过程中遵守实验动物管理与保护的有关准则。
小鼠随机分6组,每组10只(雌雄各半):假手术组、模型组、阳性药醋酸泼尼松5 mg·kg-1组、TG 40,80和160 mg·kg-1组。造模后次日ig给药,假手术组与模型组均以同体积ig蒸馏水,连续28 d。
1.3 小鼠肺系数计算及HE和Masson染色观察肺组织病理变化
造模后给药至第28天,称体质量,3.5%水合氯醛350 mg·kg-1腹腔注射麻醉后处死,分离出双肺,置于冰生理盐水中漂洗除去血液,用滤纸洗净表面的血液后,称肺质量,根据公式计算肺系数:肺系数=肺质量(mg)/体质量(g)。
取右肺下叶,于4%中性甲醛固定24 h,经梯度乙醇脱水、石蜡包埋和切片,进行HE染色及Masson染色。于光学显微镜下观察病理变化,HE染色细胞核呈蓝色,胞质呈红色;Masson染色是常用的观察胶原纤维的染色方法,可使胶原纤维呈淡蓝色。参照Szapiel等[10]的方法,用HE染色评定肺组织肺泡炎症程度。0级:无肺泡炎,计0分;Ⅰ级:轻度肺泡炎,受累面积占全肺<20%,计1分;Ⅱ级:中度肺泡炎,受累面积为全肺的20%~50%,计2分;Ⅲ级:重度肺泡炎,全肺呈弥漫性病变分布,受累面积占全肺>50%,计3分。以Masson染色评定肺组织纤维化程度。0级:无肺间充质纤维化,计1分;Ⅰ级:轻度肺间充质纤维化,病变范围占全肺<20%,计1分;Ⅱ级:中度肺间充质纤维化,病变范围占全肺的20%~50%,计2分;Ⅲ级:重度肺间充质纤维化,病变范围占全肺>50%,肺泡融合,肺实质结构紊乱,计3分。
1.4 实时荧光定量PCR检测小鼠肺组织中α-SMA mRNA的表达
按RNA提取试剂盒说明进行样品总RNA的提取与纯化,逆转录后,进行扩增。α-SMA引物:正向5′-GACAATGGCTCTGGGCTCTGTA-3′,反向5′-TTTGGCCCATTCCAACCATTA-3′,扩增产物长度118 bp;反应条件:95℃,8.5 min进入循环;95℃,15 s,62.1℃,1 min,循环45次。以β肌动蛋白为内参,β肌动蛋白引物:正向5′-TGACAGGAT⁃GC-AGAAGGAGA-3′,反向5′-TAGAGCCAC⁃CAATCCACACA-3′,扩增产物长度104 bp;反应条件:95℃,8.5 min进入循环;95℃,15 s,60.2℃,1 min,循环45次。以β肌动蛋白为内参,用相对定量法计算α-SMA mRNA的表达水平。以循环阈值(Ct值)为统计参数,用β肌动蛋白为内参,α-SMA mRNA相对表达水平用2-ΔΔCt表示[11]。
1.5 小鼠肺组织中羟脯氨酸和谷胱甘肽含量、总抗氧化能力、羟自由基水平、一氧化氮合酶及髓过氧化物酶活性测定
准确称取左侧肺组织,按照质量(g)∶体积(mL)=1∶9的比例加入无菌生理盐水,于冰水浴匀浆,3700×g离心10 min,取上清液BCA法检测蛋白质浓度,并根据试剂盒操作步骤检测各项指标,结果用单位质量蛋白质中各指标含量表示。
1.6 统计学分析
2 结果
2.1 TG对BLM诱导PF小鼠肺系数的影响
造模后假手术小鼠活泼好动,毛发光泽发亮,体质量逐渐增加,嘴角红润,呼吸平稳,饮食及大便正常;模型组小鼠开始出现不同程度饮食、活动减少,精神萎靡,毛枯,1周后出现体质量减轻(P<0.01),肺系数显著增高(P<0.01);醋酸泼尼松组和TG给药组小鼠开始表现与模型组相似,1周后逐渐好转,体质量逐渐增加,活动增加,摄食好,肺系数明显下降(P<0.05)(表1)。
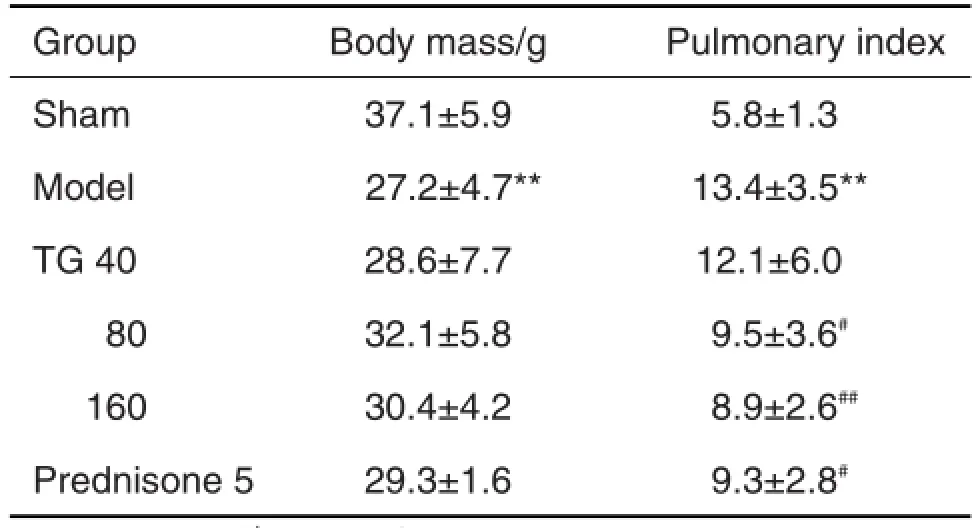
Tab.1 Effect of total ginsenosides(TG)on pulmonary index of bleomycin(BLM)induced pulmonary fibrosis mouse model
2.2 TG对BLM诱导PF小鼠肺组织病理形态的影响
HE染色结果(图1A)显示,与假手术对照组比较,模型组小鼠气管注射BLM第28天后,肺组织结构紊乱,肺泡间隔增宽,肺泡结构破坏,大量炎性细胞浸润,部分肺泡坍陷融合,成纤维细胞大量增生,纤维组织呈条索样瘢痕改变,斑片状分布,可见大片的实变;Masson染色(图1B)可见大量蓝色宽带状及片状胶原纤维沉积,纤维化改变明显,PF形成;TG 80和160 mg·kg-1剂量组及醋酸泼尼松5 mg·kg-1组小鼠肺组织肺泡壁轻度增厚,出现少量肺泡炎,肺泡结构尚存,可见少量丝状或点状胶原纤维沉积,肺组织纤维化程度明显减轻。各组肺泡炎和PF程度评分(表2)。
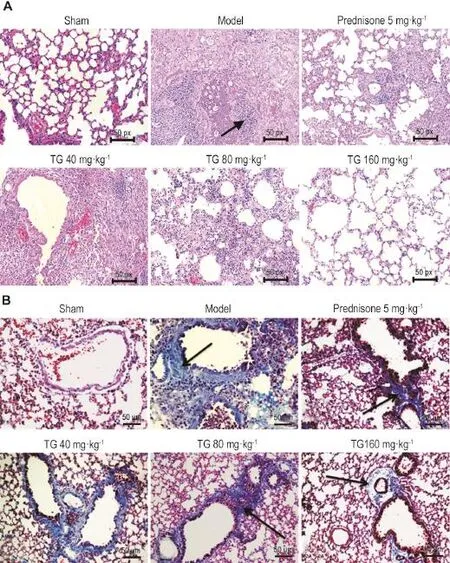
Fig.1 Effect of TG on pathological changes in alveoli in BLM induced pulmonary fibrosis mouse model by HE(A)and Masson staining(B).See Tab.1 for the mouse treatment.Arrows show the pathological changes in alveolar septal enhancement,a large number ofinflammatory cellinfiltrations,alveolar structuraldamage,and the formation ofpulmonary fibrosis.
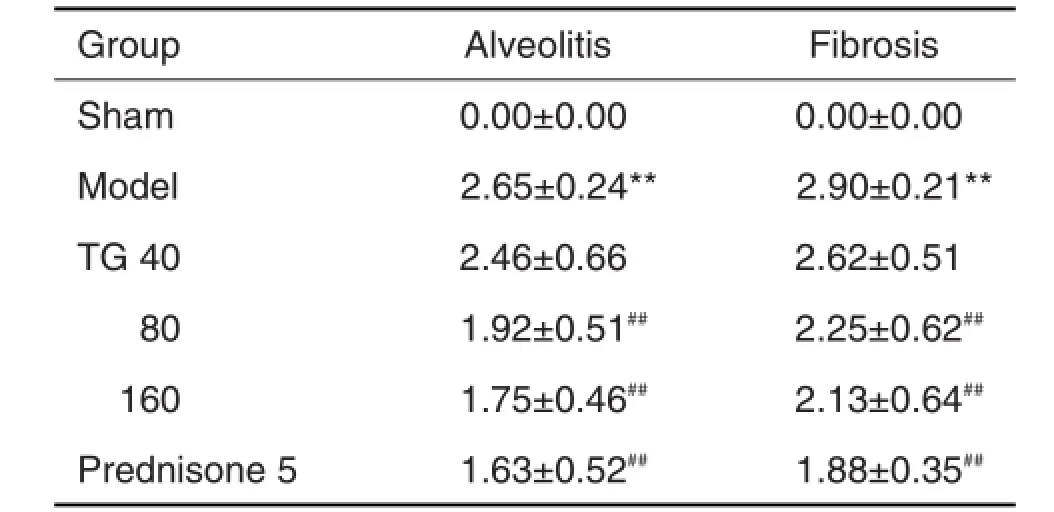
Tab.2 Effect of TGon fibrosis of BLMinduced pulmonary fibrosis mouse model
2.3 TG对BLM诱导PF小鼠肺组织α-SMA mRNA表达的影响
与假手术对照组比较,模型对照组小鼠肺组织中α-SMA mRNA的表达明显上调(P<0.05),提示BLM气管内灌注引起了小鼠的PF;与模型组比较,TG 80和160 mg·kg-1给药组及醋酸泼尼松5 mg·kg-1组α-SMA mRNA表达明显下调(P<0.05,P<0.01),提示PF程度有所改善(表3)。

Tab.3 Effect of TG on expression ofα-SMA mRNA in BLM induced pulmonary fibrosis mouse model
2.4 TG对PF小鼠肺组织中羟脯氨酸和谷胱甘肽含量、总抗氧化能力、羟自由基水平、一氧化氮合酶及髓过氧化物酶活性的影响
与假手术对照组比较,模型组小鼠肺组织中HYP含量明显升高(P<0.05),GSH的含量及T-AOC的水平均降低(P<0.05),NOS活性、·OH水平及MPO活性均显著升高(P<0.05);给药28 d后,与模型组比较,TG 80和160 mg·kg-1组及醋酸泼尼松5 mg·kg-1组肺组织中HYP含量明显降低,GSH的含量及T-AOC的水平均升高,NOS活性、·OH水平及MPO活性均显著降低(P<0.05)(表4)。
3 讨论
本研究通过建立气管内注入BLM诱导的小鼠PF模型,研究TG对肺间充质纤维化的干预作用。PF又称为肺间充质疾病,是一组由多种病因所引起的弥漫性肺间充质疾病[12]。大部分患者因PF导致肺动脉高压、呼吸困难、肺源性心脏病和右心衰竭死亡,预后极差,严重影响患者生活质量。美国胸科协会等推荐的治疗方案是糖皮质激素合用免疫抑制剂[13]。糖皮质激素通过抑制炎性细胞浸润,抑制成纤维细胞分化增殖,延缓纤维化进程,但仍无法逆转纤维化,且糖皮质激素不良反应较多,其临床应用受限,因此探索对PF治疗有效的药物显得尤为重要。
本研究HE染色和Masson胶原染色结果表明,TG可明显减轻模型小鼠肺泡结构受损及肺泡间隔增厚程度,减少炎性细胞浸润及胶原纤维含量,表明TG对大鼠PF的发生发展具有抑制作用。同时肺系数作为反映PF程度的指标之一,在PF的形成过程中,由炎症渗出、细胞肿胀、毛细血管充血等多种因素造成的肺质量增加,导致肺系数升高。本研究结果表明,TG可显著下降模型小鼠的肺系数,进一步佐证了TG改善小鼠PF的效应。PF的形成涉及细胞外基质(extracellular matrix,ECM)、炎症趋化因子等多种因素,病理过程错综复杂,主要过程为致病因子对肺泡上皮细胞和血管内皮细胞弥漫性损害,启动炎症免疫反应;多种炎性细胞参与,释放各种细胞因子和炎性介质,扩大组织损伤,并引起间充质增生;继而成纤维细胞、内皮细胞迁移、增殖以及胶原和ECM的代谢紊乱,以反馈方式使炎性损伤和增生反应加重,最终导致正常功能组织被取代和改建。
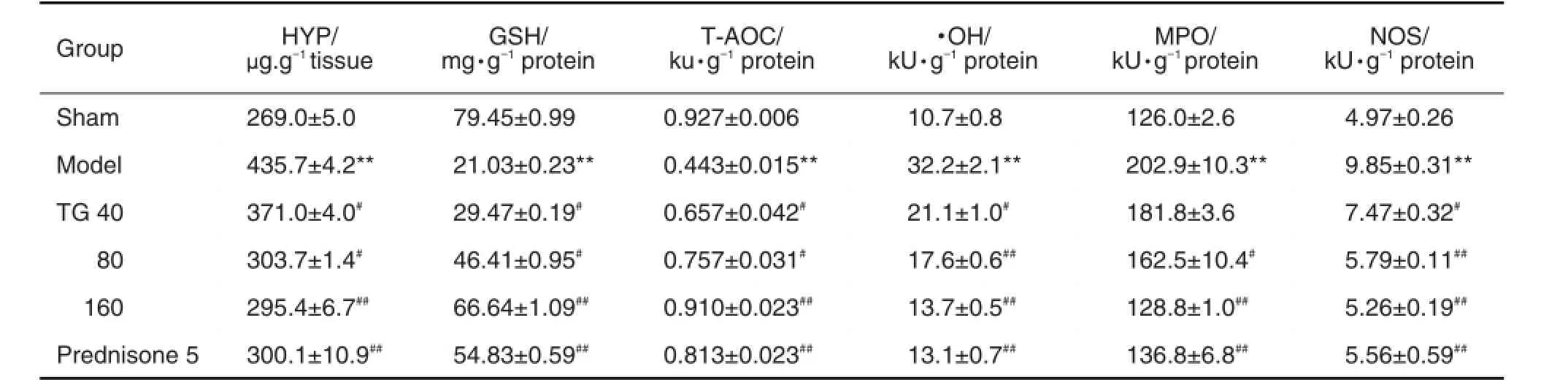
Tab.4 Effect ofTG on content of hydroxyproline(HYP)and glutathione(GSH),level of total antioxidant capacity(T-ADC)and hydroxy radical(·OH),activity of myeloperoxidase(MPO)and nitric oxide synthase(NOS)in BLM induced pulmonary fibrosis mouse model
本研究结果表明,TG能明显减低模型小鼠肺组织中HYP的含量,提示TG可调节肺组织中胶原的代谢,减轻胶原在肺间充质的沉积,起到减轻PF的作用。PF疾病是ECM过度沉积为主要特征,胶原纤维是ECM的主要成分,而HYP是胶原纤维中的特有成分,其含量直接反映组织胶原纤维含量,由于胶原主要分布于气道及血管周围,故检测肺组织HYP的含量,可反映肺组织胶原蛋白及ECM的含量。PF主要的病理变化是肺间充质中成纤维细胞活化为肌成纤维细胞,α-SMA是肺成纤维细胞表达肌纤维的标志,是生成ECM和促纤维化相关细胞因子的重要来源[14-15]。TG能显著下调实验性PF模型小鼠肺组织中α-SMA mRNA的表达。提示TG可抑制肺组织中α-SMA mRNA的表达,抑制肌成纤维细胞的活化,从而抑制PF的形成。
PF形成过程中存在氧化-抗氧化失衡[2],BLM能刺激肺泡上皮细胞和巨噬细胞,可引起活性氧生成和GSH消除增加及·OH水平增高。其中,GSH和T-AOC作为细胞内最丰富的抗氧化剂,在细胞清除氧化物过程中发挥关键作用。NOS可催化左旋精氨酸生成瓜氨酸和一氧化氮(nitrogen monoxide,NO),是生成NO的关键酶。NO及其代谢产物不仅能直接造成肺损伤,而且NO通过介导肺泡上皮细胞、巨噬细胞、成纤维细胞的增殖和凋亡,在PF过程中发挥重要作用[16]。本研究结果表明,TG可引起实验性PF模型小鼠肺组织内·OH,MPO,HYP和NOS活性及GSH含量明显降低,T-AOC水平显著升高,提示TG抗BLM诱导的实验性PF作用机制可能与调节肺组织内·OH和NOS的活性,抑制过量·OH和NO的生成,发挥抗氧化作用有关。具体的作用机制是否与影响线粒体氧化应激及细胞凋亡等方面有关,还有待进一步的深入研究。
[1]Thrall RS,Barton RW,D′amato DA,Sulavik SB. Differential cellular analysis of bronchoalveolar lavage fluid obtained at various stages during the develop⁃ment of bleomycin-induced pulmonary fibrosis in the rat[J].Am Rev Respir Dis,1982,126(3):488-492.
[2]Bargagli E,Olivieri C,Bennett D,Prasse A,Muller-Quernheim J,Rottoli P.Oxidative stress in the pathogenesis of diffuse lung diseases:a review[J].Respir Med,2009,103(9):1245-1256.
[3]Wang HN.Progress in studies on pharmacologic effects of ginsenoside[J].Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2006,11(11):1201-1206.
[4]Yang JX,Zhang JF,Zheng B,Zhang JF.Research progress of anti-tumor effect of ginsenoside Rh2[J].China Pharm(中国药师),2007,10(3):236-238.
[5]Liu YP,Cui JT.Effects of ginseng on cardiovascular system[J].Hubei J Tradit Chin Med(湖北中医杂志),2006,28(7):56-58.
[6]Hu CF,Lu DX,Sun LP,Qin L.The effect of ginsenosides of stem and leaf on mouse fatty liver and its mechanism[J].Chin Pharmacol Bull(中国药理学通报),2009,25(5):663-667.
[7]Song Q,Zhang XW,Xu ZW,Chen JW,Tang FT. Protective effects of preconditioning with ginseng stem and leave saponin against myocardium ischemia and reperfusion injury in spontaneously hypertensive rats[J].Chin J Phamacol Toxicol(中国药理学与毒理学杂志),2008,22(1):42-48.
[8]Liu Y,Mao YM,Wang XT.Comparision study on the effect of ginsenoside and vitamin E against acute lung injure in rat[J].China Prac Med(中国实用医药),2009,4(5):3-5.
[9]Liu C,Mao YM,Sun YX,Wang XT.Effect of stem and leaf ginsenoside on expression of interleukin-8 in acute lung injury albino rats[J].J Henan Univ SciTech:Med Sci(河南科技大学学报:医学版),2009,27(2):81-84.
[10]SzapielSV,Elson NA,Fulmer JD,Hunninghake GW,Crystal RG.Bleomycin-induced interstitial pulmonary disease in the nude athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[11]Deng J,Lv XT,Wu Q,Huang XN.Ginsenoside Rg1inhibits rat left ventricular hypertrophy induced by abdominal aorta coarctation:involvement of calcineurin and mitogen-activated protein kinase signalings[J].Eur J Pharmacol,2009,608(1-3):42-47.
[12]Lee SH,Shim HS,Cho SH,Kim SY,Lee SK,Son JY,et al.Prognostic factors for idiopathic pulmonary fibrosis:clinical,physiologic,pathologic,and molecular aspects[J].Sarcoidosis Vasc Diffuse Lung Dis,2011,28(2):102-112.
[13]American Thoracic Society,European Respiratory Society.This joint statement of the American Thoracic Society(ATS),and the European Respiratory Society(ERS)was adopted by the ATS board of directors,June 2001 and by the ERS Executive Committee,June 2001[J].Am J Respir Crit Care Med,2002,165(2):277-304.
[14]CaraciF,GiliE,Calafiore M,Failla M,La Rosa C, Crimi N,et al.TGF-beta1 targets the GSK-3beta/ beta-catenin pathway via ERK activation in the transition of human lung fibroblasts into myofibro⁃blasts[J].Pharmacol Res,2008,57(4):274-282.
[15]Ono A,Utsugi M,Masubuchi K,Ishizuka T,Kawata T,Shimizu Y,et al.Glutathione redox regulates TGF-beta-induced fibrogenic effects through Smad3 activation[J].FEBS Lett,2009,583(2):357-362.
[16]SunYM,Song FC,Chen XL.Research progress on nitric oxide and pulmonary fibrosis[J].Prog Modern Biomed(现代生物医学进展),2006,6(9):105-118.
Antioxidative effect of total ginsenosides on exprimental pulmonary fibrosis of mice
LUO Min1,2,SHU Lei1,2,LIYing-ying1,XIAO Jiang-tao1,2,SHIJing-shan1,DENG Jiang1
(1.Department of Pharmacology of Key Laboratory for Basic Pharmacology of Ministry of Education,2.School of Pharmaceutical Science,ZunyiMedical University,Zunyi 563006,China)
OBJECTIVE To observe the protective effect and underlying mechanism of total ginsenosides(TG)on bleomycin-induced pulmonary fibrosis.METHODS Intratracheal instillation of bleomycin 5 mg·kg-1was conducted to establish a pulmonary fibrosis mouse model.Kunming mice(1/2 males and 1/2 females)were randomly divided into sham-operation(Sham),model,totalginsen⁃osides 40,80 and 160 mg·kg-1and prednisone acetate(5 mg·kg-1)groups.After 28 d administration,the histopathological changes in the lung were analyzed by hematoxylin eosin(HE)and Masson staining. The exprssion ofalpha smooth muscle actin(α-SMA)in the lung was detected by real-time PCR.The content of hydroxyproline(HYP)and glutathione(GSH),leveloftotalantioxidantcapacity(T-AOC)and hydroxy radical(·OH),activity ofmyeloperoxidase(MPO)and nitric oxide synthase(NOS)in the lung were detected by corresponding kits.RESULTS Compared with the sham group,the pulmonary indexes in modelgroup were significantly increased(P<0.01),alveolitis and pulmonary fibrosis were obvious.The mRNA expression ofα-SMA,contentof HYP and·OH,activity of MPO and NOS were increased(P<0.05),but the content of GSH and T-AOC in model group was decreased(P<0.05).Compared with model group,the pulmonary indexes in TG 80 and 160 mg·kg-1and prednisone acetate 5 mg·kg-1groups were reduced(P<0.05),and the degree ofalveolitis and pulmonary fibrosis was mitigated.The mRNA expression ofα-SMA,content of HYP and·OH,the activity of MPO and NO were decreased(P<0.05),while the content of GSH and T-AOC was increased(P<0.05).CONCLUSION TG can improve the degree of mice pulmonary fibrosis induced by bleomycin.The mechanism may be related to the increased antioxidantcapacity oforganisms.
totalginsenosides;pulmonary fibrosis;alpha smooth muscle actin;oxidative damage
The project supported by National Natural Science Foundation of China(81360660);and Science and Technology Fund of Guizhou Province(2012-2349)
DENG Jiang,E-mail:dengjiang1225@sina.com,Tel:15985068916,Fax:(0851)28642404
R285.5
A
1000-3002-(2016)05-0511-06
10.3867/j.issn.1000-3002.2016.05.005
2015-12-18接受日期:2016-05-10)
(本文编辑:贺云霞)
国家自然科学基金(81360660);贵州省科学技术基金(2012-2349)
罗敏,女,硕士研究生,主要从事心血管药理及抗炎免疫药理学研究,E-mail:543010175@qq.com,Tel:13984295140;邓江,女,硕士,教授,主要从事心血管药理及抗炎免疫药理学研究。
邓江,E-mail:dengjiang1225@sina.com,Tel:15985068916,Fax:(0851)28642404

