孕中期血清AFP、uE3和fβ-hCG水平与子痫前期的关系研究
龙伟 陆蓓亦 王晶 薛平平 刘建兵 周琴 虞斌 王慧艳
(南京医科大学附属常州妇幼保健院,江苏 常州 213003)
孕中期血清AFP、uE3和fβ-hCG水平与子痫前期的关系研究
龙伟 陆蓓亦 王晶 薛平平 刘建兵 周琴 虞斌 王慧艳*
(南京医科大学附属常州妇幼保健院,江苏 常州 213003)
目的 利用现有产前筛查资源,探讨孕中期母体甲胎蛋白(AFP)、游离雌三醇(uE3)和游离人绒毛膜促性腺激素β亚基(fβ-hCG)血清水平与子痫前期发生的关系。方法 回顾性分析2014年1月至2015年12月期间于本院行孕中期母体血清学产前筛查的孕妇临床数据,通过病历资料与电话随访明确其妊娠并发症和结局。经排除子宫肌瘤、输卵管囊肿等其他合并症病例后,共186例在后期妊娠中发生子痫前期的孕妇纳入研究,其中发生轻度子痫前期119例,发生重度子痫前期67例。另选择同期行产前筛查经随访确定为正常结局的孕妇,根据年龄和孕周相近原则(年龄相差1岁,孕周相差不超过1周)按1∶1随机匹配作为病例对照,收集两组孕妇产前筛查及相关的临床资料。采用EmpowerStats统计软件进行统计分析,组间比较根据资料分布类型分别采用t检验或Kruskal-Wallis秩和检验,子痫前期发病危险因素采用条件logistic回归模型分析。结果 与正常孕妇组相比,后期妊娠发生子痫前期的孕妇孕中期血清uE3(6.46±2.19 vs 7.13±2.30,P=0.002)显著降低;AFP和fβ-hCG则无统计差异。在调整年龄、孕周等其他因素后,血清uE3是子痫前期发生的保护因素(uE3:OR=0.80,95% CI:0.70~0.91,P=0.0008),结论 发生子痫前期的孕妇在孕15~20周时血清uE3低于未发生子痫前期的孕妇,血清uE3是子痫前期的独立保护因素。
子痫前期;甲胎蛋白;游离雌三醇;游离人绒毛膜促性腺激素β亚基
子痫前期是妊娠20周后以新发高血压、蛋白尿为主要临床特征的妊娠期特有疾病,对孕产妇及胎儿健康造成严重威胁。子痫前期发病率约为2%~5%[1],常导致胎儿生长受限、胎盘早剥、早产、围产儿死亡、孕产妇死亡等不良预后。目前临床上主要依靠孕产妇高血压和蛋白尿等症状对子痫前期进行诊断,但此时孕产妇通常出现多脏器损伤,导致治疗困难,孕产妇和围产儿预后不良。因此,寻找有效、早期的子痫前期预测指标具有重要的意义。本研究通过现有孕中期产前筛查资源,分析母体甲胎蛋白(AFP)、游离雌三醇(uE3)和游离人绒毛膜促性腺激素β亚基(fβ-hCG)血清水平与孕妇发生子痫前期的的关系,为临床上预测子痫前期提供参考。
1 资料和方法
1.1 研究资料 回顾性分析2014年1月至2015年12月期间于本院行孕中期(15~20孕周)母体血清学产前筛查的孕妇临床数据,通过医院信息系统、病案资料与电话随访了解并记录孕妇的妊娠并发症和结局。经排除子宫肌瘤、输卵管囊肿等其他合并症病例及多胎妊娠病例后,共186例在后期妊娠中发生子痫前期的孕妇纳入研究,其中发生轻度子痫前期119例,发生重度子痫前期67例。子痫前期诊断标准参照中华医学会妇产科学分会制定的妊娠期高血压疾病诊治指南(2012版)[2]。收集孕妇行产前筛查时的年龄、体重、孕周、分娩孕周及新生儿体重等临床资料,并根据年龄和孕周相近原则(年龄相差1岁,孕周相差不超过1周)按1∶1比例从同期行产前筛查且具有妊娠结局的正常孕妇中随机匹配,作为病例对照,收集两组孕妇产前筛查及相关的临床资料。血清AFP、uE3及fβ-hCG采用时间分辨荧光免疫测定。

2 结果
2.1 研究对象的一般资料 在20周后发生子痫前期组及未发生子痫前期对照组的一般资料见表1。在匹配孕妇年龄与筛查孕周后,子痫前期组的体重显著高于对照组(P=0.006)。此外,部分与分娩有关的资料在两组间也具有差异,在发生子痫前期的孕妇中,其分娩孕周(P=0.001)及新生儿体重(P=0.013)均低于对照组;而出现早产儿的频率高于对照组(P=0.024)。

表1 研究对象一般资料的比较
2.2 研究对象的孕中期筛查标志物血清水平分析 孕中期血清筛查标志物的血清含量见表2。AFP和fβ-hCG在两组间统计学无差异,而发生子痫前期的孕妇血清uE3含量低于对照组(P<0.05),且轻度及重度子痫前期uE3均低于对照组(P<0.05)。在轻度子痫前期及重度子痫前期两组间,AFP、uE3及fβ-hCG无统计差异。
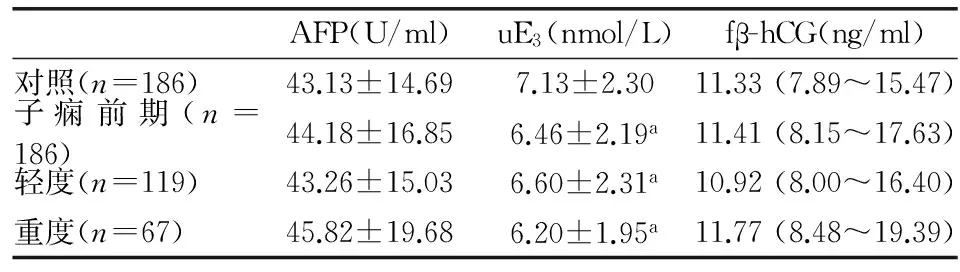
表2 孕中期血清筛查标志物的比较
注:a:与对照相比,P<0.05。
2.3 子痫前期潜在危险因素的单因素及多因素回归分析 为观察与孕妇发生子痫前期的独立因素,我们对孕妇年龄、筛查孕周、体重、血清AFP、uE3及fβ-hCG进行单因素及多因素回归分析。单因素回归分析结果显示,体重(OR=1.03,95% CI:1.01~1.06,P=0.0089)、uE3(OR=0.82,95% CI:0.73~0.92,P=0.0010)与子痫前期的发生有关,结果见表3。将孕妇体重、AFP、uE3和fβ-hCG作为自变量纳入回归方程,在调整孕妇年龄和筛查孕周后,孕妇体重是子痫前期发生的危险因素(OR=1.04,95% CI:1.01~1.07,P=0.0008);血清uE3是子痫前期发生的保护因素,提示uE3升高发生子痫
前期的风险降低(OR=0.80,95% CI:0.70~0.91,P=0.0032),结果见表4。

表3 发生子痫前期潜在危险因素的单因素回归分析

表4 孕中期产前筛查血清学指标与发生子痫前期的多因素回归分析
注:*:模型I:调整年龄、筛查孕周。
3 讨论
子痫前期的发病机制尚未完全清楚,主要有炎症免疫反应失衡、胎盘缺血缺氧、氧化应激、血管内皮细胞损伤等,胎盘的缺血缺氧、血管内皮细胞的损伤能引起多种血清标志物的改变,包括一些与炎症相关的细胞因子[4]、血管内皮因子和胎盘生长因子[5],其中部分因子在子痫前期症状发生前其血清含量就已发生变化,这使得子痫前期的早期预测得以实现成为可能,有关预测子痫前期的研究也备受关注[6]。最近在一项多中心前瞻性研究中发现,可溶性血管内皮生长因子受体sFlt-1与胎盘生长因子(PlGF)的比值≤38时阴性预测价值可达99.3%[7]。国内也有学者相关研究显示β-hCG与PIGF比值用于预测重度子痫前期的AUC可达0.914[8]。这些研究均显示血清标志物应用于预测子痫前期的巨大潜力。
如能利用现有的孕中期母体血清筛查资源,在唐氏筛查的基础上对子痫前期进行筛查,不失为一种简便、经济的筛查方法。为此我们回顾了近两年有关子痫前期患者孕中期筛查血清标志物等资料,结果显示在最终发展为子痫前期的患者中血清uE3要低于正常生理妊娠的孕妇。进一步条件logistic回归分析中提示uE3是子痫前期的独立保护因素。
孕早期及孕中期uE3水平的降低是一些不良妊娠结局的危险因子[9]。有研究显示孕中期uE3含量降低的孕妇人群中,更容易出现早发型重度子痫前期,且妊娠期高血压疾病的发生率也高于uE3含量正常的孕妇[10]。大量研究表明,雌激素水平的降低,促进了子痫前期的发生,而子痫前期孕妇血压的增高,全身小血管痉挛导致胎盘血流灌注不足,使胎儿胎盘单位雌激素合成能力下降,进一步降低了uE3水平[11]。本研究中观察到,子痫前期患者炎症反应呈过度激活状态,白细胞和中性粒细胞计数增加较正常妊娠高,中性粒细胞过度活化,而活化的中性粒细胞能合成活性氧自由基(ROS),如超氧离子(O2-),通过抑制NO活性和减少前列环素的合成间接收缩血管或直接使血管平滑肌收缩[12],血管内皮细胞受损是子痫前期的主要病理变化,是多器官损伤的病理基础,内皮细胞功能受损可表现为NOS减少,导致NO合成减少。而雌激素可抑制炎症反应,舒张血管,清除氧自由基,保护内皮细胞。雌激素通过抑制细胞色素C的合成及caspase 9/caspase 3活性而延迟中性粒细胞的凋亡[13],但并不激活中性粒细胞,这可能是妊娠期间正常孕妇体内白细胞虽然较非妊娠期增高,但并没有引起过度炎症免疫反应而发生排斥胚胎或胎儿的原因之一,同时保护母体免受感染;雌激素能激活NOS,增加NO释放,NO进入血管平滑肌细胞,激活鸟苷酸环化酶,导致cGMP生成减少从而引起血管平滑肌的舒张,起到舒张血管的作用[14];雌激素还可以减少过氧化物的产生,并增加过氧化物歧化酶和细胞外超氧化物歧化酶的转录及表达,增加对氧自由基的清除,起到保护血管内皮细胞的作用[15]。
可能是由于对照组按条件匹配导致样本量相对过少等原因导致,本研究中未观察到在子痫前期与正常组间AFP和fβ-hCG有差异,但也有不少研究报道其与子痫前期有关。在妊娠期,来源于胎儿肝细胞AFP可少量通过胎盘进入母体。有报道显示在孕11~13和19~24周时,在最终发展成子痫前期的孕妇中血清AFP较正常孕妇有所升高[16]。fβ-hCG与子痫前期关系的似乎随孕周变化。有研究认为在发展为子痫前期的孕妇中孕中期(16~20周)fβ-hCG升高,其中位数校正值用于预测初产妇子痫前期的敏感度和特异度可达88.5%和92.0%[17],而在孕9~13+6周时fβ-hCG水平低的孕妇更容易发生早发型子痫前期[18]。这可能是由于fβ-hCG水平本身随孕周变化而变化有关。
虽然大部分唐氏筛查血清标志物在发展成为子痫前期孕妇和正常生理妊娠孕妇中差异显著,但因其敏感性、特异性不高,无论早期还是孕中期唐氏筛查指标,单独用于子痫前期的筛查,其价值有限[19]。临床医生应联合其他血清标志物或结合子痫前期的高危因素,如孕妇年龄、体重指数增高、糖尿病、血压升高[20],提高子痫前期的预测准确率,尽可能做到早发现、早诊断、早治疗,这对于子痫前期的早期筛查、及时诊治及改善预后均有重要的临床意义。
[1] Ananth CV, Keyes KM, Wapner RJ. Pre-eclampsia rates in the United States, 1980-2010: age-period-cohort analysis [J]. BMJ (Clinical research ed), 2013, 347:f6564-f6564.
[2] 中华医学会妇产科学分会妊娠期高血压疾病学组. 妊娠期高血压疾病诊治指南(2012版) [J]. 中华妇产科杂志, 2012, 47(6): 476-480.
[3] 林林, 陈常中, 余晓丹. 应用 Empower Stats 软件分析阈值效应[J]. 中华流行病学杂志, 2013, 34(011): 1139-1141.
[4] Azizieh F, Raghupathy R, Makhseed M. Maternal cytokine production patterns in women with pre-eclampsia [J]. Am J Reprod Immunol, 2005, 54(1): 30-37.
[5] Valbuena-Diez AC, Blanco FJ, Oujo B, et al. Oxysterol-induced soluble endoglin release and its involvement in hypertension [J]. Circulation, 2012, 126(22): 2612-2624.
[6] Seely EW, Solomon CG. Improving the prediction of preeclampsia [J]. New Engl J Med, 2016, 374(1): 83-84.
[7] Zeisler H, Llurba E, Chantraine F, et al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia [J]. New Engl J Med, 2016, 374(1): 13-22.
[8] 郑琪珍, 邓玉清, 钟世林, 等. 孕中期早期孕妇血清中β-HCG、PlGF水平及比值变化预测重度子痫前期的价值 [J/CD]. 中国产前诊断杂志(电子版), 2015, 7(3): 19-25.
[9] Tianhua H, Hoffman B, Meschino W, et al. Prediction of adverse pregnancy outcomes by combinations of first and second trimester biochemistry markers used in the routine prenatal screening of Down syndrome [J]. Prenatal diagnosis, 2010, 30(5): 471-477.
[10] Yaron Y, Cherry M, Kramer RL, et al. Second-trimester maternal serum marker screening: maternal serum alpha-fetoprotein, beta-human chorionic gonadotropin, estriol, and their various combinations as predictors of pregnancy outcome [J]. Am J Obstet Gynecol, 1999, 181(4): 968-974.
[11] Tache V, Baer RJ, Currier RJ, et al. Population-based biomarker screening and the development of severe preeclampsia in California [J]. Am J Obstet Gynecol, 2014, 211(4): 377.e1-8.
[12] Tsukimori K, Fukushima K , Tsushima A , et al. Generation of reactive oxygen species by neutrophils and endothelial cell injury in normal and preeclamptic pregnancies [J]. Hypertension, 2005, 46(4):696-700.
[13] Molloy EJ,O'Neill AJ,Granthamet JJ,et al. Sex-specific alterations in neutrophil apoptosis: the role of estradiol and progesterone [J]. Blood, 2003,102(7):2653-2659.
[14] Wynne FL,Payne JA , Cain AE,et al. Age-related reduction in estrogen receptor-mediated mechanisms of vascular relaxation in female spontaneously hypertensive rats[J]. Hypertension,2004, 43(2):405-412.
[15] Gragasin FS,Xu Y , Arenas IA ,et al. Estrogen reduces angiotensin II-induced nitric oxide synthase and NAD(P)H oxidase expression in endothelial cells [J]. Arterioscler Thromb Vasc Biol, 2003,23(1):38-44.
[16] Bredaki FE, Mataliotakis M, Wright A, et al. Maternal serum alpha-fetoprotein at 12, 22 and 32 weeks' gestation in screening for pre-eclampsia [J]. Ultrasound Obstet Gynecol, 2016, 47(4): 466-471.
[17] Roiz-Hernandez J, de JC-MJ, Fernandez-Mejia M. Human chorionic gonadotropin levels between 16 and 21 weeks of pregnancy and prediction of pre-eclampsia [J]. Int J Gynaecol Obstet, 2006, 92(2): 101-105.
[18] Yliniemi A, Makikallio K, Korpimaki T, et al. Combination of PAPPA, fhCGbeta, AFP, PlGF, sTNFR1, and Maternal Characteristics in Prediction of Early-onset Preeclampsia [J]. Clin Med Insights Reprod Health, 2015, 9:13-20.
[19] 陈儒香. 孕早中期子痫前期筛查的研究进展[J]. 现代妇产科进展, 2014, 23(4): 305-307.
[20] Duckitt K, Harrington D. Risk factors for pre-eclampsia at antenatal booking: systematic review of controlled studies [J]. BMJ (Clinical research ed), 2005, 330(7491): 565.
编辑:宋文颖
Objective By analyze the available data of second-trimester(gestational age between 15 and 20 weeks) maternal serum prenatal screening, to evaluate the relationship between preeclampsia and serum markers, alpha-fetoprotein(AFP), unconjugated estriol(uE3), and free beta-human chorionic gonadotropin (fβ-hCG). Method Retrospective analysis the data of pregnant women who had been evaluated with second-trimester maternal serum prenatal screening performed at Changzhou Maternal and Child Health Care Hospital from 2014 through 2015. 186 pregnant women were diagnosed with preeclampsia after 20 weeks of gestation, included 119 mild cases and 67 severe cases. The cases combine with hysteromyoma, cystic salpinx were exclude in the study. Each case with preeclampsia was matched one control participant by computerized algorithm as the ratio 1∶1. The control participants were produced from the healthy pregnant women who received maternal serum prenatal screening at the same period.The clinical data, include maternal age, weight, gestational age at enrollment, gestational age at delivery and infant’s birth weight were recorded and compared, and the independent relationship between preeclampsia and serum maker were estimatedby multiple regression analyses with an adjustment for potential confounders. Results The serum level of uE3 in preeclampsia patients was lower than in controls, while there was no difference in AFP and fβ-hCG. After adjusted potential confounders, preeclampsia was associated with uE3 with the OR= 0.80(95%CI: 0.70~0.91,P=0.0008).Conclusions In 15~20 gestational weeks, the serum level of uE3 was reduce in pregnant women who later develop into preeclampsia, uE3 was an independent protective factor for preeclampsia.
preeclampsia;alpha-fetoprotein;unconjugated estriol;beta-human chorionic gonadotropin
10.13470/j.cnki.cjpd.2016.03.008
R714.25
A
2016-06-25)
*通讯作者:王慧艳,E-mail:1429249854@qq.com

