短期围封对西藏北部高寒草甸土壤线虫群落的影响
薛会英, 罗大庆, 胡 锋, 李辉信, 王景升, 屈兴乐, 王鸿源, 于宝政, 孙 巧
1 西藏大学农牧学院, 林芝 860000 2 南京农业大学资源与环境科学学院, 南京 210095 3 中国科学院地理科学与资源研究所, 北京 100101
短期围封对西藏北部高寒草甸土壤线虫群落的影响
薛会英1, 罗大庆1, 胡 锋2, 李辉信2, 王景升3, 屈兴乐1, 王鸿源1, 于宝政1, 孙 巧1
1 西藏大学农牧学院, 林芝 860000 2 南京农业大学资源与环境科学学院, 南京 210095 3 中国科学院地理科学与资源研究所, 北京 100101
为了解放牧对高寒草甸的影响, 以及围封对高寒草甸的恢复作用, 2013年5月、8月、10月, 分别对藏北短期围封高寒草甸和自由放牧高寒草甸不同深度土层的土壤线虫群落及土壤理化性质等进行了调查。调查结果表明, 3a围封提高了土壤全氮、磷、钾及土壤有机质含量, 土壤保水能力也明显提高;围封使土壤线虫个体密度下降, 但物种多样性和丰富度却提高了;围封使土壤线虫群落中的植食性线虫所占比重呈下降趋势, 食真菌线虫比重加大。短期围封有利于高寒草甸生态系统的正向演替, 使之向更稳定的方向发展, 同时, 土壤线虫数量对土壤理化性质变化有明显的响应, 通过土壤线虫群落的群落特征可以反映放牧干扰及围封对高寒草甸生态系统的影响。
线虫;生物多样性;高寒草原生态系统;西藏;围封;放牧
近些年来, 藏北草原退化草地面积呈明显增加趋势, 2013年仅轻度退化草地面积就占到了藏北总土地面积的62.0%[1], 而过度放牧是藏北草地退化的主要驱动力之一。
围封是当前退化草地的重要恢复措施之一。许多研究结果表明, 围封能够明显增加草地植被的高度、盖度、丰富度以及地上生物量[2-6], 而植被会通过凋落物和根际分泌物等因素影响土壤的理化性质并导致土壤动物群落发生相应的变化, 这种变化又会通过土壤动物的行为及生理生化过程对地上植被造成影响。地上植被与地下土壤动物群落之间相互作用, 通过反馈和负反馈共同维护着草地生态系统的稳定性。而一直以来, 相关研究大多着眼于围封后植被恢复和土壤理化性质方面, 对地下部尤其是对土壤动物的关注则相对较少[7-9], 针对西藏高原特殊环境条件下放牧以及围封对草地生态系统影响方面的研究则更为匮乏[10-11]。
线虫是土壤动物中的重要类群, 其不仅直接或间接参与土壤生态过程, 而且对生境变化反应灵敏, 其环境指示作用已受到国内外学者们的广泛关注[12-24]。
本研究以藏北高寒草甸为对象, 通过对短期围封、自由放牧天然高寒草甸土壤线虫群落组成及物种多样性进行研究, 试图阐明土壤线虫群落对自由放牧以及围封措施的响应机制, 探讨其在藏北高寒草甸生态系统生态过程中的环境指示意义, 以期为退化草地恢复、草地资源的合理利用以及当地畜牧业发展提供理论依据。
1 研究方法
1.1 样地设置
研究样地设置在那曲地区那曲县德吉乡切玛热巴村, 中国科学院地理资源所西藏那曲站, 地理位置31°38′38.87″N, 92 ° 00′51.44″E, 海拔4596 m。此区域土壤为高山草甸土, 季节性冻土。地被植物主要优势种及亚优势种有高山嵩草(Kobresiapygmaea)、二裂委陵菜(Potentillabifurca)、矮火绒草(Leontopodiumnanum)、乳白香青(Anaphallislactea)、钉柱委陵菜(P.saundersiana)、垂穗披碱草(Elymusnutans)、草地早熟禾(Poapratensis)和紫羊茅(Festucarubra)等。
分别在围栏内草地(围封3 a)、围栏外自由放牧草地设置样地, 面积20 m×20 m, 平行样地3个, 共6个样地, 样地间的距离约50—100 m。于2013年5月(春季, 草地返青期)、8月(夏季, 草类盛长期)、11月(秋冬季, 枯草期), 分别对围栏内、外样地按照随机布点方式用内径7 cm土钻进行取样, 每个样地布设3个采样点, 分别采集深度为0—5 cm, 5—10 cm, 10—15 cm, 15—20 cm, 20—25 cm 土层原状土样, 分别组成不同土层的混合土样。 将土壤样品装入聚乙烯袋中, 贴上标签后带回实验室进行后续测定。
1.2 土壤线虫的分离与鉴定
称取土壤鲜样30.0 g, 浅盘法室温分离48 h[24], 用孔径为0.045 mm的筛子收集线虫, 用5%甲醛溶液固定线虫。在解剖镜下进行计数, 制片。利用土壤含水量的测定结果, 将线虫个体数量转换成条/100 g干土。
依据《DE NEMATODEN VAN NEDERLAND》[25]、《Dorylaimida—Free-living, Predaceous and Plant-parasitic Nematodes》26]、《中国土壤动物检索图鉴》[27]、《植物线虫分类学》[28]和《中国淡水和土壤线虫的研究》[29], 在体视显微镜下观察, 将线虫鉴定到属。
各属优势度的划分:个体数量占总捕获量10%以上者, 为优势属(+++);个体数量占总捕获量1%—10%者, 为常见属(++);个体数量占总捕获量1%以下者, 为稀有属(+)[30-31]。
1.3 土壤线虫营养类群的划分
根据食性将线虫分为如下几个营养类群:食细菌性线虫(Bacterivores)、食真菌性线虫(Fungivores)、植食性线虫(Plant-parasites)和杂食/捕食性线虫(Omnivores/predators)[32]。
1.4 土壤线虫群落结构生物多样性指标
Pielou均匀度指数:J′=H′/lnS
Simpson优势度指数:λ=∑(ni/N)2
Margalef丰富度指数:SR=(S-1)/lnN
成熟度指数(Maturity Index,MI, 不包括植食性线虫)[33]:MI=∑c(i)×pi
植植食性线虫成熟度指数(Plant Parasite Index, PPI)[33]: PPI=∑c(i)×pi
PPI/MI[19]
线虫通路比值(Nematode Channel Ratio, NCR):NCR=Ba/(Ba+Fu)
瓦斯乐斯卡指数(Wasilewska index,WI):WI=(Ba +Fu)/Pp
式中,ni为第i类群的个体数,N为群落所有类群的个体总数;c(i)为非植物寄生性(植物寄生性)土壤线虫第i类群colonizer-persister值;S为类群数;n为非植物寄生性(植物寄生性)土壤线虫类群数;Pi为土壤线虫群落非植物寄生性(植物寄生性)土壤线虫第i类群的个体数占群落总个体数的比例;Ba、Fu、Pp分别代表食细菌性线虫、食真菌性线虫、植食性线虫的数量。
1.5 土壤理化性质测定[34]
(1)pH采用电位法。水土比为2.5∶1。
(2)土壤含水量采用烘干法。105℃, 8h左右烘至恒重。
(3)土壤有机质采用外加热-重铬酸钾容量法。
(4)碱解氮采用扩散法。
(5)全磷采用磷钼蓝比色法。
(6)全钾、速效钾采用火焰光度法。
(7)全氮采用半微量开氏法。
1.6 数据处理
采用SPSS13.0软件进行单、双因素ANOVA分析和线性相关分析, 以估测不同季节、不同深度土层以及两者交互作用对土壤线虫群落各参数的影响;用Excel绘制图表及计算。
2 结果与分析
2.1 土壤理化性质
自由放牧、围封高寒草甸2个样地的土壤理化性质见表1。结果显示:围封在一定程度上增加了土壤含水量, 并明显高于自由放牧样地(P=0.013);全氮、磷、钾的含量在围封3a后均显著增加, 全磷的增加尤为明显(PN=0.021,PP=0.001,Pk=0.045);土壤有机质在围封后有所增加, 但差异不显著(P=0.235);土壤pH值在围封样地和自由放牧样地间差异不显著, 但围封降低了土层间pH值的变化幅度, 使土壤表层与深层的pH趋同。
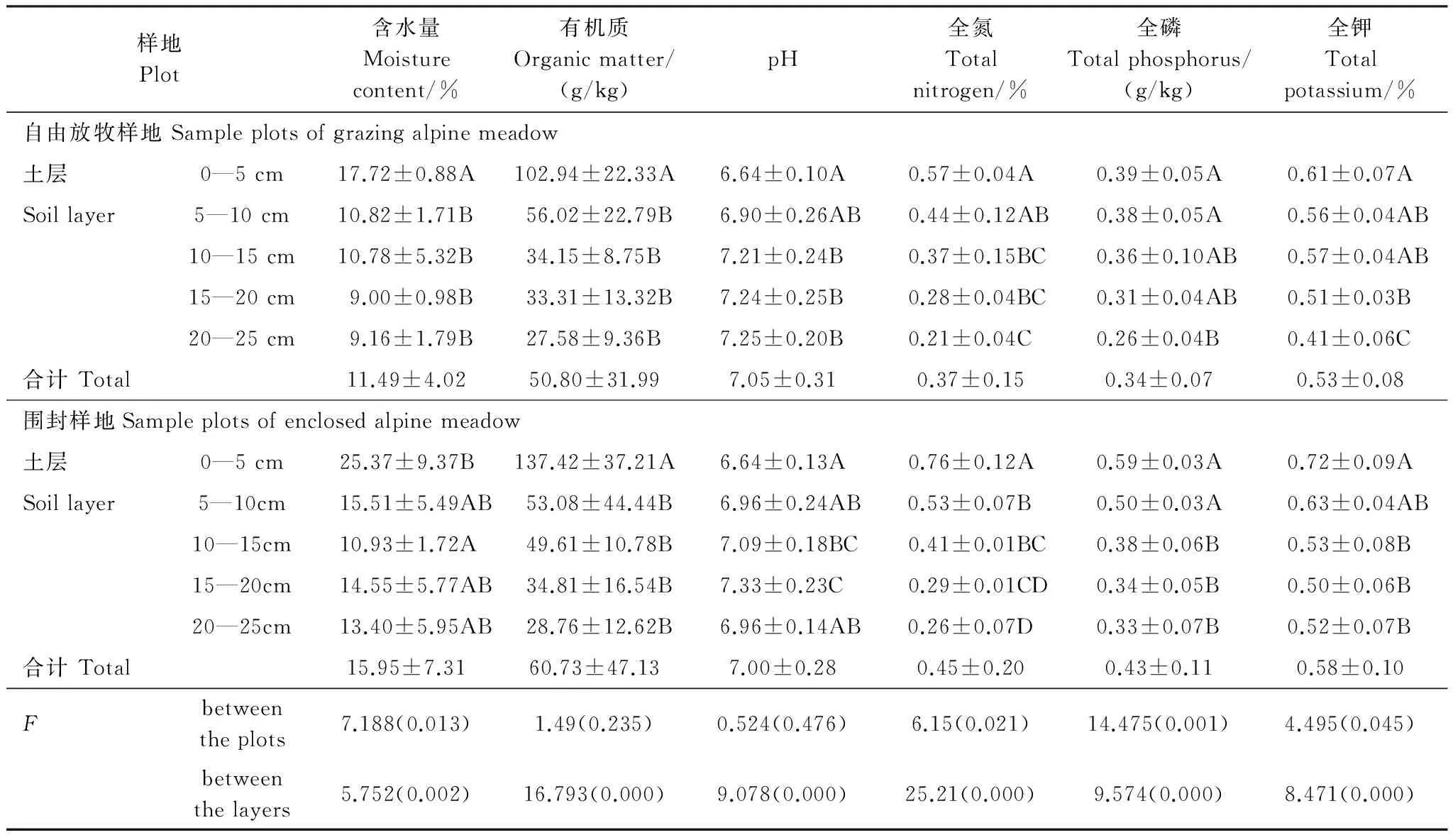
表1 样地主要土壤理化性质
平均值± 标准差;同列数据后字母不同表示差异显著(P< 0. 05,邓肯法)
2.2 土壤线虫群落结构
2.2.1 土壤线虫群落种类构成情况
从2个样地3个季节的土壤样品中共分离得到线虫11919 条, 平均密度782 条/100g干土, 分类鉴定到的线虫有4870 条, 隶属于2 纲5 目67 属, 具体情况见表2。
放牧高寒草甸样地分离得到土壤线虫6602条, 平均密度849 条/100g干土, 分属于2纲5目33科53属, 其中,Tylencholaimus为优势属, 其个体数量占总数的15.68%,Helicotylenchus、Tylenchorhynchu等20个属为常见属, 个体数量占到了总数的73.19%,Wilsonema、Prismatolainus等32个属为稀有属。
围封高寒草甸样地分离得到土壤线虫5317 条, 平均密度714 条/100g干土, 分属于2纲5 目33 科57 属,Tylencholaimus、Tylenchorhynchus为优势属, 个体数量占总数的30.57%,Cephalobus、Ditylenchus等16个属为常见属, 其个体数量占总数的48.41%,Epidorylaimus、Rhabdolaimus等39个属为稀有属。
围封使高寒草甸土壤线虫群落中的优势类群、稀有类群种类及其个体数量增加, 常见属的种类及个体数量则出现了下降的趋势。

表2 不同处理样地土壤线虫群落组成及营养类群c-p值
G.:自由放牧样地(Sample plots of grazing alpine meadow);E:围封样地(Sample plots of enclosed alpine meadow);+++:优势属(dominant genus);++:常见属(common genus);+:稀有属(rare genus);-:未出现(Not observed)
2.2.2 土壤线虫个体密度及其时空分布
从图1可以看出, 自由放牧样地和围封样地土壤线虫在不同生长时期其个体密度均具明显的表聚性, 随着土壤深度的增加密度逐渐减小。
不同季节的不同土层, 放牧样地土壤线虫个体密度几乎都大于围封样地, 统计分析表明, 样地间没有明显差异(P返青期=0.271,P盛长期=0.904,P枯草期=0.309,N=15), 而土层间差异显著(P返青期<0.000,P盛长期<0.000,P枯草期=0.020,N=6)。
并且, 2个样地在返青期的土壤线虫个体密度明显高于其它2个生长时期(P<0.000,P<0.000), 盛长期和枯草期间差异不显著(P=0.765);围封样地表层(0—5cm)土样中的线虫个体密度在进入枯草期后降低的幅度明显大于自由放牧样地。

图1 土壤线虫个体密度(Mean±SD)的季节变化和垂直分布Fig.1 Vertical distrbution and seasonal variation of individual density of soil nematodes(Mean±SD)
2.3 土壤线虫群落的营养结构
自由放牧样地土壤线虫群落中以植食性线虫个体数量最多, 占到了线虫总数的35.86%, 其次为食细菌性线虫, 所占比例为25.09%, 食真菌性线虫位居第三, 占21.85%, 杂食/捕食性线虫最少, 仅占17.20%。
围封样地土壤线虫群落各营养类群个体数量:食真菌性线虫>植食性线虫>食细菌性线虫>杂食-捕食性线虫, 分别占线虫总数的29.73%、27.74%、23.29%、19.24%。
围封使土壤线虫群落中的植食性线虫比例下降, 食真菌线虫比例增加。围封改变了土壤线虫的营养结构。但ANOVA统计分析结果表明, 两样地间各营养类群在个体数量上有差异, 但差异不显著(P>0.05), 见图2。
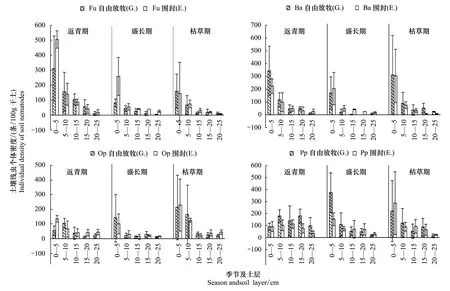
图2 土壤线虫营养结构Fig.2 Soil nematode trophic structure
2.4 土壤线虫群落的生态指数
从表3可以看出, 围封样地的多样性指数H′、丰富度SR均高于放牧样地, 其中, 多样性指数H′达到显著水平(P<0.05);围封样地的优势度指数λ明显低于放牧样地(P<0.05);两样地间的均匀度指数J′和PPI/MI差异不显著(P>0.05)。两样地间生态指数的差异, 几乎在所有的生长季都有相同的表现。
WI指数反映土壤线虫种群结构组成与土壤健康程度。当WI=1时, 表明单位土壤中有益的非植物线虫数量(食细菌和食真菌线虫)与有害的植物寄生线虫数量相当, 土壤健康程度一般;WI>1时, 值越大, 说明土壤健康状况越好;WI<1时, 值越小, 说明土壤健康程度越差。总体来说, 自由放牧样地WI指数低于围封样地, 尤其是在盛长期, 自由放牧样地WI指数仅为0.70, 土壤健康程度较差。
两个样地的NCR值在返青期和盛长期均低于0.5, 枯草期均高于0.5。样地间差异不显著(P>0.05)。
2.5 土壤线虫个体密度与土壤理化性质间的关系
土壤线虫个体密度与土壤理化性质之间的相关性分析结果见表4。全钾在枯草期以及碱解氮在返青期与土壤线虫个体密度相关性较小(P>0.05);全氮、全磷、有机质、速效钾、土壤含水量与不同生长时期的土壤线虫个体密度均呈显著正相关(P<0.05);pH则与不同生长时期的土壤线虫个体密度均呈极显著负相关(P<0.01);全磷、全钾、碱解氮含量与线虫密度之间的相关性随生长季变化而变化。

表3 土壤线虫群落生态指数
H′:多样性Shannon-Weiner diversity;J′:均匀度Eveness;λ:优势度Dominance;SR:丰富度Richness;PPI/MI:植食性线虫成熟度指数/成熟度指数Plant Parasite Index/Maturity Index;WI:瓦斯乐斯卡指数Wasilewska index;NCR:线虫通路比值Nematode Channel Ratio
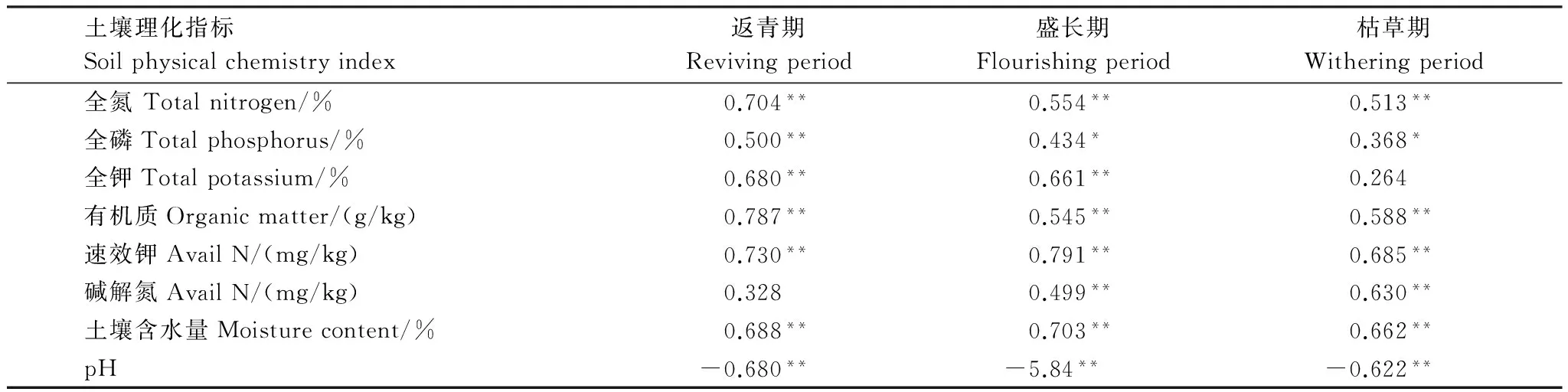
表4 土壤线虫个体密度与土壤性质间的相关系数
*P<0.05; **P<0.01, (n=90).
3 讨论
为了解放牧对高寒草甸的影响, 以及围封对高寒草甸的恢复作用, 2013年分别对藏北短期围封高寒草甸和自由放牧高寒草甸土壤线虫群落的种类构成、个体密度、生态指数, 以及土壤理化性质等进行了调查研究。
3a围封使土壤全氮、磷、钾的含量及含水量明显增加, 土壤有机质含量也有一定程度的提高。围封增加了植被覆盖度和地表凋落物的数量, 因而土壤含水量增加, 土壤水分状况得到改善。土壤全量养分增加的趋势与前人的研究结果一致[4, 35]。pH由于围封而使土壤表层与深层趋同, 这与其它的研究结果一致[36]。土壤线虫个体密度与土壤理化性质之间的相关性分析结果表明:土壤线虫数量对土壤理化性质变化有明显的响应, 因此, 通过土壤线虫群落的数量特征可以反映放牧干扰及围封对高寒草甸生态系统的影响。
围封使土壤线虫个体密度下降, 但物种多样性和丰富度却提高了, 同时, 优势度明显下降。围封使土壤线虫群落中的植食性线虫所占比重呈下降趋势, 食真菌线虫比重加大, 这说明围封有利于高寒草甸生态系统的正向演替, 使之向更稳定的方向发展。WI指数反映出同样的结果, 并表示出在放牧强度最大的盛长期(8月), 高寒草甸土壤生态系统受到的损伤最大。
Bongers于1997年提出PPI/MI值的应用, 他认为在一定条件下PPI/MI值反映土壤生态系统对外界干扰恢复程度可能更敏感[19], 但在本次调查研究中采用的此指数在2个样地间无明显差异。
虽然围封改变了土壤线虫群落的结构组成、个体密度以及多样性特征, 但是, 2个样地NCR值反映出的土壤有机质分解途径是一致的:返青期和盛长期主要依赖真菌降解途径, 枯草期则以细菌分解途径为主。
土壤线虫群落的种类构成、个体密度、生态指数是评价土壤线虫群落结构变化的量化指标, 上述不同指标能够在一定程度反映群落的环境质量状况。本文通过调查研究土壤线虫的种类构成、个体密度、生态指数, 反映出围栏封育和自由放牧高寒草甸不同生境中土壤线虫群落的差异, 说明藏北高寒草甸围封植被恢复方式有明显的正向影响, 自由放牧高寒草甸在植被盛长期受到了较大的放牧压力, 进一步过载将会导致草地生态系统退化。
4 小结
结果显示, 围封3a后, 土壤含水量、全氮、磷、钾的含量呈现出上升的趋势;土壤pH值没有出现明显变化。
围封使高寒草甸土壤线虫群落的组成结构发生改变, 优势类群种类及其个体数量明显增加, 而常见属的种类及个体数量则出现下降的趋势。
在不同季节的不同土层, 放牧样地土壤线虫个体密度几乎都大于围封样地, 但差异不显著。
围封使土壤线虫群落的营养结构发生变化, 自由放牧样地各营养类群线虫的个体数量大小顺序为:植食性线虫>食细菌性线虫>食真菌性线虫>杂食/捕食性线虫, 而围封样地则为:食真菌性线虫>植食性线虫占线虫>食细菌性线虫>杂食/捕食性线虫, 但两样地间各营养类群在个体数量上的差异不显著。
围封样地的多样性指数H′、丰富度SR均高于放牧样地, 而优势度指数λ明显低于放牧样地;自由放牧样地WI指数低于围封样地, 尤其在盛长期仅为0.70, 土壤健康程度较差。2个样地的NCR值在返青期和盛长期均低于0.5, 枯草期均高于0.5。样地间差异不显著。
[1] 王景升, 张宪洲, 陈宝雄, 石培礼, 张俊龙, 沈振西, 陶建, 武建双. 藏北高寒草地退化现状、原因与恢复模式. 资源与生态学报: 英文版, 2013, 4(1): 43-49.
[2] 杨鹏翼, 喻文虎, 向金城, 陆飒. 围栏封育对矮化芦苇草地草群结构动态变化的影响. 草业科学, 2006, 23(9): 12-14.
[3] 都耀庭, 张东杰. 禁牧封育措施改良高寒地区退化草地的效果. 草业科学, 2007, 24(7): 22-24.
[4] Mekuria W, Veldkamp E, Haile M, Nyssen J, Muys B, Gebrehiwot K. Effectiveness of exclosures to restore degraded soils as a result of overgrazing in Tigray, Ethiopia. Journal of Arid Environments, 2009, 69(2): 270-284.
[5] Evju M, Halvorsen R, Rydgren K, Austrheim G, Mysterud A. Effects of sheep grazing and temporal variability on population dynamics of the clonal herbGeraniumsylvaticumin an alpine habitat Gunnar Austria. Plant Ecology, 2011, 212(8): 1299-1312.
[6] 殷国梅, 张英俊, 王明莹, 薛艳林, 赵和平. 短期围封对草甸草原群落特征与物种多样性的影响. 中国草地学报, 2014, 36(3): 61-66.
[7] 桑媛, 贾尝, 阮维斌, 马成仓, 高玉葆. 围封对内蒙古中东部草原植物群落和土壤线虫群落的影响. 生态环境学报, 2010, 19(10): 2332-2338.
[8] 张莉, 党军, 刘伟, 王启兰, 向泽宇, 王长庭. 高寒草甸连续围封与施肥对土壤微生物群落结构的影响. 应用生态学报, 2012, 23(11): 3072-3078.
[9] 张伟东, 尚艳芳, 王雪峰. 土壤线虫群落对大连石门山森林植被恢复的响应. 生态学报, 2010, 30(4): 878-886.
[10] 王向涛, 高洋, 苗彦军, 孙磊, 赵玉红, 张泽生, 刘金卫. 围栏和退化条件下西藏高山嵩草草甸土壤种子库的比较. 西北农林科技大学学报: 自然科学版, 2015, 43(4): 203-209.
[11] 龙毅, 孟凡栋, 王常顺, 白玲, 钟扬, 汪诗平. 高寒草甸主要植物地上地下生物量分布及退化对根冠比和根系表面积的影响. 广西植物, 2015, 35(4): 532-538.
[12] Yeates G W, Wardle D A, Watson R N. Responses of soil nematode populations, community structure, diversity and temporal variability to agricultural intensification over a seven-year period. Soil Biology and Biochemistry, 1999, 31(12): 1721-1733.
[13] Bongers T, Ferris H. Nematode community structure as a bioindicator in environmental monitoring. Trends in Ecology & Evolution, 1999, 14(6): 224-228.
[14] Neher D A. Nematode communities: indicators of soil health//Proceedings of the VII International Congress of Ecology, Florence, Italy, 1998: 308-308.
[15] 张薇, 宋玉芳, 孙铁珩, 宋雪英, 周启星. 土壤线虫对环境污染的指示作用. 应用生态学报, 2004, 15(10): 1973-1978.
[16] Neher D A. 2001. Role of nematodes in soil health and their use as indicators. Journal of Nematology, 2001, 33(4): 161-168.
[17] Niles R K, Freckman D W. From the ground up: nematode ecology in bioassessment and ecosystem health//Barker K R, Pederson G A, Windham G L, eds. Plant-Nematode Interactions. Madison, WI: American Society of Agronomy, 1998: 65-85.
[18] Bongers T, Bonger M. Functional diversity of nematodes. Applied Soil Ecology, 1998, 10(3): 239-251.
[19] Bongers T, Van der Meulen H, Korthals G. Inverse relationship between the nematode maturity index and plant parasite index under enriched nutrient conditions. Applied Soil Ecology, 1997, 6(2): 195-199.
[20] 吴东辉, 尹文英, 阎日青. 植被恢复方式对松嫩草原重度退化草地土壤线虫群落特征的影响. 应用生态学报, 2007, 18(12): 2783-2790.
[21] Ferris H, Venette R C, Scow K M. Soil management to enhance bacterivore and fungivore nematode populations and their nitrogen mineralisation function. Applied Soil Ecology, 2004, 25(1): 19-35.
[22] Wasilewska L. Changes in the structure of the soil nematode community over long-term secondary grassland succession in drained fen peat. Applied Soil Ecology, 2006, 32(2): 165-179.
[23] Wu J H, Fu C Z, Lu F, Chen J K. Changes in free-living nematode community structure in relation to progressive land reclamation at an intertidal marsh. Applied Soil Ecology, 2005, 29(1): 47-58.
[24] 毛小芳, 李辉信, 陈小云, 胡锋. 土壤线虫三种分离方法效率比较. 生态学杂志, 2004, 23(3): 149-151.
[25] Bongers T. De Nematoden Van Nederland. Utrecht: Stichting Uitgeverij Koninklijke Nederlandse Natuurhistorische Vereniging, Utrecht, 1988. (请核对文献类型)
[26] Jairajpuri M S, Ahmad W. Dorylaimida: Free-Living, Predaceous and Plant-Parasitic Nematodes. New Delhi: Oxford and IBH Publishing Co, 1992.
[27] 尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[28] 谢辉. 植物线虫分类学(第二版). 北京: 高等教育出版社, 2005.
[29] 吴纪华. 中国淡水和土壤线虫的研究[D]. 武汉: 中国科学院水生生物研究所, 1999.
[30] 梁文举, 张万民, 李维光, 段玉玺. 施用化肥对黑土地区线虫群落组成及多样性产生的影响. 生物多样性, 2001, 9(3): 237-240.
[31] 吴东辉, 尹文英, 卜照义. 松嫩草原中度退化草地不同植被恢复方式下土壤线虫的群落特征. 生态学报, 2008, 28(1): 1-12.
[32] Yeates G W, Bonges T, De Goede R G M, Freckman D W, Georgieva S S. Feeding habits in soil nematode families and genera——An outline for soil ecologists. Journal of Nematology, 1993, 25(3): 315-331.
[33] Bongers T. The maturity index: An ecological measure of environmental disturbance based on nematode species composition. Oecologia, 1990, 83(1): 14-19.
[34] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
[35] Su Y Z, Li Y L, Cui J Y, Zhao W Z. Influences of continuous grazing and livestock exclusion on soil properties in a degraded sandy grassland, Inner Mongolia, Northern China. Catena, 2005, 59(3): 267-278.
[36] Jiang D M, Li Q, Liu F M, Jiang Y, Liang W J. Vertical distribution of soil nematodes in an age sequence ofCaraganamicrophyllaplantations in the Horqin Sandy Land, Northeast China. Ecological Research, 2007, 22(1): 49-56.
Effect of short-term enclosure on soil nematode communities in an alpine meadow in Northern Tibet
XUE Huiying1, LUO Daqing1, HU Feng2, LI Huixin2, WANG Jingsheng3, QU Xingle1, WANG Hongyuan1, YU Baozheng1, SUN Qiao1
1CollegeofAgricultureandAnimalHusbandry,TibetUniversity,Linzhi860000,China2CollegeofNaturalResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China3InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China
Alpine meadow is extensively distributed throughout Northern Tibet, and is the typical ecosystem of the Tibetan plateau. Collectively, alpine meadow represents the largest and most important ecosystem in Northern Tibet. The aim of the present study was to examine the restoration of degraded grassland and the rational use of grassland resources, and to provide a theoretical basis for local animal husbandry development in the alpine meadow of northern Tibet. We conducted an experiment using alpine meadow sample plots of both enclosed and grazed land in Naqu County in the Naqu region of the Tibet Autonomous Region, China (31°38′38.87″N, 92°00′51.44″E). To better understand the effect of grazing on alpine meadow habitats, and how degraded land may recover following enclosure, we surveyed the variation in soil nematode communities at soil depths from 0—25 cm. From May to November 2013, we carried out a survey in all sample plots to investigate variation in soil nematode communities in different soil layers ranging from 0 to 25 cm, in order to understand the effect of grazing on alpine meadows and the role of enclosure for the recovery of degraded alpine meadows in northern Tibet. We collected soil nematodes using the shallow basin method, and measured the following soil chemical properties: soil pH, organic matter content, and concentrations of total nitrogen, phosphorus, and potassium. We compared the composition, distribution, and diversity of nematode communities between grazed and enclosed plots using indices of individual density, diversity, and trophic composition. We also analyzed the relationships between nematode communities and soil chemical properties. Overall, nematode communities differed between grazed and enclosed sample plots. Short-term (3a) enclosure increased the biodiversity and total abundance of soil nematodes. Nematode groups increased in abundance in grazing plots from Plant parasites > Bacterivores > Fungivores > Omnivores-predators, while group abundances in enclosed sample plots decreased from Fungivores > Plant parasites > Bacterivores > Omnivores-predators. Various trophic groups showed no significant differences between the two sample areas. Enclosures reduced the proportion of plant predatory nematodes, and stabilized the nematode composition of the alpine meadow ecosystem. The Shannon-Wiener (H′) and Margalef indices (SR) were higher in enclosed plots than grazed plots, whereas the dominance index (λ) was lower for grazed than for enclosed plots. Wasilewska index (WI) showed that grazing intensity was highest in the period during which alpine meadow vegetation flourishes (August). At high grazing intensity, soil health declined, suggesting that further intensification of grazing will cause degeneration of the alpine meadow. Enclosures changed the structure of the soil nematode community, density, and diversity characteristics. However, nematode channel ratio values (NCR), which reflect soil organic matter decomposition pathways, were the same in both sample areas. Soil organic matter degradation occurred mainly through the fungal biodegradation pathway during reviving and flourishing periods, whereas bacterial decomposition dominated during the withering period. Our analyses of the relationships between soil nematode communities and soil chemical properties revealed that soil nematode abundance responded to changes in soil physical and chemical properties. This study demonstrates that grazing and enclosure have distinct effects on soil nematode communities in the northern Tibetan alpine meadow ecosystem.
nematode; biodiversity; alpine grassland ecosystem; Tibet; enclosures; grazing
国家自然科学基金地区科学基金项目(31260144);西藏特色农牧资源研发协同创新中心——高原生态项目
2015- 07- 22;
2016- 04- 21
10.5846/stxb201507221536
*通讯作者Corresponding author.E-mail: 472425717@qq.com
薛会英, 罗大庆, 胡锋, 李辉信, 王景升, 屈兴乐, 王鸿源, 于宝政, 孙巧.短期围封对西藏北部高寒草甸土壤线虫群落的影响.生态学报,2016,36(19):6139- 6148.
Xue H Y, Luo D Q, Hu F, Li H X, Wang J S, Qu X L, Wang H Y, Yu B Z, Sun Q.Effect of short-term enclosure on soil nematode communities in an alpine meadow in Northern Tibet.Acta Ecologica Sinica,2016,36(19):6139- 6148.

