基于Ussing Chamber技术的红景天苷大鼠肠黏膜透过性研究*
顾星,姚少姿,皮佳鑫,刘博缨,韩煦,刘志东
(1.天津中医药大学,现代中药发现与制剂技术教育部工程研究中心,天津300193;2.天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津300193)
·中药研究·
基于Ussing Chamber技术的红景天苷大鼠肠黏膜透过性研究*
顾星1,2,姚少姿1,2,皮佳鑫1,2,刘博缨1,2,韩煦1,2,刘志东1,2
(1.天津中医药大学,现代中药发现与制剂技术教育部工程研究中心,天津300193;2.天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津300193)
[目的]研究红景天苷在大鼠离体肠黏膜中的透过情况。[方法]采用Ussing Chamber技术,考察不同浓度红景天苷于大鼠肠黏膜透过情况,并考察维拉帕米(Ver)和十二烷基硫酸钠(SDS)对红景天苷大鼠肠黏膜透过的影响。[结果]不同浓度红景天苷在大鼠不同肠段的单位时间转运速率(Flux)随浓度升高而增大,不同肠段表观渗透系数(Papp)无统计学差异(P>0.05)。Ver加入一定量的SDS后,红景天苷在回肠和结肠的Papp显著增加(P<0.01或P<0.05),当SDS浓度为2 g/L时,回肠Papp增加为对照组的2.76倍。[结论]红景天苷在大鼠全肠段均有吸收,且吸收具有浓度依赖性,以被动吸收为主,Ver对红景天苷大鼠各肠吸收无影响,SDS促进了红景天苷回肠和结肠吸收。
红景天苷;Ussing Chamber技术;P-糖蛋白;紧密连接;维拉帕米;十二烷基硫酸钠
红景天苷(Salidroside)是景天科红景天属(Rhodiola rosea L.)红景天的主要药效成分之一,具有耐缺氧、抗衰老,治疗糖尿病、冠心病、肺源心脏病及老年痴呆症,降血脂、降血糖,增强免疫功能,抗肝纤维化等作用[1]。红景天苷属于酚类物质,极性大,亲水性强,油水分配系数较小[2],胃肠道黏膜透过性差,口服生物利用度低,从而影响了红景天苷的疗效充分发挥,限制了其广泛应用。对于红景天苷的口服吸收的机制还尚不明确,可能原因有肠黏膜紧密连接的阻碍[3]、主动外排作用[4]等。Ussing Chamber技术早期用于研究上皮组织的离子转运,目前,其应用主要集中在药学领域,具有快捷、简便等特点,能在离体情况下模拟胃肠道生理环境,通过监测组织的电生理变化,比较真实地反映上皮细胞在体内的实时状态,常用于药物的渗透性和转运机制的研究[5]。本实验采用Ussing Chamber技术,以红景天苷为模型药物,初步研究红景天苷在大鼠肠黏膜中的透过情况,为红景天苷的进一步开发利用提供一定理论依据。
1 仪器与材料
1.1实验仪器Ussing Chamber仪器(美国生理仪器公司,信号采集系统为ADInstruments Pty Ltd,数据处理软件为LabChart7.2);超高效液相-质谱/质谱(UPLC-MS/MS,Agilent 1690型UPLC色谱仪,Agilent 6460 Triple Quad LC/MS型三重四极杆串联质谱仪);DKB-501A型水浴锅(上海精宏实验设备有限公司);台式通用冷冻离心机(美国Thermo Fisher公司);XP205电子天平(瑞士METTLER TOLEDO公司);ALC-110.4电子天平(德国ACCULAB公司);Milli-Q超纯水系统(美国Millipore公司)。
1.2实验材料红景天苷(Salidroside/Sal,中新药业,批号:W16-1-3,纯度≥98.0%);维拉帕米(Verapamil/Ver,Sigma,MDL No.:MFCD00055208,纯度≥99.0%);十二烷基硫酸钠(SDS)、二水磷酸二氢钠(NaH2PO4·2H2O)、无水氯化钙(CaCl2)、氯化钠(NaCl分析纯)、氯化钾(KCl)、碳酸氢钠(NaHCO3)、六水氯化镁(MgCl2·6H2O)和葡萄糖(D-glucose)均为分析纯。
1.3实验动物健康SD大鼠,雄性,大鼠体质量250~300 g,购买自中国人民解放军军事医学科学院卫生环境医学研究所,动物合格证号:SCXK-(军)2014-0001。相关研究遵照动物实验原则进行。
2 方法与结果
2.1溶液配制
2.1.1Krebs-Ringe(rK-R)溶液及K-R肠液的配制
称取CaCl2:2.78 g,KCl:3.51 g,MgCl·26H2O:2.44 g,NaH2PO4·2H2O:1.44 g置于烧杯中,加去离子水500 mL充分溶解,即得储备液;称取NaCl:6.84 g,NaHCO3:2.10 g,D-glucose:1.98 g置于1 000 mL容量瓶中,加入适量去离子水充分溶解,加入储备液50 mL,以去离子水定容摇匀,再通入混合气体(95% O2-5%CO2)15 min,待pH值变为7.2-7.4时,即得K-R溶液。截取适宜长度的大鼠肠段,用冰浴过的生理盐水冲洗干净后,置于K-R溶液中,于37.5℃下共孵育一段时间,即得K-R肠溶液。
2.1.2对照品溶液配制取Sal对照品,精密称量,以K-R溶液为溶剂制备成每1 mL含2.5 mg Sal的母液。
2.1.3供试品溶液配制分别精密吸取“2.1.2”项下的Sal对照品母液,用K-R溶液稀释为50、100、200、400 mg/L Sal溶液。
分别精密吸取已配制的2.5 g/L Ver溶液和“2.1.2”项下的Sal对照品母液,用K-R溶液稀释为100 mg/L Sal-100 mg/L Ver、100 mg/L Sal-200 mg/L Ver溶液[6]。
分别取SDS,精密称量,加入K-R溶液溶解,再分别精密吸取“2.1.2”项下的Sal对照品母液,用KR溶液稀释为100 mg/L Sal-0.5 g/L SDS、100 mg/L Sal-1g/LSDS、100mg/LSal-2g/L SDS溶液。
2.2Ussing Chamber实验
2.2.1系统装置准备Ussing Chamber系统主要由以下部分组成:尤斯室、电压电流钳、数据采集系统与数据分析软件,另外有配有恒温水浴箱、混合气体(95%O2-5%CO2)循环系统等。将电极头(由琼脂糖、3 mol/mL KCl等组成)接入装置,尤斯室两边各加入5 mL K-R溶液,将系统电压和电流调零,以消除溶液和系统电阻对肠黏膜的影响。
2.2.2大鼠肠黏膜制备将大鼠禁食16-18 h后,断颈处死,即刻开腹取出不同肠段。选择十二指肠、空肠、回肠、结肠为考察肠段,每个肠段分别截取10-15 cm,用生理盐水冲洗干净,置入冰浴的K-R溶液中培养10 min。每个肠段剪取2-3 cm,于冰浴板上小心剥离浆膜层,将分离好的肠黏膜固定于样本夹中即可。
2.2.3接收液收集与处理将制备好的样本固定于尤斯室中,即刻于装置的黏膜侧和浆膜侧分别加入5 mL K-R溶液,并开始采集各项电生理指标(钳制电压为5 mV,每1 min给1次电刺激,持续时间为0.2 s)。实验中持续通入混合气体(95%O2-5% CO2)、并于37.5℃水浴维持肠黏膜的生物活性,平衡15-20min待大鼠肠黏膜各项电生理指标稳定后[7],取出装置中的K-R溶液,于黏膜侧和浆膜侧分别添加37.5℃水浴保温的5 mL药液和新鲜K-R溶液,并分别在加药后15、30、60、90、120、150、180 min,从浆膜侧取0.5 mL接收液并立即补加新鲜K-R溶液,将所取的接收液离心(12 000 r/min、4℃)10 min,取上清液于UPLC-MS/MS进样分析。
2.3分析方法建立
2.3.1液相色谱-质谱条件液相色谱条件:色谱柱为AgilentEclipsePlusC18柱(2.1mm×50mm,1.8μm),柱温为30℃,进样量3 μL,流速:0.3 mL/min。流动相为:乙腈(A)-水(B),0-1.5 min:9%-10%A,1.5- 3 min:10%-60%A,3-4 min:60%-9%A,4-6 min:9%A。
质谱条件为:电喷雾离子源(ESI),负离子模式,多级反应监测(MRM),碰撞电压为120 V,碰撞能0 eV,雾化气流速为13.0 L/min,雾化气温度为350℃,检测离子对为299.11→299.11 m/z。
2.3.2线性关系将Sal母液以空白K-R肠溶液依次稀释浓度梯度为23.4、45.8、93.5、187.0、374.0、748.0、1 496.0、3 740.0 μg/L,于“2.4.1”项下的方法进样分析,以浓度对峰面积做线性回归得= 14.243X+30.318(r2=0.999 1),表明Sal在23.4~3 740.0 μg/L范围内线性关系良好。
2.3.3精密度将浓度分别为46.8、187.0、1496.0μg/L的Sal溶液测定日内精密度RSD值分别为2.86%、1.70%、0.99%,日间精密度RSD值分别为6.18%、4.74%、3.91%。表明日内、日间精密度良好。
2.3.4稳定性将接收液分别于0、2、4、6、8、10、12 h于“2.4.1”项下的方法进样分析。以峰面积计算RSD值为1.94%,说明样品在12 h之内测定稳定性良好。
2.4数据处理
2.4.1单位面积累积透过量(Qtn)、单位面积转运速率(Flux)[8]和表观渗透系数(Papp)计算公式如下:
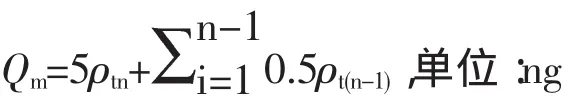
其中,ρtn为设计时间点扩散池接收侧的药物质量浓度;0.5和5分别表示取样体积和加入供试液的体积(mL);
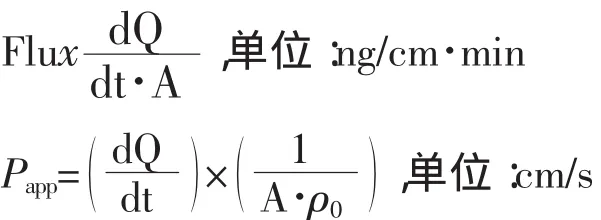
2.4.2肠黏膜跨膜电阻统计从开始记录组织电生理参数起,各通道每1 min采集得到一个电阻值,再将每一个取样时间点与上一个取样时间点的该段时间内所有电阻值取平均值,作为该取样时间点的电阻值(给药前平衡时间内平均电阻值作为取样时间点零时刻的电阻值)。
2.4.3统计学方法采用SPSS18.0软件进行数据分析,结果以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2.5实验结果
2.5.1大鼠肠黏膜活性研究在Ussing Chamber实验过程中,通常以肠黏膜跨膜电阻来检测或者评价组织完整性并反应其活性[5]。本实验监测了大鼠各离体肠段(Sal给药浓度为100 mg/L)在180 min内的跨膜电阻。由图1结果可知,各肠段跨膜电阻值在一正常范围值内波动;十二指肠、空肠、回肠和结肠的平均跨膜电阻值分别为(77.45±40.78)Ω/0.5 cm2、(82.95±48.02)Ω/0.5 cm2、(75.65±33.00)Ω/0.5 cm2、(86.67±52.26)Ω/0.5 cm2。结果表明实验时间内肠黏膜的生物活性较好。

图1 十二指肠、空肠、回肠和结肠的电阻值(n=11)Fig.1 Resistanceofduodenum,jejunum,ileumandcolon(n=11)
2.5.2不同浓度Sal肠黏膜的透过情况本实验以Ussing Chamber技术,研究不同浓度的Sal溶液在大鼠肠黏膜的透过情况。Sal给药浓度分别为50、100、200、400mg/L时,随着浓度的增加,大鼠各个肠段(十二指肠、空肠、回肠和结肠)对Sal Flux显著增加(P<0.01)。而随着Sal的浓度增加时,各肠段组内的Papp差异无显著性(P>0.05)。不同浓度下十二指肠、空肠、回肠和结肠总的Papp(Total)分别为(6.30±1.86)×10-6cm/s、(7.26±2.09)×10-6cm/s、(6.17±2.11)×10-6cm/s和(6.67±1.46)×10-6cm/s,组间差异无显著性(P>0.05)。结果表明,Sal在大鼠全肠段均有吸收,无明显的吸收窗,且Sal的肠吸收具有浓度依赖性,以被动吸收为主。结果见表1、表2。
表1 不同浓度Sal于大鼠各肠段的Flux(±s)Tab.1 Flux of Sal for different concentration in isolated different mesentery segments(±s)
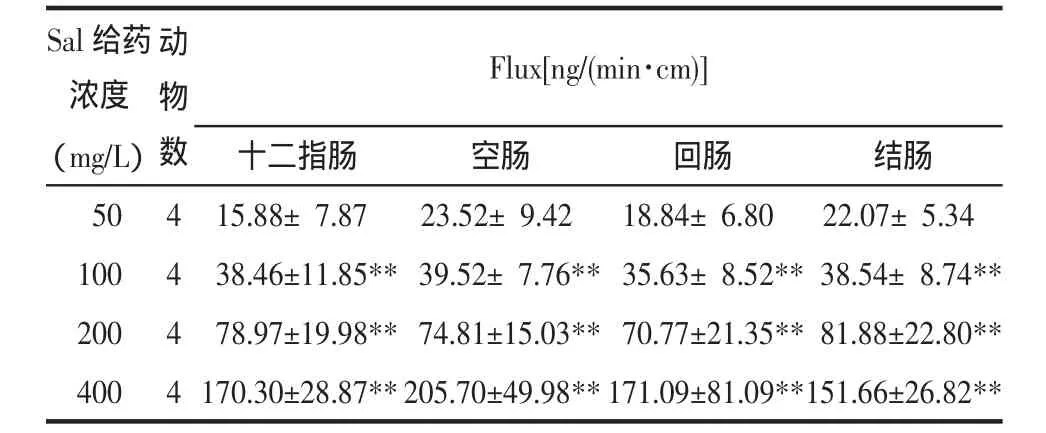
表1 不同浓度Sal于大鼠各肠段的Flux(±s)Tab.1 Flux of Sal for different concentration in isolated different mesentery segments(±s)
注:与Sal给药50 mg/L组比较,**P<0.01。
Sal给药浓度(mg/L)050 100 200 400动物数4 4 4 4 Flux[ng/(min·cm)]十二指肠空肠回肠结肠15.88±7.8723.52±9.4218.84±6.8022.07±5.34 38.46±11.85**39.52±7.76**35.63±8.52**38.54±8.74** 78.97±19.98**74.81±15.03**70.77±21.35**81.88±22.80** 170.30±28.87**205.70±49.98**171.09±81.09**151.66±26.82**
表2 不同浓度Sal在大鼠各肠段的Papp(±s)Tab.2 Pappof Sal for different concentration in isolated different mesentery segments(±s)
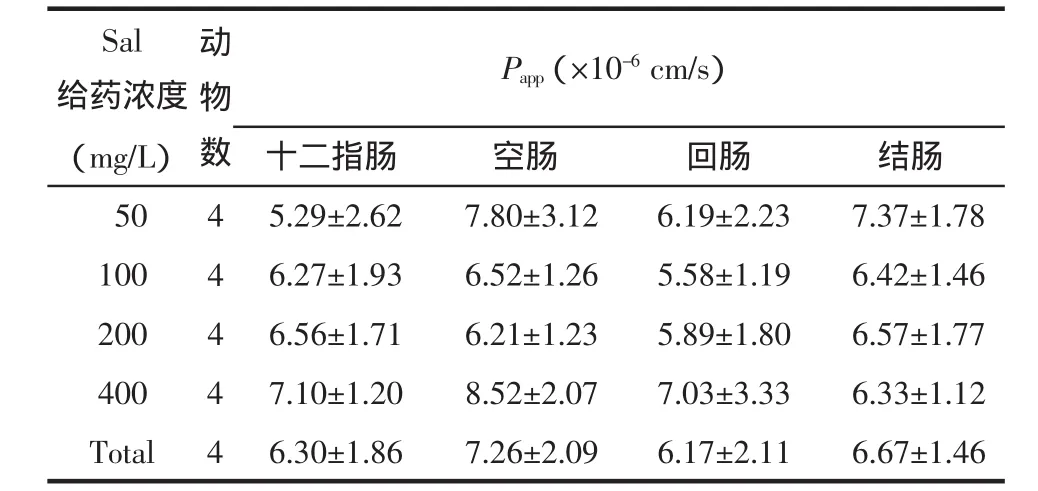
表2 不同浓度Sal在大鼠各肠段的Papp(±s)Tab.2 Pappof Sal for different concentration in isolated different mesentery segments(±s)
注:不同浓度下,不同肠段之间相互比较,P>0.05。
Sal给药浓度(mg/L)050 100 200动物数4 4 4 Papp(×10-6cm/s)十二指肠空肠回肠结肠5.29±2.627.80±3.126.19±2.237.37±1.78 6.27±1.936.52±1.265.58±1.196.42±1.46 6.56±1.716.21±1.235.89±1.806.57±1.77 4004 Total46.30±1.867.26±2.096.17±2.116.67±1.46 7.10±1.208.52±2.077.03±3.336.33±1.12
2.5.3Ver对Sal肠黏膜的透过影响Ver常被用作P-糖蛋白抑制剂来研究口服药物的转运机制[6,9-10]。本实验分别以100、200 mg/L Sal给药50 mg/L两个给药浓度作为对照,考察Ver对Sal大鼠肠黏膜吸收的影响[4]。由表3结果可知,100 mg/L Ver对100、200 mg/L Sal在大鼠各肠段吸收并无显著促进作用(P>0.05)。本实验研究结果表明,大鼠离体肠黏膜对Sal的吸收可能没有P-糖蛋白的参与。
表3 Ver对Sal大鼠肠黏膜Papp的影响(±s)Tab.3 Effects of Ver on Pappof Sal in isolated different mesentery segments(±s)

表3 Ver对Sal大鼠肠黏膜Papp的影响(±s)Tab.3 Effects of Ver on Pappof Sal in isolated different mesentery segments(±s)
组别对照(100 mg/L Sal) 100 mg/L Sal-100 mg/L Ver对照(200 mg/L Sal)动物数4 4 4 Papp(×10-6cm/s)十二指肠空肠回肠结肠6.27±1.936.52±1.265.58±1.196.42±1.46 8.08±2.195.81±0.866.78±2.397.80±3.04 6.56±1.716.21±1.235.89±1.806.57±1.77 200 mg/L Sal-100 mg/L Ver 46.96±4.154.47±1.157.73±2.518.46±1.88
2.5.4SDS对Sal肠黏膜的透过影响SDS是一种阴离子表面活性剂,属于比较安全的口服吸收促进剂,打开紧密连接而促进药物的吸收是其促渗的作用机制之一[11]。本实验以100 mg/L Sal作为对照,考察不同浓度的SDS(浓度分别为0.5、1、2 g/L)对Sal的大鼠肠黏膜透过性影响。在十二指肠和空肠中,加入一定浓度的SDS,其Papp无显著增加。在回肠中,随着加入SDS浓度的升高,Papp显著增加,当SDS浓度为2 g/L时,其Papp增加至15.42×10-6cm/s(P<0.01),为对照组的2.76倍。在结肠中加入一定浓度的SDS,Papp也显著增加(P<0.05)。结果表明,一定浓度的SDS能够显著促进Sal在回肠和结肠的吸收。见表4。
表4 SDS对Sal大鼠肠黏膜Papp的影响(±s)Tab.4 Effects of SDS on Pappof Sal in isolated different mesentery segments(±s)

表4 SDS对Sal大鼠肠黏膜Papp的影响(±s)Tab.4 Effects of SDS on Pappof Sal in isolated different mesentery segments(±s)
注:与对照组比较,*P<0.05,**P<0.01。
组别动物对照(100 mg/L Sal) 100 mg/L Sal-0.5 g/L SDS 100 mg/L Sal-1 g/L SDS数4 4 4 Papp(×10-6cm/s)十二指肠空肠回肠结肠6.27±1.936.52±1.265.58±1.196.42±1.46 5.01±0.47 5.03±1.607.44±1.4110.00±0.72* 5.13±1.06 5.29±4.139.47±1.43*11.70±2.10* 100 mg/L Sal-2 g/L SDS45.10±1.02 7.95±2.71 15.42±4.82**10.00±2.27*
3 讨论
3.1肠黏膜电生理及活性研究Ussing Chamber技术被国外学者誉为肠道屏障功能研究的金标准,常用于肠通透性、转运机制及保护肠道屏障功能机制等方面的研究[12],在实验过程中,通过监测肠黏膜跨膜电阻来检测或者评价组织完整性以及反映其活性[13-14]。在Ungell等[15]利用Ussing Chamber技术的研究中,要求大鼠小肠组织的跨膜电阻不得小于70 Ω/cm2。本实验在180 min内监测到各肠段黏膜跨膜电阻始终在一定范围内波动,表明肠黏膜完整且活性状态良好[5]。而其他浓度的Sal(50、200、400 mg/L)以及加入Ver、SDS后,对肠黏膜的电阻值并无影响,各肠段的电阻值(数据未列出)均在正常范围内波动。在数据处理过程中,以跨膜电阻作为参考指标,将电阻值超出范围的肠黏膜对应的相关参数不纳入数据统计,保证了实验结果更为真实可靠。
3.2不同浓度Sal肠黏膜透过情况本实验结果可知,各肠段对Sal均有吸收且吸收程度相当,Sal在大鼠肠黏膜中转运具有浓度依赖性,主要以被动转运为主。Watanabe等[16]以Ussing Chamber技术研究发现,当Papp>2.5×10-5cm/s时,可以认为药物容易被人体吸收。Sal极性较大,亲水性强,属于溶解性好的药物,在本实验中发现Sal于大鼠肠黏膜的累积百分透过率不足1%(数据未列出),按照口服药物的生物药剂学分类系统分类,Sal属于高溶解性、低渗透性的Ⅲ类药物,而按照定量生物药剂学分类系统(QBCS)分类,由表2结果中各肠段的Papp(Total)可知,红景天苷属于边界药物(0.5<q<1,2×10-6<Papp<10-5,其中q为剂量数的倒数),对于该范围内的药物,对其吸收程度与剂量数和渗透性的相关性难以作出肯定的预测[17],仍需要广泛而深入的研究和探讨。
3.3Sal肠黏膜转运机制研究口服药物穿透小肠细胞的途径主要是细胞内途径和细胞间途径,药物经细胞内途径转运的机制包括被动扩散、外排泵参与的被动扩散和载体参与的主动转运3种;大多数难以通过细胞间途径穿过生物膜的药物主要通过细胞间途径(与紧密连接相关)并以被动扩散的方式透过细胞膜,膜渗透性差的亲水性或水溶性药物的吸收及促进主要与细胞间的紧密连接相关[17]。Ver是经典的P-糖蛋白抑制剂,而本实验发现100 mg/L Ver对100、200 mg/L Sal在大鼠各肠段吸收并无促进作用,表明Sal的大鼠肠吸收并没有P-糖蛋的参与,这与李科宇[4]以Caco-2模型研究Sal透过机制的结果并不一致,这可能与选择不同的评价模型有关,相关问题还需深入研究。
SDS作为一种较安全的口服吸收促进剂,有学者以Caco-2模型证明了SDS可以打开紧密连接[11]从而促进药物的吸收。根据本实验结果,在十二指肠和空肠中,0.5、1、2 g/L SDS对Sal的吸收并无促进作用;而0.5、1、2 g/L SDS能够显著增加大鼠回肠和结肠对Sal的吸收,这可能与SDS打开了回肠和结肠上皮细胞间的紧密连接有关。当然,对于口服药物在胃肠道中的转运是一个相当复杂的过程,并不仅仅受单方面因素的影响,而是多方因素共同作用的结果。
总的来说,以Ussing Chamber技术在口服药物肠通透性和转运机制研究中,应用于难溶解性、低渗透性模型药物较多[15-16,18],并且适用性较强,但是对于易溶解性、低渗透性模型药物的研究、尤其是对于转运机制方面研究相对较少,其适用性还需深入研究。
[1]张雪松,李英.红景天苷现代药理作用概述[J].中国中西医结合肾病杂志,2014,3(15):262-264.
[2]林俊芝,邹亮,傅超美,等.红景天苷和酪醇油水分配系数的测定及大鼠小肠吸收动力学研究[J].中成药,2013,3(3):483-486.
[3]韦志坤,程爱国.肠黏膜细胞的紧密连接与肠壁通透性的研究进展[J].世界华人消化杂志,2011,19(4):394-399.
[4]李科宇.在大鼠体内红景天苷吸收、代谢及排泄过程的考察[D].吉林:延边大学,2010.
[5]Lane LC.A guide to Ussing chamber studies of mouse intestine[J]. Am J Physiol Gastrointest Liver Physiol,2009,296(6):1151-1166.
[6]黄海英.基于P-GP转运体研究复方马蹄香抗焦虑胶囊主要成分的吸收机制[D].北京:北京中医药大学,2015.
[7]HongyuL,DavidNS,MartinJH.Transepithelialelectrical measurements with the Ussing Chamber[J].J Cyst Fibros,2004,3(2): 123-126.
[8]黎国富,杨劲,华小懿,等.Ussing Chamber模型研究甘草酸二铵经大鼠肠黏膜的转运和代谢[J].中国中医药杂志,2010,35(17): 2261-2266.
[9]段炼.辣椒素的肠道转运特性与TRPV1通道及多药耐药蛋白间的关系[D].广州:南方医科大学,2013.
[10]沙先谊.9-硝基喜树碱小肠吸收机制及其自微乳化给药系统的研究[D].上海:复旦大学,2005.
[11]Lecuyse EL,Sutton SC.In vitro models for selection of development candidate.Permeability studies to define mechanisms of absorption enhancement[J].Adv Drug Deliv Rev,1997,23(1-3):163-183.
[12]Guo N,Hu ZW,Fan XX,et al.Simultaneous determination of salidroside and its aglycone metabolite p-tyrosol in rat plasma by liquid chromatography-tandem mass spectrometry[J].Molecules, 2012,17(4):4733-4754.
[13]杨振,秦环龙.Ussing Chamber在肠道屏障功能研究中的进展[J].肠外与肠内营养,2006,13(4):233-236.
[14]刘晓雷,张莉,顾星,等.Ussing chamber技术在药物肠吸收方面的应用进展[J].中国新药杂志,2015,24(6):644-648.
[15]Ungell AL,Nylanders U,Gonschior AK,et al.Membrane transport of drugs in different regions of the intestinal tract of the rat[J]. J Pharm Sci,1998,87(3):360-366.
[16]Watanabe E,Takahashi M,Hayashi M.A possibility to predict the absorbability of poorly water-soluble drugs in humans based on rat intestinal permeability assessed by an in vitro chamber method[J]. Eur J Pharm Biopharm,2004,58(3):659-665.
[17]平其能.中药成分的胃肠道转运与剂型设计[M].北京:化学工业出版社,2010.
[18]赵博欣,孙亚彬,段炼.应用Ussing Chamber技术评价芹菜素与柚皮素经大鼠肠黏膜透过特征[J].中国药学杂志,2011,46(20): 1581-1586.
(本文编辑:高杉,滕晓东)
Study on permeabilities of Salidroside via rat mesentery mucosa by using Ussing Chamber
GU Xing1,2,YAO Shao-zi1,2,PI Jia-xin1,2,LIU Bo-ying1,2,HAN Xu1,2,LIU Zhi-dong1,2
(1.Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique,Ministry of Education,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin State Key Laboratory of Modern Chinese Medicine-Province and Ministry Co-established State Key Laboratory Cultivation Base,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To investigate the permeability of salidroside in mesentery mucosa of rat ex vivo.[Methods]The Ussing Chamber was employed to investigate the ex vivo permeability in rat mesentery mucosa of salidroside with different concentrations or with the addition of verapamil and SDS.[Results]It was found that the Flux of salidroside was increased with the increasing concentration,and there was no difference(P<0.05)in the apparent permeability coefficient(Papp)in different mesentery segments of rat.The Pappof salidroside got significantly increased in ileum and colon(P<0.01 or P<0.05),and reached to 2.76-fold compared with the control in ileum,when a certain amount of SDS was added in the donator side.[Conclusion]Salidroside could be slightly absorbed in all mesentery segments of rat with a passive concentration-dependent transportation.There were no effects of verapamil on permeation of salidroside,and SDS could significantly increase salidroside permeation in ileum and colon of rat.
salidroside;Ussing Chamber;P-gp;tight junction;verapamil;SDS
R285.5
A
1672-1519(2016)11-0689-05
新世纪优秀人才支持计划(NCET-12-1068)。
顾星(1988-),男,硕士研究生,主要从事中药制剂研究。
刘志东,E-mail:lonerliuzd@163.com。
(2016-04-25)
10.11656/j.issn.1672-1519.2016.11.15

