地西他滨联合半量CAG方案治疗老年急性髓系白血病的临床疗效
张红霞 吴广胜 王 燕
(石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832000)
地西他滨联合半量CAG方案治疗老年急性髓系白血病的临床疗效
张红霞 吴广胜 王 燕
(石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832000)
目的 探讨去甲基化药物地西他滨联合半量CAG方案与单用CAG方案治疗老年急性髓系白血病(AML)的临床疗效及安全性。方法 40例老年AML患者按用药方法不同分为对照组和观察组,各20例。对照组单用传统的CAG方案治疗,观察组采用地西他滨联合半量CAG方案治疗。观察两组治疗效果及不良反应情况。结果 观察组患者1个疗程后完全缓解9例(45%),9例部分缓解,2例完全无效,总有效率90%,中位无病生存时间和中位总生存分别为12个月和19个月;骨髓抑制15例,肺部感染8例。对照组治疗后完全缓解7例(35%),部分缓解6例,无效7例,总有效率65%,中位无病生存时间和中位总生存分别为6个月和13个月;骨髓抑制18例,肺部感染12例,肠道感染2例,败血症2例,1例死于脑出血,1例死于多脏器衰竭。观察组的总有效率、生存情况及不良反应均优于对照组(P<0.05)。结论 地西他滨联合半量CAG方案治疗老年AML有较好的治疗效果,不增加治疗风险。
急性髓系白血病;地西他滨;CAG方案;临床疗效
急性髓系白血病(AML)是造血系统的恶性克隆性疾病。与年轻的AML患者相比,老年AML患者化疗完全缓解率低、早期死亡率高、长期生存率低、预后差,缺乏普遍适用的标准治疗方案。地西他滨用于老年AML具有一定的疗效,对于伴有高危核型的AML患者具有相同的反应率,部分患者可达到完全细胞遗传学缓解,而单用疗效有限〔1〕。因此有必要探索地西他滨与传统化疗的联合应用,在不增加化疗相关死亡风险的前提下,发挥协同作用,提高疗效。本研究对比观察传统CAG方案和地西他滨联合半量CAG方案治疗老年AML患者的疗效和安全性。
1 资料与方法
1.1 一般资料 选择2013年6月至2015年6月在我院血液科住院的40例AML患者。入选标准:①所有患者均经细胞形态学、免疫学、细胞遗传学和分子生物学确诊〔2〕;②年龄>60岁。根据患者及家属意愿分为观察组和对照组,各20例。两组患者的年龄、性别等一般资料具有可比性。见表1。
1.2 治疗方案 观察组患者采用地西他滨联合半量(CAG)方案:地西他滨 15 mg/m2,静脉滴注,每天1次,维持静点3 h以上,第1~5天;阿柔比星10 mg,静脉注射,每天1次,第3~6天;阿糖胞苷10 mg/m2,皮下注射,每12 h 1次,第3~9天;粒细胞集落刺激因子(G-CSF)200 μg/m2,皮下注射,第0~9天(WBC>20×109/L时暂停G-CSF治疗,若白细胞回落继续使用)。对照组采用传统CAG方案:阿柔比星20 mg,静脉注射,每天1次,第1~4天;阿糖胞苷20 mg/m2,皮下注射,每12 h 1次,第1~14天;G-CSF 200 μg/m2,皮下注射,第0~14天。两组均治疗2个疗程,观察效果。
1.3 疗效判定 参照《血液病诊断及疗效标准》(第3版)〔3〕判定AML的疗效,分为完全缓解(CR)、部分缓解(PR)及未缓解(NR):①CR:白血病症状及体征消失,外周血中性粒细胞绝对值≥1.5×109/L,血小板≥100×109/L,白细胞分类中无白血病细胞,骨髓中原始粒Ⅰ型+Ⅱ型单(原单+幼单)≤5%,无Auer小体,红细胞及巨核细胞系列正常,无髓外浸润。②PR:临床症状和血常规有一项未达CR,骨髓象原粒细胞Ⅰ型+Ⅱ型(原单+幼单)>5%而≤20%。③NR:临床症状、血常规及骨髓象均未达以上标准。总有效率(OR)=(CR+PR)/总例数×100%。
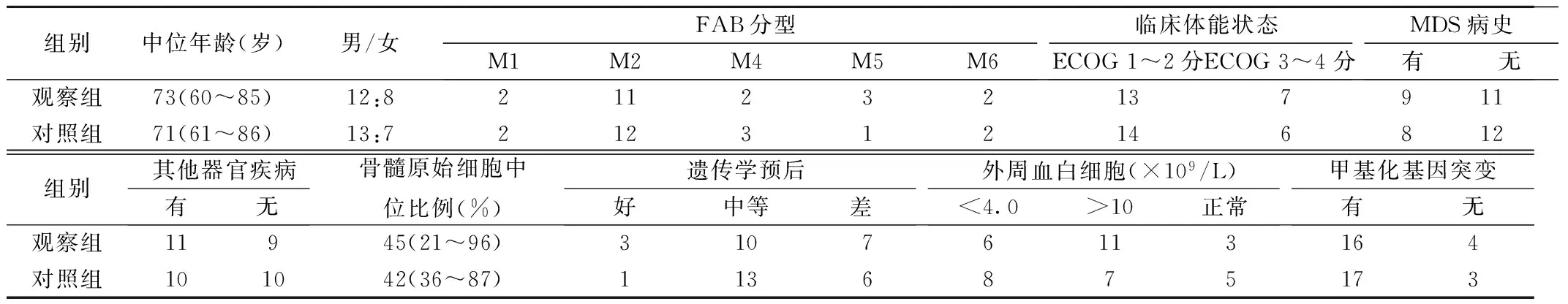
表1 两组患者的基本资料(n=20)
1.4 随访 所有患者随访至2015年11月13日,随访时间为3~28个月,中位随访时间19个月,主要通过门诊随访、电话随访,部分随访资料来源于住院病历。生存期按确诊至死亡时间或者确诊至2015年11月13日计算。
1.5 统计学方法 应用SPSS17.0软件,计数资料使用χ2检验,生存分析采用Kaplan-Meier生存分析法。
2 结 果
2.1 两组治疗效果比较 观察组患者1个疗程后CR 9例,PR 9例,NR 2例,临床总有效18例(90.0%);其中7例复杂核型患者治疗后3例达CR,9例CR中包括了3例高危者;NR者,1例为中间染色体核型,1例为复杂染色体核型。对照组患者1个疗程后,CR 7例,PR 6例,NR 7例,临床总有效13例(65.0%);其中6例复杂核型患者治疗后1例达CR,2例达PR,3例无效;7例CR中包括了1例高危者;NR者中2例为中间染色体核型,1例为良好染色体核型。提示治疗有效率与预后分层直接相关。观察组的总有效率显著高于对照组(P<0.05)。骨髓增生异常综合征(MDS)相关者、甲基化基因突变者应用地西他滨联合化疗2个疗程后的CR及总有效率均显著高于非MDS相关者(P<0.05)。见表2。
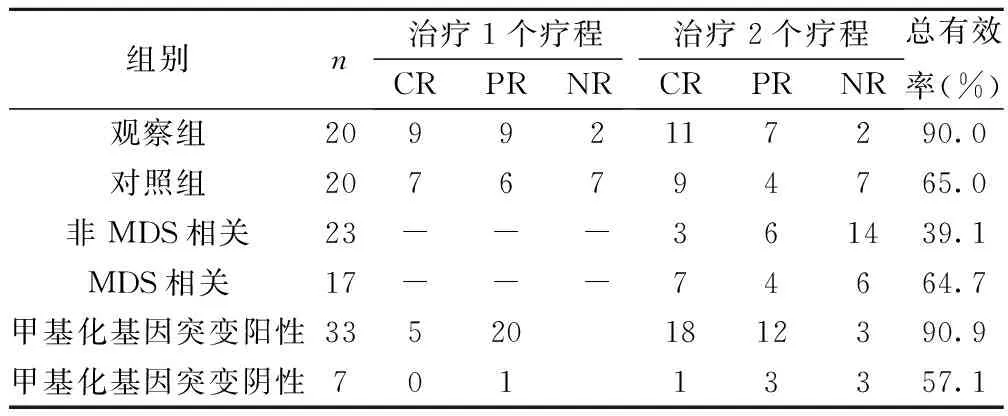
表2 两组治疗效果比较(n)
2.2 生存情况分析 观察组无病生存时间0~27个月,总生存时间3~28个月,中位无病生存时间和中位总生存分别为12个月和19个月。对照组无病生存时间0~18个月,总生存时间3~31个月,中位无病生存时间和中位总生存分别为6个月和13个月,观察组中位无病生存时间和中位总生存均显著长与对照组(P<0.05)。
2.3 不良反应 两组不良反应主要为粒细胞缺乏、肺部感染、发热、血小板减少、胃肠道反应、肝功能损害。观察组出现骨髓抑制15例、合并肺部感染8例,骨髓抑制持续中位时间为10(8~28)d,高峰多出现在治疗后7~14 d;对照组出现骨髓抑制18例、合并肺部感染12例、肠道感染2例、败血症2例,骨髓抑制持续中位时间为18(7~31)d,高峰多出现在治疗后5~14 d,对照组的严重不良事件发生率高于治疗组(P<0.05)。
3 讨 论
AML是老年人最常见的急性白血病类型,临床发病率随年龄增加而上升。老年AML多存在预后不良因素,脏器功能减退,部分患者合并慢性疾病,因此疗效较差。研究显示老年患者3年的生存率只有9%~10%。传统的CAG方案治疗老年AML患者取得了较好的效果,但安全性及治疗早期相关死亡率仍未获得满意的效果,迫切需要探索疗效确切且耐受性好的适合于老年AML患者的化疗方案。
国内外研究发现,染色体缺失与异常DAN甲基化共同引起抑癌基因的沉默,基因高甲基化是AML患者致病及预后不良的因素之一〔4,5〕。近年来,美国国立综合癌症网络(NCCN)、欧洲肿瘤内科学会和欧洲白血病网推荐对老年AML使用去甲基化药物治疗。目前去甲基化药物主要以地西他滨和阿扎胞苷为代表,作用机制为高剂量的细胞毒性作用和低剂量的诱导DNA去甲基化,在诱导去甲基化作用上,地西他滨经磷酸化结合DNA后能与DNA甲基转移酶(DMMT)共价结合,并抑制其活性,使甲基不能转移到胞嘧啶上,随着细胞的分裂逐渐降低DNA甲基化,避免细胞的单克隆无限增殖,使细胞恢复正常终末分化,衰老凋亡、地西他滨广泛用于AML、MDS等的治疗,取得一定成效〔6〕。Kantarjian等〔7〕报道单用地西他滨治疗急性非淋巴细胞白血病,治疗时不同剂量地西他滨其CR率不同,其中20 mg·m-2·d-1静脉输注(1 h以上),5 d为1个疗程,可最大限度地诱导去甲基化,获得最高CR,毒副作用也相对较小。Fang等〔8〕对15例AML患者单独使用地西他滨治疗,具体方案地西他滨每日20 mg/m2,静脉滴注时间>1 h,第1~5天,观察发现复杂染色体核型异常、复发难治性AML患者均可提高治疗有效率,从地西他滨治疗中获益。
本研究20例患者经地西他滨联合CAG方案治疗,CR率较传统方案高。尤其对于MDS转化的白血病、不良核型、甲基化基因突变阳性的患者有更高的缓解率,并能延长患者总生存期。患者的耐受性较好,各年龄阶段患者均可以承受,地西他滨联合半量CAG方案主要毒副作用为Ⅲ°~Ⅳ°的骨髓抑制,80%的感染性发热,中性粒细胞(ANC)、血小板(BPC)恢复时间分别为25、16 d,血细胞恢复时间较常规诱导治疗方案较快,无感染性死亡病例,非血液学不良反应不明显,所有患者未发现明显的肝肾、心脏、神经系统的不良反应。说明地西他滨联合半量CAG方案治疗老年AML安全有效。
1 Buckley SA,Walter RB.Antigen-specific immunotherapies for acute myeloid leukemia〔J〕.Hematology Am Soc Hematol Educ Program,2015;2015(1):584-95.
2 O' Donnell MR,Abboud CN,Altman JK,etal.The NCCN clinical practice guidelines in oncology(NCCN Guidelines TM)acute myeloid leukemia〔EB/OL〕.(2012-5-25).
3 张之南,申 悌.血液病诊断及疗效标准〔M〕.第3版.北京:科学出版社,2007:106.
4 Shaikh MS,Adil SN,Shaikh MU,etal.Frequency of chromosomal abnormalities in Pakistani adults with acute lymphoblastic leukemia〔J〕.Asian Pac J Cancer Prev,2014;15(21):9495-8.
5 田 慧.甲基化转移酶抑制剂治疗急性髓系白血病的研究进展〔J〕.国际输血及血液学杂志,2012;35(3):215-8.
6 周 冰,马梁明,梁立新.地西他滨在恶性血液肿瘤治疗中的应用〔J〕.肿瘤研究与临床,2013;25(2):136-8.
7 Kantarjian HM,Thomas XG,Dmozynska A,etal.Multicenter,randomized,open-label,phase Ⅲ trial of decitabine versus patient choice,with physician advice,of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia〔J〕.J Clin Oncol,2012;30(21):2670-7.
8 Fang BZ,He GS,Wu DP,etal.Clinical observation of decitabine treatment for patients with acute myeloid leukemia〔J〕.Tumor,2011;31(11):1022-5.
〔2015-12-17修回〕
(编辑 袁左鸣)
吴广胜(1980-),男,硕士,教授,主任医师,主要从事血液病方面的研究。
张红霞(1980-),女,硕士,主治医师,主要从事血液病方面的研究。
R55
A
1005-9202(2016)20-5058-03;
10.3969/j.issn.1005-9202.2016.20.056

