皮肤基底细胞癌及鳞状细胞癌组织中分化抑制因子-1、血管内皮生长因子、凝血酶敏感蛋白-1、微血管密度表达状况及意义
闫铁夫 何晓楠 孙 健 王莉丽 付玉萍
(辽宁医学院附属第一医院皮肤科,辽宁 锦州 121000)
皮肤基底细胞癌及鳞状细胞癌组织中分化抑制因子-1、血管内皮生长因子、凝血酶敏感蛋白-1、微血管密度表达状况及意义
闫铁夫 何晓楠 孙 健 王莉丽 付玉萍
(辽宁医学院附属第一医院皮肤科,辽宁 锦州 121000)
目的 探讨皮肤基底细胞癌(BCC)及鳞状细胞癌(SCC)组织中分化抑制因子(ID)-1、血管内皮生长因子(VEGF)、凝血酶敏感蛋白(Tsp)-1及微血管密度(MVD)表达状况及其临床意义。方法 SCC及BCC患者各30例,取患者病理组织标本,另选取24例正常皮肤组织样本作为对照组。应用免疫组化法测定各组织标本中ID-1,VEGF,Tsp-1和微血管标记抗体CD34的表达水平,计数肿瘤MVD;采用RT-PCR方法检测ID-1、Tsp-1、VEGF mRNA表达情况;应用Western印迹方法检查ID-1、Tsp-1、VEGF蛋白水平。结果 SCC组、BCC组及对照组MVD值及ID-1、VEGF、Tsp-1阳性表达率比较差异显著(P<0.05),两两比较,SCC组、BCC组与对照组比较均有统计学差异(P<0.05),且A组、B组间MVD值存在统计学差异(P<0.05)。三组ID-1、VEGF及Tsp-1 mRNA及蛋白表达水平均有显著差异(P<0.05),两两组间比较也均有显著差异(P<0.05)。结论 皮肤SCC、BCC的发病与ID-1、VEGF、Tsp-1和MVD密切相关,其中ID-1与VEGF存在协同关系,能够促进肿瘤组织内血管生成,在皮肤SCC中表现更明显。
ID-1;VEGF;Tsp-1;MVD;皮肤鳞状细胞癌;基底细胞癌
临床上非黑素性皮肤癌(NMSC)主要分为皮肤鳞状细胞癌(SCC)与基底细胞癌(BCC)〔1〕。临床治疗的关键在于有效抑制肿瘤新生血管生成。机体旁分泌大量的血管内皮生长因子(VEGF)刺激局部肿瘤内皮细胞不断增殖,加速血管生成进程。有研究证实〔2〕,分化抑制因子-1,即DNA结合抑制因子(ID)-1在多种恶性肿瘤中出现高表达,具有促进肿瘤发展及加速肿瘤血管生成的作用〔3〕。机体中存在的另外一种抑制血管生成的因子是凝血酶敏感蛋白(Tsp)-1,通过抑制机体内皮细胞凋亡,进而抑制内皮细胞的增殖和迁移,从而产生抑制肿瘤血管生成的作用。CD34是一种与血管内皮细胞增殖相关的蛋白,主要通过传递内皮细胞间质内信号加速血管生成,常作为肿瘤微血管密度(MVD)标记物。本研究分析皮肤BCC和SCC组织中ID-1、VEGF、Tsp-1及MVD的表达状况及临床意义。
1 资料与方法
1.1 研究对象 选择2012年2月至2014年5月我院确诊的SCC及BCC患者各30例,诊断标准参考文献〔4〕。患者病理组织标本分别取自面部、头皮、会阴及四肢等位置。另选取正常皮肤组织样本24例作为对照组,样本来源主要是非肿瘤移植皮肤移植者、美容者等。
1.2 药物试剂 一抗主要是兔抗人ID-1、VEGF、Tsp-1,CD34多克隆抗体、小鼠抗人β-actin多克隆抗体〔5〕;二抗选择辣根、碱性磷酸酯酶标记的山羊抗兔、山羊抗小鼠多克隆抗体。主要药剂选择甲醛、甘氨酸、Western印迹电泳缓冲液、SDS、转膜液、Tris-base、洗涤液、封闭液、洗涤液、RIPA蛋白裂解液、聚偏氟乙烯(PVDF)膜、蛋白Marker、甲苯磺酰氟(PMSF)、5×上样缓冲液、考马斯亮蓝染色液、丽春红染液、二辛可宁酸(BCA)蛋白浓度检测试剂盒、定影液和显色液等。引物序列:ID-1正链5'-CAAGTGGCCAGAGGCATGCACTT-3',负链5'-GATGTAGTCTTTACCATCCTGTTG-3';Tsp-1正链5'-AACCGCATTCCAGAGTCTGG-3',负链5'-TTCACCACGTTGTTGTCAAGGGT-3';VEGF正链5'-GAAGTGGTGAAGTTCATGGATGTC-3',负链5'-CGATCGTTCTGTATCACTCTTTCC-3'。
1.3 免疫组化 所有组织蜡块样本处理采用包埋、切片、脱蜡及抗原修复。一抗兔抗人CD34采用磷酸盐缓冲液(PBS)1∶50条件下稀释,空白对照选择PBS代替一抗。二抗是羊抗兔IgG-辣根过氧化物酶(HRP)1∶200条件下稀释,后采用二氨基联苯胺(DAB)显色,树胶封片后备用。ID-1,VEGF,Tsp-1表达阳性标准是胞质、胞膜内存在棕黄色颗粒。MVD水平检测采用Weidner微血管计数方法,将样本切片放置于40倍显微镜下,随后确定染色最高血管密度位置,显微镜观察指标转换为200倍,选择3个最高血管密度区计数微血管数目,MVD值即为微血管数目的平均值〔6〕。
1.4 RT-PCR检测ID-1,Tsp-1和VEGF mRNA在肿瘤组织中的表达情况 选择新鲜冰冻组织标本为样本,首先提取总RNA和扩增RT-PCR。95℃预变性10 min;94℃变性1 min,60℃退火1 min,72℃延伸2 min,连续进行30个循环;再72℃延伸8 min。在琼脂糖凝胶中将获得的PCR产物进行电泳、分离,采用紫外分析仪观察结果并拍摄。采用Lab Works凝胶成像分析系统测定阳性电泳条带平均灰度值,并计算各样本基因与β-actin电泳条带平均灰度值的比值〔7〕。
1.5 Western印迹免疫印迹法检测ID-1,Tsp-1和VEGF蛋白水平 采用预冷过的PBS洗涤新鲜冰冻组织样本3次,随后将其加入裂解液400 μl中,将裂解细胞冻存30 min,4℃ 14 000 r/mim离心5 min,分离得到上清液并测定蛋白质浓度;进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)、转膜,在室温下使用含5%胎牛血清(BSA)的Tris盐酸缓冲液(TBST)封闭1 h,在4℃条件下加入ID-1、VEGF与β-actin抗体(1∶500),摇床过夜,随后加二抗,浓度调节为1∶1 000后进行杂交、洗膜、显色〔8〕。
1.6 统计学方法 应用SPSS18.0,计量数据多组数据比较采用单因素方差分析,组间比较采用SNK法;计数资料组间比较采用χ2检验,指标间的相关性采用Pearson相关分析。
2 结 果
2.1 各组MVD及ID-1、VEGF、Tsp-1阳性表达率比较 三组MVD值及ID-1、VEGF、Tsp-1阳性表达率比较差异显著(P<0.05);两两比较,SCC组、BCC组与对照组比较均有统计学差异(P<0.05),SCC组、BCC组间除MVD值存在统计学差异外(P<0.05),其他指标无统计学差异(P>0.05)。见表1。
2.2 各组 ID-1、VEGF及Tsp-1 mRNA及蛋白表达水平比较 三组ID-1、VEGF及Tsp-1 mRNA及蛋白表达水平比较差异显著(P<0.05);相对于对照组,SCC组、BCC组VEGF、ID-1 mRNA及蛋白表达水平明显提高,Tsp-1水平显著降低(P<0.05)。SCC组、BCC组比较,ID-1、VEGF、Tsp-1 mRNA及蛋白表达存在统计学差异(P<0.05)。见表2,表3。

表1 各组MVD及ID-1、VEGF、Tsp-1阳性表达率比较
与对照组比较:1)P<0.05;与BCC组比较:2)P<0.05;下表同
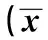
表2 各组ID-1、VEGF及Tsp-1 mRNA表达水平比较±s)

表3 各组 ID-1、VEGF及Tsp-1的蛋白表达水平比较
2.3 各指标间相关性分析 Tsp-1表达与ID-1表达、MVD值呈负相关(r=-0.635、-0.736,均P<0.05),ID-1表达与VEGF水平呈正相关(r=0.748,P<0.05)。
3 讨 论
BCC作为临床常见皮肤科疾病,其发病机制与基底细胞样细胞(即生发细胞)增生有关,表现为圆柱、小叶、条索状、缎带状,属于恶性皮肤肿瘤〔6〕;多出现在头面部,临床病理表现为肿瘤表面结节、丘疹,伴随糜烂和溃疡等,病程进展较慢。SCC主要源自表皮附属器角质形成细胞,主要在老年人群中多发,属于恶性肿瘤,发病部位多位于头皮、面部、手背等位置,病因复杂,确诊较困难。
ID蛋白属于螺旋-环-螺旋(HLH)反式作用因子,主要包括ID-1、ID-2、ID-3及ID-4,能够与碱性HLH蛋白(b HLH)产生作用,对蛋白分化转录产生抑制作用,从而进行分化抑制,因此又称作DNA结合抑制因子。相关研究证实〔7〕ID-1蛋白可以通过参与机体内多种信号通路,进而影响人类恶性肿瘤发生发展进程,有潜在癌蛋白属性,主要能够将细胞周期阻断、阻止细胞增殖,有学者称之为准原癌基因。本次研究结果显示,ID-1的异常升高与BCC、SCC的发生有关,与相关研究结论〔8〕相似。
肿瘤内血管生成情况与肿瘤的发生及转移、远期生存率等预后有关,而肿瘤血管生成状况主要采用MVD作为评估金标准。本次研究结果表明,MVD值与皮肤BCC、SCC的发生有关,且皮肤SCC存在显著新血管生成状况。肿瘤细胞原位生长需要依靠充足营养,可促进肿瘤组织内产生丰富血管组织,而肿瘤血管结构往往并不完全,肿瘤转移阻力最小,并且与外周血管相连,便于形成淋巴转移。这同时也是皮肤SCC相对于皮肤BCC,具有恶性度高、侵袭性强及易转移扩散等特点,导致肿瘤组织血液供应缺乏。
有研究提示〔9〕Tsp-1可以抑制内生性血管生成,其作用机制是加速肿瘤血管成熟,对化疗药物敏感性提高,降低肿瘤内部血管密度,并减少血流量,使肿瘤组织出现明显萎缩。本研究表明Tsp-1可能与抑制皮肤肿瘤有关,临床治疗方案可以选择激活Tsp-1,增加其表达水平,从而抑制肿瘤血管生成,最终达到抑制肿瘤发生、发展的作用。ID-1对皮肤SCC、BCC的发生发展具有重要作用,可能与肿瘤血管生成关系密切。ID-1促进血管生成机制〔10〕:ID-1能够在机体内发挥双向调节作用,ID-1表达水平增加,能够激活VEGF转录,从而促进肿瘤血管生成;反之则抑制VEGF转录活性;②ID-1能够有效抑制Tsp-1转录,从而对肿瘤新生血管生成进行有效调控。
综上所述,皮肤SCC、BCC的发病与ID-1、VEGF、Tsp-1和MVD密切相关,其中ID-1与VEGF存在协同关系,能够促进肿瘤组织内血管生成,同时与肿瘤细胞分化程度、MVD值具有相关性。因此,抑制ID-1表达、阻断VEGF活化,可能对皮肤SCC、BCC发生发展起到抑制作用。
1 Sathyakumar M,Sriram G,Saraswathi T,etal.Immunohistochemical evaluation of mast cells and vascular endothelial proliferation in oral precancerous lesion-leukoplakia〔J〕.J Oral Maxillofac Pathol,2012;16(3):343-8.
2 Prislei S,Mariani M,Raspaglio G,etal.RON and cisplatin resistance in ovarian cancer cell lines〔J〕.Oncol Res,2010;19(1):13-22.
3 董慧婷,张永红,杨 蕾,等.皮肤鳞状细胞癌300例临床及病理回顾分析〔J〕.中国皮肤性病学杂志,2011;25(4):275-7.
4 李轶楠,李东宁.ID-1,VEGF及Tsp-1在皮肤鳞状细胞癌和基底细胞癌组织中的表达〔J〕.中国皮肤性病学杂志,2013;27(8):767-71.
5 李海宁,丁永慧.宫颈鳞状上皮癌变过程中Id-1和p53的表达及其相关性研究〔J〕.宁夏医科大学学报,2015;37(9):1022-5.
6 赵 聪,杨 森,彭 为,等.TSP-1基因在口腔黏液表皮样癌中的表达与肿瘤分化的相关性〔J〕.西部医学,2015;27(11):1638-40,1643.
7 樊秀婷.弗林蛋白酶、转移抑制基因23和血管内皮生长因子在老年眼睑基底细胞癌中的表达及意义〔J〕.中国老年学杂志,2014;34(10):2665-7.
8 An X,Xu G,Yang L,etal.Expression of hypoxia-inducible factor-1α,vascular endothelial growth factor and prolyl hydroxylase domain protein 2 in cutaneous squamous cell carcinoma and precursor lesions and their relationship with histological stages and clinical features〔J〕.J Dermatol,2014;41(1):76-83.
9 刘 瑶,王逸飞,张春敏,等.Id-1mRNA在人皮肤鳞状细胞癌A431细胞中的表达〔J〕.中国麻风皮肤病杂志,2013;29(4):239-42.
10 Luo Y,Zhang X,Tan Z,etal.Astrocyte elevated gene-1 as a novel clinicopathological and prognostic biomarker for gastrointestinal cancers:a meta-analysis with 2999 patients〔J〕.PLoS One,2015;10(12):e0145659.
〔2015-12-17修回〕
(编辑 袁左鸣)
闫铁夫(1972-),男,副主任医师,主要从事皮肤与性病方面的研究。
R73
A
1005-9202(2016)20-5051-03;
10.3969/j.issn.1005-9202.2016.20.052

