一株牛副流感病毒3型的分离鉴定
张忠玉(山东省安丘市兴安畜牧兽医管理站 262100)
一株牛副流感病毒3型的分离鉴定
张忠玉(山东省安丘市兴安畜牧兽医管理站 262100)
牛副流感病毒3型是引起牛呼吸道疾病的主要病原之一。本研究从河南省某牛场具有急性呼吸道症状的牛鼻腔棉拭子中,应用牛肾脏细胞MDBK进行病毒分离,分离的病毒能吸附并凝聚豚鼠红细胞,血凝效价为1:32。对病毒进行提取RNA,反转录后PCR扩增HN基因,测序结果显示,分离病毒序列为牛副流感病毒3型。
牛副流感病毒3型;分离;鉴定;RT-PCR
牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)属于单股负链RNA病毒,该病毒为副黏病毒科副黏病毒亚科呼吸道病毒属[1]。近年来,奶牛呼吸道疾病引起的肺炎病例越来越多,主要原因是牛副流感病毒3型混合细菌感染以及支原体感染是引起[2-6]。血清流行病学调查显示,我国BPIV3总体阳性率为77.6%[7]。朱远茂等证实我国BPIV3流行2个基因型,即基因C型和A型[8]。本研究从表现呼吸道症状的牛鼻拭子中分离一株牛副流感病毒3型,并对其进行了鉴定。
1 材料与方法
1.1 细胞和培养基
牛肾细胞(MDBK)由本实验室保存,DMEM培养基和胎牛血清均为Gibco公司产品。MDBK细胞用含10%胎牛血清的DMEM培养液培养,用含EDTA的胰酶消化细胞后,置于含5%CO2培养箱37°C下培养。
1.2 病料的细胞接种
将采集牛鼻腔深部鼻液的鼻拭子用300μL灭菌PBS浸泡,3000rpm/min离心5min后,吸取上清液,用0.22μm的滤膜过滤除菌后接种MDBK细胞,37°C孵育1h后用PBS洗细胞,换成1%血清的DMEM。反复冻融3次后,接下一代,盲传3~5代直至出现CPE。
1.3 主要试剂
RNA提取试剂盒购自杭州博日公司,PrimeScript反转录酶、RNA酶抑制剂、LA Taq DNA聚合酶和DNA Maker等均购自TaKaRa公司(大连)引物由Invitrogen有限公司(北京)合成。
1.4 病毒滴定(TCID50) 测定
将分离毒株的第7代细胞毒进行滴定,测定毒价。方法为:将病毒液用不含血清的DMEM培养基按10-1~10-8系列稀释,每个稀释度做8个重复,每孔接种100μL,每孔加100μLMDBK细胞在CO2培养箱中培养。5~7d后根据CPE判定结果。
1.5 RT-PCR鉴定
根据发表的BPIV3的HN基因[8,9],利用Oligo7设计引物, HNF(5'TGGCTGTATTAGAATCCCATC 3')和 HNR(5'ATAGTACATTATGCCAAGTCC 3'),目的片段大小为803bp。按照说明提取RNA,进行反转录。40μL反转录体系:RNA模板 25μL, Buffer8μL, 反转录引物 2μL, 2.5mMdNTP4μL,HPRI RNA 酶抑制剂 1μL, 25°C 作用 15min, 42°C 反应 1h。PCR反应:PCR反应于100μL体系中进行:ddH2O70μL,LATaq buffer10μL, dNTP(2.5mmol/L)6μL, 上、 下游引物各4μL, 模板 DNA5μL,, 后加 LA-Taq1μL。 反应条件: 94°C5min; 94°C45s, 50°C40s, 72°C50s, 30 个 循 环 ; 72°C10min。取PCR产物5μL于0.8%琼脂糖凝胶电泳15min,观察并照相。将PCR产物连直接送往Invitrogen公司(北京)进行测序,应用DNAStar软件分析测定的序列。
1.6 血凝试验
将出现CPE变化的细胞培养液进行血凝试验,方法参照殷震等编著的 《动物病毒学》。
2 结果
2.1 病毒的分离
在牛场采集的鼻拭子病料中,PBS浸毒后接种MDBK细胞培,并在细胞上盲传至细胞病变,可见典型的细胞变大、变圆现象,皱缩现象,然后局部细胞开始融合,最后融合细胞坏死、脱落(见图1A)。对照组细胞培养72h后生长良好,铺满培养瓶底,未见细胞发生病变(见图1B)。
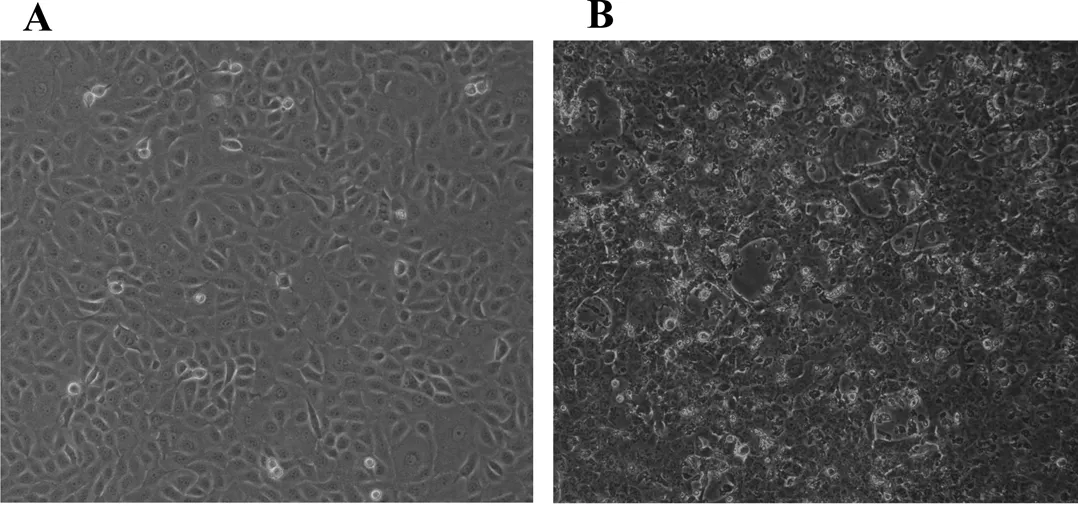
图1 A:正常MDBK细胞;图1B:接毒后72hCPE
2.2 病毒的滴定(TCID50的测定)
2.3 病毒的RT-PCR鉴定
按照参考文献方法进行扩增,产物经0.8%琼脂糖凝胶电泳分析,所得产物为803bp,与预期结果相一致(见图2)。

图2 病毒HN基因RT-PCR产物电泳鉴定结果
2.4 序列测定与分析
用DNAStar软件对测序结果进行分析,分离毒株HN基因序列与参考毒株(GenBank accession number:AF178655)基因序列同源性为94.1%。
2.5 血凝和血凝抑制试验
血凝试验结果为待检样本的血凝素效价为1:32。
3 讨论
近年来,我国牛群中爆发了牛呼吸道传染病发病率越来越高,死亡率也有上升趋势,对养牛羊造成严重的经济损失。牛呼吸道疾病是由多种病原引起的,病毒主要包括牛传染性鼻气管炎病毒、牛呼吸道合胞体病毒、牛副流感病毒3型、牛病毒性腹泻病毒,此外,混合细菌会感染也是牛呼吸道疾病的重要原因。本研究从采集的具有明显临呼吸道症状的病牛鼻液并料中成功分离出1株BPIV3。
病料应采集鼻液,这样分离病毒的成功率高。本研究用MDBK细胞分离培养病毒,出现了明显的CPE,对分离病毒传代3后提取RNA,反转录和目的基因扩增,分离株HN基因片段序列与GenBank中已发表的毒株序列同源性为949.1%,从分子水平上证明该毒株为BPIV3。RT-PCR诊断方法快速、敏感、特异性强,可以从病料中直接反转录后扩增DNA,为BPIV3的诊断提供了有效的手段。BPIV3的分离和鉴定为开展相关诊断试剂研究奠定了良好的基础。
[1]Collins PL,Chanock RM,McChinstosh K,Parainfluenza virus In.:Fields BN.Fields灾irology[M].3rd.Philadclphia:Lippin-cdtt Raven,1996:1205-1223.
[2]Griffin D.Economic impact associated with respiratory diease in beef cattle[J].灾et Clin North Am Food Anim Pract,1997,13(3):367-377.
[3]Henrickson K.J,Savatski LL.Antigenic structure,funcyion,and evolution of the hemagglutinin neuraminidase protein of human parainfluenza virus typeⅠ[J].Journal of Infectious Diseases,1997,176(4):867-875.
[4]Kapil S,Basaraba RJ.Infectious bovine rhinotracheitis,parainfluenza 3,and respiratory coronavirus[J].灾eterinary Clinics of North America and Food Animal Practice,1997,13(3):455-469.
[5]Sattar SA,Bohl EH,Senturk M.灾iral causes of bovine abortion in-Ohio[J].Journal of American Medical Association,1965,147:1207-1210.
[6]周玉龙,侯喜林,朴范泽.奶牛无浆体病PCR诊断方法的建立及应用[J].中国预防兽医学报,2007,29(9):718-722.
[7]王海勇,童钦,王炜,等.我国牛副流感病毒3型血清学调查[J].中国预防兽医学报,2014(2):154-156.
[8]Zhu,Y.M.,Shi,H.F.,Gao,Y.R.,et al.Isolation and genetic characterizationof bovine parainfluenza virus type 3 from cattle in China.灾et.Microbiol.2011,149:446-451.
[9]Sakai,Y.,Suzu,S.,Shioda,T.,Shibuta,H.,Nucleotide sequence of the bovine parainfluenza 3 virus genome:its 3'end and the genes of NP,P,C and M proteins.Nucleic Acids Res,1978,15(7):2927-2944.
张忠玉(1975-),女,汉族,山东省安丘市人,大学本科,兽医师,研究方向:动物医学。

