梵净山藤茶水提取物药效学初步研究
康超+王芳+刘盈盈+秦华军+席培宇+贾强
摘要:为研究梵净山藤茶水提取物(AGWE)对乙醇性肝损伤、血脂、血糖、血压的影响,通过构建急性毒性乙醇性肝损伤模型,考察不同剂量浓度的AGWE对小鼠的预防作用和SD大鼠肝损伤的保护作用,检测试验动物的死亡率、血清中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平;通过构建高血脂大鼠模型和四氧嘧啶构建糖尿病模型,经口灌胃AGWE,检测动物模型血清总胆固醇(TC)、甘油三酯(TG)和血糖水平;制备大鼠胸动脉离体血管环,检测AGWE 对血管环的舒张作用。结果表明,AGWE降低了小鼠对乙醇致死的死亡率,增强了小鼠对乙醇急性毒性的耐受性;灌胃不同剂量的AGWE,可明显降低大鼠血清中ALT、AST水平,且呈剂量依赖;能显著降低血清TC、TG、葡萄糖水平(P<0.05),可以减少血管的收缩作用,使血管舒张。AGWE对乙醇性肝损伤、高血脂、高血糖、高血压均具有良好的保护作用。
关键词:藤茶水提物;乙醇性肝损伤;血脂;血糖;血压
中图分类号: R284.1 文献标志码: A
文章编号:1002-1302(2016)09-0260-04
藤茶别称端午茶、藤婆茶、山甜茶、龙须茶、白茶、甘露茶、白毛猴等,系葡萄科蛇葡萄属显齿蛇葡萄[Ampelopsis grossedentata(Hand-Mazz) W.T.Wang]的嫩茎叶,主要分布于湖南、湖北、云南、贵州、广东、广西、福建等地[1]。藤茶中含有多种化学物质,如黄酮类、酚类、苷类、蛋白质、氨基酸等[1-3],此外,还包括烷烃类、醛类、有机酸、醇类及甾醇类等多种挥发性物质[4]。研究表明,藤茶及其提取物具有抗菌消炎[5-7]、抗肿瘤[8-10]、抗氧化[11-12]、降血糖[13-15]、降血脂[16-18]、保肝护肝[19-20]等作用。梵净山位于贵州东北部,拥有同纬度地区保存最完好的亚热带原始森林,属亚热带山地湿润季风气候区,动植物资源丰富,拥有丰富而优质的野生藤茶资源。然而,关于梵净山藤茶的药理功效却未见报道。本研究首次报道梵净山野生藤茶提取物对血脂、血糖、血压的影响,探讨了梵净山藤茶的药理学作用,为梵净山藤茶的合理利用和产品开发提供依据。
1 材料与方法
1.1 受试物
梵净山野生藤茶,采集自贵州省梵净山自然保护区的野生藤茶。
1.2 试验动物
NIH小鼠(批号:44007200006820),雌雄各半,清洁级标准,体质量18~22 g,由广东省医学实验动物中心提供。SD大鼠[批号:SCXK-(粤)2008-0002],雄性,清洁级标准,体质量180~220 g,由广东省医学实验动物中心提供。Wistar大鼠[批号:SCXK-(粤)2008-0002],雄性,体质量223.7~276.3 g,清洁级标准,共40只,由广东省医学实验动物中心提供。
1.3 试剂和仪器
试剂:99.7%乙醇(分析纯,杭州长征化工厂,批号:20100302)、联苯双酯滴丸(北京协和药厂)、地奥心血康(成都地奥制药集团有限公司)、四氧嘧啶(美国Sigma公司)、盐酸二甲双胍(贵州天安药业有限责任公司)、普萘洛尔(山西云鹏制药有限公司)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)试剂盒均购自南京建成生物工程研究所,自动生化分析仪(日立7100)、旋转蒸发仪(壹叶3100)、BL-420E生物机能实验系统(成都泰盟科技有限公司),其他均为常规试剂和仪器。
1.4 方法
1.4.1 AGWE制备 将采集的梵净山藤茶的嫩枝叶粉碎,热水提取3次,合并滤液,浓缩成浸膏。给药时蒸馏水溶解为目的给药剂量,分别相当于生药200 mg/kg体质量和2 000 mg/kg 体质量。
1.4.2 动物分组及胸动脉离体血管环制备 (1)乙醇急性毒性学试验:将NIH小鼠随机分成5组,每组10只。
(2)乙醇急性毒性的预防试验:将NIH小鼠随机分成5组,即空白对照、乙醇对照组和AGWE低、中、高剂量组,每组10只。
(3)乙醇致肝损伤保护作用:将SD大鼠随机分成6组,即空白对照、阴性对照、阳性对照和AGWE低、中、高3个剂量组,每组10只。
(4)降血脂试验:将SD大鼠(雌雄各半)随机分成4组,即空白对照、模型组、阳性对照组和AGWE组,每组10只。除空白组外,其余组别SD大鼠连续给予高脂饲料(基础饲料87.3%、胆固醇2%、胆盐0.5%、猪油10%、甲基硫氧嘧啶0.2%[21])14 d,空白组给予基础饲料。随机抽取每组30%的动物眼球后血管丛取血,检测血清总胆固醇(TC)、甘油三酯(TG)水平,确定动物模型。
(5)降血糖试验:将NIH小鼠随机分成4组,即空白对照、模型组、阳性对照和AGWE组,每组10只。将四氧嘧啶溶于生理盐水溶液中,配制为72 mg/kg。通过NIH小鼠尾静脉注射四氧嘧啶(72 mg/kg)生理盐水溶液,72 h后检测血清葡萄糖水平,以血糖值大于16 mmol/L作为造模成功标准。
(6)胸动脉离体血管环制备:Wistar大鼠断头处死,开胸迅速取出胸主动脉,置于预先用混合气体(95% O2和5% CO2)饱和的4 ℃的K-H溶液中,冲洗至无血迹,去除外周的脂肪组织和结缔组织,剪成2~3 mm长的血管环,将血管环置于盛有10 mL的K-H溶液(37 ℃恒温,并持续通入95% O2和5% CO2的混合气体,pH值=7.4)的恒温套瓶中。每一根血管环用2个三角型挂钩贯穿血管环管腔,一端固定,另一端连接于张力传感器,张力变化由BL-420E生物机能实验系统采集并记录。血管环加静息张力2 g左右,稳定90 min,期间每15 min用预温至37 ℃的K-H溶液更换液体,使血管环完全稳定。
1.4.3 试验方法 (1)乙醇急性毒性学试验:每组试验动物,分别灌胃不同剂量的乙醇1次,记录死亡数,并计算死亡率和半数致死剂量。
(2)乙醇急性毒性的预防试验:NIH大鼠随机分组后,每组给予半数致死量乙醇的同时给药。样品组给予不同剂量的AGWE(50、100、200 mg/mL),空白组和模型组给予等体积生理盐水,记录死亡数,并计算死亡率。
(3)乙醇致肝损伤保护作用:SD大鼠随机分组后,阳性对照组腹腔注射联苯双酯滴丸(0.2 g/kg),样品组腹腔分别注射AGWE低、中、高剂量(400、1 000、2 000 mg/kg),空白对照和模型组腹腔分别注射等体积生理盐水。1次/d,连续给药10 d,分别于第5、9天给药1 h后腹腔注射乙醇溶液(3 mL/kg),空白组注射等体积生理盐水,并于第10天给药4 h 后眼眶取血1 mL,3 000 r/min离心10 min,检测血清中ALT、AST含量。
(4)降血脂试验:高脂饲料饲养第15天开始给药,各试验动物组分别经口灌胃给药。样品供试组给药AGWE(2 000 mg/kg),阳性对照组给药地奥心血康(30 mg/kg),模型组和空白对照给予等体积生理盐水,1次/d,连续给药28 d(末次给药后,禁食不禁饮8 h)。所有动物经眼球后血管丛采血,取血清检测血脂水平。
(5)降血糖试验:阳性对照组给药盐酸二甲双胍(150 mg/kg),样品供试组给药AGWE (200 mg/kg),对照组和模型组给予等体积生理盐水,1次/d,连续7 d。于末次给药后1 h,小鼠眼眶静脉丛取血测定血糖水平。
(6)降血压试验:先制备胸动脉离体血管环,待立体血管环稳定后,用60 mmol/L的KCl重复刺激3次,诱发血管的最大收缩幅度,连续3次同样的刺激,使血管收缩幅度<10%时,以此作为100%收缩张力。阳性药物组给药普萘洛尔(0.10 mg/kg),样品供试组给药AGWE(2 000 mg/kg),对照组给予体积60 mmol/L的KCl溶液。记录不同药物下血管环的张力变化,并计算舒张率,公式如下:
舒张率=加受试药后张力-加受试药前张力药物刺激后张力-药物刺激前张力×100%。
1.5 数据分析和处理
数据采用SPSS17.0软件进行统计学处理,结果取平均值,以x[TX-*5]±s表示,采用t检验进行统计学分析。
2 结果与分析
2.1 AGWE解酒护肝作用
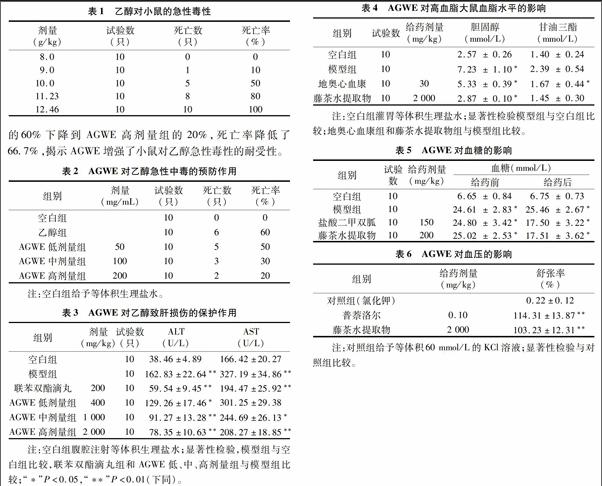
2.1.1 乙醇急性毒性学试验 为研究乙醇对小鼠的急性毒性作用,分别给予不同剂量的乙醇1次,其死亡数和死亡率见表1。从表1可以看出,随着剂量的增加,死亡率逐渐上升。当乙醇剂量增加到12.46 g/kg时,死亡率达到100%。根据数据及半数致死量(LD50)的计算方法得出乙醇对小鼠的LD50为10.11 g/kg。
2.1.2 AGWE对乙醇急性毒性的预防试验 为考察不同AGWE浓度对乙醇急性毒性的预防作用,每组试验动物给予半数致死量乙醇的同时给予AGWE低、中、高剂量(分别相当于生药量50、100、200 mg/mL),结果见表2。从表2可以看出,随着AGWE浓度的增加,小鼠死亡率逐渐降低,从乙醇组的60%下降到AGWE高剂量组的20%,死亡率降低了66.7%,揭示AGWE增强了小鼠对乙醇急性毒性的耐受性。
2.1.3 AGWE对乙醇致肝损伤的保护作用 分别考察不同剂量的AGWE对乙醇致肝损伤的保护作用,结果见表3。从表3可以看出,与空白组比较,模型组血清中ALT、AST含量显著升高(P<0.01),揭示化学性肝损伤造模成功。与模型组比较,AGWE各剂量组和联苯双酯滴丸可显著降低大鼠血清中ALT含量(P<0.05)。AGWE中,高剂量和联苯双酯滴丸可显著降低大鼠血清中AST含量(P<0.05)。其中,AGWE 高剂量组对血清中ALT、AST作用与联苯双酯滴丸组相当,说明该提取物对乙醇性肝损伤具有明显的保护作用。此外,随着提取物剂量的逐渐增加,血清中ALT、AST含量逐渐减少,表明AGWE对乙醇性肝损伤的保护作用呈剂量依赖。
2.2 藤茶提取物对血脂的影响
连续给药28 d后,眼球后血管丛采血检测血脂水平,结果见表4。从表4可以看出,地奥心血康和AGWE(2 000 mg/kg)2个组的总胆固醇和甘油三酯水平显著低于模型组(P<0.05)。此外,藤茶水提取物组的胆固醇水平显著低于地奥心血康组(P<0.05),对甘油三酯的影响,两者之间无显著性差异。结果表明,AGWE能明显地降低胆固醇和甘油三酯水平,且优于地奥心血康。
2.3 藤茶水提取物对血糖的影响
连续给药7 d后,小眼眶静脉丛取血测定小鼠血糖水平,结果见表5。从表5可以看出,AGWE(200 mg/kg)和盐酸二甲双胍2个组的血糖水平明显低于模型组血糖水平(P<0.05),两者之间无显著性差异。结果表明,AGWE能明显降低小鼠血糖水平,与盐酸二甲双胍效果相当。
2.4 藤茶水提取物对血压的影响
当大鼠胸动脉离体血管环处于最大收缩张力时(收缩幅度<10%),用普萘洛尔和AGWE(2 000 mg/kg)分别对血管环进行刺激,记录血管舒张幅度并计算舒张率,结果见表6。从表6可以看出,在普萘洛尔和AGWE的刺激下,处于紧张的血管环明显舒张,其舒张率分别为(114.31±13.87)%和(103.23±12.31)%,与对照组比较,两者能明显减轻收缩幅度(P<0.01)。普萘洛尔和AGWE对血管有舒张作用,两者之间无显著性差异。结果表明,AGWE具有明显降血压作用,与普萘洛尔效果相当。
3 讨论
本试验研究了藤茶水提取物对乙醇性肝病、“三高”、抗炎症等作用。乙醇性肝病是我国常见的肝脏疾病之一,是由长期大量饮酒导致的,严重危害人的健康。初期通常表现为脂肪肝,进而可发展成乙醇性肝炎、肝纤维化和肝硬化。严重酗酒时可诱发广泛肝细胞坏死,甚至肝功能衰竭。本研究通过灌胃乙醇建立大鼠急性毒性肝损伤模型,观察藤茶水提物对乙醇性肝损伤的保护作用。表明藤茶水提取物增强了小鼠对乙醇急性毒性的耐受性,明显降低了大鼠血清中ALT、AST含量,与之前研究结果一致[19-20,22]。乙醇在肝脏代谢过程中可产生大量的活性氧自由基(如OH-、O-2、H2O2)导致生物膜发生脂质过氧化反应,引起膜的流动性和通透性发生改变,最终导致细胞结构和功能的损坏[23];另一方面,产生的脂质过氧化物——丙二醛(MDA)可以与蛋白质、核酸(DNA、RNA)等大分子化合物交联,导致细胞和胞内细胞器代谢及功能障碍,甚至死亡[24]。AST主要分布于胞浆和线粒体,是一种线粒体酶,极易受到乙醇的影响[24]。梵净山藤茶水提取物能明显降低血清中AST水平,揭示了藤茶水提取物具有清除肝脏代谢过程中氧自由基,防止生物膜发生脂质过氧化反应的功能,从而达到保肝护肝的作用。
“三高”即高血脂、高血糖和高血压的简称,是导致心血管疾病的直接因素。如何有效控制高血脂、高血糖、高血压的发生,对心脑血管疾病的防治有着深远的意义。体质量指数(BMI)升高所致心血管风险部分由高血压、高血脂和高血糖介导,降低血压、血脂和血糖可使BMI升高引起的冠心病和卒中额外风险分别减少一半和3/4[25]。研究表明,藤茶总黄酮能降低血清TC、TG、LDL-C含量,减少肝系数和apoB/apoA比值,提高血清HDL-C含量[17-18],且能降低阴虚小鼠血糖和饥饿小鼠肝糖原水平,增加胰岛素抗性[26],能降低大鼠血糖值,改善血脂,升高胰岛素水平,并减轻胰岛细胞的损伤[15]。结果表明,梵净山藤茶水提取物能明显降低试验型血脂、血糖水平,达到降血脂、血糖的效果,与之前研究结果一致,同时揭示其具有潜在的减肥功效。此外,本试验研究了藤茶水提物对大鼠胸腔离体血管环的影响,表明藤茶水提取物能缓解由KCl刺激的血管紧张作用,表现了良好的降压效果。
本研究仅涉及水提取物的药效作用,对乙醇性肝损伤和“三高症”均有良好的效果,但对其具体的活性成分和作用机制尚未研究。藤茶含有多种化学成分,其中总黄酮的含量可达40%[27],其保肝护肝、抗“三高”可能体现在黄酮类化合物上,其活性成分的筛选和药理作用机制有待后续研究。总之,梵净山具有独特的气候环境,拥有丰富、优质的野生藤茶资源,其药理活性的研究可为梵净山藤茶保健饮品和药用开发提供依据。
参考文献:
[1]罗祖友,付晓芳,吴谋成. 藤茶的研究进展[J]. 食品科学,2005,26(8):513-517.
[2]Du Q Z,Chen P,Jerz G,et al. Preparative separation of flavonoidglycosides in leaves extract of Ampelopsis grossedentata usinghigh-speed counter-current chromatography[J]. Journal of Chromatography A,2004,1040(1):147-149.
[3]Wang D Y,Zheng Z Z,Xu S Y,et al. Four new isoflavones fromAmpelopsis grossedentata[J]. Journal of Asian Natural ProductsResearch,2002,4(4):303-308.
[4]郁浩翔,郁建平. 贵州梵净山藤茶及其近缘种广东蛇葡萄挥发性成分比较[J]. 山地农业生物学报,2012,31(6):557-560.
[5]曾春晖,杨 柯,徐明光,等. 广西藤茶总黄酮对金黄色葡萄球菌抗菌机制研究[J]. 中国实验方剂学杂志,2013,19(10):249-252.
[6]祁 佳,李莉霞,卜书红,等. 藤茶提取物清咽抗炎作用及其机制的研究[J]. 贵阳中医学院学报,2013,35(1):19-21.
[7]陈 帅,郁建平. 藤茶总黄酮抗炎及抑菌作用的实验研究[J]. 贵阳中医学院学报,2013,35(1):1-3.
[8]周春权,姚 欣,陈晓明,等. 藤茶提取物的抗肿瘤作用研究[J]. 中药新药与临床药理,2011,22(6):640-642.
[9]郑作文,郭成贤,毛 健,等. 藤茶总黄酮对人胃癌SGC-7901细胞增殖抑制作用的实验研究[J]. 时珍国医国药,2009,20(5):1158-1159.
[10]李 刚,郑作文,唐云丽. 藤茶总黄酮体外抗人肝癌细胞作用研究[J]. 中国药房,2008,19(9):652-654.
[11]肖 浩,郑小江,朱玉婷. 藤茶多酚体外抗氧化作用[J]. 食品与生物技术学报,2011,30(5):679-682.
[12]Wang Y F,Bian X Y,Park J,et al. Physicochemical properties,in vitro antioxidant activities and inhibitory potential againstα-glucosidase of polysaccharides from Ampelopsis grossedentata leaves and stems[J]. Molecules,2011,16(9):7762-7772.
[13]钟正贤,覃洁萍,周桂芬,等. 广西藤茶总黄酮降血糖的实验研究[J]. 中国中药杂志,2002,27(9):687-689.
[14]李玉山,李 田,戴清堂,等. 藤茶茶多糖对实验性糖尿病大鼠血糖的影响[J]. 营养学报,2006,28(4):356-357,360.
[15]钟正贤,周桂芬,陈学芬,等. 藤茶总黄酮对链脲霉素所致糖尿病大鼠的降糖作用[J]. 中药药理与临床,2003,19(5):19-20.
[16]刘翠娥,王海玉,王亚东,等. 藤茶辅助降血脂作用的研究[J]. 食品科学,2005,26(11):237-241.
[17]李玉山,谭志鑫,李 田,等. 藤茶对大鼠高血脂和心肌酶的影响[J]. 营养学报,2006,28(6):506-509.
[18]陈玉琼,倪德江,程 倩,等. 藤茶总黄酮及二氢杨梅素降血脂作用研究[J]. 茶叶科学,2007,27(3):221-225,242.
[19]郑洁静,续洁琨,江 涛,等. 藤茶总黄酮对拘束负荷引起小鼠肝损伤的保护作用[J]. 中国药理学通报,2006,22(10):1249-1253.
[20]钟正贤,周桂芬,陈学芬,等. 广西藤茶中双氢杨梅树皮素保肝作用的实验研究[J]. 中国中医药科技,2002,9(3):155-156.
[21]刘建文. 药理实验方法学——新技术与新方法[M]. 2版.北京:化学工业出版社,2008:259.
[22]钟正贤,覃洁萍,周桂芬,等. 广西藤茶总黄酮保肝作用的实验研究[J]. 广西科学,2002,9(1):57-59,63.
[23]周晓娟,王 超. 槲皮素对大鼠慢性酒精性肝损伤的保护作用[J]. 长江大学学报:自然科学版,2013,10(33):8-10.
[24]徐迪波. 生姜乙醇提取物干预小鼠酒精性肝损伤及相关抗氧化活性研究[D]. 扬州:扬州大学,2010.
[25]Lu Y,Hajifathalian K,Ezzati M,et al. Metabolic mediators of the effects of body-mass index,overweight,and obesity on coronary heart disease and stroke:a pooled analysis of 97 prospective cohorts with 1.8 million participants[J]. The Lancet,2014,383:970-983.
[26]钟正贤,周桂芬,陈学芬,等. 藤茶总黄酮药理作用的实验研究[J]. 中国中医药科技,2004,11(4):224-225.
[27]何桂霞,裴 刚,周天达. 显齿蛇葡萄中总黄酮和二氢杨梅素的含量测定[J]. 中国中药杂志,2000,25(7):423-425.

