番茄抗叶霉病的生理指标分析
刘冠+赵婷婷+薛东齐+杨欢欢+姜景彬+李景富+许向阳


摘要:为明确番茄叶霉病过敏性坏死反应中的活性氧代谢、细胞保护酶和激素含量的变化,通过对番茄叶霉病抗病材料HN19(含Cf-19)、HN42(含Cf-11)、Ontrio7516(含Cf-5)和感病材料 Money Maker(含Cf-0)分别接种叶霉菌生理小种1.2.3.4。结果表明:在接种72 h后,不亲和互作体系(抗病材料)出现坏死斑,番茄叶片活性氧的积累在接种后3、15 d出现2个峰值,而亲和互作体系(感病材料)只在接种后5 d产生1个峰值。不亲和互作体系中,第1次活性氧含量的高峰伴随着过敏性坏死反应(HR),表明高浓度的活性氧会导致细胞死亡。通过对亲和互作及非亲和互作体系中的细胞保护酶系(超氧化物歧化酶、过氧化物酶、过氧化氢酶)活性及激素(乙烯、水杨酸、脱落酸)含量分析发现,含有不同Cf基因的番茄品种在活性氧的积累、细胞保护酶活性及激素含量上存在相对统一的变化规律。
关键词:番茄叶霉病;过敏性坏死;ROS;保护酶系;激素
中图分类号: S436.412.1+9 文献标志码: A
文章编号:1002-1302(2016)09-0133-05
番茄(Solanum lycopersicum)是世界范围内分布的主要蔬菜作物,据联合国粮农组织统计,2012年全球番茄产量1.62亿t,创造了550亿美元的净利润[1]。番茄叶霉病(Cladosporium fulvum)是番茄保护地生产中的主要病害,被侵染后既降低番茄的产量,又影响果实的品质,有时甚至使植株死亡[2]。番茄Cf抗病基因介导对叶霉菌的抗性遵循基因对基因假说,抗病基因Cf与无毒基因Avr的相互作用使得抗病品种对生理小种产生特异性识别。有研究表明,Avr9/Cf-9和Avr4/Cf-4介导番茄产生的过敏坏死在产生速度、强度和组织特异性等方面均存在显著差异[3]。当番茄抗性品种被叶霉病菌侵染后,多数在侵染区域产生过敏性坏死反应(hypersensitive response,HR)[4]。有学者认为HR可能是细胞程序化死亡(programmed cell death,PCD)的一种形式[5],因为植物体内发生HR时也表现出细胞凋亡的特征,如番茄原生质体用HR激发子花生四烯酸处理时也形成DNA梯形带[6]。番茄叶霉菌的侵染可以分为3个阶段:早期包括蛋白激酶激活[7]、活性氧分子(reactive oxygen species,ROS)产生[8-9]、膜质氧化和谷胱甘肽积累;中期包括脂肪氧化酶活性增强、电解液渗漏[10]和防御基因表达[11-12];后期包括水杨酸积累、病症出现和细胞程序性死亡。HR中有多种信号分子参与,而活性氧是诱导HR的一个重要因子。当病原菌侵染寄主植物时,可使其体内活性氧产生与清除之间的动态平衡被打破[13]。在植物与病原菌大多数不亲和互作中,伴随HR的最显著特征就是氧化暴发,在短时间内积累大量的ROS,引起过敏性细胞死亡,在HR过程中发挥着重要的作用[14]。细胞保护酶系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等,它们有清除ROS的作用,使其维持在正常水平,防止其对细胞膜的毒害[15]。综上所述,一方面ROS及细胞保护酶之间与植物过敏性抗病反应有关,因而被认为是植物抗病防卫反应的组成部分;另一方面,ROS作为信号物质参与植物对病原菌侵染的防御反应、细胞死亡和抗病基因表达的调控等[16-17]。另外有研究表明,植物激素水杨酸(salicylic acid,SA)、乙烯(ethylene,ETH)是植物抗病信号转导途径中的重要调控因子[18]。此外,植物激素脱落酸(abscisic acid,ABA)、生长素(auxin)、赤霉素(gibberellin,GA)、细胞分裂素(cytokinine,CK)和油菜素内酯(brassinosteroid,BR)等也被报道参与调控植物对病原菌的抗性[19-22]。
目前对于番茄叶霉菌的研究主要集中在抗病基因及其无毒基因的克隆,而很少集中在生理指标的测定上,本试验旨在探究番茄抗叶霉病菌侵染的过程中活性氧、细胞保护酶活性和激素水平的变化规律,以及亲和互作体系与非亲和互作体系的区别,以明确番茄抗叶霉病的生理机制,揭示其抗病机制,为番茄的抗叶霉病育种提供基础信息。
1 材料与方法
1.1 试验材料
供试番茄品种(表1)及供试叶霉菌生理小种1.2.3.4,由东北农业大学园艺学院番茄课题组提供;HN19(含Cf-19)、Ontrio7516(含Cf-5)、HN42(含Cf-11)与叶霉菌生理小种1.2.3.4均为不亲和互作(incompatible interaction),即表现为免疫或高抗;Money Maker(简称 mm,含Cf-0)与叶霉菌生理小种之间的相互作用是亲和互作(compatible interaction),即表现为感病。
1.2 试验方法
1.2.1 试验材料的种植与接种 将供试材料种于温室中,每份供试材料设3次重复,每次重复40株。将供试材料用喷雾接种法分别接种叶霉菌生理小种1.2.3.4,接种苗龄为4~5张真叶。接种前转入小棚保湿24 h,使空气相对湿度达到100%。用小型喷雾器将菌液喷于叶片背面,接种后保持湿度在85%以上,温度在20~25 ℃。接种后0、1、3、5、8、15、18、21 d分别取供试材料第5或第6张真叶,每个材料取4~5张叶,用无菌水洗净,液氮冷冻后于-80 ℃保存。
1.2.2 锥虫蓝染色观察 在接种叶霉菌后96 h,采用洪薇的方法进行锥虫蓝染色观察[23],用OLYMPUS SZX10显微镜镜检,并拍照。
1.2.3 ROS、CAT、POD、SOD活性及ETH、ABA、SA含量的测定 分别采用上海劲马实验设备有限公司的植物活性氧(ROS)ELISA试剂盒E-60016、植物乙烯(ETH)ELISA试剂盒E-60049、植物激素脱落酸(ABA)ELISA试剂盒E-60004、植物激素水杨酸(SA)ELISA试剂盒E-60046进行测定;SOD活性采用氮蓝四唑法测定,POD活性采用愈创木酚比色法测定,CAT活性采用高锰酸钾滴定法测定。
2 结果与分析
2.1 锥虫蓝染色观察
叶片接菌前都呈现健康,在接菌3 d时,亲和与不亲和互作体系的叶片表征没有任何变化(图1)。但用锥虫蓝染色后,不亲和互作番茄叶片在接种后72 h出现HR现象(图2), 图2-a、图2-b、图2-c中在沿叶脉方向出现坏死细胞群。而与叶霉菌亲和互作的Money Maker在接种后96 h时,尚未出现HR现象。接菌后15 d时,亲和互作叶片表面可看出有1小块叶霉菌霉层(图1),而此时染色图片中可看出亲和互作体系Money Maker叶片坏死斑的面积大于不亲和互作体系(图2),由此推测菌丝生长更为快速。
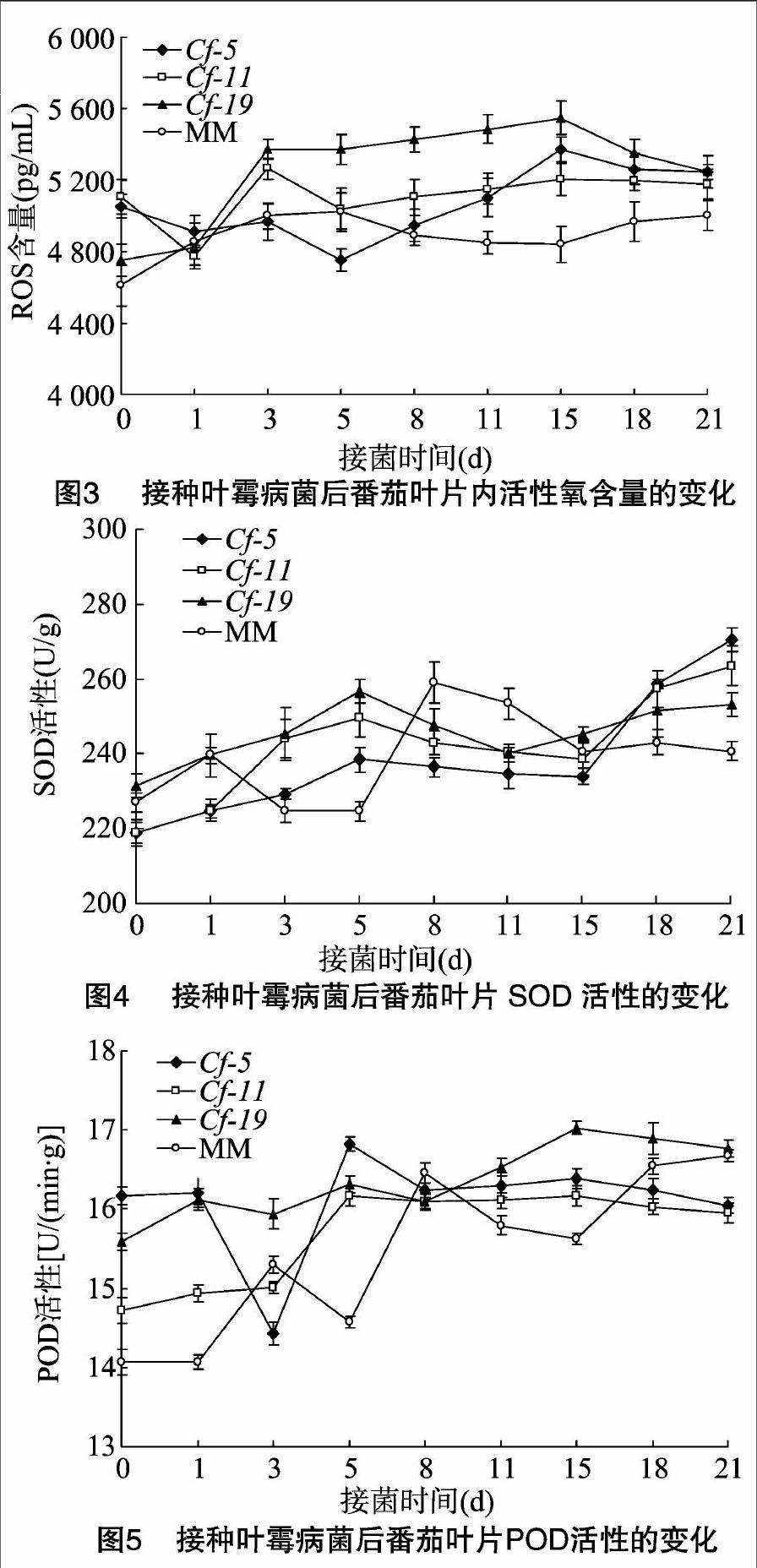
2.2 番茄抗叶霉病过敏性坏死反应中ROS含量的变化
病原菌的侵染可破坏植物体内活性氧的产生与清除之间的动态平衡,从图3可见,在番茄品种与叶霉菌互作体系中,接种后0~21 d内不亲和互作体系与亲和互作体系中ROS变化趋势完全不同,但不亲和互作体系中变化趋势大致相同。不亲和互作体系Cf-5、Cf-11、Cf-19中,ROS含量出现2个高峰,而亲和互作体系Money Maker中只有1个峰。不亲和互作体系Cf-5、Cf-11、Cf-19的ROS含量在接种后3 d达到第1个峰值,而亲和互作体系Money Maker的ROS含量接种后变化不大,接种后3 d呈上升趋势,到接种后5 d达到峰值。不亲和互作体系Cf-5、Cf-11、Cf-19的ROS峰值高于亲和互作体系Money Maker。虽然3个不亲和互作体系在叶霉菌侵染后,ROS含量都出现了2个峰值且变化趋势大致相同,但略有区别。对于不亲和互作体系而言,接种后3 d,ROS大量积累,此时有可能是出现HR的时间。对于亲和互作体系而言,接种后5 d左右活性氧含量突增,此时有可能是病斑产生时间。由此推断,ROS积累高峰期基本与番茄叶片坏死斑产生是同步的。
2.3 番茄抗叶霉病过敏性坏死过程中细胞保护酶活性的变化
SOD、POD、CAT都是植物膜脂过氧化酶促防御系统中重要的保护酶。SOD在细胞保护酶系统中的作用是清除超氧阴离子等活性氧,同时产生歧化产物H2O2,CAT、POD在保护酶系统中主要起到酶促降解H2O2的作用[24]。
2.3.1 SOD活性 SOD是植物体内清除自由基的关键酶之一,它能催化植物体内分子氧活化的第1个中间产物O-2[KG-*2]· 发生歧化反应生成O2 、H2O2, 其活性高低可用于衡量植物抗性的强弱[25]。由图4可知,接种叶霉病菌后,番茄叶片中SOD活性在不同互作体系中有不同变化趋势,但在不亲和互作体系中变化趋势大致相同。亲和互作体系Money Maker中的SOD活性在接种后1 d迅速升高后迅速下降,在接种后3 d达到谷值,然后升高。不亲和互作体系Cf-5、Cf-11、Cf-19中的SOD活性在接种后逐渐升高,并且均在接种后5 d达到峰值,之后迅速下降,在接种后15 d达到1个谷值。与ROS含量的变化相比可见,不亲和互作体系中的ROS含量在出现第1个峰值时,其SOD活性处于中间值,表明此时有相对较高活性的SOD并没有抑制ROS的积累。
2.3.2 POD活性 植物细胞内存在的POD可催化分解H2O2生成H2O和O2,还可使脂肪酸、芳香胺和酚类物质等氧化。相关文献报道,POD活性升高是植物抗性的一种表现形式[26]。接种叶霉病菌后,番茄叶片中POD活性在不同互作体系中发生不同的变化趋势,但不亲和互作体系中的变化趋势大致相同。从图5可见,在取样时间内,亲和互作体系Money Maker的POD 活性出现2个峰值,而不亲和互作体系只有1个峰值,且其峰值高于亲和互作体系。与ROS含量的变化相比,无论亲和互作体系还是非亲和互作体系,POD活性的变化与其没有太大的对应关系。
2.3.3 CAT活性 接种叶霉病菌后,番茄叶片中CAT活性在不同互作体系中具有不同的变化趋势。由图6可见,亲和互作体系的CAT活性在接种后迅速上升,并在接种后5 d达到1个峰值,之后迅速下降,在接种后8 d达到1个低谷,之后逐渐升高;在不亲和互作体系中CAT活性变化趋势大致相同,但其活性还是略有不同。在不亲和互作体系中CAT活性在接种后略有下降后逐渐上升,在接种后5 d达到峰值。与ROS含量的变化相比,在亲和互作体系中CAT活性的变化与ROS的积累相反。不亲和互作体系的CAT活性在接种后有所降低,这说明在亲和互作前期,植物体内降解H2O2的能力下降,有利于H2O2的积累。
2.4 番茄抗叶霉病过敏性坏死过程中植物激素含量的变化
2.4.1 ETH含量 乙烯作为植物中唯一的气体激素,虽然分子量小,却参与种子萌发、幼苗发育、花叶以及果实的衰老与凋谢等植物生长发育过程,在植物应对各种胁迫的抗性反应中亦具有至关重要的作用[27]。由图7可知,在未接种叶霉菌时,各个品种内的乙烯含量处于相同水平,接菌后含量均有所上升。Money Maker中ETH含量在接种后11 d达到1个顶峰后下降,最后逐渐稳定。非亲和互作体系中的ETH含量在接种后明显高于非亲和互作体系,基本在接种后18 d时达到顶峰值,之后变化稳定。
2.4.2 ABA含量 脱落酸在植物受到环境中不利因素的胁迫后,可以调控下游基因帮助植物适应复杂环境。最新研究表明,脱落酸在植物抗病反应中具有重要作用[28]。由图8可以看出,番茄叶片接菌后,亲和互作体系和非亲和互作体系整体趋势大致相同,但亲和互作体系中ABA含量迅速增加,而不亲和互作体系则变化较为缓慢。在接种后8 d,亲和互作体系内ABA含量达到最大值,而后趋于平缓。非亲和互作体系中ABA含量虽然也在升高,但折现斜率相对于亲和互作体系较低且含量少。
2.4.3 SA含量 水杨酸是一种酚类物质,它广泛参与植物的种子萌发、细胞生长、呼吸作用、衰老相关等基因的表达以及对病害的抵抗等生命活动[29]。由图9可知,番茄接种叶霉菌后非亲和互作体系中没有相对统一的变化规律,各个品种内SA含量变化比较复杂。Money Maker中SA含量先迅速升高,之后变化缓慢至接种后11 d时出现谷值后又升高。在非亲和互作体系中,Cf-5、Cf-11、Cf-19的变化规律也各不相同。含有Cf-5基因的品种内SA含量到接种后5 d达到顶峰,然后缓慢下降,最终变化趋势相对稳定;而含有Cf-11基因的品种内SA含量到接种后5 d出现谷值,而后缓慢升高;含有Cf-19基因的品种内SA含量变化则相对稳定。
3 结论与讨论
本研究利用番茄抗叶霉病不同品种、感叶霉病品种与不同生理小种叶霉病菌之间不同的互作表现,从叶霉菌侵染番茄叶片后活性氧积累及细胞保护酶活性等方面出发,探讨活性氧的产生变化及其细胞保护酶活性的变化,以期找到含有不同Cf基因的抗病品种在接种后的活性氧及保护酶活性变化规律。结果表明,亲和互作体系与不亲和互作体系在叶霉病菌侵染后,活性氧积累和细胞保护酶系活性变化是不同的,但不亲和互作体系中活性氧的积累和细胞保护酶活性的变化规律大致相同。
在不亲和互作体系中,叶霉病菌侵染番茄叶片内活性氧的积累有2个高峰,这与Lamb等的研究结果[30]类似。其中第1次活性氧含量迅速增加是在接种后3 d,可能与叶片上产生过敏性坏死斑的时间相吻合;不亲和互作体系第2个活性氧含量累计峰值产生在接种后15 d;亲和互作体系中,在接种后5 d活性氧的积累达到了1个峰值。不亲和互作体系的活性氧积累的第1个峰值低于第2个峰值,说明其应该是作为信号分子启动了植物的抗病反应,这与Jabs的研究[31]相一致。无论番茄是因为感病叶片被破坏或是因抗病而产生大量坏死斑,都有强度极高的活性氧积累。这表明高强度活性氧含量的突增会导致细胞死亡,这与Tiwari等的结论[32]一致。
在亲和互作体系与非亲和互作体系中,细胞保护酶SOD、POD、CAT的功能和作用是不同的。在亲和互作体系中,叶霉病菌侵染番茄后的前期SOD、CAT含量适中,因此没有活性氧积累;而在非亲和互作体系中,叶霉病菌侵染番茄后的前期SOD活性与CAT活性呈负相关,此时活性氧含量剧增,超氧阴离子含量增加,且从接种叶片的坏死斑症状看出,此时细胞死亡加剧,由此推测超氧阴离子在细胞死亡中有重要作用。龙书生等对小麦条锈病的过敏性坏死反应的研究也证实了这一点[24]。
含有Cf基因的番茄材料接种叶霉病菌后,其SOD活性高于感病材料,可能是感病材料叶片中O-2含量增加超越了防御系统的清除能力,导致脂膜过氧化反应的结果。王全华等对外源GO基因导入番茄后对叶霉病的抗性机制的研究也证实了这一点[33]。
ETH、ABA、SA是在叶霉菌侵染番茄植株过程中产生变化较为明显的3种激素。ABA是在植物抗病过程中重要的调节激素,而在亲和互作体系中ABA含量明显高于非亲和互作体系,说明ABA在叶霉菌引起的生物胁迫反应中起负调控作用,这与Bari等的研究观点相一致[34]。在蔡新忠等的以水杨酸积累缺失型nahG和乙烯不应型etr11转基因烟草植株为材料,对水杨酸和乙烯在依赖于番茄Cf-4和Cf-9基因的过敏坏死中的调控作用进行比较研究,结果发现水杨酸对植物抗病基因介导的过敏性坏死产生和调节中的作用,而且说明水杨酸对产物结构域相同的Cf抗病基因决定的过敏性坏死中的作用也有显著区别。而本试验中非亲和互作体系中ETH含量较高,由此可看出在HR反应中ETH起到正调控作用,而SA含量变化较为复杂,与蔡新忠等研究结果[35]相吻合。
本试验主要通过测定在番茄抗叶霉病过程中活性氧的积累、细胞保护酶活性及激素含量的变化,发现含有不同Cf基因的番茄抗叶霉病品种在活性氧积累、保护酶活性和激素含量的变化上存在一致的规律,其中SA对非亲和互作中结构域相似Cf基因在HR反应中的变化也各不相同。本研究为在分子水平上研究番茄对叶霉病菌产生过敏性反应的机制,以及进一步研究番茄与叶霉病菌的专一性识别及过敏性反应的信号传递机制奠定了基础。
参考文献:
[1]Vincent H,Wiersema J,Kell S,et al. A prioritized crop wild relative inventory to help underpin global food security[J]. Biological Conservation,2013,167(3):265-275.
[2]Areshchenkova T,Ganal M W.Long tomato microsatellites are predominantly associated with centromeric regions[J]. Genome,1999,42(3):536-544.
[3]Cai X,Takken F L W,Joosten M H A J,et al. Specific recognition of AVR4 and AVR9 results in distinct patterns of hypersensitive cell death in tomato,but similar patterns of defence-related gene expression[J]. Molecular Plant Pathology,2001,2(2):77-86.
[4]韩建东,曹远银,姚 平. 小麦—秆锈菌互作中的激发子对小麦过敏性坏死反应和防御酶活性的诱导[J]. 华北农学报,2009,24(1):79-82.
[5]范文艳.植物的超敏性细胞死亡研究初探[J]. 黑龙江农业科学,2005(2):31-34.
[6]Liu J,Liu X,Dai L,et al. Recent progress in elucidating the structure,function and evolution of disease resistance genes in plants[J]. Journal of Genetics and Genomics,2007,34(9):765-776.
[7]Romeis T,Ludwig A A,Martin R,et al. Calcium-dependent protein kinases play an essential role in a plant defence response[J]. The Embo Journal,2001,20(20):5556-5567.
[8]May M J,Hammond-Kosack K E,Jones J D G.Involvement of reactive oxygen species,glutathione metabolism,and lipid peroxidation in the Cf-gene-dependent defense response of tomato cotyledons induced by race-specific elicitors of Cladosporium fulvum[J]. Plant Physiology,1996,110(4):1367-1379.
[9]Romeis T,Piedras P,Zhang S,et al. Rapid Avr9-and Cf-9-dependent activation of MAP kinases in tobacco cell cultures andleaves:convergence of resistance gene,elicitor,wound,and salicylateresponses[J]. Plant Cell,1999,11(2):273-287.
[10]Hammondkosack K E,Silverman P,Raskin I,et al. Race-specific elicitors of Cladosporium fulvum induce changes in cell morphology and the synthesis of ethylene and salicylic acid in tomato plantscarrying the corresponding Cf disease resistance gene[J]. PlantPhysiology,1996,110(4):1381-1394.
[11]Ashfield T,Hammond K E,Harrison K,et al. Cf gene-dependent induction of a b-1,3-glucanase promoter in tomato plants infected with Cladosporium fulvum[J]. Molecular Plant Microbe Interactions,1994,7(5):645-656.
[12]Wubben J P,Lawrence C B,de Wit P. Differential induction of chitinase and 1,3-β-glucanase gene expression in tomato by Cladosporium fulvumand its race-specific elicitors[J]. Physiological and Molecular Plant Pathology,1996,48(2):105-116.
[13]Grant J J,Loake G J.Role of reactive oxygen intermediates and cognate redox signaling in disease resistance[J]. Plant Physiology,2000,124(1):21-30.
[14]Foyer C H,Lopez-Delgado H,Dat J F,et al. Hydrogen peroxide and glutathione associated mechanisms of acclamatory stress tolerance and signaling[J]. Physiologia Plantarum,1997,100(2):241-254.
[15]Elstner E F.Oxygen activation and oxygen toxicity[J]. AnnualReview of Plant Physiology,2003,33(1):73-96.
[16]Jabs T,Dietrich R A,Dangl J L.Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide[J]. Science,1996,273(5283):1853.
[17]Levine A,Tenhaken R,Dixon R,et al. H2O2 from the oxidative burst orchestrates the plant hypersensitive disease resistance response[J]. Cell,1994,79(4):583-593.
[18]Pieterse C M J,Leon-Reyes A,Ent S V D,et al. Networking by small-molecule hormones in plant immunity[J]. Nature Chemical Biology,2009,5(5):308-316.
[19]Spoel S H,Dong X.Making sense of hormone crosstalk during plant immune responses[J]. Cell Host and Microbe,2008,3(6):348-351.
[20]Eckmann L,Kagnoff M F.Cytokines in host defense against Salmonella[J]. Microbes and Infection,2001,3(14/15):1191-200.
[21]Ueguchi-Tanaka M,Nakajima M,Katoh E,et al. Molecular interactions of a soluble gibberellin receptor,GID1,with a rice DELLA protein,SLR1,and gibberellin[J]. The Plant Cell,2007,19(7):2140-2155.
[22]Anderson J P,Badruzsaufari E,Schenk P M,et al. Antagonistic interaction between abscisic acid and jasmonate-ethylene signaling pathways modulates defense gene expression and disease resistance in Arabidopsis[J]. Plant Cell,2005,16(12):3460-3479.
[23]洪 薇. 番茄抗叶霉病分子机理及抗病相关基因分离技术体系的建立[D]. 杭州:浙江大学,2007.
[24]龙书生,曹远林,李亚玲,等. 小麦抗条锈病过敏性坏死反应中的活性氧代谢[J]. 西北农林科技大学学报:自然科学版,2009(11):125-130.
[25]匡传富,罗 宽. 烟草品种对青枯病抗病性及抗性机制的研究[J]. 湖南农业大学学报:自然科学版,2002,28(5):395-398.
[26]Simte H C,Dasgupta D R.De novo synthesis of peroxidase isozymes of soybean var.Clark-63 infected with the root-knot nematode,Meloidogyne incognita[J]. Indian Journal of Nematology,1987,17(2):247-253.
[27]Guo H,Ecker J R.The ethylene signaling pathway:new insights[J]. Current Opinion in Plant Biology,2004,7(1):40-49.
[28]Curvers K,Seifi H,Mouille G,et al. Abscisic acid deficiency causes changes in cuticle permeability and pectin composition that influence tomato resistance to Botrytis cinerea[J]. Plant Physiology,2010,154(2):847-860.
[29]Vlot A C,Dempsey D M A,Klessig D F.Salicylic acid,a multifaceted hormone to combat disease[J]. Annual Review of Phytopathology,2009,47:177-206.
[30]Lamb C,Dixon R A.The oxidative burst in plant disease resistance[J]. Annual Review of Plant Biology,1997,48(1):251-275.
[31]Jabs T.Reactive oxygen intermediates as mediators of programmed cell death in plants and animals[J]. Biochemical Pharmacology,1999,57(3):231-245.
[32]Tiwari B S,Belenghi B,Levine A.Oxidative stress increased respiration and generation of reactive oxygen species,resulting in ATP depletion,opening of mitochondrial permeability transition,and programmed cell death[J]. Plant Physiology,2002,128(4):1271-1281.
[33]王全华,王秀峰,林忠平. 外源GO基因导入番茄后对叶霉病的抗性机制[J]. 中国农业科学,2006,39(7):1365-1370.
[34]Bari R,Jones J D G.Role of plant hormones in plant defence responses[J]. Plant Molecular Biology,2009,69(4):473-488.
[35]蔡新忠,徐幼平. 水杨酸和乙烯对依赖于Cf基因的过敏坏死的调控作用[J]. 植物生理与分子生物学学报,2003,29(1):11-14.

