彩叶芋愈伤组织的诱导、增殖及植株再生
蔡小东+Zhanao+Deng
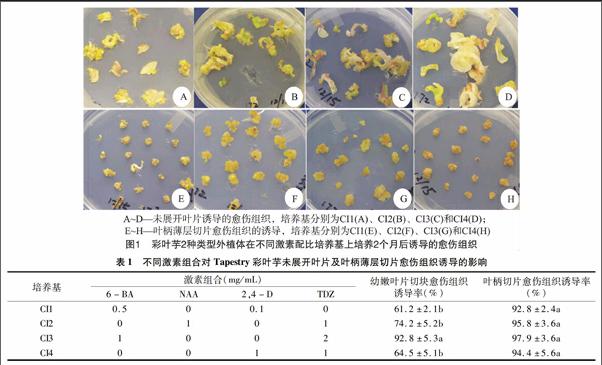

摘要:以Tapestry彩叶芋(Caladium ×hortulanum Birdsey)未展开叶片和叶柄薄层切片为外植体,研究了不同激素浓度配比对Tapestry彩叶芋愈伤组织的诱导、增殖及植株再生的影响。结果表明:在4种愈伤组织诱导培养基上均能产生愈伤组织,其中2 mg/L TDZ和1 mg/L 6-BA是彩叶芋愈伤组织诱导的最佳激素配比;叶柄薄层切片是诱导愈伤组织的理想外植体,其愈伤组织诱导率均在90%以上;愈伤组织在MS基本培养基上增殖率最高,愈伤组织质地致密,呈颗粒状;诱导的愈伤组织分化能力很强,在附加有1 mg/L 6-BA和1 mg/L NAA的MS培养基上再生了许多幼苗。
关键词:彩叶芋;愈伤组织诱导;横切薄层培养;植株再生
中图分类号: S682.360.4+3 文献标志码: A
文章编号:1002-1302(2016)09-0075-03
彩叶芋(Caladium×hortulanum Birdsey)为天南星科彩叶芋属多年生草本观叶植物,又称花叶芋、五彩竿,原产南美洲热带地区。因其叶色、脉色、条纹、斑块艳丽夺目,观赏期较长,常常用于盆栽观赏、花圃栽培,在美化城市方面效果极佳[1-3]。为改良彩叶芋园艺性状,增加其观赏价值,培育新品种,常常采用商业品种与育种系列进行有性杂交[1-2]。然而,彩叶芋花偏少、花期不固定、花粉及种子寿命短等因素极大地影响了有性杂交育种效率[4]。而且,目前有性杂交育种最大的问题是,即使大量增加杂交后代的数量,杂交后代群体中新类型也越来越缺乏[1]。因此,有必要采用新的育种手段来培育彩叶芋新类型。
愈伤组织是快速繁殖、种质保存、体细胞诱变、原生质体培养和融合、遗传转化及有用化合物生产等研究的理想起始材料。建立彩叶芋愈伤组织诱导、增殖及再生体系,通过转化或体细胞杂交等方法进行彩叶芋品种的遗传改良,在彩叶芋生物技术研究中具有重要的意义。本试验对彩叶芋愈伤组织的诱导、增殖及小苗再生进行了研究,以期为将来彩叶芋生物技术育种奠定基础。
1 材料与方法
1.1 试验材料
Tapestry(Caladium×hortulanum Birdsey)彩叶芋是块茎繁殖苗,种植于美国佛罗里达大学海湾沿岸研究教育中心(the University of Floridas Gulf Coast Research and Education Center,Wimauma,Florida,U.S.A.)温室中。从温室中剪取生长良好的彩叶芋未展开叶片和未展开叶的叶柄备用。
1.2 外植体的处理
取Tapestry彩叶芋未展开叶片和叶柄,在自来水下冲洗30 min后先用75%乙醇浸泡15 s,再用0.5%二氯异氰尿酸钠(PhytoTechnology Laboratories,Shawnee Mission,Kansas,U.S.A.)外加2~3滴吐温-20浸泡20 min,其间轻轻振荡4~5次。消毒处理后叶片叶柄分别用无菌水冲洗3次,再用无菌滤纸吸干叶片和叶柄表面的水分。然后在超净工作台上用手术刀片将消毒后的叶片切成约0.5 cm×0.5 cm小块,叶柄则被横切成1.5~2.0 mm厚的薄片。
1.3 愈伤组织的诱导
以MS为基本培养基,在前人的研究[5-9]基础上共设计了4种培养基用于Tapestry彩叶芋2种外植体愈伤组织的诱导,分别为CI1:MS+0.5 mg/L 6-BA+0.1 mg/L 2,4-D;CI2:MS+1 mg/L TDZ+1 mg/L NAA;CI3:MS+2 mg/L TDZ+1 mg/L BA;CI4:MS+1 mg/L TDZ+1 mg/L 2,4-D。所有培养基均添加20 g/L蔗糖和7.0 g/L琼脂,pH 值为5.8。每培养皿接种10~12个叶片切块或18~20个叶柄薄层切片,试验重复3次。接种后放入培养箱中进行暗培养,培养温度(25±2) ℃。60 d后统计愈伤组织诱导率。
1.4 愈伤组织的增殖
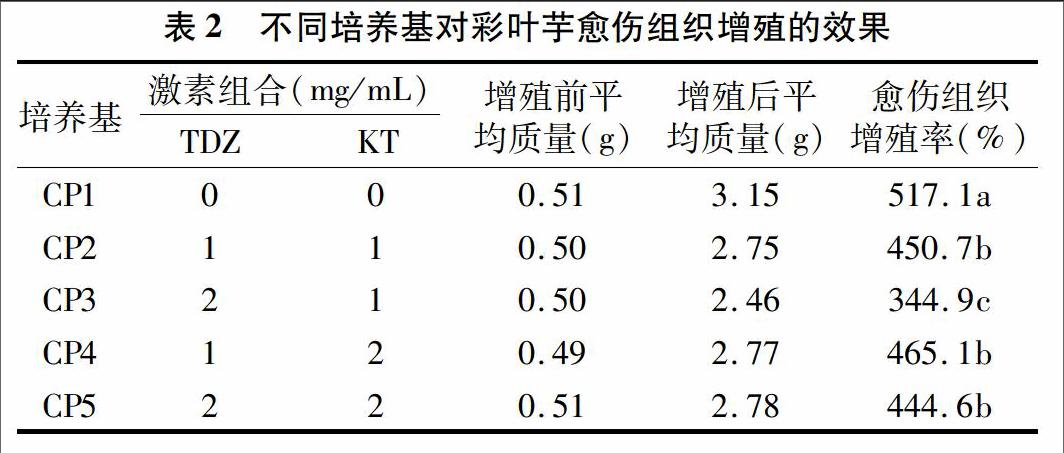
以MS为基本培养基,附加水解乳蛋白0.5 g/L及不同浓度的TDZ和KT,共设计5种培养基用于愈伤组织的增殖。将愈伤组织从原来的外植体上剥离下来,切成固定大小,称取约0.5 g愈伤组织分别接种于愈伤组织增殖培养基上,每种培养基接种5瓶。接种后进行暗培养,培养温度(25±2) ℃。30 d后统计愈伤组织增殖率。
愈伤组织增殖率=(增殖后质量-增殖前质量)/增殖前质量×100%。
1.5 植株再生
挑选直径在0.4 cm左右的愈伤组织块,转入含有1 mg/L 6-BA和1 mg/L NAA的分化培养基中,在光照条件下培养,光照度为2 000 lx 左右,光—暗周期16 h—8 h,温度(25±2) ℃。
2 结果与分析
2.1 2种外植体愈伤组织形成的过程
外植体接种7 d后开始观察愈伤组织的形成过程,结果如图1所示:虽然不同培养基均能诱导彩叶芋2种外植体产生愈伤组织,但这2种外植体愈伤组织形成过程各不相同。Tapestry彩叶芋未展开叶片切块在愈伤组织诱导培养基上培养10 d后,叶片边缘慢慢向上拱起,切口边缘处颜色渐渐变淡,开始膨大。培养1个月后,部分叶片切口附近开始出现淡黄色愈伤组织。培养2个月后,在添加有2 mg/L TDZ和1 mg/L BA的CI3培养基上叶片切口处再生了大量淡黄色颗粒状愈伤组织(图1-C),而在其他3种培养基上只再生了少量致密的愈伤组织(图1-A、B、D)。叶柄薄层切片愈伤组织发生时间要早10 d左右,培养20 d后,叶柄薄层切片边缘就开始出现愈伤组织。培养至2个月时,在这4种培养基上,叶柄薄层切片四周及表面即布满了大量淡黄色愈伤组织(图1-E、F、G、H)。并且在附加0.5 mg/L和0.1 mg/L 2,4-D的CI1培养基上(图1-A、E),2种外植体诱导的愈伤组织有少量分化出胚状体,甚至有芽和根的再生。这些在CI1培养基上再生的愈伤组织继续培养1个月后,愈伤组织体积继续增大,部分分化为胚状体,并且再生了许多具有根和芽的小苗。这说明CI1培养基非常适合于彩叶芋愈伤组织的分化。
2.2 不同激素组合对愈伤组织诱导率的影响
激素的种类及其浓度组合是调控外植体产生愈伤组织的主导因素。外植体接种在愈伤组织诱导培养基上2个月后,统计愈伤组织诱导率,结果如表2所示:这2种外植体在不同种类和浓度激素的诱导下,都能产生愈伤组织,但对不同种类激素的反应不同。对于未展开叶片切块,CI3培养基中愈伤组织诱导率高达92.8%,显著高于其他处理(P<0.05)。对于叶柄薄层切片,所设计的4种培养基中愈伤组织诱导率均在90%以上,其中CI3培养基中愈伤组织诱导率也是最高,达到97.9%,但这4种培养基愈伤组织诱导率之间没有显著性差异。这表明彩叶芋愈伤组织的诱导对激素的适应范围比较广,是很容易诱导愈伤组织的单子叶植物。叶柄薄层切片愈伤组织诱导效果优于叶片切块,而2 mg/L TDZ和1 mg/L6-BA 是彩叶芋愈伤组织诱导的理想激素组合。
2.3 不同激素组合对愈伤组织增殖的影响
虽然本研究中2种外植体在适宜的培养基上均能形成愈伤组织,但数量相对较少。为获得状态良好、足够数量的彩叶芋愈伤组织,需进行增殖培养。试验比较了不同浓度TDZ和NAA组合对彩叶芋愈伤组织增殖的影响。表2结果显示,培养1个月后,愈伤组织在这些培养基上均实现了不同程度的增殖。其中未添加任何激素的CP1培养基上,愈伤组织增殖率达到517.1%,显著高于其他处理。然而,如图2-A和2-B所示,这些愈伤组织在所有这些培养基上虽然能够快速增殖,但是愈伤组织仍然呈现颗粒状。少数愈伤组织再生了胚状体,甚至还再生了芽或根(图2-A),这可能是由于添加一定浓度的TDZ和NAA促使愈伤组织发生了分化。在解剖显微镜下观察发现,这些愈伤组织大多呈颗粒状,结构较致密(图2-C)。
2.4 小苗的再生
愈伤组织在附加有1 mg/L 6-BA和1 mg/L NAA的MS培养基上培养1个月后,再生了大量带有根和芽的小苗。所有愈伤组织块均再生了带有芽和根的幼苗,且单个愈伤组织块可分化出多棵小苗。这些小苗叶片是绿色的,没有彩色叶脉和彩色斑点。当小苗长满培养瓶时,培养基表面还生长有大量愈伤组织和胚状体。
3 讨论
愈伤组织的产生是不同种类及浓度激素相互作用的结果。6-BA、2,4-D、TDZ等是外植体诱导愈伤组织所常采用的激素,6-BA能刺激愈伤组织的形成,2,4-D在诱导脱分化和细胞增殖方面效果较为明显,而TDZ是一种具有很强细胞分裂素活性的激素,具有促进愈伤组织生长的作用。前人研究表明,彩叶芋在组织培养中对生长调节剂的适应范围比较广[5-10]。如王颖等在试验中发现,彩叶芋在不同组合的激素培养下都能产生愈伤组织,再生出小植株,但是愈伤组织启动时间、愈伤组织诱导率和愈伤组织分化率不同[7]。本研究发现,在4种不同激素配比的愈伤组织诱导培养基中均能产生愈伤组织,这与前人的研究结果是一致的。
此外,植物叶片、茎尖、叶柄、叶脉及子叶等是愈伤组织诱导常用的外植体。彩叶芋一般以叶片为外植体进行组织培养研究,叶柄薄层切片作为外植体在彩叶芋离体培养中鲜见报道[11]。横切薄层培养(transverse thin cell layer culture,tTCL)是指将外植体横切成大约1 mm厚的切片进行培养的方法。本研究中以彩叶芋未展开叶片和叶柄薄层切片为外植体,结果发现,叶柄薄层切片是诱导愈伤组织的理想外植体,其愈伤组织诱导率均在90%以上。这可能是由于薄层培养具有组织结构简单、对调控因子敏感、培养易成功等优点[12]。
优良的愈伤组织应具备质地疏松、增殖迅速、分化容易等特点[13]。状态良好的愈伤组织是原生质体操作、体细胞杂交、转基因、植株再生等的重要基础。本研究中获得的愈伤组织大多颗粒较大,结构致密,易于分化成苗,适合于组培快繁,但不适合于原生质体培养等研究。因此,彩叶芋愈伤组织在继代保存、愈伤组织悬浮系的建立等方面仍需进一步研究。
参考文献:
[1]Deng Z A. Caladium genetics and breeding:recent advances [J]. Floriculture and Ornamental Biotechnology,2012,6:53-61.
[2]Wilfret G J. Caladium[M]//de Hertogh A,le Nard M. The physiology of flower bulbs. Amsterdam:Elsevier,1993:239-247.
[3]周肇基. 观叶新宠彩叶芋[J]. 花木盆景:花卉园艺,2000(12):4.
[4]Cai X D,Cao Z,Xu S X,et al. Induction,regeneration and characterization of tetraploids and variants in ‘ TapestryCaladium[J]. Plant Cell Tissue & Organ Culture,2015,120(2):689-700.
[5]王 颖. 彩叶芋的组培扩繁及其抗寒性研究[D]. 杭州:浙江农林大学,2013:10-13.
[6]梁国平. 彩叶芋的组培快速繁殖[J]. 热带农业科技,1994(1):33.
[7]王 颖,陆国权. 彩叶芋组织培养研究进展[J]. 北方园艺,2012(12):196-198.
[8]Thongpukdee A,Thepsithar C,Chiensil P. Somaclonal variation of Caladium bicolor(Ait.) Vent. ‘ Jao Ying after in vitro culture propagation [J]. Acta Hort,2010,55:281-288.
[9]曹谷云,唐效蓉,程玉兰. 花叶芋的组织培养[J]. 湖南林业科技,1993(1):9-12.
[10]李维强,刘 静. 花叶芋组培快繁的应用研究[J]. 郑州牧业工程高等专科学校学报,2004,24(4):260-261.
[11]周祖富,艾素云. 彩叶芋薄层培养及胚状体发生的组织学研究[J]. 广西农业生物科学,1992,11(2):20-24.
[12]王鸿鹤,黄学林. 薄层培养的应用现状与前景[J]. 植物学报,1999,16(6):631-635.
[13]周宜君,周生闯,刘 玉,等. 植物生长调节剂对植物愈伤组织的诱导与分化的影响[J]. 中央民族大学学报:自然科学版,2007,16(1):23-28.

