基因组编辑育种技术及国内外发展态势分析
许 丽 王 玥 李祯祺 苏 燕(中国科学院上海生命科学信息中心,上海 200031)
基因组编辑育种技术及国内外发展态势分析
许 丽 王 玥 李祯祺 苏 燕(中国科学院上海生命科学信息中心,上海 200031)
许丽,硕士,中国科学院上海生命科学信息中心馆员,主要从事生命科学领域的战略情报和学科情报研究。
E-mail:xuli@sibs.ac.cn
基因组编辑技术自诞生以来,以其精确性和高效性迅速在作物和畜禽育种领域得到开发与应用,并展现出广阔的应用前景。随着技术壁垒降低,基因组编辑育种产业发展潜力初显,并已经开始进入基因组编辑育种时代。但是,在基因组编辑技术掀起动植物育种革命的同时,其安全隐患也成为公众关注的焦点,文章简析了基因组编辑育种技术的发展现状以及国内外发展态势,并对我国基因编辑育种技术的发展提出了一系列建议。
基因 组编辑技术自问世以来,因其精确性和高效性迅速应用于基础研究、农作物改良、微生物改造、疾病治疗等领域,2013年CRISPR/Cas技术的出现更是掀起了基因组编辑技术应用的狂潮。基因组编辑技术在动植物育种中的应用方兴未艾,给 动植物育种发展带来新思路,将使农业领域出现颠覆性创新。
1 生物学研究的有力工具
随着生物技术的不断发展,细胞核移植、转基因等生物工程技术推动了动植物育种的快速发展,但精准性差、效率低等问题阻碍了人类改造和利用生物的进程。 人工核酸内切酶介导的基因组编辑技术的出现,实现了对基因组基因组的高效、靶向修饰,且突破了物种和基因的限制,在动植物遗传改良领域掀起一场颠覆性革命。该技术获得多个奖项,先后入选“《Nature Methods》年度技术”、“《Science》年度十大科学突破”、“《The Scientist》年度生命科学七大技术突破”以及“《MIT科技评论》的年度十大科技突破”,并荣膺2015年度基础物理学和生命科学“科学突破奖”。
发展至今,目前基因组的精确编辑主要包括三种技术:锌指核酸酶(ZFN)技术、类转录激活因子样效应物核酸酶技术(TALEN)和RNA介导的成簇的规律间隔的短回文重复序列(CRISPR)。尤其是第三代基因组编辑技术CRISPR/ Cas技术,因其设计简单、价格低廉、易于编程且高效,成为最有应用前景的基因组编辑技术。
2 国内外基因组编辑育种技术快速发展
基因组编辑育种技术无需引入外源基因,可直接对动植物自身基因组进行操作,与自然突变或物理、化学诱变的机理相似,因此,基因组编辑育种不同于转基因育种,其应用潜力开始显现。
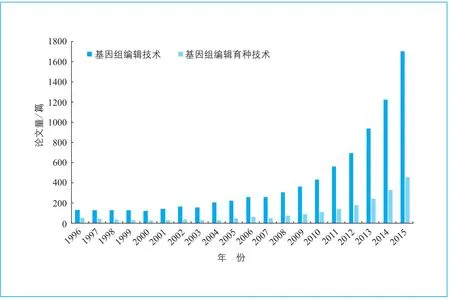
图1 基 因组编辑育种技术论文发表数量年度趋势
2.1 基因组编辑技术发展加速动植物育种步伐
20世纪90年代, 基因组编辑技术逐渐兴起,尤其是近几年发展迅速,相关研究论文发表量呈指数增长;基因组编辑技术也逐渐应用于育种领域,自2010年起论文发表量快速增加,仅2015年即发表了456篇相关论文(图1)。其中,美国在基因组编辑育种技术研究领域的发文量遥遥领先,德国、中国分居第2、第3位(图2)。基因组编辑技术目前已成功应用于烟草、水稻、小麦等作物的高产量、高抗性、新品种的选育,以及抗致命性病毒的猪、产含生长因子牛奶的牛等经济性畜禽的育种。
SHAN Q W, WANG Y P, LI J, et al.Targeted genome modification of crop plants using a CRISPRCas system.Nature Biotechnology.2013, 31(8):686-688.
2 参考文献
WANG Y P, CHENG X, SHAN Q W, et al.Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew.Nature Biotechnology.2014, 32(9):947-951.
3 参考文献
NIU Y, SHEN B, CUI Y, et al.Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos.Cell.2014, 156(4):836-843.
4 参考文献
ZETSCHE B, VOLZO S E, ZHANG F.A split-Cas9 architecture for inducible genome editing and transcription modulation.Nature Biotechnology.2015, 33(2):139-142.
5 参考文献
RAN F A, CONG L, YAN W X, et al.In vivo genome editing using Staphylococcus aureus Cas9.Nature.2015, 520(7546):186-191.
6 参考文献
SLAYMAKER I M, GAO L Y, ZETSCHE B, et al.Rationally Engineered Cas9 Nucleases with Improved Specificity.Science.2015, (6268): 84-88.
我国在基因组编辑技术的应用领域开展了一系列研究,并获得了多项突破性成果。我国科研人员利用基因组编辑技术实现了水稻和小麦基因的定点突变1 2,证实该技术可用于植物改良,提高育种效率;同时,我国先后建立全球首对靶向基因组编辑猴模型3、首例基因组编辑狗模型;并首次结合CRISPR/Cas9与体细胞核移植技术获得了位点特异性的基因敲入猪模型;发展至今,我国还利用基因组编辑技术首次实现了对家蚕丝、不同肉质的滩羊、不同毛色的绵羊的选育。
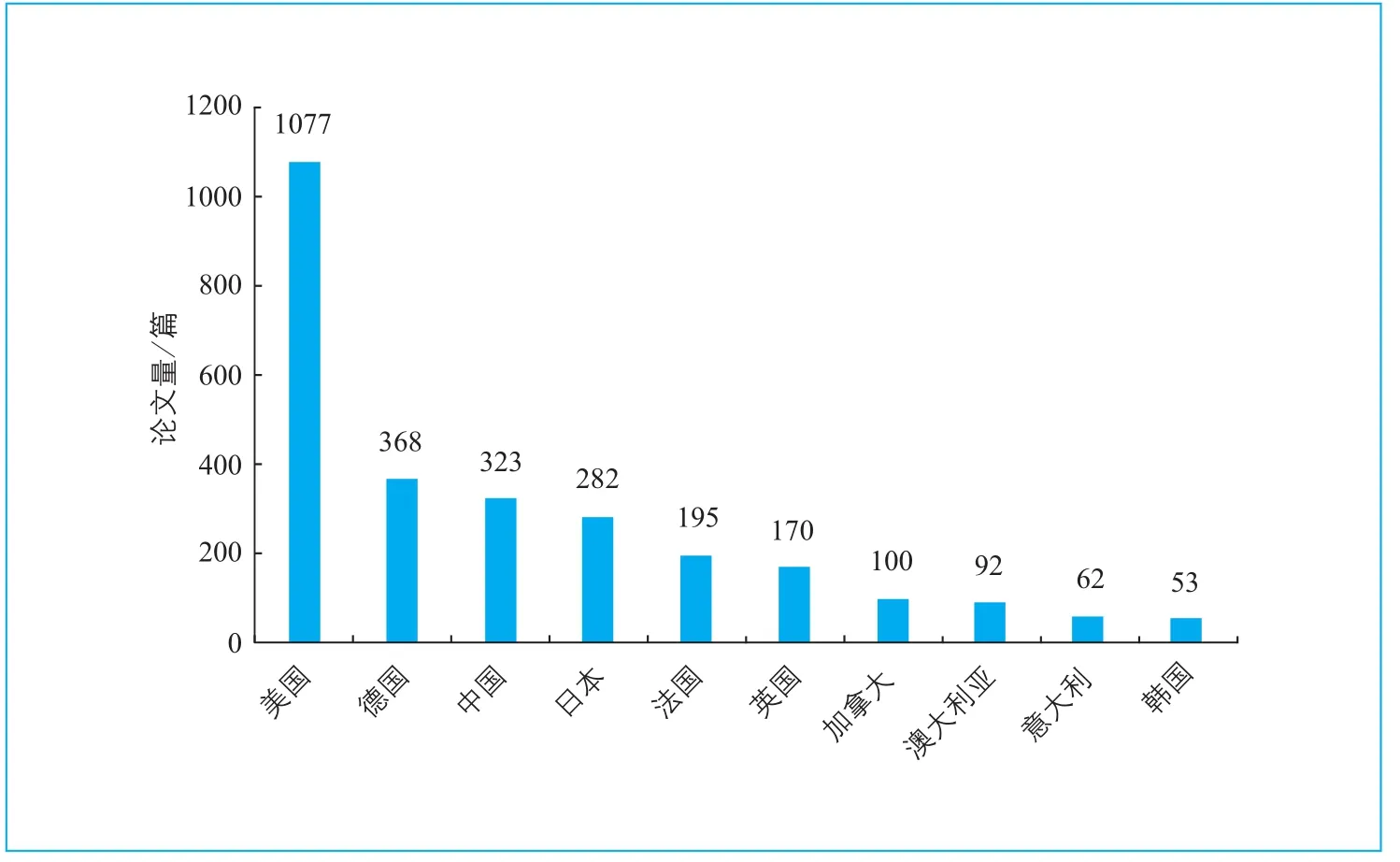
图2 基因 组编辑育种技术论文发表国家/地区分布
2.2 基因组编辑育种技术的应用范围将进一步扩展
基因组编辑技术专利4申请数量整体也呈增长趋势(数据来源于Thomson lnnovation数据库),2010年以后,相关专利申请数量快速攀升,至2015年达到357件(图3)。从专利申请的国家/地区分布来看,美国(190件)遥遥领先,中国(81项)位列第2,两国均较关注基因组编辑育种技术的应用开发。此外,日本、韩国等也开展了相关技术的开发工作(表1)。
7 参考文献
ZETSCHE B, GOOTENBERG J S, ABUDAYYEH O O, et al.Cpf1 Is a Single RNAGuided Endonuclease of a Class 2 CRISPR-Cas System.Cell.2015, 163(3):759-771.
8 参考文献
SHMAKOV S, ABUDAYYEH O O, MAKAROVA K S, et al.Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems.Molecular Cell.2015, 60(3):385-397.
9 参考文献
KONERMANN S, BRIGHAM M D, TREVINO A E, et al.Optical control of mammalian endogenous transcription and epigenetic states.Nature.2013, 500(7463):472-476.
10 参考文献
BARZEL A, PAULK N K, SHI Y, et al.Promoterless gene targeting without nucleases ameliorates haemophilia B in mice.Nature.2014, 517(7534): 360-364.
11 参考文献
GAO F, SHEN X Z, JIANG F, et al.DNA-guided genome editing using the Natronobacterium gregoryi Argonaute.Nature Biotechnology, 2016, 34: 768-773.
12 参考文献
HUANG S W, WEIGE D, BEACHY R N, et al.A proposed regulatory framework for genome-edited crops.Nature Genetics.2016, 48(2):109-111.
自基因组编辑技术出现以来,科研人员不断优化更新相关技术。ZFN技术操作过程繁琐、成本高、脱靶会导致细胞毒性,TALEN技术所使用的分子较大、载体导入困难等问题限制了ZFN和TALEN技术的应用。第三代基因组编辑技术CRISPR/Cas技术以其设计简单、价格低廉、易于编程且高效,引发基因组编辑育种狂潮。但是,CRISPR/Cas技术仍然存在脱靶等问题,影响了其应用的安全性和有效性。包括张锋本人在内的很多科学家围绕该技术不断 地进行改进。新型“分裂Cas9结构”4、金黄 色葡萄球菌Ca s9核酸酶5、化脓 性链球菌Cas9核酸酶6扩展了Cas9工具箱;CRISPR/Cpf1技术7、第二类C R I S P R/C a s技术8有助于降低CR ISPR/Cas技术的脱靶效应,提高其高效性和特异性。与光遗传技术整合开发的光诱导转录效应技术9,为光调控提供了方法;与体细胞核移植技术的结合,进一步扩展了基因组编辑技术在作物和畜禽育种领域的应用。缺陷基因功能性拷贝插入患者基因组中的新方法10可能成为新的基因组编辑技术;我国科研人员最新开发的NgAgo基因组编辑技术11,甚至有望超越CRISPR/Cas技术。而随着技术被不断改进,脱靶、安全性问题的解决,基因组编辑技术的应用范围将进一步扩大。

图3 基因组 编辑育种技术专利申请数量年度趋势
2.3 基因组编辑育种技术产业潜力初显

表1 基因组 编辑育种技术专利申请国家/地区分布
核心技术门槛的降低,意味着该行业将迎来爆发期。此前,由于技术壁垒与监管成本高昂,转基因育种被以孟山都公司为首的大公司垄断;而基因组编辑育种技术的应用,不仅减少了转基因新品种的风险,而且降低了准入门槛,使一些小公司、校办企业也有机会进入该领域。
目前,农业生物技术巨头已经开始进入基因组编辑育种时代。美国杜邦公司已获得CRISPR/Cas技术在主要农作物中的独家知识产权使用权,并预计到2020年底将会出售利用该技术编辑培育的种子。美国正在对通过基因组编辑技术获得的改良性大豆和玉米进行评估,预计最早将于5年内获批进入商业化。另外,美国Cibus公司推出的首个基因组编辑作物SU CanolaTM(抗磺酰脲除草剂油菜TM)已于2015年在美国开始商业化种植,并已获得了加拿大的批准。该公司通过基因组编辑技术开发的抗草甘膦亚麻品种,也有望于2019年在美国市场推出。
3 基因组编辑育种技术监管
快速发展的基因组编辑技术已在农业育种领域掀起应用狂潮,随之而来的安全隐患也成为公众关注的焦点。目前各国对利用该技术获得的产品尚无明确的管理标准。2015年6月,美国、英国、阿根廷、中国等多个国家和地区展开多次交流,旨在协调各个国家和地区对基因组编辑育种技术的监管。2016年初,中德美三国学者共同发表《关于基因组编辑作物监管框架的提案》12,提出了基因组编辑作物(genome-edited crops, GECs)管理框架。
基因组编辑育种不会引入新的遗传物质,通过该技术产生的遗传改变与自然发生的突变非常相似,所以划清转基因育种的界限对其监管尤为重要。目前,一种观点认为基因组编辑育种比转基因更天然,环境风险较小,应按非转基因动植物对待;另一种观点认为,基因组编辑技术门槛低,会加大环境风险,因此监管需更加严格;还有观点则认为对其监管应保持现状,然后再根据发展状况逐步减轻或加强监管程度,该观点认为技术操作精准度的提高并不会降低其风险。总之,大多数植物学家认为基因组编辑育种技术是常规植物育种策略的有益扩展,更易在全球范围内被接受。
3.1 美国关注基因组编辑育种产品本身风险评估
美国农业部、美国食品和药物管理局、美国环境保护署均关注基因组编辑育种技术的监管问题。2014年8月28日,美国农业部表示,基因组编辑育种技术不引入任何外源遗传物质,因此针对转基因育种的管理条例不再适用,该技术不受《生物技术监管协同框架》的管理。目前,美国对基因组编辑产品的监管遵循个案分析的原则、以科学为基础开展,基因组编辑育种产品与常规育种产品无法区分的情况下,两种产品应该等同对待。例如,美国Calyxt公司利用TALEN技术敲除相关基因,获得了耐冷藏且烹饪时较少产生致癌物质的土豆,美国农业部检测未发现其与传统土豆的差别,认定Calyxt土豆不受转基因法规监管。目前,美国政府已在网上公开一些产品的安全评价标准,供各国参考。
3.2 欧盟对基因组编辑育种产品监管相对严格
欧盟继1998年批准Mon 810转基因玉米及两个康乃馨生物技术新品种后,未再批准新的栽培申请。2007年,欧盟成立专家团就不断发展的植物育种技术进行评估,并于2012年提交报告,但相关评估报告并未公布。介于欧盟相关监管制度的滞后性,先正达公司停止了其在欧洲的基因工程项目,孟山都从欧盟撤走了其栽培档案。因此,如将基因组编辑育种纳入转基因育种范畴,该技术在欧盟将又一次陷入绝境。2015年初,国际绿色和平组织等环保组织提出,以任何方式改变DNA结构或干预基因调控的新方法均应受到欧盟的严格监管且安全标准需随技术提升而提高;欧洲食品安全局转基因生物小组则表示,如果新品种中无外源遗传物质且基因组编辑产生改变与自然突变无法区分,不应纳入已定义的转基因育种范畴;欧洲科学院科学咨询委员会则认为,不应对育种技术进行风险评估,而应针对具体新品种进行评估且在2015年初,欧洲植物科学组织与澳大利亚、日本和新西兰的相关机构重申了该观点。目前,欧洲委员会已启动了对“转基因生物体”定义的法律审查程序。2015年初,德国国家科学院发表意见书,希望德国政府重审其转基因法规,确定其监管范围。德国政府表示,欧洲委员会如认定“基因组编辑作物不是转基因作物”,则该国不会把通过基因组编辑获得的新品种视作转基因产品。
3.3 中国无针对基因组编辑育种的明确监管制度
中国针对基因组编辑育种的监管没有明确的制度,因而限制了我国研究成果的商业化生产。据2001年颁布的《农业转基因生物安全管理条例》,“农业转基因生物是指利用基因工程技术改变基因组构成,用于农业生产或者农产品加工的动植物、微生物及其产品”,通过基因组编辑获得的新品种符合该定义,因而应作为转基因新品种受到监管。为推动国内在该领域的发展,起草该条例的相关专家则建议:一要避免“转基因”概念引来的公众舆论压力,建议采用“精准育种技术”或“先进育种技术”概念;二是由于未引入外源基因,通过基因组编辑获得的新品种不应作为转基因新品种来管理;三是中国应制定简化、合理的监管程序。
目前,我国农业部针对基因组编辑育种技术的监管法规建设,还处于收集相关信息阶段,监督是否会比转基因育种技术宽松,则会参考欧美的监管策略。
3.4 其他国家对基因组编辑育种的监管表示关注
其他国家也关注基因组编辑育种的监管问题。阿根廷对由基因组编辑技术获得的动植物新品种的监管策略与美国类似,阿根廷国家农业生物技术咨询委员会认为,只要所获得产品不含外源基因,则不纳入转基因产品的监管范畴。日本规定利用基因组编辑获得的品种在种植及应用前,需请主管部门裁决该产品是否应纳入转基因产品进行监管。
4 未来发展建议
基因组编辑技术的优势,特别是不引入外源基因的特性,使其在分子育种中具有广阔的市场空间。我国在基因组编辑育种技术领域开展了一系列研究,并获得了多项突破性成果,但在技术研发和改进方面的工作相对较少,且其商业化进程仍相对滞后。因此,从长远来看,我国还要加强原创性基因组编辑技术的开发和改进,扩展基因组编辑技术应用范围研究。同时,注重知识产权保护策略的制定和监管法规的建设。
4.1 优化现有技术,发展新型基因组编辑育种技术
尽管较之传统生物工程技术,基因组编辑技术精确性和效率大大提高,但是仍然存在着脱靶等问题,提高了应用于作物和畜禽育种的风险,因此应着眼于开发识别脱靶位点的高通量筛查技术、降低脱靶效应方法以及特异的核酸酶输送方式,甚至研究应用真核生物核酸酶的可能性。此外,鉴于基因组编辑育种技术不可估量的商业价值,除了现有的CRISPR/ Cas技术外,还应开展具有自主知识产权的DNA剪切酶技术。
4.2 加强监管法规建设
基因组编辑技术是一把“双刃剑”,其技术伦理监管一直是各国政府和社会重点关注的问题。一方面,基因组编辑育种技术壁垒低,其滥用可能会造成无法预测的后果。另一方面,中国针对转基因育种采取的防守策略,即增加审批程序,在限制转基因产品进口的同时,很大程度上阻遏了我国在转基因育种领域的发展。鉴于此,相关监管部门应组织科学界、管理者、产业界等共同研讨,制定切实可行的法规,严格监控其应用范围和程度,在符合安全标准情况下发展基因组编辑育种技术,为人类和社会造福。
10.3969/j.issn.1674-0319.2016.04.006


