不同保存方法对天山樱桃总DNA提取效果的影响
李春侨,周 龙,陆 彪,齐延巧,盛 芳
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052;2.特克斯县林业局,新疆特克斯 835500)
不同保存方法对天山樱桃总DNA提取效果的影响
李春侨1,周 龙1,陆 彪2,齐延巧1,盛 芳1
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052;2.特克斯县林业局,新疆特克斯 835500)
【目的】寻找天山樱桃叶片样品较适合的保存方法,比较研究不同保存方法对天山樱桃总DNA提取效果的影响。【方法】以天山樱桃幼嫩叶片为试验材料,分别采用液氮保存、冷冻保存、干燥保存和微波不同时间处理后硅胶干燥保存等保存方法,比较分析各保存方法对所提取样品总DNA质量的影响。【结果】通过-70℃冷冻保存、室温保存、硅胶干燥保存、微波干燥2 min保存的样品所提取总DNA的纯度较高,液氮保存的样品所提取总DNA的完整性好;干燥保存法保存的样品所提取的总DNA扩增效果较好。【结论】考虑到野外采样受到多方面因素的限制,适合天山樱桃分子生物学研究的保存方法为硅胶干燥保存。
天山樱桃;保存方法;总DNA
0 引 言
【研究意义】天山樱桃(CerasustianschanicaPojark)又称野樱桃,哈萨克语称其牙,属于蔷薇科(Rosaceae)樱桃属(Cerasus)矮生樱亚属植物。目前天山樱桃在我国仅分布在新疆伊犁和塔城地区[1]。对于天山樱桃的研究主要集中在繁殖生物学特性、植物学特征、花粉萌发特性、组织培养中的茎段快速繁殖、花芽形态分化等方面,但还未涉及到天山樱桃分子生物学方面的研究。近年来对于分子生物学研究多采用分子标记的方法,尤其从20世纪90年代以来,基于PCR的RFLP、RAPD、SSR、AFLP等新的DNA分子标记技术层出不穷,无论采用哪种分子标记技术,都需要获得较高纯度和浓度的DNA样品[2]。而提取DNA的纯度和浓度与材料保存方法、新鲜程度和提取方法都有密切联系,研究天山樱桃分子生物学,必须研究天山樱桃叶片保存方法。【前人研究进展】目前对于样品保存方法的研究有很多,徐斌等[3]发现杜鹃红山茶叶片样品采用液氮保存,所提取样品总DNA完整性好,纯度高。黄建安等[4]认为茶树叶片样品采用硅胶干燥保存,使用SDS区室法可以提取到较高质量的总DNA。李志真等[5]发现光皮桦叶片样品采用核酸分离缓冲液保存,然后再使用改良的CTAB法可获得较高质量的总DNA。【本研究切入点】天山樱桃作为新疆特有的野生果树种质资源,属于矮生樱亚属植物,但是目前对于其分类学上的研究还不清晰,而现代分类学与亲缘关系的研究多采用分子标记的方法,这就涉及到如何获得高质量的天山樱桃总DNA,而天山樱桃自然分布于新疆天山野果林,路途遥远,分布地分散,很难做到及时带回,且天山樱桃叶片中富含糖与多酚,增加了对其总DNA的提取难度。【拟解决的关键问题】提取总DNA的质量与保存方法密切相关,如果叶片样品的保存方法不当,会严重影响所提取总DNA的质量。筛选出适合天山樱桃叶片总DNA提取的最佳保存方法,获得高质量的总DNA。
1 材料与方法
1.1 材 料
试验材料来源于新疆农业大学试验基地引种栽培的4 a生天山樱桃。
1.2 方 法
1.2.1 试验设计
将采集的天山樱桃叶片在实验室分为16份,处理1以新鲜叶片为材料,将新鲜叶片使用锡箔纸包好后存放在液氮中(处理2),冷冻保存法:将叶片存放入-70℃(处理3)、叶片存放入-20℃(处理4),干燥保存法:将叶片存放在室温下保存(处理5)、叶片使用硫酸纸包裹后存入有硅胶的密封袋中(处理6)、叶片在烘箱50℃干燥(处理7),微波不同时间处理:30 s、60 s、1.5 min、2 min、2.5 min、3 min、3.5 min、4.5 min、5.5 min(处理8、9、10、11、12、13、14、15、16),所有样品均保存26 d。
1.2.2 总DNA提取
叶片总DNA的提取方法与陈大明等[6]提取樱桃总DNA方法相同。
1.2.3 DNA质量检测
紫外分光光度计检测总DNA纯度和浓度;1.0%琼脂糖凝胶电泳检测总DNA完整性;2.0%琼脂糖凝胶检测总DNA扩增效果。
2 结果与分析
2.1 不同保存方法对总DNA纯度和浓度的影响
核酸的嘌呤、嘧啶中都有共轭双键,对紫外光有强烈的吸收作用,天然双链DNA在260 nm与280 nm处的吸收比值为1.8~2.0时纯度较好。不同保存方法对总DNA的纯度和浓度的影响可以看出,处理3、5、6、11的样品所提取总DNA纯度较高,处理2和处理13的样品所提取总DNA浓度最高,分别为0.8和0.95 μg/ μL;而处理1所提取总DNA浓度最低,只有0.2 μg/μL。表1
表1 不同保存方法总DNA纯度和浓度变化
Table 1 Effects of preservation methods on purity and concentration of genomic DNA
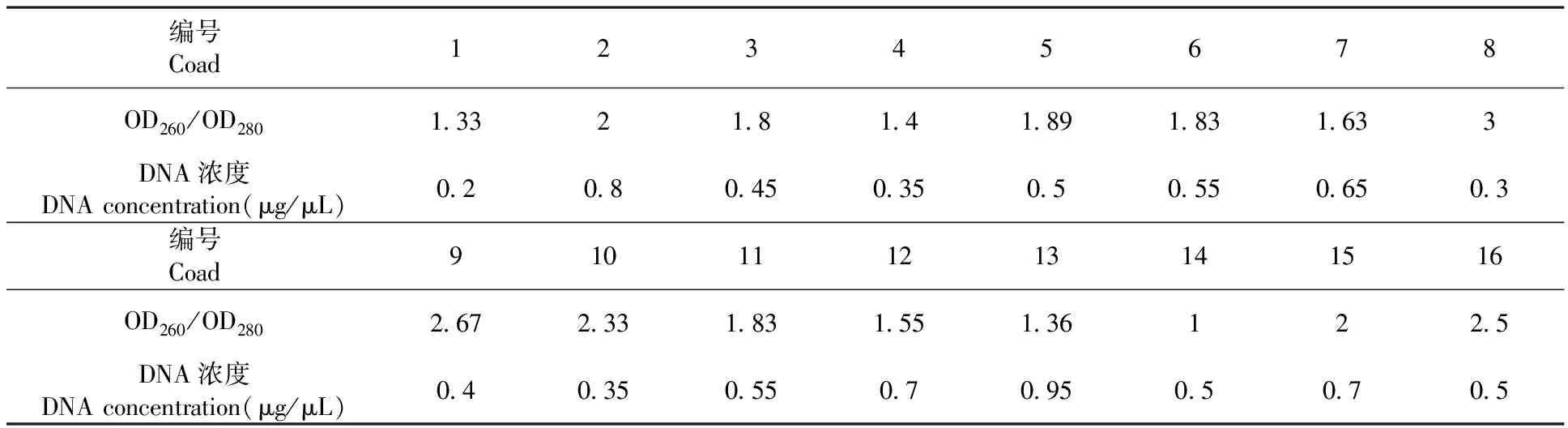
编号Coad12345678OD260/OD280133218141891831633DNA浓度DNAconcentration(μg/μL)02080450350505506503编号Coad910111213141516OD260/OD2802672331831551361225DNA浓度DNAconcentration(μg/μL)0403505507095050705
注:1:新鲜叶片、2:液氮保存、3:-70℃冷冻保存、4:-20℃冷冻保存、5:室温保存、6:硅胶干燥保存、7:烘箱干燥、8:微波30 s、9:1 min、10:1.5 min、11:2 min、12:2.5 min、13:3 min、14:3.5 min、15:4.5 min、16:5.5 min
Note:1:Fresh Leaf、2:Preservation in Liquid Nitrogen、3:Preservation at-70℃、4:Preservation at-20℃、5:Room Temperature、6: Dried with Silica、7:Dried with Oven、8:Microwave Treatment within 30 s、9:1 min、10:1.5 min、11:2 min、12:2.5 min、13:3 min、14:3.5 min、15:4.5 min、16:5.5 min
2.2 不同保存方法对总DNA完整性的影响
DNA是主要的遗传物质,要探究物种的遗传多样性,如果DNA不完整,就会对物种遗传多样性研究造成严重的影响。不同保存方法对总DNA完整性的影响可以看出:处理1和处理2的样品所提取总DNA条带整齐,无降解现象,且点样孔无残留;而处理8、9、10、11、12、13、14、15、16的样品所提取总DNA检测不出清晰条带。图1
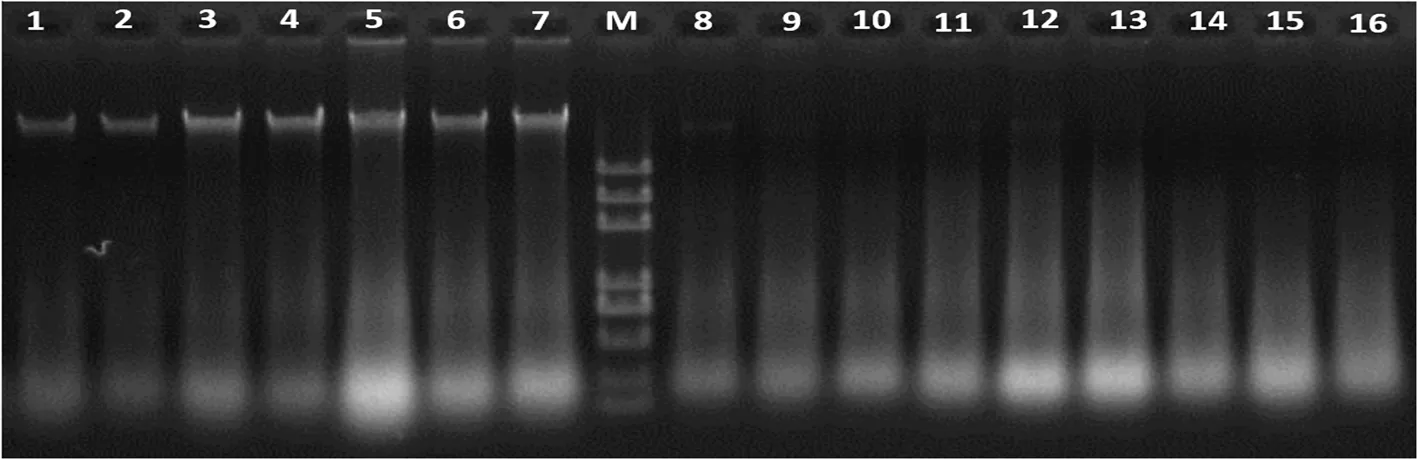
注:1:新鲜叶片、2:液氮保存、3:-70℃冷冻保存、4:-20℃冷冻保存、5:室温保存、6:硅胶干燥保存、7:烘箱干燥、8:微波30 s、9:1 min、10:1.5 min、11:2 min、12:2.5 min、13:3 min、14:3.5 min、15:4.5 min、16:5.5 min,下同
Note:1:Fresh Leaf、2:Preservation in Liquid Nitrogen、3:Preservation at -70℃、4:Preservation at -20℃、5:Room Temperature、6: Dried with Silica、7:Dried with Oven、8:Microwave Treatment within 30 s、9:1 min、10:1.5 min、11:2 min、12:2.5 min、13:3 min、14:3.5 min、15:4.5 min、16:5.5 min,the same as below
图1 不同保存方法总DNA的完整性
Fig.1 Effects of preservation methods on completeness of genomic DNA
2.3 不同保存方法对总DNA扩增效果的影响
DNA作为PCR扩增的模板,由引物扩增出特定的片段,如果DNA质量不高,很可能会造成扩增不完整和扩增错误,所以高质量的DNA对PCR扩增来说是不可缺少的。不同保存方法对总DNA扩增效果的影响可以看出:处理5、6、7样品所提取的总DNA可以扩增出较多的基因位点,主条带清晰一致,而处理16、17、18的样品所提取的总DNA扩增不出主条带,且条带少,弥散现象严重。图2
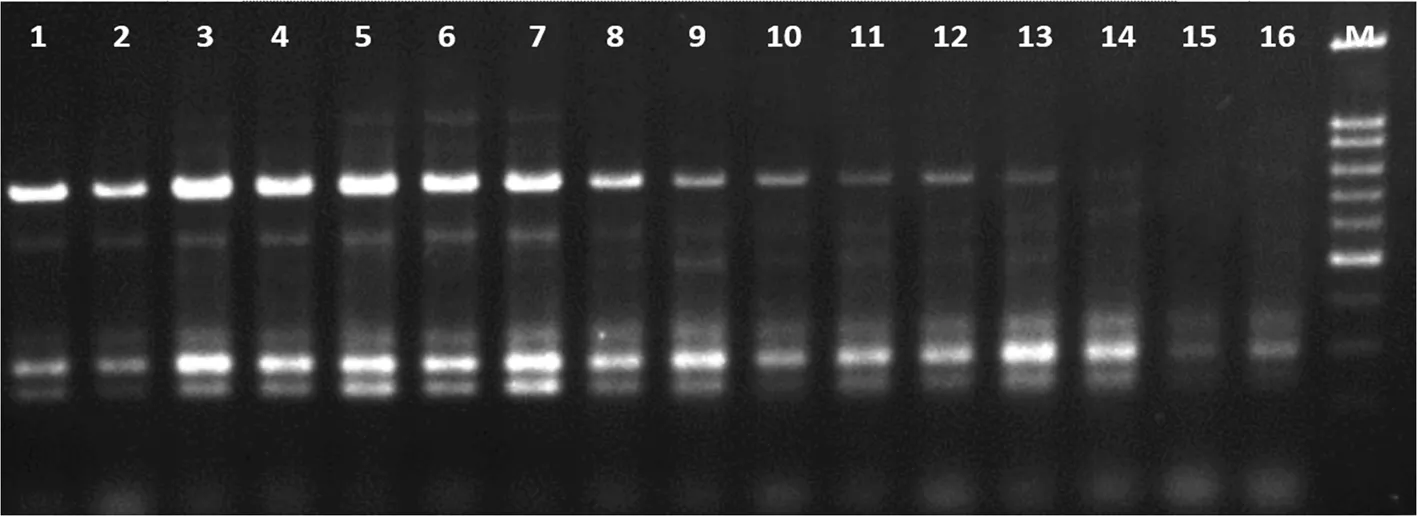
图2 不同保存方法DNA的PCR效果
Fig.2 Effects of preservation methods on PCR effect of DNA
3 讨 论
3.1 不同保存方法对提取总DNA纯度和浓度的影响
影响DNA纯度和浓度的因素有很多,主要集中在提取DNA时多糖与酚类物质没有去除干净,样品保存时间过长,样品保存方法不合适等方面。研究发现不同保存方法对所提取天山樱桃叶片总DNA的纯度和浓度影响较大,其中处理3、5、6、11(-70℃冷冻保存、室温保存、硅胶干燥保存、微波处理2 min)的样品所提取总DNA的纯度较高,这与李莉等[7]在枣叶片,王经源等[8]在刺桫椤叶片上的结论一致。而对于不同保存方法对DNA提取浓度的影响,研究发现处理6(硅胶干燥保存)所提取的DNA纯度较好,且浓度也高于均值;处理1(新鲜叶片)样品所提取总DNA的浓度最低,只有0.2 μg/μL,这与胡学林等[9]在提取新鲜核桃叶片总DNA的浓度1.5 μg/μL相比有较大差异,造成这种差异的主要原因可能是提取DNA的试剂和加样量不同,所以今后可以尝试适当增加样品量来提高天山樱桃总DNA的浓度。
3.2 不同保存方法对提取总DNA完整性的影响
关于不同保存方法对DNA完整性的影响研究有许多,朱田田等[10]提取使用液氮保存的中麻黄叶片总DNA,靖相密等[11]提取新鲜腊梅叶片总DNA,均可以获得较为完整的总DNA,这与研究中处理1、处理2和处理6(液氮保存的叶片、新鲜叶片,硅胶干燥保存)中获得完整的总DNA结果一致。同时研究中还发现,采用微波处理的所有天山樱桃样品所提取的总DNA无条带,推测可能是微波处理时损坏了天山樱桃叶片总DNA,造成DNA降解,因此认为天山樱桃叶片不适合使用微波干燥的保存方式。
3.3 不同保存方法对总DNA扩增效果的影响
PCR扩增的效果直接关系到分子标记的成功与否,也是进行基因连锁标记、遗传图谱的构建等研究的关键[12]。研究发现处理5、6、7(室温保存,硅胶干燥保存,烘箱干燥)的样品所提取的总DNA通过PCR扩增效果好,条带清晰且基因位点较多,这与刘春英等[13]在杨树叶片上,张海燕等[14]在胡杨叶片采取硅胶保存方法获得了较好的PCR扩增效果结论一致,但研究中硅胶干燥保存方法与刘春英和张海燕使用的硅胶保存方法不同,研究先使用硫酸纸包裹住样品后再装入有硅胶的密封袋中,干燥效果更好。
4 结 论
研究针对天山樱桃叶片采用液氮保存,冷冻保存,干燥保存和微波处理四种不同的保存方法,通过检测总DNA的质量研究发现不同的保存方法对天山樱桃叶片总DNA的质量影响不同。当采取-70℃冷冻保存、室温保存、硅胶干燥保存和微波处理2 min时叶片总DNA纯度较好;液氮保存和微波处理2 min有利于总DNA浓度的提高;使用液氮保存叶片样品时,总DNA的完整性最好;当采用硅胶干燥、室温干燥和烘箱干燥的保存方法保存叶片样品时,所提取的DNA可以获得条带完整、清晰可见的PCR扩增图谱。比较三种叶片总DNA提取质量的检测结果,结合天山樱桃的生境复杂性,认为硅胶干燥是天山樱桃叶片较为适合的保存方法。
References)
[1] 彭妮,周龙,王超,等.天山樱桃种子萌发特性研究[J].经济林研究,2015,33(3):145-149.
PENG Ni, ZHOU Long, WANG Chao, et al. (2015). Study on germination characteristics of seeds in Cerasus tianschanica [J].NonwoodForestResearch, 33(3): 145-149. (in Chinese).
[2] 张丽,周兰英,肖千文,等.核桃样本保存时间对DNA提取效果的影响[J].北方园艺,2008,(1):194-195.
ZHANG Li, ZHOU Lan-ying, XIAO Qian-wen, et al.(2008). Effect of Preserved Time to Extraction of Genomic DNA from Walnuts [J].NorthernHorticulture, (1): 194-195. (in Chinese).
[3] 徐斌,张方秋,潘文,等.鲜叶保存方法对杜鹃红山茶总DNA提取的影响[J].广东林业科技,2008,24(2):5-9.
XU Bin, ZHANG Fang-qiu, PAN Wen, et al.(2008).Effect of Different Preservation Methods of Fresh Leaves on Genomic DNA Extracted from Camelliaazalea [J].GuangdongForestryScienceandTechnology, 24(2): 5-9.(in Chinese).
[4] 黄健安,黄意欢,罗军武,等.鲜叶保存方法对茶树基因组DNA提取效果的影响[J].生命科学研究,2003,7(4):361-364.
HUANG Jian-an, HUANG Yi-huan, LUO Jun-wu, et al.(2003).Effect of Different Preservation Methods of Fresh Leaves on Genomic DNA Extraction from Tea Plant [J].LifeScienceResearch, 7(4): 361-364.(in Chinese).
[5] 李志真,谢一青,黄儒珠,等.不同保存方法对光皮桦总DNA提取效果的影响[J].分子植物育种,2006,4(1):131-134.
LI Zhi-zhen, XIE Yi-qing, HUANG Ru-zhu, et al.(2006). Effects of Different Preserved Methods for Total DNA Extraction of Betula Luminifera [J].MolecularPlantBreeding, 4(1):131-134.(in Chinese).
[6] 陈大明,张上隆,金勇丰.一种木本果树基因组DNA提取方法研究[J].浙江农业大学学报,1997,23(6):13-16.
CHEN Da-ming, ZHANG Shang-long, JIN Yong-feng. (1997). A method for genomic DNA preparation of woody fruit crops [J].JournalofZhejiangUniversity, 23(6): 13-16. (in Chinese).
[7] 李莉,彭建营,白瑞霞.不同方法对枣叶片基因组DNA提取效果的影响[J].果树学报,2007,24(3):389-392.
LI Li, PENG Jian-ying,BAI Rui-xia. (2007). Effect of different methods on Chinese jujube DNA extraction from leaves [J].JournalofFruitScience, 24(3): 389-392. (in Chinese).
[8] 王经源,黄儒珠.用于DNA提取的刺桫椤叶片组织保存方法研究[J].福建师范大学学报(自然科学版),2002,18(1):82-85.
WANG Jing-yuan, HUANG Ru-zhu. (2002).A Method for Field Preservation of Leaves Tissue for DNA Preparation of Alsophila spinulosa [J].JournalofFujianNormalUniversity, 18(1): 82-85. (in Chinese).
[9] 胡学林,乔霞,吴婷,等.核桃叶片不同保存方法对其DNA提取质量的影响[J].塔里木大学学报,2008,20(1):26-28,83.
HU Xue-lin, QIAO Xia, WU Ting, et al. (2008).The Influence of DNA Extraction Quality from Juglansregia L. Leaves in Different Preservation Methods [J].JournalofTarimUniversity, 20(1): 26-28,83.(in Chinese).
[10] 朱田田,杜弢,晋玲,等.不同保存方法对中麻黄总DNA提取效果的影响[J].山西农业科学,2013,41(1):23-25,59.
ZHU Tian-tian, DU Tao, JIN Ling, et al.(2013).Effect of Preservation Methods to Genomic DNA Extraction from Ephedra intermedia [J].JournalofShanxiAgriculturalSciences, 41(1):23-25, 59.(in Chinese).
[11] 靖相密,褚云霞,汤庚国,等.不同保存方法对蜡梅总DNA提取效果的影响及ISSR-PCR验证[J].分子植物育种,2008,6(2):387-392.
JING Xiang-mi, CHU Yun-xia,TANG Geng-guo, et al.(2008). Effects of Different Sample Preserving Methods on Genomic DNA Extraction of Chimonanthus praecox and their ISSR-PCR Validation [J].MolecularPlantBreeding, 6(2): 387-392. (in Chinese).
[12] 乔玉山,章镇,房经贵,等.中国李RAPD的优化反应体系及其在品种鉴定中的应用[J].果树学报,2003,20(6):445-449.
QIAO Yu-shan, ZHANG Zhen, FANG Jing-gui, et al.(2003).Optimal Reaction System of RAPD in Chinese Plum and Its Preliminary Use for Cultivar Identification [J].JournalofFruitScience, 20(6):445-449. (in Chinese).
[13] 刘春英,樊军锋,高建社,等.叶片不同保存方法对杨树总DNA提取效果的影响[J].西北林学院学报,2013,28(4):71-73.
LIU Cun-ying, FAN Jun-feng, GAO Jian-she, et al. (2013).Influence of Preservation Methods of Populus Leaves on Total DNA Extraction [J].JournalofNorthwestForestryUniversity, 28(4): 71-73. (in Chinese).
[14] 张海燕,焦培培,李志军,等.不同保存方法对胡杨-灰叶胡杨叶片总DNA质量的影响[J].塔里木大学学报,2008,20(2):47-52.
ZHANG Hai-yan, JIAO Pei-pei, LI Zhi-jun, et al.(2008).Comparison of the Effect on Different Preservation Metheds of Leaves of Populus Euphratica Oliv. and Populus Pruinosa Schrenk for DNA Analysis [J].JournalofTarimUniversity, 20(2): 47-52. (in Chinese).
Fund project:Supported by NSFC (31260466) and key discipline fund of pomology of Xinjiang Uygur Autonomous Region.
Effects of Different Preservation Methods on Genomic DNA Extraction ofCerasustianschanica
LI Chun-qiao1, ZHOU Long1, LU Biao2, QI Yan-qiao1, SHENG Fang1
(1.College of Forestry and Horticulture, Xinjiang Agricultural University, Urumqi 830052, China; 2. Forestry Bureau of Tekesi County, Tekesi Xinjiang 835500, China)
【Objective】 In order to find a sui
Table method for preserving leaf samples ofCerasustianschanica, the influence of genomic DNA extraction effect of different preservation methods was compared. 【Method】Using young leaves ofCerasustianschanicaas test material, the influence of genomic DNA extraction quality was compared through different preserving methods, such as liquid nitrogen,cryopreservation,drying,microwave treatment and etc.【Result】 The result showed that the high pure genomic DNA could be extracted by-70℃ cryopreservation, room temperature preservation, silica gel dry preservation, microwave treatment within 2 min preservation method. The integrity of genomic DNA could be extracted from the leaf samples stored with liquid nitrogen preservation method. The better amplification effect could be achieved with drying preservation method.【Conclusion】 Many factors of restriction on wild sample were taken into consideration, and we think the silica preservation method is the sui
Table way to do molecular biology research onCerasustianschanica.
Cerasustianschanica;preservation methods;genomic DNA
10.6048/j.issn.1001-4330.2016.05.009
2015-12-30
国家自然科学基金项目(31260466);新疆维吾尔自治区果树学重点学科资助项目
李春桥(1986-),男,河南人,硕士研究生,研究方向为分子生物学,(E-mail)lichunqiao3940@126.com
周龙(1976-),男,新疆人,副教授,博士,研究方向为果树种质资源与栽培生理,(E-mail)zhoulong2004@126.com
S662.5
A
1001-4330(2016)05-0845-05

