益生菌发酵产物对肉鸡肠道形态和肠道屏障功能的影响
张 俊,朱建津,刘江英,蒋 蓉,成向荣
(1.江南大学 食品学院,江苏 无锡 214122; 2.上海三智生物科技有限公司,上海 201706)
益生菌发酵产物对肉鸡肠道形态和肠道屏障功能的影响
张 俊1,朱建津1,刘江英1,蒋 蓉2,成向荣1
(1.江南大学 食品学院,江苏 无锡 214122; 2.上海三智生物科技有限公司,上海 201706)
为了研究益生菌发酵产物对肉鸡肠道形态和肠道屏障功能的影响,将495羽1日龄实验鸡随机分5组,每组9个重复,每重复11羽。各组饲喂不同饲粮:第Ⅰ组为正对照,基础日粮+杆菌肽锌80 mg·kg-1饲料+硫酸粘菌素20 mg·kg-1饲料+2%未发酵饲料;第Ⅱ组为负对照组,基础日粮+2%未发酵饲料;第Ⅲ组,基础日粮+1%未发酵饲料+1%发酵饲料;第Ⅳ组,基础饲粮+2%发酵饲料;第Ⅴ组,基础饲粮+2%灭菌发酵饲料。试验期70 d。试验结束时,取血清测内毒素(lipopolysaccharide,LPS)浓度,取回肠用于扫描电镜(SEM)检测,用无菌玻片刮取小肠黏膜用于测定肠道紧密连接蛋白的表达量。结果显示,第Ⅰ组、第Ⅳ组、第Ⅴ组血清内毒素水平有显著下降趋势;第Ⅴ组、第Ⅲ组绒毛比第Ⅱ组更长、更光滑,且其微绒毛长度显著高于第Ⅰ组、第Ⅳ组,但肠绒毛密度不及第Ⅰ组、第Ⅳ组。第Ⅴ组和第Ⅳ组肠道紧密连接蛋白表达量均显著上调。结果表明,不仅是益生菌,其发酵代谢产物对肠道健康也发挥重要作用。
发酵产物;肉鸡;肠道形态;紧密连接蛋白
抗生素作为促生长饲料添加剂用于畜禽养殖业已经有数十年,出现了细菌耐药性增加、抗生素残留等问题,因此寻找无毒副作用、无药残的绿色饲料添加剂替代抗生素成为必然趋势。目前研究表明,日粮中添加益生菌、益生元、酶、抗菌肽[1]、发酵饲料[2]、酸化剂[3]、天然植物[4]等能提高饲料转化效率、免疫功能、消化能力、胴体品质等,但是大部分替代物难以达到令人满意的效果。发酵饲料不仅含有益生菌,还有有机酸、肽等发酵代谢产物,研究表明,细菌细胞壁中肽聚糖的水解产物胞壁酰二肽(MDP)[5]、细菌分泌的磷壁酸[6]、某些乳杆菌的胞外蛋白和丁酸[7-8]、多聚磷酸盐[9]、多种细菌产生的吲哚[10]等能参与调节肠道上皮紧密连接蛋白的合成,促进动物肠道健康。为了研究益生菌及其发酵产物对肠道屏障的影响,本实验以在日粮中添加发酵饲料和灭菌发酵饲料并与正对照组及负对照组对比,通过观察肉鸡肠道形态、测定血清内毒素和紧密连接蛋白基因表达的情况,以评价益生菌发酵产物对肉鸡的肠道黏膜形态和屏障功能的影响。
1 材料与方法
1.1 材料
1.1.1 仪器
单向阀塑料袋(温州创佳包装材料有限公司);扫描电镜(SU1510,日本日立株式会社);实时定量PCR仪(Applied Biosystems Prism 7900,美国Applied Biosystems公司)。
1.1.2 试剂
植物乳杆菌菌液、发酵菌粉(上海三智生物科技有限公司);Biozol RNA提取试剂(美国BIOMIGA公司);ELISA试剂盒(厦门慧嘉生物科技有限公司);引物序列(上海捷瑞有限公司);SYBR Green Master Mix(韩国Bioneer公司)。
1.1.3 发酵饲料
发酵底物(豆粕40%、麦麸30%、玉米皮40%)经锤片式粉碎机粉碎,筛孔直径2 mm。植物乳杆菌菌液、菌粉、水和发酵底物按照质量10∶1∶500∶1 000的比例混匀,置于含单向阀塑料袋内,密封并保持在(25 ± 5) ℃,pH<4.8时饲料发酵成功。植物乳杆菌菌液Lactobacillusplantarum,发酵菌粉中枯草芽孢杆菌Bacillussubtilis、地衣芽胞杆菌Bacilluslicheniformis、酿酒酵母Saccharomycescerevisiae的活菌数分别为1×108、0.5×107、5×107、1.5×107cfu·g-1。
1.1.4 灭菌发酵饲料
将发酵饲料密封,121 ℃灭菌10 min。
1.1.5 实验动物
购自常州立华畜禽有限公司的1日龄慢速黄羽肉鸡495羽,初重(41.27 ± 0.49) g
1.1.6 基础日粮
试验日粮为玉米豆粕型日粮,参照美国国家研究委员会标准(NRC,1994)配制,基础日粮组成及营养成分见表1。
1.2 试验设计与动物饲养
将495羽实验鸡随机分成5组,每组9个重复,每重复11羽。第Ⅰ组为正对照,饲喂基础日粮+杆菌肽锌80 mg·kg-1+硫酸粘菌素20 mg·kg-1饲料;第Ⅱ组为负对照组,饲喂基础饲粮;第Ⅲ组为基础饲粮+1%发酵饲料;第Ⅳ组为基础饲粮+2%发酵饲料;第Ⅴ组为基础饲粮+2%灭菌发酵饲料。实验鸡自由饮水和采食,常规免疫,常规饲养管理。实验期70 d,试验结束时,每组选择体质量接近的鸡8羽(公母各半),进行屠宰试验。
1.3 样品采集
在实验第70天,处理组中随机选取8羽接近平均体质量的健康仔鸡屠宰,肉鸡颈脉放血,用采血管收集血液,待血液自然凝固后,1 574g,离心10 min,取上层血清分装于0.5 mL 塑料离心预混料为每kg日粮提供:Mn 110 mg (MnSO4·H2O);Fe 66.5 mg (FeSO4·H2O);Zn 88 mg (ZnSO4·7H2O);Cu 8.8 mg (CuSO4·5H2O);I 0.7 mg (CaI2);Se 0.288 mg (Na2SeO3);VA 11 500 IU;VD33500 IU;VE 30 mg;VK35 mg;VB13.38 mg;VB29 mg;VB68.96 mg;VB120.025 mg;氯化胆碱800 mg;泛酸钙13 mg;烟酸45 mg;生物素0.08 mg;叶酸1.20 mg。
表1 基础日粮配方及营养水平
Table 1 Composition and nutrient levels of the basal diet
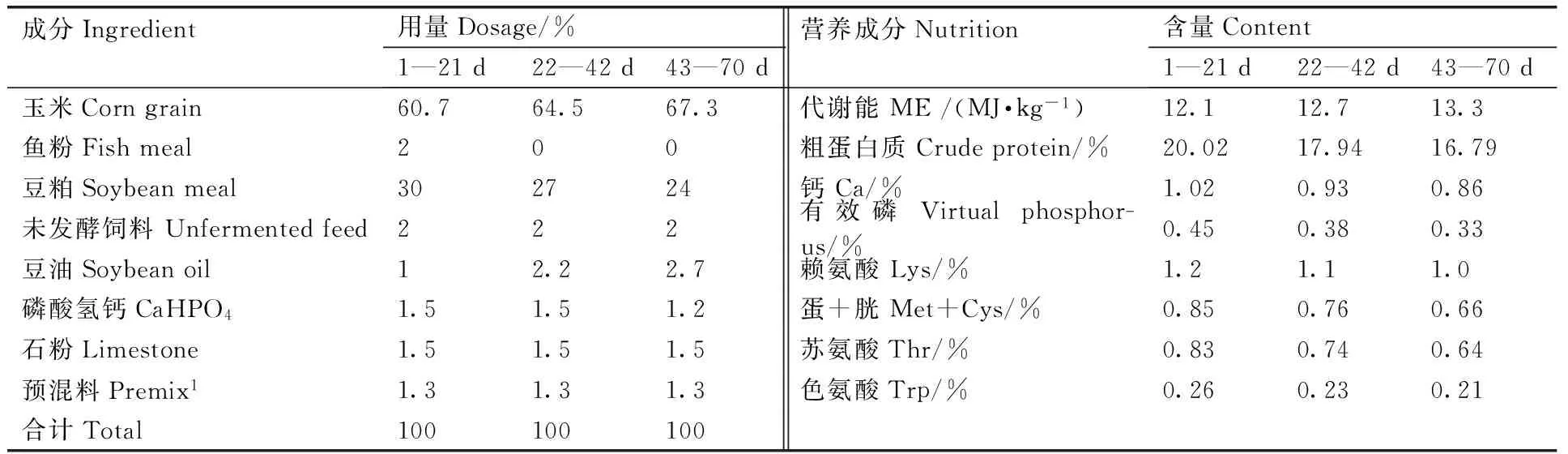
成分Ingredient用量Dosage/%1—21d22—42d43—70d营养成分Nutrition含量Content1—21d22—42d43—70d玉米Corngrain60.764.567.3代谢能ME/(MJ·kg-1)12.112.713.3鱼粉Fishmeal200粗蛋白质Crudeprotein/%20.0217.9416.79豆粕Soybeanmeal302724钙Ca/%1.020.930.86未发酵饲料Unfermentedfeed222有效磷Virtualphosphor-us/%0.450.380.33豆油Soybeanoil12.22.7赖氨酸Lys/%1.21.11.0磷酸氢钙CaHPO41.51.51.2蛋+胱Met+Cys/%0.850.760.66石粉Limestone1.51.51.5苏氨酸Thr/%0.830.740.64预混料Premix11.31.31.3色氨酸Trp/%0.260.230.21合计Total100100100
Premix provided for per kilogram of diet: Mn 110 mg (as MnSO4·H2O); Fe 66.5 mg (FeSO4·H2O); Zn 88 mg (ZnSO4·7H2O); Cu 8.8 mg (CuSO4·5H2O); I 0.7 mg (CaI2); Se 0.288 mg (Na2SeO3); VA 11 500 IU; VD33 500 IU; VE 30 mg; VK35 mg; VB13.38 mg; VB29 mg; VB68.96 mg; VB120.025 mg; Choline chloride 800 mg; Calcium pantothenate 13 mg; Niacin 45 mg; Biotin 0.08 mg; Folic acid 1.20 mg.
管中;迅速取肠分段,用载玻片轻轻刮取回肠中段肠黏膜置于塑料离心管并加入1.5 mL Biozol RNA提取试剂,皆用液氮速冻并置于-80 ℃超低温冰箱中保存。取回肠近中段,用4%戊二醛清洗并固定。
1.4 测定指标及方法
1.4.1 肠绒毛形态
常规方法制成扫描电镜材料, 用扫描电镜观察、照相,并测量微绒毛长度。
1.4.2 血清内毒素测定
严格按照ELISA试剂盒说明操作。
1.4.3 紧密连接蛋白基因表达
实时定量PCR(real time-PCR)法测定回肠黏膜转录因子NF-KBp65、Toll样受体TLR2、紧密连接蛋白Claudin-3、Occludin、ZO-1与内参基因β-actin的相对表达丰度。提取肠黏膜组织总RNA,琼脂糖凝胶电泳检查RNA的完整性。核酸蛋白检测仪于260 nm检测RNA浓度并稀释到合适浓度进行反转录。cDNA反转录反应体系(10 μL):第一步,模板RNA+DEPC水6.00 μL,dNTP(10 nmol·L-1)2.00 μL,Oligo(dT)2.00 μL混匀,70 ℃水浴5 min后,迅速取出至冰浴冷却;第二步,DEPC水9.25 μL ,5×逆转录缓冲液5.00 μL,Rnase Inhibitor(50 U·μL-1)0.25 μL,M-MLV逆转录酶(200 U·μL-1)0.50 μL混匀,37 ℃水浴1.5 h,95 ℃水浴5 min,4 ℃冷却。从而得到cDNA样品,将反转录得到的cDNA分别稀释至适当浓度后作为荧光定量PCR反应模板,-20 ℃保存。运用Prime Premier 5.0软件设计紧密连接蛋白基因和内参基因引物,引物序列见表2。实时定量PCR仪进行测定。反应体系为10 μL∶SYBR Green Master Mix 5.0 μL,上下游引物各0.4 μL,cDNA 0.5 μL,DEPC水3.7 μL。PCR反应条件为: 95 ℃预变性5 min,95 ℃变性20 s,60 ℃退火30 s,共40个循环,72 ℃延伸2 min,最后95 ℃ 15 s生成熔解曲线。
1.5 统计分析数据
用Excel统计后,根据各基因的Ct值计算扩增效率和分析熔解曲线,以确定模板和引物达到用荧光定量检测组织相对表达量的要求。用2-ΔΔCt法计算出肠道粘膜每个样品重复3 次后取平均值。通过SPSS17.0进行One-way ANOVA 分析,并进行LSD与Duncan’s 多重比较,以P<0.05作为差异显著性判断标准,数据结果均以平均值±标准误(SEM) 表示。
2 结果与分析
2.1 发酵产物对回肠形态的影响
由图1可知,Ⅰ组(A)回肠绒毛褶皱数目相对较多,绒毛密度高,绒毛间缝隙较小,绒毛表面略粗糙;Ⅱ组(B)肠绒毛褶皱较少,绒毛变宽、严重萎缩并塌陷,绒毛密度较低;Ⅲ组(C)的肠绒毛褶皱饱满、表面光滑、较粗短,绒毛数量相对正对照组较少;Ⅳ组(D)肠绒毛褶皱较Ⅱ组、Ⅲ组、Ⅴ组多,绒毛密度较高,绒毛饱满且表面光滑;Ⅴ组(E)的肠绒毛与Ⅲ组相似,但肠绒毛表面比Ⅲ组光滑,且绒毛较长,表明实验组改善了肠道形态。
表2 Real-time PCR 所需序列引物
Table 2 Primer sequences for Real-time PCR analysis
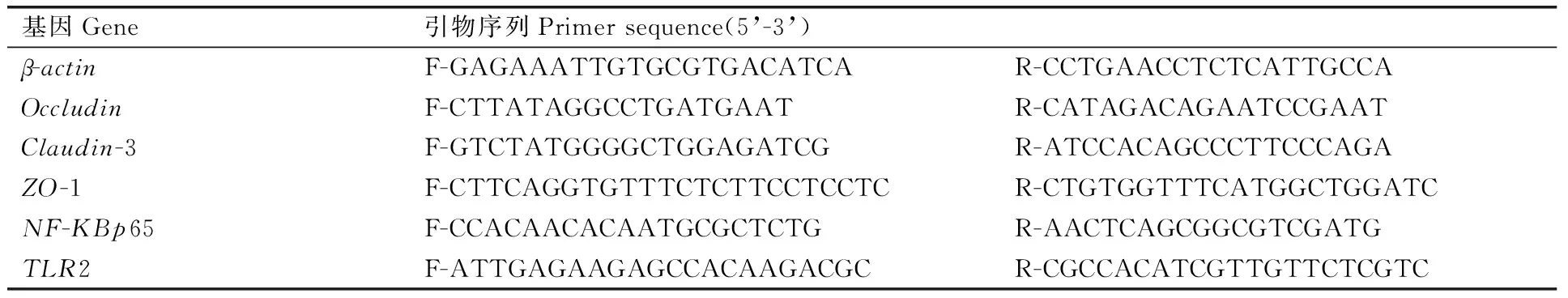
基因Gene引物序列Primersequence(5’-3’)β-actinF-GAGAAATTGTGCGTGACATCAR-CCTGAACCTCTCATTGCCAOccludinF-CTTATAGGCCTGATGAATR-CATAGACAGAATCCGAATClaudin-3F-GTCTATGGGGCTGGAGATCGR-ATCCACAGCCCTTCCCAGAZO-1F-CTTCAGGTGTTTCTCTTCCTCCTCR-CTGTGGTTTCATGGCTGGATCNF-KBp65F-CCACAACACAATGCGCTCTGR-AACTCAGCGGCGTCGATGTLR2F-ATTGAGAAGAGCCACAAGACGCR-CGCCACATCGTTGTTCTCGTC

A—E分别为Ⅰ—Ⅴ组。SEM×150A-E showed result of treatment Ⅰ-Ⅴ, respectively. SEM×150图1 益生菌发酵产物对肉鸡回肠绒毛形态的影响Fig.1 Effects of fermentation metabolite on intestinal villus morphology of chicken ileum
2.2 发酵产物对血清内毒素水平和微绒毛高度的影响
由表3可知,实验组Ⅲ、Ⅳ、Ⅴ的血清内毒素含量相对于负对照组Ⅱ组分别提高4.8%、6.7%和6.1%,且高于正对照组Ⅰ组,但差异均不显著(P=0.08),表明抗生素、发酵饲料和发酵产物在一定程度上可降低肠道通透性。实验Ⅴ组回肠微绒毛高度比Ⅰ组、Ⅲ组、Ⅳ组分别提高70.5%、27.1%、72.4%(P<0.05),但与Ⅱ组差异不显著(P>0.05)。Ⅲ组微绒毛高度比Ⅰ组、Ⅳ组分别高34.1%、35.6%(P<0.05),Ⅰ组、Ⅳ组之间无LPS,内毒素水平;HIM,回肠微绒毛高度。同列数据后无相同小写字母的表示差异显著(P<0.05),n=8。下同。
表3 益生菌发酵产物对肉鸡血清内毒素水平和回肠微绒毛高度的影响
Table 3 Effects of fermentation metabolite on serum LPS and height of ileum microvilli (HIM) in broilers

处理Treat-mentsLPSHIM/μmⅠ11.77±0.500.88±0.02cⅡ13.75±0.601.51±0.04aⅢ13.09±1.341.18±0.06bⅣ12.83±0.640.87±0.03cⅤ12.91±0.301.50±0.02a
LPS, lipopolysaccharide content. HIM, height of ileum microvilli in broilers. Data in the same column followed by no same letter indicated significant difference atP<0.05.n=8. The same as below.
显著差异(P>0.05),表明发酵产物扩大肠道吸收面积。
2.3 发酵产物对紧密连接蛋白基因表达的影响
由表4可知,添加灭菌发酵饲料组Ⅴ组肠黏膜的TLR2、claudin-3、ZO-1、NF-kBmRNA表达量显著高于负对照组II组(P<0.05),但TLR2、claudin-3的mRNA表达量显著低于发酵饲料组Ⅳ组(P<0.05);Ⅳ组TLR2、claudin-3、ZO-1、NF-kB的mRNA表达量显著高于负对照组(P<0.05),且claudin-3的表达量显著高于正对照组。各个处理对occludin的表达没有显著影响(P>0.05)。
表4 益生菌发酵产物对肉鸡回肠紧密连接蛋白基因表达的影响
Table 4 Effects of fermentation metabolite on expressions of tight junction protein genes in chicken ileum
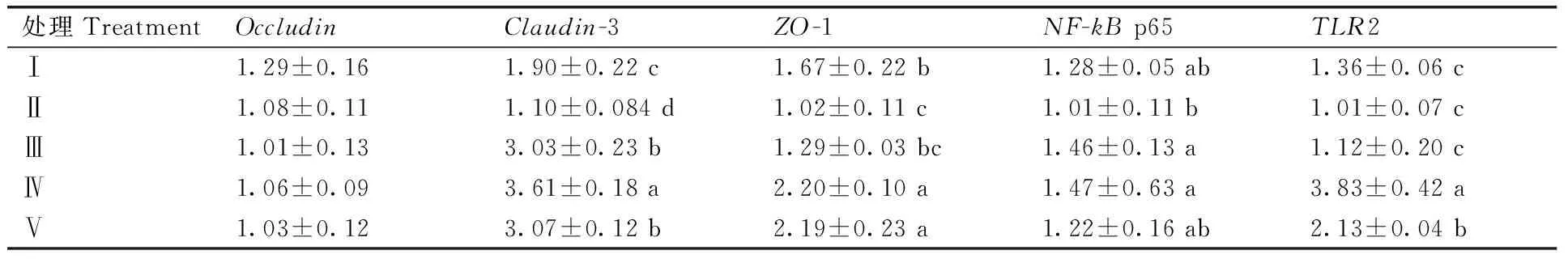
处理TreatmentOccludinClaudin-3ZO-1NF-kBp65TLR2Ⅰ1.29±0.161.90±0.22c1.67±0.22b1.28±0.05ab1.36±0.06cⅡ1.08±0.111.10±0.084d1.02±0.11c1.01±0.11b1.01±0.07cⅢ1.01±0.133.03±0.23b1.29±0.03bc1.46±0.13a1.12±0.20cⅣ1.06±0.093.61±0.18a2.20±0.10a1.47±0.63a3.83±0.42aⅤ1.03±0.123.07±0.12b2.19±0.23a1.22±0.16ab2.13±0.04b
3 讨论
良好的肠道形态对肉鸡健康至关重要,如小肠绒毛密度、长度和微绒毛高度会影响小肠的吸收面积,肠绒毛表面光滑有利于防御微生物入侵、发挥物理屏障功能、提高健康水平[11]。本实验中添加2%灭菌发酵饲料组的回肠绒毛密度与添加1%发酵饲料组的回肠绒毛相似且都有提高,但低于添加2%发酵饲料组和正对照组。但其微绒毛高度相对增高,从而扩大了小肠面积,这恰好与正对照组的结果相反。表明灭菌和未灭菌发酵饲料都能改善肠道形态,发酵饲料中的益生菌和发酵产物都产生了有益影响。但灭菌发酵饲料对肠道形态的改善程度不如未灭菌发酵饲料,因为益生菌能改善肠道形态[12],所以可能是灭菌后活菌数降低,降低了对肠绒毛密度增加的刺激。但是其效果仍优于负对照组,推测原因可能是发酵产物中的有机酸、氨基酸、小肽等代谢产物改善了肠内营养状态,有利于微绒毛的生长发育。
内毒素是革兰氏阴性细菌在代谢过程或死亡后从细胞壁中释放出来的类脂多糖体(脂多糖)。内毒素会随肠道细菌的移位进入血液循环而引起一系列病理改变,因此,血清内毒素能间接反映肠黏膜的屏障功能[13]。本实验中,负对照组和实验组Ⅳ、Ⅴ的血清内毒素浓度均有降低趋势,但差异不显著,在一定程度上表明发酵饲料和灭菌发酵饲料降低了肠道通透性,提高了肉鸡肠道屏障功能。此结果与肠道形态结构的改善相对应。
肠粘膜上皮细胞之间的紧密连接是肠道物理屏障的主要结构,紧密连接的通透性决定着整个肠上皮细胞的屏障功能[14]。益生菌可以提高紧密连接蛋白的表达量。Patel等[15]研究发现在新生小鼠日粮中添加益生菌可以促进claudin-3的表达,同时促进新生小鼠肠道屏障功能的发育成熟;Resta-Lenert等[16]研究发现嗜热乳酸链球菌(Streptococcusthermophilus)和嗜酸乳杆菌能够激活磷酸肌醇3激酶(PI3K)信号分子通路、p38、ERK、c-Jun氨基末端激酶(JNK),提高ZO-1和Occludin蛋白磷酸化表达量,增强HT-29细胞和Caco-2细胞的屏障功能。基因水平的研究表明,植物乳杆菌(Lactobacillusplantarum)MB452能够改变肠上皮细胞紧密连接蛋白相关基因表达量,如编码细胞骨架和Occludin的基因[17]。在本实验中,日粮中添加2%发酵饲料和2%灭菌发酵饲料与添加抗生素和未发酵饲料相比,回肠黏膜中claudin-3、ZO-1、TLR2的表达量均显著上调,添加2%发酵饲料的肉鸡回肠黏膜NF-kBp65表达量显著高于负对照组,且与其他组无显著差别,因此,发酵饲料组的结果可能是因为益生菌的作用。本实验中,灭菌的发酵饲料也提高了紧密连接蛋白表达量,可能是益生菌的细胞壁成分或发酵代谢产物的影响。研究表明,细菌细胞壁中肽聚糖的水解产物胞壁酰二肽(MDP)可通过增强TLR2-MyD88-Nf-kB信号通路增强TJ蛋白表达[5],细菌分泌的磷壁酸也参与TJ调节[6]。此外,细菌的一些代谢产物也参与TJ的调节,如某些乳杆菌的胞外蛋白和丁酸[7-8]、多聚磷酸盐[9]、多种细菌产生的吲哚[10]。
综上所述,益生菌发酵产物能在一定程度上降低血清内毒素水平,改善肠道形态,上调肠道紧密连接蛋白表达量,表明益生菌发酵产物能改善肠道形态结构和提高肠道机械屏障功能。但是详细机制尚不完全清楚,需要进一步探究。
[1] THACKER P A. Alternatives to antibiotics as growth promoters for use in swine production: a review [J].JournalofAnimalScienceandBiotechnology, 2013, 4(35):1-12.
[2] NIBA A, BEAL J, KUDI A, et al. Bacterial fermentation in the gastrointestinal tract of non-ruminants: influence of fermented feeds and fermentable carbohydrates [J].TropicalAnimalHealthandProduction, 2009, 41(7):1393-1407.
[3] 冯尚连, 朱建津, 孙玥莹, et al. 乳酸对仔猪消化酶发育的影响 [J]. 浙江农业学报, 2013, 25(3):475-479.
FENG S L, ZHU J J, SUN Y Y, et al. Effects of lactate on the development of Digestive enzymes in piglets [J].ActaAgriculturaeZhejiangensis, 2013, 25(3): 475-479. (in Chinese with English abstract)
[4] 冯尚连, 姜红进, 朱建津, 等. 超微粉碎茶粉对猪生长和胴体品质的影响 [J]. 浙江农业学报, 2014, 26(2):285-289.
FENG S L, JIANG J H, ZHU J J, et al. Effect of ultramicro-pulverization tea powder on growth and carcass quality of pigs [J].ActaAgriculturaeZhejiangensis, 2014, 26(2): 285-289. (in Chinese with English abstract)
[5] HIEMSTRA I H, BOUMA G, GEERTS D, et al. Nod2 improves barrier function of intestinal epithelial cells via enhancement of TLR responses [J].MolecularImmunology, 2012, 52(3/4):264-272.
[6] MIYAUCHI E, MORITA M, ROSSI M, et al. Effect of D-alanine in teichoic acid from the Streptococcus thermophilus cell wall on the barrier-protection of intestinal epithelial cells [J].Bioscience,Biotechnology,andBiochemistry, 2012, 76(2):283-288.
[7] BANSAL T, ALANIZ R, JAYARAMAN A. Role for the Bacterial Signal Indole in Promoting Epithelial Cell Barrier Function [J].JournalofEpithelialBiologyandPharmacology, 2012, 5(1):32-38.
[8] PENG L, LI Z R, GREEN R S, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers [J].TheJournalofNutrition, 2009, 139(9):1619-1625.
[9] SEGAWA S, FUJIYA M, KONISHI H, et al. Probiotic-derived polyphosphate enhances the epithelial barrier function and maintains intestinal homeostasis through integrin-p38 MAPK pathway [J].PloSOne, 2011, 6(8):e23278.
[10] SANCHEZ B, URDACI M C, MARGOLLES A. Extracellular proteins secreted by probiotic bacteria as mediators of effects that promote mucosa-bacteria interactions [J].Microbiology, 2010, 156(11):3232-3242.
[11] YAMAUCHI K-E. Review on chicken intestinal villus histological alterations related with intestinal function [J].TheJournalofPoultryScience, 2002, 39(4):229-242.
[12] PIRARAT N, PINPIMAI K, ENDO M, et al. Modulation of intestinal morphology and immunity in nile tilapia (Oreochromisniloticus) byLactobacillusrhamnosusGG [J].ResearchinVeterinaryScience, 2011, 91(3):92-97.
[13] WU B, CUI H, PENG X, et al. Analysis of the Toll-like receptor 2-2 (TLR2-2) and TLR4 mRNA expression in the intestinal mucosal immunity of broilers fed on diets supplemented with nickel chloride [J].InternationalJournalofEnvironmentalResearchandPublicHealth, 2014, 11(1):657-670.
[14] ELAMIN E, JONKERS D, JUUTI-UUSITALO K, et al. Effects of ethanol and acetaldehyde on tight junction integrity:invitrostudy in a three dimensional intestinal epithelial cell culture model [J].PloSOne, 2012, 7(4):e35008.
[15] PATEL R M, MYERS L S, KURUNDKAR A R, et al. Probiotic bacteria induce maturation of intestinalclaudin3 expression and barrier function [J].TheAmericanJournalofPathology, 2012, 180(2):626-635.
[16] RESTA-LENERT S, BARRETT K. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasiveEscherichiacoli(EIEC) [J].Gut, 2003, 52(7):988-997.
[17] ANDERSON R C, COOKSON A L, MCNABB W C, et al.LactobacillusplantarumMB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation [J].BioMedCentralMicrobiology, 2010, 10:316.
(责任编辑 卢福庄)
Effects of fermentation metabolite produced by probiotics on intestinal morphology and intestinal barrier function in chicken
ZHANG Jun1, ZHU Jian-jin1, LIU Jiang-ying1, JIANG Rong2, CHENG Xiang-rong1
(1.SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi214122,China; 2.ShanghaiSanzhiBiotechnologyCo.Ltd.,Shanghai201706,China)
In order to evaluate the effects of fermentation metabolite produced by probiotics on intestinal morphology and intestinal barrier function in chicken, 495 1-d-old broilers were randomly allotted into 5 dietary treatments, namely: Treatment Ⅰ, positive control, basal diet + bacitracin zinc 80 mg·kg-1feed + colistin sulfate 20 mg·kg-1feed + 2% unfermented feed; Treatment Ⅱ, negative control, basal diet + 2% unfermented feed; Treatment Ⅲ, basal diet + 1.0% fermented feed + 1% unfermented feed; Treatment Ⅳ, basal diet + 2.0% fermented feed; Treatment Ⅴ, basal diet + 2.0% sterilized fermented feed. The serum was collected for lipopolysaccharide (LPS) test, ileum was removed for observation of intestinal morphology by scanning electron microscopy (SEM), and the intestinal mucosa was scraped from the ileum by glass slide to determine the expression of intestinal tight junction. It was shown that the levels of serum lipopolysaccharide in treatment Ⅰ, Ⅳ, Ⅴ tended to be decreased significantly. The treatment Ⅴ and Ⅲ had higher and smoother intestinal villus in ileum than treatment Ⅱ, and the length of microvilli in these 2 treatments were significantly higher than that in treatment Ⅰ and Ⅳ, but villi density was less than that of treatment Ⅰ and Ⅳ. The expression of intestinal tight junction protein in treatment Ⅴ and Ⅳ were up-regulated significantly. These results suggested that not only probiotics but also fermentation metabolite played role in intestinal barrier function.
fermentation metabolite; broilers; intestinal morphology; tight junction protein
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2016.10.05
2016-02-19
江苏省自然科学基金(青年项目)(BK20140147)
张俊(1990—),女,河南南阳人,硕士研究生,研究方向为营养代谢与调控。E-mail: 18206180298@163.com
S831;Q939.9
A
1004-1524(2016)10-1657-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(10): 1657-1662
张俊,朱建津,刘江英,等. 益生菌发酵产物对肉鸡肠道形态和肠道屏障功能的影响[J].浙江农业学报,2016,28(10): 1657-1662.
——鞭毛、纤毛和微绒毛(2)

