右美托咪啶对脑功能区手术患者术中唤醒效果的影响*
魏福生,杨 蕾,叶玲玲,马龙先
(南昌大学第一附属医院麻醉科,南昌 330006)
·经验交流· doi:10.3969/j.issn.1671-8348.2016.30.031
右美托咪啶对脑功能区手术患者术中唤醒效果的影响*
魏福生,杨 蕾,叶玲玲,马龙先△
(南昌大学第一附属医院麻醉科,南昌 330006)
目的 观察不同剂量右美托咪啶(DEX)对颅脑功能区手术患者唤醒效果的影响。方法 将美国麻醉医师协会(ASA)Ⅰ~Ⅱ级,病变累及脑功能区拟行术中唤醒手术患者39例,按随机数字表法分为D1组、D2组、C组,每组13例。所有患者均采用静脉麻醉诱导置入喉罩。其中,D1、D2组麻醉诱导后静脉泵注DEX 0.8 μg/kg为负荷量,泵注时间15 min,继之分别以 0.4、0.2 μg·kg-1·h-1维持,C组静脉泵注等量生理盐水。唤醒试验开始时停用其他麻醉药物。记录各组患者唤醒时间、唤醒质量、唤醒时的警觉/镇静(OAA/S)评分,以及高血压、心动过速、呛咳、体动等不良反应的发生情况。结果 所有患者均成功实施术中唤醒,并顺利完成手术。D1组及D2组唤醒质量评级明显高于C组(P<0.05);D2组术中唤醒时间明显短于D1组及C组(P<0.05);唤醒时D2组及C组OAA/S评分明显高于D1组(P<0.05);D1组和D2组患者唤醒期间高血压、心动过速、呛咳、体动发生率明显低于C组,心动过缓发生率明显高于C组(P<0.05)。结论 DEX可提高脑功能区手术患者的唤醒质量,降低唤醒期间不良事件发生率,麻醉维持DEX 0.2 μg·kg-1·h-1唤醒效果较好。
右美托咪啶;脑功能区手术;唤醒试验;唤醒质量
脑功能区手术易造成患者术后重要神经功能障碍,如肢体偏瘫、失写及失语等。运用唤醒麻醉技术,在患者被唤醒状态进行脑功能区定位以确定手术范围,是手术时保护脑功能的有效方法[1]。目前,唤醒麻醉已经成为脑功能区手术神经功能诊断时最可靠的麻醉方式[2]。右美托咪啶(dexmedetomidine,DEX)具有镇静、镇痛和抗焦虑作用[3],无呼吸抑制作用而且有助于维持血流动力学稳定[4],这些特性决定其适合用于唤醒试验患者。本研究拟观察不同剂量DEX用于脑功能区手术患者行唤醒试验的效果和安全性。
1 资料与方法
1.1 一般资料 本研究经本院医学伦理委员会批准,患者及家属知情同意。选择病变累及脑功能区的患者39例,其中脑胶质瘤37例,海绵状血管瘤2例;男18例,女21例;年龄35~58岁;体质量50~70 kg;美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级。患者术前神志清楚,能进行良好的沟通交流。按随机数字表法将患者均分为3组(n=13):DEX 1组(D1组)、DEX 2组(D2组)和生理盐水组(C组)。采用患者不知晓的单盲法。术前1 d访视患者,详细解释术中唤醒的目的、方法及如何配合,进行唤醒试验训练。所有患者术前禁食8 h、禁饮4 h,术前30 min肌肉注射盐酸戊乙奎醚0.5 mg。
1.2 方法
1.2.1 麻醉方法 入手术室后,监测脉搏血氧饱和度(SpO2)、收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、心率(HR)、心电图(ECG)、呼气末二氧化碳分压(PETCO2)和反应熵(response entropy,RE),桡动脉和右颈内静脉穿刺置管,监测直接动脉压和中心静脉压(CVP)。麻醉诱导:依次静脉注射异丙酚1.5~2.5 mg/kg、芬太尼3~4 μg/kg和罗库溴铵0.8 mg/kg,2%利多卡因喉头表面麻醉后置入喉罩,听诊确定其位置正确后行机械通气,维持PETCO235~40 mm Hg。在上头架、切头皮、去除颅骨和切开硬脑膜前,0.2%罗哌卡因行局部浸润麻醉,切头皮前静脉注射芬太尼2 μg/kg。麻醉维持:靶控输注(TCI)丙泊酚(批号:X15074B,AstraZeneca公司,意大利)2~4 μg/mL、瑞芬太尼(批号:6150501,湖北人福药业有限公司)0.2 μg·kg-1·min-1,其中,D1、D2组麻醉诱导后静脉泵注负荷剂量DEX(批号:12041034,江苏恒瑞医药股份有限公司)0.8 μg/kg,泵注时间为15 min,分别继以0.4 μg·kg-1·h-1、0.2 μg·kg-1·h-1速率维持;C组静脉泵注等量生理盐水。锯开颅骨前静脉快速滴注地塞米松10 mg和20%甘露醇250 mL。切开硬脑膜时丙泊酚血浆靶浓度降至2 μg/mL。术中维持RE值于40~60,HR 60~90次/分钟,MAP 70~105 mm Hg。
1.2.2 唤醒过程 术者在术前拟定唤醒时间点(T1),在拟定唤醒前30 min停顺苯磺酸阿曲库铵(T2)。当术者将皮层电刺激(CS)等准备就绪进行唤醒时(T0),D1、D2组DEX减至0.1 μg·kg-1·h-1,所有患者唤醒期泵注瑞芬太尼0.05 μg·kg-1·min-1,并停止其他麻醉药。当患者潮气量(VT )为8 mL/kg、呼吸频率大于15次/分钟,且RE>80时,每20秒大声呼唤患者姓名1次,并要求患者做握拳动作和活动双侧足的动作,若患者能按指令活动双手及双足,即视其为清醒(T3),在患者清醒状态下,外科医生应用皮质微电流刺激术(cortex electrical stimulation CES)定位病灶,对合并继发性癫痫者同时应用皮层脑电图(ECOG)确定手术范围。在唤醒期间若发生影响手术的呛咳或体动,则每次静脉注射丙泊酚0.5 mg/kg,当外科医生切除病灶时(T4),恢复TCI异丙酚3~5 μg/mL、瑞芬太尼0.2 μg·kg-1·min-1、顺苯磺酸阿曲库铵0.1 mg·kg-1·h-1。术毕患者苏醒后入神经外科重症监护室(NICU)。术中唤醒时间为停用丙泊酚至患者清醒时间(T0~T3)。
1.2.3 唤醒质量 根据唤醒时患者的反应状态将唤醒质量分为4级:Ⅰ级,患者听到呼唤睁眼苏醒,并按指令活动四肢;Ⅱ级,勉强睁眼清醒,按指令活动四肢时肢体有不自主活动;Ⅲ级,患者突然睁眼清醒,伴有肢体非指令性躁动;Ⅳ级,患者突然睁眼清醒但身体严重躁动,影响手术进行或内固定的稳定[5]。于唤醒结束时按以上方法予以唤醒质量评级。
1.2.4 观察指标 观察并记录各组患者术中唤醒时间、唤醒质量、手术时间及唤醒时的警觉/镇静(OAA/S)评分。OAA/S评分标准[6]:0分为对挤压斜方肌等伤害刺激无反应;1分为对温和的刺激或轻度推摇无反应;2分为对温和的刺激或轻度的推摇有反应;3分为仅对大声或反复呼名有反应;4分为对正常语调的呼名反应冷淡;5分为对正常语调的呼名反应迅速。记录患者唤醒期间高血压、心动过速、心动过缓、呛咳、体动、脑组织膨胀等不良反应。
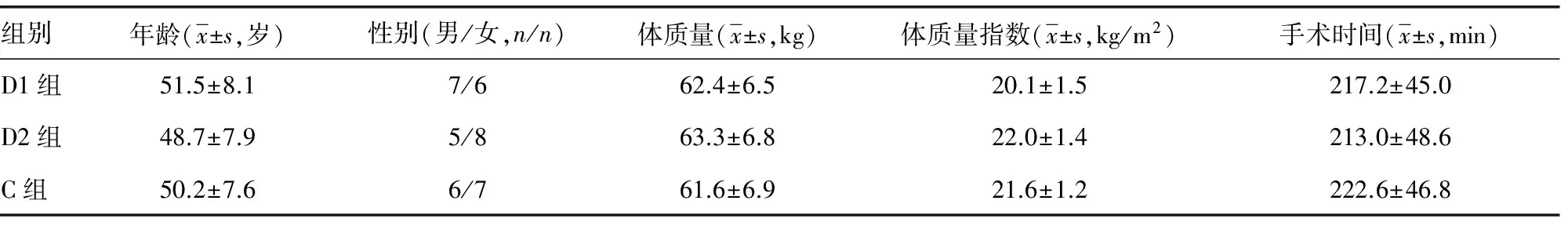
表1 3组患者一般情况比较(n=13)
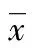
2 结 果
2.1 3组患者一般情况比较 3组患者一般资料各指标、手术时间等差异无统计学意义(P>0.05),见表1。3组患者术中均无脑组织膨胀、呼吸抑制发生,均成功实施术中唤醒。
2.2 3组唤醒时间及OAA/S评分比较 D2组术中唤醒时间明显短于D1组及C组(P<0.05);唤醒时D2组及C组OAA/S评分明显高于D1组(P<0.05);D2组OAA/S评分与C组比较差异无统计学意义(P>0.05),见表2。
*:P<0.05,与C组比较;#:P<0.05,与D1组比较。
2.3 3组患者唤醒质量分级构成情况比较 D1组及D2组唤醒质量评级明显高于C组(P<0.05);D1组、D2组唤醒质量为Ⅰ级加Ⅱ级者所占比例明显高于C组(P<0.05);D1组、D2组唤醒质量为Ⅲ级加Ⅳ级者所占比例明显低于C组(P<0.05);D1组与D2组唤醒质量差异无统计学意义(P>0.05),见表3。
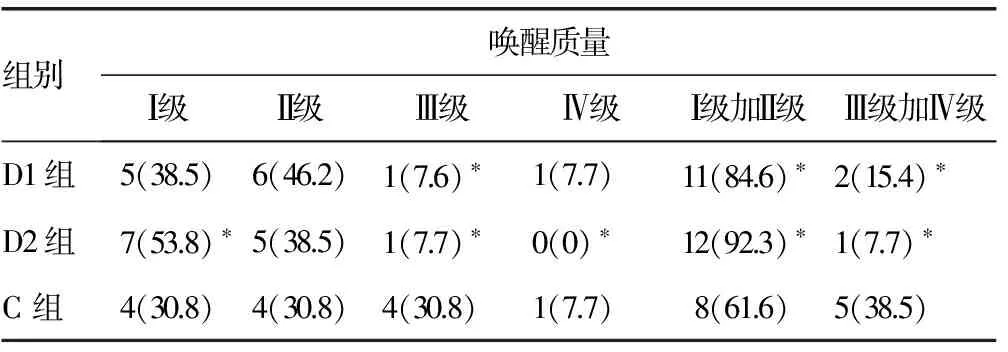
表3 3组患者唤醒质量分级构成情况的比较[n=13,n(%)]
*:P<0.05,与C组比较。
2.4 3组患者唤醒期间不良反应发生率比较 D1组及D2组患者高血压、心动过速、呛咳、体动的发生率明显低于C组(P<0.05);D1组和D2组心动过缓发生率明显高于C组(P<0.05),D1组与D2组唤醒期不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
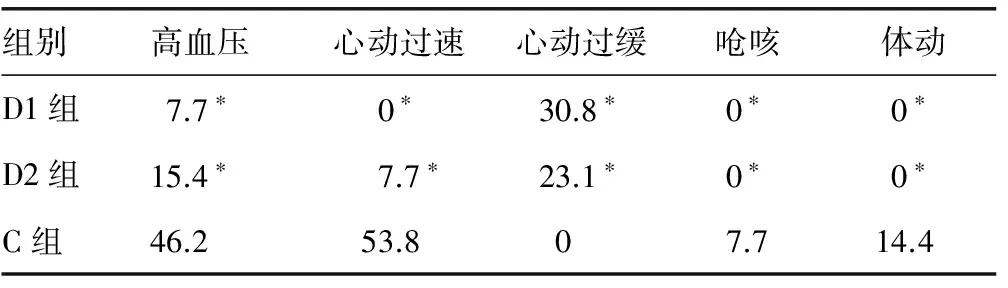
表4 3组患者唤醒期间不良反应发生率的比较(n=13,%)
*:P<0.05,与C组比较。
3 讨 论
唤醒麻醉是一个“麻醉-清醒-麻醉”的过程,基本要求包括:(1)具有合适的麻醉深度,患者快速苏醒并完成指令;(2)能维持足够的通气;(3)合理选用麻醉药并及时调整麻醉药的用量,避免麻醉药物血药浓度过高导致不良反应或血药浓度过低,以及诱发血压升高等并发症。DEX是一种高选择性α2受体激动剂,主要作用于大脑蓝斑,可产生类似于自然睡眠的可唤醒的镇静,其镇静作用也不影响脑功能区手术中的电生理学监测[3],高鹏等[7]成功将其用于语言功能区手术。
临床上DEX常规用法为经15 min静脉滴注负荷量0.3~1.0 μg/kg,随后以0.2~0.7 μg·kg-1·h-1速率维持,因此本研究经15 min静脉输注负荷量0.8 μg/kg后,D1组和D2组分别以0.4、0.2 μg·kg-1·h-1速率维持。本研究结果显示,D2组术中唤醒时间明显短于D1组及C组,唤醒时D2组OAA/S评分明显高于D1组,笔者考虑DEX具有剂量依赖的镇静效应[8],D1组麻醉维持所用DEX的剂量比较大,其产生较长时间及更深程度的镇静。同时说明脑功能区手术DEX 0.2 μg·kg-1·h-1速率维持输注可使患者达到合适的镇静。
本研究发现,D1组及D2组唤醒质量评级明显高于C组,同时唤醒期D1组及D2组患者的高血压、心动过速、呛咳、体动发生率明显低于C组,说明本研究所用两种剂量DEX均可提高患者的唤醒质量并降低唤醒期间不良事件发生率,这可能与DEX激活中枢神经系统突触后膜α2肾上腺素能受体,抑制交感神经元活性,抑制儿茶酚胺分泌及产生镇痛作用等有关[9]。本研究证实麻醉维持应用DEX可取得良好唤醒效果,尤其是DEX联合瑞芬太尼在唤醒试验中获得良好的唤醒质量评级,这与Mold Nazaruddin等[10]的研究结果相似。
[1]Tonn JC.Awake craniotomy for monitoring of language function:benefits and limits[J].Acta Neurochir(Wien),2007,149(12):1197-1198.
[2]Erickson KM,Cole DJ.Anesthetic considerations for awake craniotomy for epilepsy[J].Anesthesiol Clin,2007,25(3):535-555.
[3]Rozet I.Anesthesia for functional neurosurgery:the role of dexmedetomidine[J].Curr Opin Anaesthesiol,2008,21(5):537-543.
[4] Chattopadhyay U,Mallik S,Ghosh S,et al.Comparison between propofol and dexmedetomidine on depth of anesthesia:a prospective randomized trial [J].J Anaesthesiol Clin Pharmacol,2014,30(4):550-554.
[5]张艺泷,米卫东.全静脉麻醉与静吸复合麻醉用于脊柱侧弯矫形术中唤醒的比较[J].解放军医学杂志,2006,31(5):480-481.
[6] Bae JY,Choi dY,Woo CH,et al.The BIS and hemodynamic changes in major burn patients according to a slow infusion of propofol for induction[J].Korean J Anaesthesiol,2011,60(3):161-166.
[7]高鹏,古妙宁,蔡铁良,等.右美托咪啶对全麻下语言功能区手术术中唤醒的影响[J].临床麻醉学杂志,2015,31(1):60-62.
[8]徐蓉蓉,黄文起.右美托咪定药代动力学和药效动力学的研究进展[J].广东医学,2012,33(8):1037-1040.
[9]Cai Y,Xu H,Yan J,et al.Molecular targets and mechanism of action of dexmedetomidine in treatment of ischemia/reperfusion injury[J].Mol Med Rep,2014,9(5):1542-1550.
[10]Mohd Nazaruddin WH,Mohd Fahmi L,Laila AM,et al.Awake craniotomy:a case series of anaesthetic management using a combination of scalp block,dexmedetomidine and remifentanil in Hospital Universiti Sains Malaysia[J].Med J Malaysia,2013,68(1):64-66.
江西省卫生计生委科技计划基金资助项目(20155168)。 作者简介:魏福生(1974-),副主任医师,硕士,主要从事临床麻醉学研究。△
R614.2
B
1671-8348(2016)30-4274-03
2016-04-09
2016-07-07)

