阿米卡星不同给药方式治疗呼吸机相关性肺炎的临床观察
李 依,邓 磊(四川省医学科学院/四川省人民医院急诊ICU,成都 610072)
阿米卡星不同给药方式治疗呼吸机相关性肺炎的临床观察
李依*,邓磊(四川省医学科学院/四川省人民医院急诊ICU,成都610072)
目的:观察阿米卡星不同给药方式治疗呼吸机相关性肺炎的疗效和安全性。方法:回顾性收集109例呼吸机相关性肺炎患者资料,按给药方式的不同分为观察组(58例)和对照组(51例)。两组患者均给予注射用头孢曲松钠3.0 g,加入0.9%氯化钠注射液100 ml中,静脉滴注,q12 h。在此基础上,对照组患者给予硫酸阿米卡星注射液7.5 mg/kg,每日1次;观察组患者给予硫酸阿米卡星注射液7.5 mg/kg,加入0.45%氯化钠注射液20 ml,雾化吸入,每日2次。两组疗程均为7 d。观察两组患者治疗前后的临床肺部感染评分(CPIS)、丙氨酸转氨酶(ALT)、血清肌酐(Cr)、氧合指数(PaO2/FiO2)、白细胞介素(IL)-10、IL-6、C反应蛋白(CRP)、肿瘤坏死因子(TNF)-α、治疗后3个月累积死亡率及不良反应发生情况。结果:治疗前,两组患者CPIS评分、ALT、Cr、PaO2/FiO2、IL-10、IL-6、CRP、TNF-α比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CPIS评分、TNF-α、IL-6、CRP水平均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05);两组患者治疗前后IL-10水平比较差异无统计学意义(P>0.05)。观察组患者PaO2/FiO2及对照组ALT、Cr、PaO2/FiO2均显著高于同组治疗前,且观察组PaO2/FiO2高于对照组,但观察组ALT、Cr均显著低于对照组,差异均有统计学意义(P<0.05)。观察组患者治疗后3个月累积死亡率显著低于对照组,差异有统计学意义(P<0.05)。两组患者治疗期间均未见严重不良反应发生。结论:雾化吸入阿米卡星治疗呼吸机相关肺炎的疗效优于静脉用药,可有效降低患者炎症因子水平和死亡率,且不增加不良反应的发生。
呼吸机相关肺炎;阿米卡星;雾化吸入;给药方式;鲍曼不动杆菌
随着重症医学的发展,呼吸功能障碍可通过机械通气得到有效治疗,但机械通气可导致患者并发呼吸机相关性肺炎(Ventilator-associated pneumonia,VAP),目前VAP已成为医院内感染的主要原因之一[1-2]。接受机械通气的患者往往合并基础疾病,加之感染,使患者的预后有被进一步恶化的可能[3-4]。鲍曼不动杆菌是医院内感染主要致病菌之一,对于该致病菌的治疗主要为静脉给予氨基糖苷类药物,但存在细菌耐药情况,使临床疗效并不理想[5]。雾化吸入药物可直达肺部,提高肺部药物浓度,可能会提高药物的抗菌效果[6]。为此,在本研究中笔者观察了阿米卡星不同给药方式治疗VAP的疗效和安全性,旨在为临床提供参考。
1 资料与方法
1.1资料来源
回顾性收集2013年1月-2015年1月我院收治的109例VAP患者资料,将所有患者按给药方式的不同分为观察组(58例)和对照组(51例)。两组患者性别、年龄、体质量指数(BMI)等基本资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过。
表1 两组患者基本资料比较(±s)Tab 1 Comparison of basic information between 2 groups(±s)

表1 两组患者基本资料比较(±s)Tab 1 Comparison of basic information between 2 groups(±s)
项目男性/女性,例年龄,岁BMI,kg/m2吸烟史,例是否饮酒史,例是否观察组(n=58)36/22 65.3±4.5 22.6±1.5 23 35 19 39对照组(n=51)35/16 66.1±4.9 22.3±1.6 26 25 23 28
1.2纳入与排除标准
纳入标准:(1)缺血性脑卒中合并呼吸功能障碍并接受机械通气;(2)经肺泡灌洗液细菌鉴定为鲍曼不动杆菌感染;(3)药敏试验证实对阿米卡星及头孢曲松过敏。排除标准:(1)对头孢菌素类、氨基糖苷类药物过敏;(2)严重肝、肾功能障碍;(3)合并恶性肿瘤等终末期疾病。
1.3治疗方法
两组患者均给予注射用头孢曲松钠(海口市制药厂有限公司,规格:1.0 g,批准文号:国药准字H46020652)3.0 g,加入0.9%氯化钠注射液100 ml中,静脉滴注,q12 h。在此基础上,对照组患者给予硫酸阿米卡星注射液(福建三爱药业有限公司,规格:2 ml∶0.2 g,批准文号:国药准字H35020161)7.5 mg/kg,每日1次;观察组患者给予硫酸阿米卡星注射液7.5 mg/kg,加入0.45%氯化钠注射液20 ml,雾化吸入,每日2次。两组疗程均为7d。
1.4观察指标
观察两组患者治疗前后的临床肺部感染(CPIS)评分[7]、丙氨酸转氨酶(ALT)、血清肌酐(Cr)、氧合指数(PaO2/FiO2)、白细胞介素(IL)-10、IL-6、C反应蛋白(CRP)、肿瘤坏死因子(TNF)-α、治疗后3个月累积死亡率及不良反应发生情况。
1.5统计学方法
采用SPSS 23.0统计软件对数据进行分析。计量资料以±s 表示,采用t检验;计数资料以率表示,采用χ2检验;死亡率以Kaplan-Meier曲线分析,采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1两组患者治疗前后CPIS评分比较
治疗前,两组患者CPIS评分比较,差异无统计学意义(P>0.05)。治疗后,两组患者CPIS评分均显著低于同组治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后CPIS评分比较(±s,分)Tab 2 Comparison of CPIS scores between 2 groups before and after treatment(±s,score)

表2 两组患者治疗前后CPIS评分比较(±s,分)Tab 2 Comparison of CPIS scores between 2 groups before and after treatment(±s,score)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
项目CPIS评分观察组(n=58)治疗前8.5±1.9治疗后3.2±1.2*#对照组(n=51)治疗前8.1±2.1治疗后3.9±1.5*
2.2两组患者治疗前后ALT、Cr、PaO2/FiO2比较
治疗前,两组患者ALT、Cr、PaO2/FiO2比较,差异均无统计学意义(P>0.05)。治疗后,观察组患者PaO2/FiO2及对照组ALT、Cr、PaO2/FiO2均显著高于同组治疗前,且观察组PaO2/FiO2高于对照组,但观察组ALT、Cr均显著低于对照组,差异均有统计学意义(P<0.05),详见表3(1mm Hg=0.133kPa)。
表3 两组患者治疗前后ALT、Cr、PaO2/FiO2比较(±s)Tab 3 Comparison of ALT,Cr,PaO2/FiO2between 2 groups before and after treatmen(tx±s)
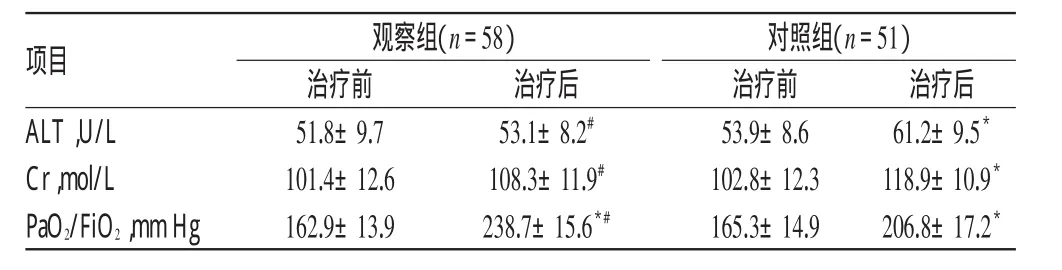
表3 两组患者治疗前后ALT、Cr、PaO2/FiO2比较(±s)Tab 3 Comparison of ALT,Cr,PaO2/FiO2between 2 groups before and after treatmen(tx±s)
项目ALT,U/L Cr,mol/L PaO2/FiO2,mmHg观察组(n=58)治疗前51.8±9.7 101.4±12.6 162.9±13.9治疗后53.1±8.2#108.3±11.9#238.7±15.6*#对照组(n=51)治疗前53.9±8.6 102.8±12.3 165.3±14.9治疗后61.2±9.5*118.9±10.9*206.8±17.2*
2.3两组患者治疗前后IL-10、IL-6、CRP、TNF-α水平比较
治疗前,两组患者IL-10、IL-6、CRP、TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-6、CRP、TNF-α水平均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05);两组患者治疗前后IL-10水平比较差异无统计学意义(P>0.05),详见表4。
表4 两组患者治疗前后IL-10、IL-6、CRP、TNF-α水平比较(±s)Tab 4 Comparison of IL-10,IL-6,CRP,TNF-α between 2 groups before and after treatment(±s)

表4 两组患者治疗前后IL-10、IL-6、CRP、TNF-α水平比较(±s)Tab 4 Comparison of IL-10,IL-6,CRP,TNF-α between 2 groups before and after treatment(±s)
项目TNF-α,ng/L IL-6,ng/L CRP,mg/L IL-10,ng/L观察组(n=58)治疗前31.21±8.25 19.35±5.29 33.67±11.13 13.98±4.19治疗后19.17±6.21*#13.17±4.13*#17.36±9.98*#14.11±5.16对照组(n=51)治疗前29.79±8.96 20.03±6.12 35.12±12.18 13.69±4.35治疗后23.15±5.28*16.89±5.12*25.32±11.09*13.85±4.87
2.4两组患者治疗后3个月累积死亡率比较
观察组患者治疗后3个月累积死亡率显著低于对照组,差异有统计学意义(P<0.05),详见表5、图1。
2.5不良反应
两组患者治疗期间均未见严重不良反应发生,也均未有因发生不良反应而终止治疗的患者。
3 讨论
抗菌药物是VAP的主要治疗药物[8]。以往医院内感染主要以革兰阳性菌为主,但随着医疗器械、物品的种类和数量不断增多,医院内感染的病原菌开始向革兰阴性菌为主的趋势发展[9]。其中,鲍曼不动杆菌在VAP中的检出率不断增多,已成为该病的主要致病菌。多数第三代头孢菌素类抗菌药物对此类致病菌的疗效较好,但临床应用中却发现耐药情况严重。阿米卡星是一种氨基糖苷类抗菌药物,可作用于细菌核糖体的30S亚单位,抑制细菌合成蛋白质,与半合成青霉素类或头孢菌素类合用常可获得协同抗菌作用,但其毒副作用较大,具有较强的耳、肾毒性[10-11]。雾化吸入方式给药可直接将药物吸入至感染灶,在局部形成高浓度药物累积效应,相较全身用药所需剂量较小,不良反应相对较少。
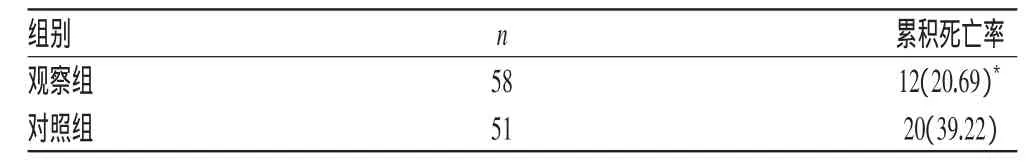
表5 两组患者治疗后3个月累积死亡率比较[例(%)]Tab 5 Comparison of cumulative mortality after 3 months of treatment between 2groups[case(%)]
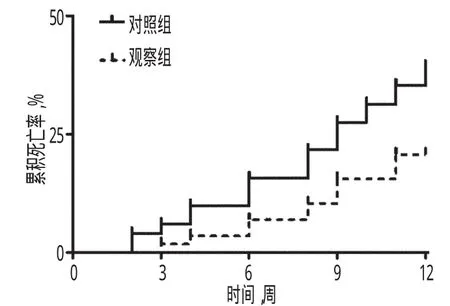
图1 两组患者治疗后3个月累积死亡率Fig 1 Curves of cumulative mortalities after 3 months of treatment in 2groups
本研究结果显示,治疗后两组患者CPIS评分均显著低于同组治疗前,且观察组低于对照组,差异有统计学意义。这提示,雾化吸入阿米卡星的疗效优于静脉用药。ALT是一种较为敏感的肝功能指标,其水平升高提示肝脏实质细胞受损。Cr是经典肾功能指标,其水平升高提示肾功能受损,且该指标并不受尿量影响。治疗后,观察组患者PaO2/FiO2及对照组ALT、Cr、PaO2/FiO2均显著高于同组治疗前,且观察组PaO2/FiO2高于对照组,ALT、Cr均显著低于对照组,差异均有统计学意义。这提示,雾化吸入给药可有效降低阿米卡星的肝、肾毒性。TNF-α、IL-6及CRP均为经典的非特异性促炎因子,其水平可在一定程度上反映全身炎症因子水平,而炎症因子是危重病患者发生多器官功能障碍的诱发因素[12]。本研究结果显示,治疗后两组患者TNF-α、IL-6、CRP水平均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义。这提示,雾化吸入给药可有效降低炎症因子水平,控制肺部感染,其机制可能为通过降低体内炎症因子水平而达到改善预后的目的。观察组患者治疗后3个月累积死亡率显著低于对照组,差异有统计学意义。该结果可能与全身炎症因子水平与肺部感染的有效控制有关,但具体机制有待进一步研究。
综上所述,雾化吸入阿米卡星治疗VAP的疗效优于静脉用药,可有效降低患者炎症因子水平和死亡率,且不增加不良反应的发生。由于本研究纳入的样本量较小,故此结论有待大样本、多中心研究进一步证实。
[1]Almomani BA,McCullough A,Gharaibeh R,et al.Incidence and predictors of 14-day mortality in multidrug-resistant acinetobacter baumannii in ventilator-associated pneumonia[J].J Infect Dev Ctries,2015,9(12):1323.
[2]Shabot MM,Chassin MR,France AC,et al.Using the ta-rgeted solutions tool(R)to improve hand hygiene compliance is associated with decreased health care-associated infections[J].Jt Comm J Qual Patient Saf,2016,42(1):6.
[3]Wolkewitz M.Estimating the risk of ventilator-associated pneumonia as a function of time[J].Am J Respir Crit Care Med,2015,192(5):640.
[4]Wheeler KE,Cook DJ,Mehta S,et al.Use of probiotics to prevent ventilator-associated pneumonia:a survey of pharmacists'attitudes[J].J Crit Care,2016,31(1):221.
[5] 武芳,张叶毛,赵建平,等.医院2012-2014年鲍曼不动杆菌耐药性监测分析[J].中国医药,2015,10(10):1537.
[6]Lee JH,Cheng KT,Malinin V,et al.(99m)Tc-labeled therapeutic inhaled amikacin loaded liposomes[J].J Liposome Res,2013,23(4):336.
[7]Bickenbach J,Marx G.Diagnosis of pneumonia in mechanically ventilated patients:what is the meaning of the CPIS?[J].Minerva Anestesiol,2013,79(12):1406.
[8]Gottesman T,Yossepowitch O,Lerner E,et al.The accuracy of gram stain of respiratory specimens in excluding staphylococcus aureus in ventilator-associated pneumonia [J].J Crit Care,2014,29(5):739.
[9]RogersAD,Deal C,ArgentAC,et al.Ventilator associated pneumonia in major paediatric burns[J].Burns,2014,40(6):1141.
[10]Pitance L,Reychler G,Leal T,et al.Aerosol delivery to the lung is more efficient using an extension with a standard jet nebulizer than an open-vent jet nebulizer[J].J Aerosol Med Pulm Drug Deliv,2013,26(4):208.
[11]Chi SY,Kim TO,Park CW,et al.Bacterial pathogens of ventilator associated pneumonia in a tertiary referral hospital[J].Tuberc Respir Dis:Seoul,2012,73(1):32.
[12]Ozkan A,Silan F,Uludag A,et al.Tumour necrosis factor alpha,interleukin 10 and interleukin 6 gene polymorphisms of ischemic stroke patients in south Marmara region of Turkey[J].Int J Clin Exp Pathol,2015,8(10):13500.
(编辑:陈宏)
Clinical Observation of Amikacin Different Administrations Route in the Treatment of Ventilator-associated Pneumonia
LI Yi,DENG Lei(Dept.of Emergency ICU,Sichuan Academy of Medical Sciences/Sichuan Provincial People’s Hospital,Chengdu 610072,China)
OBJECTIVE:To observe the efficacy and safety of amikacin different administrations in the treatment of ventilatorassociated pneumonia.METHODS:Data of 109 patients with ventilator-associated pneumonia were divided into observation group(58 cases)and control group(51 cases)based on different administrations.All patients2/FiO2),IL-10,IL-6,C-reactive protein(CRP),tumor necrosis factor(TNF)-α,cumulative mortality after 3 months of treatment and the incidence of adverse reactions before and after treatment in 2 groups were observed.RESULTS:Before treatment,there were no significant differences in the CPIS score,ALT,Cr,PaO2/FiO2,IL-10,IL-6,CRP and TNF-α levels in 2 groups(P>0.05).After treatment,CPIS score,TNF-α,IL-6 and CRP levels in 2 groups were significantly lower than before,observation group was lower than control group,the difference was statistically significant(P<0.05),and there was no significant difference in IL-10 before and after treatment in 2 groups(P>0.05).PaO2/FiO2in observation group and ALT,Cr and PaO2/FiO2in control group were significantly higher than before,PaO2/FiO2in observation group was higher than control group,ALT and Cr were significantly lower than control group,the differences were statistically significant(P<0.05).The cumulative mortality after 3 months of treatment in observation group was significantly lower than control group,the difference was statistically significant(P<0.05).And there were no severe adverse reactions during treatment.CONCLUSIONS:The efficacy of amikacin by aerosol inhalation is superior to by intravenous infusion in the treatment of ventilator-associated pneumonia,it can effectively reduce inflammatory cytokine levels and mortality rate,do not increase the incidence of adverse reactions.
3.0 g Ceftriaxone sodium for injection,adding into 100 ml 0.9%Sodium chloride injection,intravenously,once every 12 h.Based on it,control group
7.5 mg/kg Amikacin sulfate injection,once a day.Observation group
7.5 mg/kg Amikacin sulfate injection,adding into 20 ml 0.45%Sodium chloride injection,aerosol inhalation,twice a day.The treatment course for both groups was 7 d.Clinical pulmonary infection score(CPIS),alanine aminotransferase(ALT),serum creatinine(Cr),oxygenation index(PaO
Ventilator-associated pneumonia;Amikacin;Aerosol inhalation;Administration route;Acinetobacter baumannii
R453
A
1001-0408(2016)27-3780-03
10.6039/j.issn.1001-0408.2016.27.12
*主治医师。研究方向:急诊急救。电话:028-87769262。E-mail:liyi7941@163.com
(2016-01-08
2016-07-04)

