高糖环境下人骨髓间充质干细胞复合兔脱细胞真皮支架体外成骨能力检测
张彧婷 孙 权 沙 峰 孙石柱 姚立杰 李静平 沈 雷
齐齐哈尔医学院解剖学教研室,黑龙江齐齐哈尔161006
高糖环境下人骨髓间充质干细胞复合兔脱细胞真皮支架体外成骨能力检测
张彧婷 孙 权 沙 峰 孙石柱 姚立杰 李静平 沈 雷
齐齐哈尔医学院解剖学教研室,黑龙江齐齐哈尔161006
目的探讨脱细胞真皮支架在高糖环境下对骨髓间充质干细胞(hBMSC)的保护作用,以及促进hBMSC向成骨细胞分化的能力。方法建立脱细胞真皮基质和含300mmol/L葡萄糖的细胞高糖模型,在高糖环境下,培养hBMSC为高糖对照组,在高糖条件下,hBMSC种植在脱细胞真皮基质上为基质实验组,正常条件下培养的hBMSC为正常对照组,每组均进行成骨细胞诱导实验。利用MTT实验检测hBMSC的增殖情况;利用骨形成蛋白-1(BMP-1)免疫荧光染色检测hBMSC成骨细胞分化情况,ELISA实验检测各组hBMSC的BMP-1、碱性磷酸酶(ALP)的含量。结果与高糖对照组比较,基质实验组hBMSC的细胞增殖光密度(OD值)升高,差异有统计学意义(P<0.01);hBMSC在脱细胞真皮基质的生长状态良好,基质实验组BMP-1染色阳性的细胞数目明显高于高糖对照组(P<0.01);基质实验组BMP-1、ALP等蛋白的含量明显增高(P<0.01)。结论高糖环境下,脱细胞真皮基质有利于促进hBMSC分化为成骨细胞。
高糖;骨髓间充质干细胞;脱细胞真皮基质;成骨细胞
糖尿病是一种以高血糖为典型表现的复杂性全身疾病,高血糖状态常导致血管、神经发生严重的病理改变[1]。Palmer BF认为:糖尿病及其并发症已经成为影响我国等国家发展的重要影响因素[2],人口老龄化和糖尿病患病人数的增多常导致糖尿病患者骨质疏松,骨折不易愈合等严重问题[3],加重患者家庭及社会经济负担[4]。如何改善糖尿病骨质状况,加速糖尿病性骨损伤的修复是迫切需要解决的问题。
脱细胞皮肤基质间充质干细胞(mesenchymal stem cells,MSC)由于具有来源广泛、低免疫性、多分化等优势,为逆转糖尿病性组织缺氧和促进组织修复带来了希望,是细胞治疗和骨组织工程技术首选的种子细胞[5]。皮肤组织的再生能力非常强,脱细胞真皮细胞外基质具有复杂的三维结构[6],是具有广泛应用前景的生物组织支架材料,对支持移植细胞生长、促进组织修复具有关键效果[6]。但是高糖状态下,MSC在脱细胞真皮基质的成骨分化尚鲜见报道。本研究拟揭示高糖环境下,MSC在脱细胞真皮基质的生长和成骨分化情况,为MSC组织工程技术促进骨组织新生,治疗高糖缺氧性骨组织损伤奠定研究基础。
1 料与方法
1.1 细胞来源
GFP标记的人骨髓间充质干细胞(hBMSC)购于广州赛业生物公司。
1.2 主要试剂和实验仪器
体重2~3 kg雄性新西兰白兔购自齐齐哈尔医学院动物实验中心[动物合格证号:SYXK(黑)20140022],胎牛血清(FBS)、α-MEM培养基、青链霉素和L-谷氨酰胺均购于广州赛业生物公司,地塞米松、抗坏血酸、β-甘油磷酸钠、VEGF、噻唑蓝(MTT)和葡萄糖等均购于美国Sigma公司,兔抗人BMP-1抗体和TRITC标记羊抗兔IgG购自美国Santa cruz公司,人骨形成蛋白-1(BMP-1)、碱性磷酸酶(ALP)的ELISA试剂盒购于美国R&D公司。Emax酶标仪为美国Molecular Devices公司产品,F-7000荧光分光光度计为日立公司产品,BX50型显微镜和SU1510型扫描电子显微镜分别为日本OLYMPUS、日立公司的产品。
1.3 实验方法
1.3.1 脱细胞真皮的制备8只体重2~3 kg雄性新西兰白兔,按照30 mg/kg耳缘静脉注射3%戊巴比妥钠,常规备皮、消毒,切取背部6 cm×6 cm全层皮肤,清理周围组织后,首先加入0.9%氯化钠溶液,在37℃摇床孵育12 h,去除表皮层[6];然后置于0.125%胰蛋白酶溶液中,37℃,消化24 h,依次经过0.1%、0.5%十二烷基磺酸钠(SDS)震荡洗涤12 h,60Co消毒处理密封,-80℃保存。扫描电镜观察样品结构[7-8]。
1.3.2 细胞培养和实验分组含10%FBS的α-MEM培养基培养hBMSC,37℃、5%CO2培养者为正常对照组;若α-MEM培养基中含300mmol/L葡萄糖,则为高糖培养基。在细胞高糖模型下,未进行任何刺激的hBMSC为高糖对照组;将hBMSC种植在脱细胞真皮基质上进行培养则为基质实验组;每组细胞均进行成骨诱导分化。成骨分化培养基为:α-MEM培养基中若含10%FBS、1×10-7mol/L地塞米松、50 mg/L抗坏血酸、10 mmol/Lβ-甘油磷酸钠。
1.3.3 MTT法检测细胞增殖情况按实验分组,或在96孔板底放置脱细胞真皮基质,每组均添加1×104hBMSC后,在正常条件下培养24 h。每孔加入150μL含 0.1%FBS的正常或高糖α-MEM培养基,37℃、5%CO2条件下培养12 h;每孔加入20μL的5%MTT孵育4 h,然后添加100μL二甲基亚砜,492 nm波长测定每个样品吸光度(OD值)。
1.3.4 免疫荧光染色各组分化诱导的hBMSC,DAPI进行细胞核标记,4%多聚甲醛固定,4℃条件下,用兔抗人BMP-1抗体(1:200)孵育12 h后,添加山羊抗兔IgG(1:150),DAKO水溶性封片液进行封片。
1.3.5 人BMP-1、ALP蛋白的检测按照人BMP-1、ALP蛋白的ELISA试剂盒说明,裂解各组细胞,提取各组细胞裂解液,ELISA实验检测人BMP-1、ALP蛋白的表达。
1.4 统计学方法
所有实验均重复3次,实验数据采用SPSS 18.0软件进行统计,结果以均数±标准差(x±s)表示,并进行方差分析或t检验,以P<0.05为差异有统计学意义。
2 果
2.1 hBMSC的增殖情况
正常对照组、高糖对照组和基质实验组hBMSC增殖的OD值进行方差分析,发现各组hBMSC增殖的OD值并不相等(F=247.35,P=0.0001)。与正常对照组OD值(1.453±0.164)比较,高糖对照组hBMSC的OD值(0.618±0.110)明显降低,二者比较差异有统计学意义(P<0.01);与高糖对照组比较,基质实验组hBMSC的细胞增殖OD值(1.294±0.135)升高比较明显,二者比较差异有统计学意义(P<0.01)。
2.2 脱细胞真皮基质结构
扫描电镜观察发现,未脱细胞的皮肤比较致密,见图1A;脱细胞真皮基质几乎不含细胞,纤维组织比较丰富,空隙较大,见图1B。

图1 扫描电镜观察正常皮肤或脱细胞真皮基质的形态
2.3 各组hBMSC的BMP-1染色和扫描电镜观察
与高糖对照组比较,基质实验组BMP-1染色阳性的细胞明显增多,差异有统计学意义(Q=9.535,P<0.01),见图2A、2B。扫描电镜观察发现,hBMSC突起较多,与脱细胞真皮基质黏附在一起,生长状态良好,见图2C。
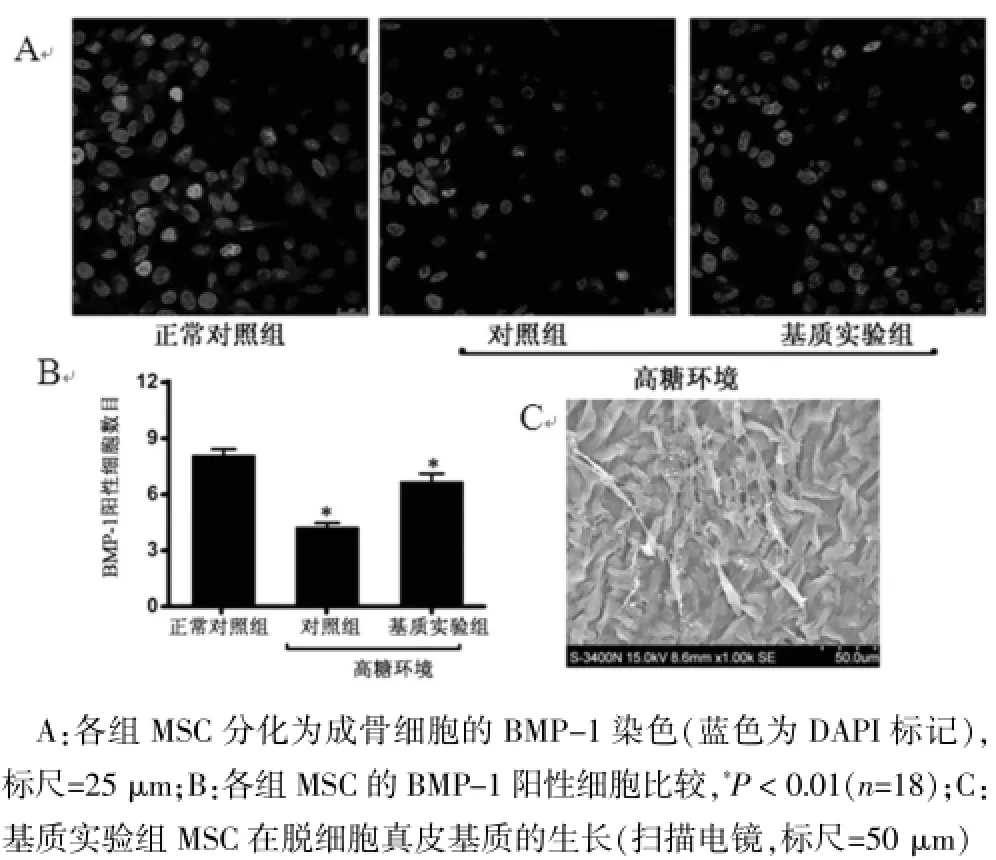
图2 各组hBMSC在脱细胞真皮基质的生长和成骨分化
2.4 ALP、BMP-1蛋白的检测
与未脱细胞皮肤比较,脱细胞真皮基质的ALP蛋白含量降低(P<0.05);相对于未脱细胞皮肤,脱细胞真皮基质组的BMP-1蛋白含量降低(P<0.05),见表1。与高糖对照组比较,基质实验组的ALP蛋白含量明显增高(P<0.01);相对于高糖对照组,基质实验组的BMP-1蛋白含量明显增高(P<0.01),见表2。
表1 正常条件下未脱细胞皮肤与脱细胞真皮基质的ALP、BMP-1含量(μg/mL,n=24)

表1 正常条件下未脱细胞皮肤与脱细胞真皮基质的ALP、BMP-1含量(μg/mL,n=24)
注:ALP:碱性磷酸酶;BMP-12:骨形成蛋白-1
组别ALP BMP-1未脱细胞皮肤脱细胞真皮基质t值P值11.352±0.841 1.386±0.538 48.894 0.037 17.121±0.915 2.823±0.393 70.339 0.021
表2 高糖条件下对照组与基质实验组的ALP、BMP-1含量(μg/mL,,n=24)

表2 高糖条件下对照组与基质实验组的ALP、BMP-1含量(μg/mL,,n=24)
注:ALP:碱性磷酸酶;BMP-12:骨形成蛋白-1
组别ALP BMP-1对照组基质实验组t值P值4.539±0.221 8.947±0.625 118.712 0.00001 5.204±0.180 10.468±0.853 57.851 0.0001
3 论
随着世界经济、交通高速发展,全球骨损伤的发病率逐年增加;外伤、感染或肿瘤切除导致的骨组织损伤、骨延迟愈合或不连接问题是世界性骨科难题。糖尿病及其并发症已经成为困扰人们的重要疾病,由于糖尿病的高血糖状态常常导致多种离子、多糖成分代谢紊乱,进而发生糖尿病性骨质疏松等骨疾病[9],严重影响着患病人群的健康和生命质量。
骨组织除了含有较多血管、神经纤维外,还含有大量骨细胞,对骨的再生修复具有重要意义。虽然利用MSC分化为骨细胞对促进骨组织损伤具有重要意义[10],但是,如果能够在三维环境下激发间充质干细胞的成骨分化活性,将对利用组织工程技术促进糖尿病性骨损伤修复具有重要意义。皮肤是人体最大的器官,再生能力非常强,如果利用宿主皮肤构建组织工程材料将降低患者排斥反应,皮肤中含有的3D结构和有效的活性因子将有效促进种子细胞分化和生长,对治疗糖尿病骨病等具有重要意义。研究发现,存在于骨髓、脂肪等多种组织的MSC,具有多分化性能、易适应局部微环境生存等特咖[11]。在缺血性心脏病、糖尿病足皮肤溃疡等许多由于缺氧引起的疾病治疗中,利用MSC细胞治疗技术或MSC组织工程技术具有喜人的治疗效果和广泛的应用[12],并认为MSC的多分化特性更适用于糖尿病等多种组织损伤的病例[12]。也有研究发现,高糖缺氧环境会导致组织产生大量活性氧(reactive oxygen species,ROS)[13],ROS粒子比较微小,由于存在未配对的自由电子,因此ROS十分活跃,呈现一种不稳定自由基状态,往往导致细胞膜脂质、蛋白质等发生变性,造成MSC、血管内皮细胞等细胞器损伤,细胞生物活性降低,造成组织损伤等[14]。因此,抗高糖损伤一直是移植MSC技术确保移植细胞正常生长和分化的关键问题。如果利用自体生物组织材料既可以避免生物排斥反应,又可以促进MSC生长,达到修复骨组织损伤的目的,将较好地解决高糖环境下,移植的MSC活性降低等问题。相对于肠黏膜等部位组织,皮肤是人体最大的浅表器官,取材方便,再生能力强,符合自体生物组织材料的筛选条件[15]。
皮肤的细胞外基质主要由胶原蛋白、纤维蛋白、整合素等多糖或蛋白质构成复杂的三维结构,并具有良好的孔隙率和丰富的细胞活性因子等条件,可以更好地利于体内细胞的生长[16],如果良好模拟细胞的体内生长基质,将对细胞的生长具有积极作用。近年来发现,MSC、内皮祖细胞(EPC)在静电纺丝制作的三维纳米生物材料上尚能正常生长,并对糖尿病足具有促进愈合的作用[17-18],这些成果提示,构建脱细胞的皮肤细胞外基质会具有较好的三维立体结构,皮肤基质中的VEGF、EGF等多种细胞活性因子能够促进种植的MSC生长,对维持MSC功能、促进MSC分化具有重要影响。在本实验中,扫描电镜下也可以观察到脱细胞真皮基质的纤维组织间隙较大,纤维纵横交错,细胞结构分成非常少,说明皮肤脱细胞比较彻底,排除了皮肤细胞对实验的干扰。说明利用梯度SDS法脱细胞简单可行。相对于高糖对照组,基质实验组MSC增殖的OD值明显升高,MSC在脱细胞真皮基质的生长状态良好,说明脱细胞真皮基质的三维结构更好地模拟了体内细胞生长环境[19],适合MSC在高糖环境的生长,此外,还可能是由于皮肤基质含有一定量的VEGF、EGF等细胞因子,这些因子对促进细胞生长和黏附于三维介质具有积极作用[20],研究也发现,基质实验组的MSC分化为成果细胞能力明显强于高糖对照组,这进一步说明脱细胞真皮基质的确含有成骨诱导因子,可以促进MSC分化为成骨细胞。本研究利用BMP-1染色的手段,也发现基质实验组BMP-1染色的阳性细胞数明显高于高糖对照组,说明脱细胞真皮机制包含的VEGF等因子[15]积极促进了MSC在脱细胞真皮基质向成骨细胞分化。
综上所述,利用脱细胞真皮基质将对保护MSC抗高糖缺氧损伤,为促进MSC分化为成骨细胞带来机遇。由于皮肤基质中含有大量成骨因子,如果将含MSC的脱细胞真皮基质移植到糖尿病组织损伤区域,将对加快修复糖尿病性组织疾病具有重要意义。下一步拟将血管活性因子、趋化因子等转染到MSC内,构建含修饰后MSC的人工皮肤,观察MSC组织工程治疗糖尿病骨损伤,动员血管内皮细胞等宿主细胞归巢,加速组织损伤修复的作用和机制,为移植MSC的临床应用和细胞归巢的研究提供基础研究数据。
[1]Poittevin M,Bonnin P,Pimpie C,et al.Diabetic microangiopathy:impact of impaired cerebral vasoreactivity and delayed angiogenesis after permanent middle cerebral artery occlusion on stroke damage and cerebral repair in mice[J].Diabetes,2014,64(3):999-1010.
[2]Palmer BF,Clegg DJ.Electrolyte and Acid-Base Disturbances in Patientswith DiabetesMellitus[J].N Engl JMed,2015,373(6):548-559.
[3]Starup-Linde J,Vestergaard P.Management of endocrine disease:Diabetes and osteoporosis:cause for concern?[J]. European Journalof Endocrinology,2015,173(3):93-99.
[4]刘中浩,高红伟,邢德国,等.糖尿病性骨质疏松模型雌激素、一氧化氮及转化生长因子β1的变化[J].中国组织工程研究与临床康复,2011,15(11):1953-1956.
[5]Sanz AR,Carrion FS,Chaparro AP.Mesenchymal stem cells from the oral cavity and their potential value in tissue engineering[J].Periodontol,2015,67(1):251-267.
[6]Takami Y,Yamaguchi R,Ono S,etal.Clinical Application and HistologicalPropertiesof Autologous Tissue-engineered Skin Equivalents Using an Acellular Dermal Matrix[J]. Journal of Nippon Medical School,2014,81(6):356-363.
[7]Moreno LA,Cox KL.Quantification of dsDNA using the Hitachi F-7000 Fluorescence Spectrophotometer and Pico-Green dye[J].JVis Exp,2010(45):2465.
[8]Londono R,Badylak SF.Regenerative Medicine Strategies for Esophageal Repair[J].Tissue Eng Part B Rev,2015,21(4):393-410.
[9]Oliveira AL,Moore Z.Treatment of the diabetic foot by offloading:a systematic review[J].JWound Care,2015,24(12):560-570.
[10]Jeon YJ,Kim J,Jin HC,et al.Comparative analysis of humanmesenchymalstem cellsderived from bonemarrow,placenta and adipose tissue as sources of cell therapy[J]. JournalofCellular Biochemistry,2015,117(5):1112-1125.
[11]Kato J,Kamiya H,Himeno T,et al.Mesenchymal stem cellsameliorate impairedwound healing through enhancing keratinocyte functions in diabetic foot ulcerations on the plantar skin of rats[J].JDiabetes Complications,2014,28(5):588-595.
[12]Jackson WM,Nesti LJ,Tuan RS.Concise review:clinical translation of wound healing therapies based on mesenchymal stem cells[J].Stem Cells Transl Med,2012,1(1):44-50.
[13]Quagliaro L,Piconi L,Assaloni R,et al.Primary role of superoxide anion generation in the cascade of events leading to endothelial dysfunction and damage in high glucose treated HUVEC[J].Nutrition Metabolism& Cardiovascular Diseases Nmcd,2007,17(4):257-267.
[14]Wang X,Sng MK,Foo S,et al.Early controlled release of peroxisome proliferator-activated receptor beta/delta agonist GW 501516 improves diabetic wound healing through redoxmodulation ofwound microenvironment[J]. JControl Release,2015,197:138-147.
[15]Baldursson BT,Kjartansson H,Konrádsdóttir F,et al. Healing rate and autoimmune safety of full-thickness wounds treated with fish skin acellular dermal matrix versus porcine small-intestine submucosa:a noninferiority study[J].International Journalof LowerExtremityWounds,2015,14(1):37-43.
[16]Subramanian A,Schilling TF.Tendon development and musculoskeletal assembly:emerging roles for the extracellularmatrix[J].Development,2015,142(24):4191-4204.
[17]Shen L,ZengW,Wu YX,etal.Neurotrophin-3 accelerates wound healing in diabetic mice by promoting a paracrine response in mesenchymal stem cells[J].Cell Transplantation,2013,22(6):1011-1121.
[18]He S,Shen L,Wu Y,et al.Effect of Brain-Derived Neurotrophic Factor on Mesenchymal Stem Cells-seeded electrospinning biomaterial for treating ischemic diabetic ulcers viamilieu-dependentdifferentiationmechanism[J]. Tissue Engineering Part A,2014,21(5-6):928-938.
[19]Vapniarsky N,ArziB,Hu JC,etal.ConciseReview:Human Dermis as an Autologous Source of Stem Cells for Tissue Engineering and Regenerative Medicine[J].Stem Cells Translational Medicine,2015,4(10):1187-1198.
[20]Mao AS,Mooney DJ.Regenerativemedicine:Current therapies and future directions[J].Proc Natl Acad Sci USA,2015,112(47):14452-14459.
Detection of human bonemarrow mesenchym al stem cells integrate rabbit acellular dermal matrix stenting of in vitro osteogenesis ability in high glucose environment
ZHANG Yuting SUN Quan SHA Feng SUN Shizhu YAO Lijie LIJingping SHEN Lei
Department of Anatomy,QiqiharMedical School,Heilongjiang Province,Qiqihar 161006,China
Objective To investigate the protective effect of human bonemarrowmesenchymal stem cells(hBMSC)with the acellular dermalmatrix stenting in the high glucose environment,and the differentiation ability with the promotion form human bone marrow mesenchymal stem cells to osteoblasts.Methods Acellular dermal matrix and the high glucose model of containing 300 mmol/L glucose were established.With the high glucose environment,hBMSC was cultured to be the controlgroup.With the high glucose condition,hBMSC was planted to be the acellular dermalmatrix experimental group.With the normal condition,hBMSC was planted to be the normal control group.All groups had the osteoblasts induction experiment,the proliferation of hBMSC was detected by using MTT.the osteoblasts differentiation of hBMSC was detected by using fluorescence staining,and the content of BMP-1 and ALP in the experiment groups was detected by using ELISA.Results Compared with the high glucose control group,cell proliferation and matrix optical density(OD)of the hBMSCmatrix experiment group was increased,with significant statistic difference(P<0.01);hBMSC was in good condition in the acellular dermalmatrix.The number of BMP-1 positive cells in the culture group was significantly higher than that in the high glucose group(P<0.01);The contents of BMP-1,ALP proteins were significantly increased(P<0.01).Conclusion In the high glucose environment,the acellular dermalmatrix has the significantpromotion of differentiation from hBMSC to osteoblasts.
High glucose;Bonemarrow mesenchymal stem cells;Acellular dermalmatrix;Osteoblast
R318.06
A
1673-7210(2016)05(c)-0021-04
2016-01-29本文编辑:赵鲁枫)
黑龙江省教育厅面上项目(12541901)。
张彧婷(1978-),女,硕士,主要从事骨组织修复研究。
沈雷(1975-),男,硕士,副教授,硕士生导师,主要从事干细胞组织工程与再生医学研究。

