对二氯苯与Cd复合污染对毫米级根际微域土壤酶活性的联合毒性效应评价
孙福红,周启星,陈艳卿
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012 2.南开大学环境科学与工程学院,天津 300071 3.中国环境科学研究院环境标准研究所,北京 100012
对二氯苯与Cd复合污染对毫米级根际微域土壤酶活性的联合毒性效应评价
孙福红1,周启星2,陈艳卿3*
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012 2.南开大学环境科学与工程学院,天津 300071 3.中国环境科学研究院环境标准研究所,北京 100012
通过多隔层根际箱培养试验研究疏水性有机污染物对二氯苯(1,4-DCB)和重金属Cd单一与复合污染对不同作物毫米级根际微域土壤脱氢酶和脲酶活性的毒性效应,并利用联合作用模型分析二者联合毒性效应的作用类型。结果表明:与对照组相比,1,4-DCB单一胁迫抑制大豆各毫米级根际微域土壤脱氢酶活性,但能促进脲酶活性;低浓度1,4-DCB抑制小麦根际微域土壤脱氢酶和脲酶活性,高浓度1,4-DCB则促进近根际区域土壤脱氢酶和脲酶活性。低浓度Cd胁迫促进大豆根际微域土壤脱氢酶活性,高浓度Cd则起抑制作用;脲酶活性则随Cd浓度增加而显著增加,均高于对照组;Cd抑制小麦各毫米级根际微域土壤脱氢酶和脲酶活性。随根际距离增加,大豆近根际区域(1 mm)土壤脲酶活性受到诱导,而小麦中央区域和1、2 mm近根际区域土壤脱氢酶活性被显著抑制。二者复合污染对植物毫米级根际微域土壤酶活性的联合毒性效应与其浓度组合、植物种类、根际距离以及酶类型有关。
对二氯苯;复合污染;脲酶;脱氢酶;联合毒性效应
根际是植物生长和分泌过程中形成的物理、化学、生物学性质不同于土体的复杂微型生态系统。目前国际上关于根际环境的界面过程以及毒理学研究已成为土壤学和植物修复的热点[1]。由于植物根系及根系分泌作用的存在,致使根际环境形成了在pH、养分状况、微生物组成及酶活性等方面的特殊生境[2],根际对外界环境的氧化胁迫反应敏感[1-2]。与非根际土壤相比,根际土壤中微生物活性通常会高出5~20倍,从而影响根际微域土壤酶的活性[3]。已证实植物根际效应对外源污染物在土壤中的降解和毒性作用机制具有很大的影响和调节作用[4-6]。吕笑非[2]研究发现:植物根际的存在提高了土壤的总水溶性有机碳含量,增加了土壤微生物碳含量;在苯并(a)芘的污染胁迫下,根际效应的存在促进了土壤多酚氧化酶、脱氢酶的活性,并促进了PAHs在土壤中的降解能力。
环境污染问题实际上是多种污染物共存引起的复合污染,一种污染物的环境行为和生态毒性效应往往受到共存污染物的影响,因此阐明污染物的环境行为,解释其生态毒性发生机制,应考虑2种或2种以上污染物共存的复合污染体系[7-8]。目前,已有不少研究报道了单一污染物(如五氯酚、多氯联苯、芘、磺胺嘧啶)在毫米级根际微域中的降解行为[9-12],重金属在根际微域中的形态转化及生物有效性变化[13]等,而对根际微域环境中复合污染生态毒性效应的报道相对较少[14]。因此,有必要对根际微域环境中有机污染物和重金属复合污染生态毒性效应开展系统的科学研究。
典型疏水性有机污染物对二氯苯(1,4-DCB)主要用作防蛀剂、除臭剂、杀虫剂和杀菌剂,亦常用作土壤消毒剂和熏蒸剂。1,4-DCB已被列入美国国家环境保护局(US EPA)优先监测污染物和我国水体优先控制污染物黑名单,被国际癌症研究机构(IARC)确定为可能的人类致癌物。1,4-DCB具有很强的挥发性,在空气中不会发生直接的光降解反应,会随大气干湿沉降作用落到土壤表层,造成土壤污染。1,4-DCB具有较高的脂溶性和难降解性,能够在环境中长期存在并具有生物富集作用。因此,1,4-DCB会对土壤微生物和植物产生较大毒害作用,甚至威胁人体健康。Cd是土壤环境中普遍存在的重金属污染物,1,4-DCB和Cd在环境中均具有持久性和难降解性,二者在土壤中的共存会对人体健康和生态环境产生潜在的长期危害。而目前关于二者复合污染对植物根际微域土壤酶活性联合毒性效应评价的研究还很缺乏。
土壤酶是土壤环境中最活跃的有机成分之一,其驱动土壤的代谢过程,催化土壤微生物的活性,对土壤圈中养分元素的循环和污染物的净化起着重要作用。其活性高低可反映土壤营养物转化、能量代谢和污染物降解等能力的强弱[15-16]。笔者以土壤脱氢酶和脲酶活性为评价指标,通过多隔层根际箱室内培养试验,利用污染物联合作用模型,研究1,4-DCB与Cd对不同植物各毫米级根际微域土壤酶活性的联合毒性效应及其作用类型,考察二者对植物根际微域土壤酶活性的毒性效应随根际距离远近梯度变化的响应趋势,以期为土壤环境质量评价、生态风险评价和污染治理工作提供试验依据和理论指导。
1 材料与方法
1.1 供试材料
1,4-DCB〔东京化成工业株式会社(TCI)生产〕,色谱纯(GC)级别,纯度为99%。供试棕壤采自中国科学院沈阳生态实验站未被污染的地块。生态实验站地处下辽河平原,属于暖温带半湿润大陆性气候,年均气温7~8 ℃,降水量为650~700 mm,无霜期147~164 d。采集0~20 cm的表层土壤,去除植物残体及砾石,室温下自然风干,充分混匀后,过2 mm筛备用。在研磨和保存过程中应防止样品受到污染。供试植物大豆和小麦均为东北地区主栽作物,品种分别为铁丰30号和辽春10号。
1.2 试验方法
室内模拟试验采用根际箱培养方法。根际箱的设计参照Naoki等[17]方法进行。根际箱材料为不透明的PVC板,长、宽、高均为10 cm,壁厚约4 mm,内部由相同规格的隔板将植物根际土壤按照距离根系远近分隔成中央区域(10 mm)、两侧的近根系区域(1~5 mm)和远根系区域(>5 mm)。中央区域为植物根系生长区,装80.0 g土壤(以干质量计),以此为中心,分别在左右两侧(近根系区域)每隔1 mm用隔板分层,共分5层,以此将植物根系限制在中央区域生长,每层装土5.0 g。5层以外区域视为远根际土壤,装土340.0 g。隔板由有机玻璃框支撑的400目尼龙网做成,框的厚度为0.8 mm。这种设计在充分避免根系组织生长进入相邻两侧近根系区域,实现各土层间彼此物理分离的同时,又确保土壤微生物及根系分泌物等的层间迁移活动。收获时,可观察到两侧的近根系区域并无根须组织穿过。
于培养皿内将作物种子培养发芽,挑选长势良好、大小一致的芽移入根际箱,将根际箱放入温室中,保持土壤含水量在20%左右,间歇光照条件(光照12 h,黑暗12 h)下培养1周后,开始间苗,每盒中央区域等距离保留3株大豆幼苗和5株小麦幼苗。随后向各根际箱土壤中添加不同浓度的污染物,污染物浓度选择参考GB 15618—1995《土壤环境质量标准》,每种浓度重复2次。大豆试验中,Cd浓度为0,1.0和10.0 mgkg,1,4-DCB浓度为0,4.0和40.0 mgkg,复合污染为10.0 mgkg Cd与4.0和40.0 mgkg 1,4-DCB组合。小麦试验中,Cd浓度为0,1.0和10.0 mgkg,1,4-DCB浓度为0,0.4,4.0和40.0 mgkg,复合污染为10.0 mgkg Cd与0.4和40.0 mgkg 1,4-DCB组合。按上述步骤培养30 d后开箱,逐一取出各层隔板,测定土壤脱氢酶、脲酶活性,每种浓度重复3次。
1.3 分析方法
土壤脱氢酶活性采用2,3,5-三苯基四唑氯化物显色法(TTC法)测定[18];土壤脲酶活性采用苯酚-次氯酸钠比色法测定[18]。
1.4 联合毒性效应分析
通常根据污染物的性质、作用靶位点的不同而选择不同的模型来评价联合作用类型。本研究采用Bliss Independence Model[19-22]来评价1,4-DCB与Cd对土壤酶活性的联合毒性作用类型,其数学表达式为:

(1)

(2)
pA+B=pA+pB-pA·pB
(3)
式中:pA为污染物A对酶活性的影响;pB为污染物B对酶活性的影响;pA+B为污染物A与B联合作用对酶活性影响的预测值。
Bliss Independence Model零假设为:复合污染对土壤酶活性影响的观测值与通过式(3)得到的理论预测值相等,即差异不显著,则为加合作用。如果理论预测值显著(P<0.05)高于观测值,则为协同作用;反之,则为拮抗作用。采用Excel和SPSS 13.0对试验数据进行平均值计算、方差分析和多重比较。
2 结果与讨论
2.1 复合污染对大豆和小麦毫米级根际微域土壤脱氢酶活性的毒性效应
1,4-DCB与Cd复合污染胁迫作用下,大豆和小麦各毫米级根际微域土壤脱氢酶活性变化如图1所示。

图1 1,4-DCB与Cd浓度对大豆和小麦各毫米级根际微域土壤脱氢酶活性的影响Fig.1 Effects of 1,4-DCB and Cd on the activity of dehydrogenase in the millimeter rhizosphere of soybean and wheat
从图1(a)可以看出,对照组(CK)和1,4-DCB单一浓度处理(4.0和40.0 mgkg)下,大豆根际脱氢酶活性变化趋势基本一致,即中央区域脱氢酶活性最高,显著高于近根际区域和>5 mm的远根际区域,而近和远根际区域脱氢酶活性基本一致,变化不大,比中央区域酶活性低34.1%~61.2%。40.0 mgkg 1,4-DCB胁迫下,大豆各毫米级根际微域土壤脱氢酶活性普遍略微高于4.0 mgkg处理组,说明高浓度的1,4-DCB能够促进根际土壤微生物的活性,缓解对脱氢酶的抑制作用。在1.0 mgkg Cd胁迫作用下,脱氢酶活性在1 mm的近根际区域达到最高,4和3 mm次之,均显著高于中央区域,远根际区域土壤与中央区域保持一致。除中央区域外,1.0 mgkg Cd处理下大豆根际区域土壤脱氢酶活性均高于对照组。在10.0 mgkg Cd胁迫作用下,近根际区域土壤脱氢酶活性均低于中央区域和对应的对照组各区域,但远根际区域脱氢酶活性要高于对照组。总的来说,在Cd单一胁迫下,低浓度Cd促进了各毫米级根际微域土壤脱氢酶活性,而高浓度Cd则起抑制作用。低浓度1,4-DCB(4.0 mgkg)与Cd的联合作用使大豆各毫米级根际微域土壤脱氢酶活性受到抑制,低于对照组和对应的单一处理;而在高浓度1,4-DCB(40.0 mgkg)与Cd联合胁迫下,脱氢酶的活性受到显著诱导,各毫米级微域土壤脱氢酶活性显著高于对照组和对应单一处理。表明高浓度的1,4-DCB能够促进大豆毫米级根际微域土壤脱氢酶的活性。
从图1(b)可以看出,对于小麦各毫米级根际微域土壤来说,对照组脱氢酶活性的变化趋势为中央区域>1 mm>2 mm>4 mm>5 mm≈远根际区域。在0.4和4.0 mgkg 1,4-DCB单一处理下,各根际区域土壤脱氢酶的活性普遍低于对照组,而在高浓度(40.0 mgkg) 1,4-DCB胁迫下,除中央区域外,近和远根际区域脱氢酶的活性均受到促进,显著高于对照组。就近根际区域而言,40.0 mgkg 1,4-DCB单一胁迫下,脱氢酶活性显著高于2个低浓度处理组,这与大豆近根际土壤脱氢酶活性的情况一致。在Cd单一胁迫中,脱氢酶活性普遍表现为中央区域最高,各毫米级根际微域土壤的脱氢酶活性普遍低于对照组,表明Cd抑制了小麦根际土壤脱氢酶活性。在1,4-DCB与Cd联合胁迫作用下,中央区域和1、2 mm近根际区域土壤脱氢酶活性受到抑制,低于对照组,而其他区域脱氢酶活性均高于对照组。0.4 mgkg 1,4-DCB与Cd的联合胁迫导致各毫米级根际微域土壤脱氢酶活性均高于1,4-DCB单一污染,并且其在中央区域的活性低于Cd单一污染,而在近和远根际区域则高于Cd。40.0 mgkg 1,4-DCB与Cd复合污染导致中央区域和1 mm根际区域中脱氢酶活性低于Cd单一污染,其他区域则高于Cd单一污染,同时导致中央区域和1、2 mm微域低于1,4-DCB单一污染,其他区域则高于1,4-DCB单一污染。
2.2 复合污染对大豆和小麦毫米级根际微域土壤脲酶活性的毒性效应
1,4-DCB和Cd单一与复合污染对大豆和小麦各毫米级根际微域土壤脲酶活性的毒性效应如图2所示。

图2 1,4-DCB与Cd浓度对大豆和小麦各毫米级根际微域土壤脲酶活性的影响Fig.2 Effects of 1,4-DCB and Cd on the activity of urease in the millimeter rhizosphere of soybean and wheat
由图2(a)可见,对照组大豆各毫米级根际微域土壤脲酶活性虽有所波动,但变化幅度较小,基本保持一致,不存在随根际不同间距产生梯度变化的趋势。4.0和40.0 mgkg 1,4-DCB单一处理均使脲酶活性高于对照组,高浓度1,4-DCB对脲酶的促进作用要高于低浓度,脲酶活性在1 mm近根际区域达到最高值,然后随根系距离的增大而降低,在远根际区域达最低值。在Cd单一胁迫下,大豆各毫米级根际微域脲酶活性随Cd浓度的增加而显著增加,均高于对照组,表明Cd的存在促进了大豆各毫米级根际微域土壤脲酶活性。在1.0 mgkg Cd浓度下,脲酶活性变化趋势为2和4 mm>1和3 mm>中央区域≫远根际区域;在10.0 mgkg Cd浓度下,脲酶活性变化趋势为3 mm>2 mm>4和5 mm>1 mm>中央区域和远根际区域。这表明Cd污染作用下大豆近根际区域脲酶活性受到激发。在1,4-DCB与Cd复合污染条件下,与对照组相比,中央和近根际区域土壤脲酶活性受到较大的促进作用,其中1 mm近根区域脲酶活性最高。与对应的Cd单一污染相比,复合污染条件下大豆各级根际微域土壤脲酶活性变化不大。4.0 mgkg 1,4-DCB与Cd共同胁迫下,各级根际微域土壤脲酶活性要高于对应的1,4-DCB单一污染,而40.0 mgkg 1,4-DCB与Cd联合胁迫下,其各级根际微域土壤脲酶活性低于对应的1,4-DCB单一污染。综上,1,4-DCB和Cd单一与联合胁迫均导致大豆近根际区域(特别是1 mm)土壤脲酶活性得到激发,其变化较其他区域显著。
由图2(b)可以看出,对照组脲酶活性在小麦根系不同间距范围内变化较小。总的来说,与对照组相比,1,4-DCB单一胁迫下小麦各级根际微域土壤脲酶活性均受到抑制,这与大豆根际微域土壤脲酶活性的变化趋势〔图2(a)〕相反,其中0.4 mgkg 1,4-DCB单一胁迫对各级根际微域土壤脲酶活性产生抑制作用,其活性在中央区域稍低于对照组,在近根际1 mm区域先是下降达最低值,随后在2~5 mm区域开始升高,远根际区域又降低。随着1,4-DCB浓度的增加,各级根际微域土壤脲酶活性也增加,但都低于对照组,这与小麦根际微域土壤脱氢酶的变化基本一致。在Cd单一处理下,与对照组相比,各级微域土壤脲酶活性普遍受到抑制,其中1.0 mgkg Cd对脲酶活性的抑制作用高于10.0 mgkg Cd,这与小麦根际微域脱氢酶活性的变化一致,表明高浓度Cd的存在减缓了其对土壤脲酶和脱氢酶活性的抑制作用,这可能是由于高浓度Cd的胁迫作用刺激了小麦根系分泌物的活性,从而诱导了根际土壤微生物的活性,使酶活性升高,这是一种应对长期胁迫的适应机制[1]。这与前人的研究结果不一致,有研究报道重金属Cu、Pb和Zn均能在一定程度上抑制土壤脱氢酶、脲酶和酸性磷酸酶的活性[23],这主要是由于试验条件的差异导致的,本研究是针对重金属氧化胁迫下植物根际微域的土壤酶活性变化开展的,而前人关于土壤酶活性报道中没有种植植物,是纯土壤培养条件下得到的试验结果[23]。在1,4-DCB和Cd联合胁迫作用下,各级根际微域土壤脲酶活性均显著低于对照组和对应的1,4-DCB与Cd单一污染,且各级微域间脲酶活性变化差异不显著。
2.3 复合污染对毫米级根际微域土壤酶活性的联合毒性效应评价
环境中经常同时出现2种或2种以上的污染物,这些物质会对机体产生综合毒性效应,称为污染物的联合作用,联合作用有协同作用、拮抗作用、加和作用和独立作用等几种类型[16]。Bliss Independence Model能够准确预测不同作用靶位点的污染物间的联合作用,已被应用于预测重金属Cd、Cu和Pb对土壤酶活性的联合毒性效应以及不同化学品对藻类的联合毒性效应[24-25]。表1为1,4-DCB与Cd复合污染对不同作物毫米级根际微域土壤脱氢酶和脲酶活性的联合毒性效应评估。从表1可以看出,4.0和40.0 mgkg 1,4-DCB与Cd复合污染对大豆脱氢酶活性的联合作用主要表现为协同和加和作用;0.4和40.0 mgkg 1,4-DCB与Cd复合污染对小麦脱氢酶活性的联合作用类型比较复杂,有协同、拮抗和加和作用,取决于不同的浓度组合和根际距离。4.0和40.0 mgkg 1,4-DCB与Cd复合污染对大豆脲酶活性的联合作用主要表现为拮抗作用;而0.4和40.0 mgkg 1,4-DCB与Cd复合污染对小麦土壤脲酶活性的联合作用主要表现为加和和协同作用。研究发现:1,4-DCB与Cd复合污染对毫米级根际微域土壤脱氢酶和脲酶活性影响的联合作用类型比较复杂,表现不一致,与根际距离、浓度组合、作物种类等有关,这与许多研究[26-27]结论一致。Sharma等[21]认为重金属复合污染对赛葵根长的联合毒性表现为与浓度有关的拮抗作用、非加合作用和协同作用。
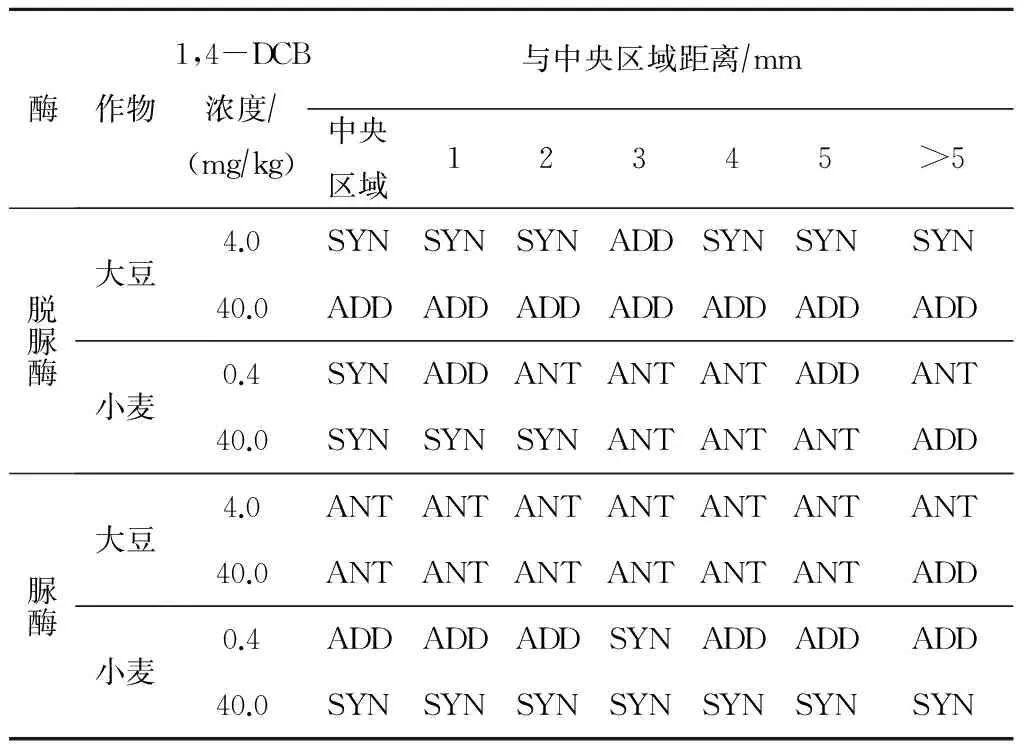
表1 1,4-DCB与Cd复合污染对毫米级根际微域土壤脱氢酶和脲酶活性的联合毒性效应评估
注:ANT为拮抗作用(antagonism);SYN为协同作用(synergism);ADD为加合作用(addition)。
研究表明:不同浓度水平1,4-DCB的存在均抑制了大豆各毫米级根际微域土壤脱氢酶活性,相反却促进了脲酶活性。低浓度Cd单一胁迫激发了大豆各毫米级根际微域土壤脱氢酶活性,而高浓度Cd则起显著抑制作用,大豆各毫米级根际微域土壤脲酶活性则随Cd浓度的增加而显著增加。王金花等[28]研究也表明:高浓度阿特拉津处理后,土壤脲酶活性明显受到抑制,而低浓度阿特拉津污染土壤脲酶活性受到一定的刺激而升高。本研究中低浓度1,4-DCB与Cd联合胁迫使大豆各毫米级根际微域土壤脱氢酶活性受到抑制,活性低于对照组和对应的单一处理;而在高浓度1,4-DCB与Cd的联合胁迫下,脱氢酶活性受到显著诱导,各毫米级微域土壤脱氢酶活性显著高于对照组和对应的单一处理。1,4-DCB和Cd单一与联合胁迫均导致大豆近根际区域土壤(特别是1 mm)脲酶活性得到激发,其变化较其他区域显著。对于小麦来说,低浓度1,4-DCB单一胁迫导致小麦各毫米级根际微域土壤脱氢酶和脲酶活性受到抑制,高浓度1,4-DCB则使近和远根际区域脱氢酶和脲酶活性得到促进;Cd单一胁迫下,小麦各毫米级根际微域土壤脱氢酶和脲酶活性均低于对照组,受到抑制。根系存在下,土壤本身的各种特性,包括土壤理化性状、土著微生物组成及多样性等均发生明显的变化,在污染物胁迫作用下,植物的活根能够通过分泌胞外酶刺激根际周围土壤微生物的活性而影响土壤酶活性[29],表现出不同于非根系的土壤微生物活性以及酶活性[1]。本研究中,在1,4-DCB和Cd单一与复合污染胁迫作用下,大豆和小麦的毫米级根际微域土壤脱氢酶和脲酶活性变化趋势不一致,这可能是由于不同作物根系对1,4-DCB和Cd氧化胁迫具有不同的耐受特性和响应机制,前人的研究[30-31]也得到了相似的结果。戴建军等通过盆栽试验研究发现:大豆和玉米根际的土壤脲酶、过氧化氢酶、多酚氧化酶和蔗糖酶活性以及微生物量碳、氮具有很大差别,主要受种植方式和植物类型的影响[30]。在放射性核素U对反枝苋、鬼针草、印度芥菜的根际土壤酶活性影响的研究中发现:同一处理浓度的氧化胁迫作用对3种不同植物根际土壤脲酶、脱氢酶和蔗糖酶活性的毒性影响差异较大,不同作物影响下不同的土壤酶活性变化趋势不同[31]。不同植物根际微域土壤的微生物活性、数量以及多样性各有不同,因此,不同种类植物根际微生物系统对污染胁迫具有不同的调节和应对机制,进而影响土壤酶活性的变化。
在本试验中,1,4-DCB和Cd单一与联合胁迫导致大豆根际中央区域的脱氢酶活性显著高于近根际和远根际土壤,而近根际区域土壤(特别是1 mm)脲酶活性得到激发,其变化较其他区域显著。小麦根际在联合胁迫下,中央区域和1 mm近根际微域土壤脱氢酶活性受抑制,随着与中央区域距离的增加,脱氢酶活性也增加,而脲酶活性在小麦根际各毫米级微域间差异不显著。综上,1,4-DCB和Cd对大豆和小麦不同距离的毫米级根际微域土壤酶活性影响不一致,并不是简单的随距离增加呈递减效应。大量的研究表明,土壤酶能够对土壤污染做出灵敏的反应,可以表征土壤退化的程度。然而,复合污染条件下,污染物对土壤酶活性的影响取决于许多环境因子,包括外源污染物的性质和浓度组合、作用时间以及酶种类、作物和土壤类型等,结果可能是正效应,也可能是负效应。因而,关于有机-无机污染物结合对土壤酶活性的影响以及应用土壤酶活性变化对其环境效应的定量化表征方法还有待进一步深入探索。
3 结论
(1)不同浓度水平1,4-DCB单一胁迫均抑制了大豆各毫米级根际微域土壤脱氢酶活性,相反却促进脲酶活性。低浓度1,4-DCB导致小麦各毫米级根际微域土壤脱氢酶和脲酶活性受到抑制,高浓度则使近和远根际区域脱氢酶和脲酶活性得到促进。
(2)低浓度Cd胁迫促进大豆各毫米级根际微域土壤脱氢酶活性,高浓度Cd则起抑制作用;脲酶活性则随Cd浓度的增加而显著增加,均高于对照组。小麦各毫米级根际微域土壤脱氢酶和脲酶活性均受到抑制。
(3) 低浓度1,4-DCB与Cd联合胁迫使大豆各毫米级根际微域土壤脱氢酶活性受抑制,低于对照组和单一处理;而高浓度的情况则相反。二者联合胁迫导致大豆近根际区域(特别是1 mm)土壤脲酶活性得到激发,其变化较其他区域显著。小麦中央区域和1、2 mm近根际区域土壤脱氢酶活性受到抑制;而各级根际微域土壤脲酶活性变化不显著。1,4-DCB和Cd对大豆和小麦不同距离的根际区域土壤酶活性影响不一致,并不是简单的随距离增加呈递减效应。
(4) 1,4-DCB与Cd复合污染对植物毫米级根际微域土壤酶活性的联合毒性效应不仅与其浓度组合有关,还与植物种类、根际距离以及酶的类型有关。
[1] 魏树和,周启星,张凯松,等.根际圈在污染土壤修复中的作用与机理分析[J].应用生态学报,2003,14(1):143-147.
WEI S H,ZHOU Q X,ZHANG K S,et al.Roles of rhizosphere in remediation of contaminated soils and its mechanisms[J].Chinese Journal of Applied Ecology,2003,14(1):143-147.
[2] 吕笑非.PAHs污染土壤修复植物的筛选及其根际微生态特征研究[D].杭州:浙江大学,2010.
[3] RAZAVI B S,ZAREBANADKOUKI M,BLAGODATSKAYA E,et al.Rhizosphere shape of lentil and maize:spatial distribution of enzyme activities[J].Soil Biology and Biochemistry,2016,96:229-237.
[4] HE Y,XU J,TANG C,et al.Facilitation of pentachlorophenol degradation in the rhizosphere of ryegrass (LoliumperenneL.)[J].Soil Biology and Biochemistry,2005,37(11):2017-2024.
[5] DASILVA M,KAMATH R,ALVAREZ P.Effect of simulated rhizodeposition on the relative abundance of polynuclear aromatic hydrocarbon catabolic genes in a contaminated soil[J].Environmental Toxicology and Chemistry,2006,25(2):386-391.
[6] DIEDHIOU S,DOSSA E,BADIANE A,et al.Decomposition and spatial microbial heterogeneity associated with native shrubs in soils of agroecosystems in semi-arid Senegal[J].Pedobiologia,2008,52(4):273-286.
[7] PAN J,YU L.Effects of Cd orand Pb on soil enzyme activities and microbial community structure[J].Ecological Engineering,2011,37(11):1889-1894.
[8] GAO Y,ZHOU P,LIANG M,et al.Assessment of effects of heavy metals combined pollution on soil enzyme activities and microbial community structure:modified ecological dose-response model and PCR-RAPD[J].Environmental Earth Sciences,2007,51(7):1221-1228.
[9] 何艳.五氯酚的土水界面行为及其在毫米级根际微域中的消减作用[D].杭州:浙江大学,2006.
[10] 丁娜.多氯联苯在毫米级根际微域中的消减行为及生物响应机制研究[D].杭州:浙江大学,2012.
[11] 许超,夏北成.运用多隔层根箱研究玉米幼苗根际微域中芘的降解[J].土壤,2010,42(4):554-559.
XU C,XIA B C.Degradation of pyrene in rhizosphere of maize seedlings (ZeamaysL.) in a rhizobox[J].Soils,2010,42(4):554-559.
[12] 金彩霞,朱雯斐,郭桦,等.毫米级根际微域磺胺嘧啶的降解动态研究[J].环境科学学报,2014,34(8):2085-2093.
JIN C X,ZHU W F,GUO H,et al.Degradation characteristics of sulfadiazine on the rhizospheric soils[J].Acta Scientiae Circumstantiae,2014,34(8):2085-2093.
[13] 江婧.根际微域重金属形态变化及其迁移转化研究[D].南昌:南昌大学,2012.
[14] SUBRAHUMNYAM G,SHEN J P,LIU Y R,et al.Effect of long-term industrial waste effluent pollution on soil enzyme activities and bacterial community composition[J].Environmental Monitoring and Assessment,2016,188(2):112.
[15] 张维平.土壤环境监测技术规范[M].北京:中国环境科学出版社,2004.
[16] 王新,周启星.土壤重金属污染生态过程、效应及修复[J].生态科学,2004,23(3):278-281.
WANG X,ZHOU Q X.The ecological process,effect and remediation of heavy metals contaminated soil[J].Ecological Science,2004,23(3):278-281.
[17] NAOKI M,JUNTA Y,TAKASHI K.Effect of plant growth on the distribution and forms of soil nutrients in the rhizosphere[J].Soil Science and Plant Nutrition,2000,46(2):439-447.
[18] 关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1987.
[19] BLISS C I.The toxicity of poisons applied jointly[J].Annals of Applied Biology,1939,26(1):585-615.
[20] KUNGOLOS A,SAMARAS P,KIPPPOULOU A M,et al.Interactive toxic effects of agrochemicals on aquatic organisms[J].Water Science and Technology,1999,40(1):357-364.
[21] SHARMA S S,SCHAT H,VOOIJS R,et al.Combination toxicology of copper,zinc,and cadmium in binary mixtures:concentration-dependent antagonistic,nonadditive,and synergistic effects on root growth inSilenevulgaris[J].Environmental Toxicology and Chemistry,1999,18(2):348-355.
[22] RENELLA G,MENCH M,LANDI L,et al.Microbial activity and hydrolase synthesis in long-term Cd-contaminated soils[J].Soil Biology and Biochemistry,2005,37(1):133-139.
[23] 傅海霞,刘怡,董志英,等.抗生素与重金属复合污染的生态毒理效应研究进展[J].环境工程,2016,34(4):60-63.
FU H X,LIU Y,DONG Z Y,et al.Progress in research on ecological toxicity of combined pollution of antibiotics and heavy metals[J].Environmental Engineering,2016,34(4):60-63.
[24] CHAPERON S,SAUVÉ S.Toxicity interaction of cadmium,copper,and lead on soil urease and dehydrogenase activity in relation to chemical speciation[J].Ecotoxicology and Environmental Safety,2008,70(1):1-9.
[25] FAUST M,ALTENBURGER R,BACKHAUS T,et al.Joint algal toxicity of 16 dissimilarly acting chemicals is predictable by the concept of independent action[J].Aquatic Toxicology,2003,63(1):43-63.
[26] CHIGBO C,BATTY L.Effect of combined pollution of chromium and benzo (a) pyrene on seed growth of Lolium perenne[J].Chemosphere,2013,90(2):164-169.
[27] SHEN G Q,LU Y T,ZHOU Q X,et al.Interaction of polycyclic aromatic hydrocarbons and heavy metals on soil enzyme[J].Chemosphere,2005,61(8):1175-1182.
[28] 王金花,朱鲁生,王军,等.除草剂阿特拉津对土壤脲酶活性的影响[J].应用生态学报,2003,14(12):2281-2284.
WANG J H,ZHU L S,WANG J,et al.Effect of atrazine on urease activity in soils with different fertility[J].Chinese Journal of Applied Ecology,2003,14(12):2281-2284.
[29] ANDERSON T,GUTHRIE E,WALTON B.Bioremediation in the rhizosphere[J].Environmental Science and Technology,1993,27(13):2630-2636.
[30] 戴建军,宋朋慧,闫暮春,等.不同种植方式对苗期大豆、玉米根际土壤酶活性及微生物量碳、氮的影响[J].东北农业大学学报,2013,44(2):17-22.
DAI J J,SONG P H,YAN M C,et al.Effect of different cropping patterns of soybean and maize seedlings on rhizosphere soil enzyme activities and microbial biomass carbon and nitrogen[J].Journal of Northeast Agricultural University,2013,44(2):17-22.
[31] 焦扬,罗学刚,唐永金,等.铀对不同植物根际土壤酶活的影响[J].环境科学与技术,2016,39(3):33-37.
JIAO Y,LUO X G,TANG Y J,et al.Effects of uranium on different plants rhizosphere soil enzyme activity[J].Environmental Science and Technology,2016,39(3):33-37. ▷
Assessment on Joint Toxic Effects of Combined Pollution of 1,4-DCB and Cd on Enzyme Activities in Millimeter Rhizosphere
SUN Fuhong1, ZHOU Qixing2, CHEN Yanqing3
1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China 2.College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China 3.Environmental Standards Institute, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
The single and joint toxic effects of hydrophobic organic compounds 1,4-dichlorobenzene(1,4-DCB) and heavy metal Cd on the activities of urease and dehydrogenase in the millimeter rhizosphere were investigated through rhizobox culture experiments. The interactions modes between 1,4-DCB and Cd were further analyzed and assessed based on the mathematical models. The results showed that the occurrence of 1,4-DCB inhibited dehydrogenase activities, but enhanced urease activities in the millimeter rhizosphere of soybean, compared with the control. Single stress of lower concentrations of 1,4-DCB reduced the activities of dehydrogenase and urease in the millimeter rhizosphere of wheat, while higher levels of 1,4-DCB promoted the activities of dehydrogenase and urease in the near-millimeter rhizosphere of wheat. The single stress of lower concentrations of Cd promoted the activities of dehydrogenase while the stress of higher concentrations of Cd inhibited the activities of dehydrogenase in the millimeter rhizosphere of soybean. The activities of urease in the millimeter rhizosphere of soybean increased with the increasing concentration of Cd. The single treatments of Cd inhibited the activities of dehydrogenase and urease in the millimeter rhizosphere of wheat, compared with the control. The changes of the activities of dehydrogenase and urease in the millimeter rhizosphere with distances were complicated under the pollution of 1,4-DCB and Cd. Generally, the stress of 1,4-DCB and Cd resulted in the increases of urease activities in near-rhizosphere (1 mm) of soybean and the decreases of dehydrogenase activities in root compartment and near-rhizosphere (1 and 2 mm) of wheat. The interactive modes of 1,4-DCB and Cd on enzymes activities in the millimeter rhizosphere depended on their concentration combinations, crop species, distances of millimeter rhizosphere and enzyme types.
1,4-dichlorobenzene; combined pollution; urease; dehydrogenase; joint toxic effects
2016-07-18
国家自然科学基金项目(41573126;41203079)
孙福红(1980—),女,副研究员,博士,主要从事环境基准与风险评估工作,sunfhiae@126.com
*责任作者:陈艳卿(1962—),女,研究员,硕士,长期从事环境基准与环境标准研究,chenyq@craes.org.cn
X171.5
1674-991X(2016)06-0571-08
10.3969j.issn.1674-991X.2016.06.082
孙福红,周启星,陈艳卿.对二氯苯与Cd复合污染对毫米级根际微域土壤酶活性的联合毒性效应评价[J].环境工程技术学报,2016,6(6):571-578.
SUN F H, ZHOU Q X, CHEN Y Q.Assessment on joint toxic effects of combined pollution of 1,4-DCB and Cd on enzyme activities in millimeter rhizosphere[J].Journal of Environmental Engineering Technology,2016,6(6):571-578.

