主动脉壁内血肿预后的中期随访研究
刘 浩 吴文辉 蒲俊舟 韩晓峰 曾庆龙 朱俊明 黄连军
首都医科大学附属北京安贞医院,北京 100029
主动脉壁内血肿预后的中期随访研究
刘 浩 吴文辉 蒲俊舟 韩晓峰 曾庆龙 朱俊明 黄连军*
首都医科大学附属北京安贞医院,北京 100029
目的 研究急性单纯主动脉壁内血肿(intramural aortic hematoma,IMH)的影像学表现及临床预后,总结其转归特点,为临床随访及治疗策略的选择提供依据。方法 选择2014年6月至2015年6月北京安贞医院连续收治的60例单纯IMH患者,所有患者均进行规律随访,分析其影像学特点及预后,平均随访时间为(10.0±4.6)个月。结果 随访期间,IMH合并出现壁间血池(intramural blood pools,IBP)11例(18.3%),溃疡样突起(ulcer-like projection,ULP)11例(18.3%),穿透性主动脉粥样硬化性溃疡(penetrating atherosclerotic aortic ulcer,PAU)4例(6.7%)。42例血肿可见明显吸收或完全吸收。31例预后良好,29例病变进展。29例病变进展的患者中,病变增大18例,主动脉破裂3例,瘤样扩张5例,夹层形成2例,肺栓塞1例;其中11例进行了腔内修复及外科手术干预。结论 IMH随访期间血肿大部分吸收,但多数患者会出现并发症,提示临床医生需要对IMH患者进行严格的影像学随访观察。
单纯主动脉壁内血肿;并发症;影像学随访观察
IMH于1920年由Krukenberg首次描述为无内膜破口的主动脉夹层,最初定义为主动脉壁内出血或主动脉内局限性血肿,血肿位于中膜与外膜之间,但无内膜破口不与管腔相通[1]。随着无创影像学检查技术与设备的发展与完善,IMH中更为微小的病变被发现。IMH最新定义为各种原因导致的主动脉壁内出现的一种病理生理改变,影像学表现为主动脉壁环形增厚,伴或不伴PAU、ULP或IBP[2]。IMH的发病机制尚不明确,可能是由于主动脉壁间滋养动脉破裂或动脉粥样硬化斑块破裂引起。Song[3]研究报道,IMH经保守治疗后血肿大部分被吸收。但也有不少研究提出,药物保守治疗过程中可能会形成动脉瘤、经典夹层或发生主动脉的破裂。本研究随访60例急性单纯IMH患者的影像学表现及临床预后,总结其转归特点,旨在为临床随访及治疗策略的选择提供依据,现报道如下。
1 材料与方法
1.1一般资料
选择2014年6月至2015年6月于首都医科大学附属北京安贞医院诊治的60例单纯IMH患者。60例患者中,男46例,女14例,年龄(59.2±11.6)岁。Stanford A型12例,Stanford B型48例。合并高血压49例,糖尿病40例,缺血性心脏病50例,脑血管疾病10例。
1.2诊断标准
单纯IMH:CT表现为主动脉壁呈新月形或环形增厚,主动脉腔内缘表面光整,并伴有内膜钙化斑内移,无内膜口或内膜裂口。
IBP:⑴ 降主动脉IBP或分支血管微小动脉瘤;⑵ 近端与主动脉管腔无明显交通或存在针尖样破口(<2 mm);⑶ 远端与肋间动脉、支气管动脉或腰动脉相通。
ULP:⑴ 位于IMH中的囊带状对比强化灶;⑵ 与主动脉管腔相通,内膜破口>3 mm;⑶ 局部无粥样硬化斑块。
PAU:⑴ 主动脉壁血肿内深大“龛影”;⑵ 广泛的动脉粥样硬化和钙化;⑶ 可并发血液外渗、纵膈血肿或心包出血。
1.3药物治疗及血压控制
本组所有患者均仅行药物保守治疗,在院期间主要使用钙离子拮抗剂、β受体阻滞剂、血管紧张素转化酶抑制剂等药物将患者收缩压控制在120 mm Hg左右,同时对患者使用镇痛、镇静等药物,随访过程中患者通过口服抗高血压药物将收缩压控制在130 mm Hg以下。
1.4随访及影像分析
对所有患者进行CT血管造影(computed tomography angiography,CTA)随访检查,随访时间为诊断后1周、1个月、3个月、6个月及每年,随访过程中如出现并发症,需适当缩短随访间隔时间,增加CTA检查次数,随访过程中密切观察病情变化及并发症情况,必要时采取其他治疗方案(如血管内覆膜支架置入术或外科手术)。由2名高年资影像科医师进行阅片,将患者的基本信息进行覆盖,并进行无序排列,消除混杂因素。
1.5终点事件及预后
终点事件为患者死亡、接受主动脉相关腔内修复或外科治疗。
预后分为稳定与进展。稳定:无主动脉相关不适且影像学随访未见病变进展,未接受主动脉相关腔内治疗及外科手术。进展:影像学显示病变进展,接受主动脉外科或腔内修复手术,影像学进展包括病灶增大、数量增多(IBP组增多>3个)、血肿明显增厚、胸腔积液明显增多。
1.6统计学分析
2 结果
60例患者随访期间,IMH合并出现IBP 11例(18.3%),ULP 11例(18.3%),PAU 4例(6.7%)。42例(70.0%)血肿可见明显吸收或完全吸收。31例(51.7%)预后良好,29例(48.3%)病变进展。29例病变进展的患者中,病变增大18例,主动脉破裂3例,瘤样扩张5例,夹层形成2例,肺栓塞1例;其中11例进行腔内修复及外科手术干预,见表1。
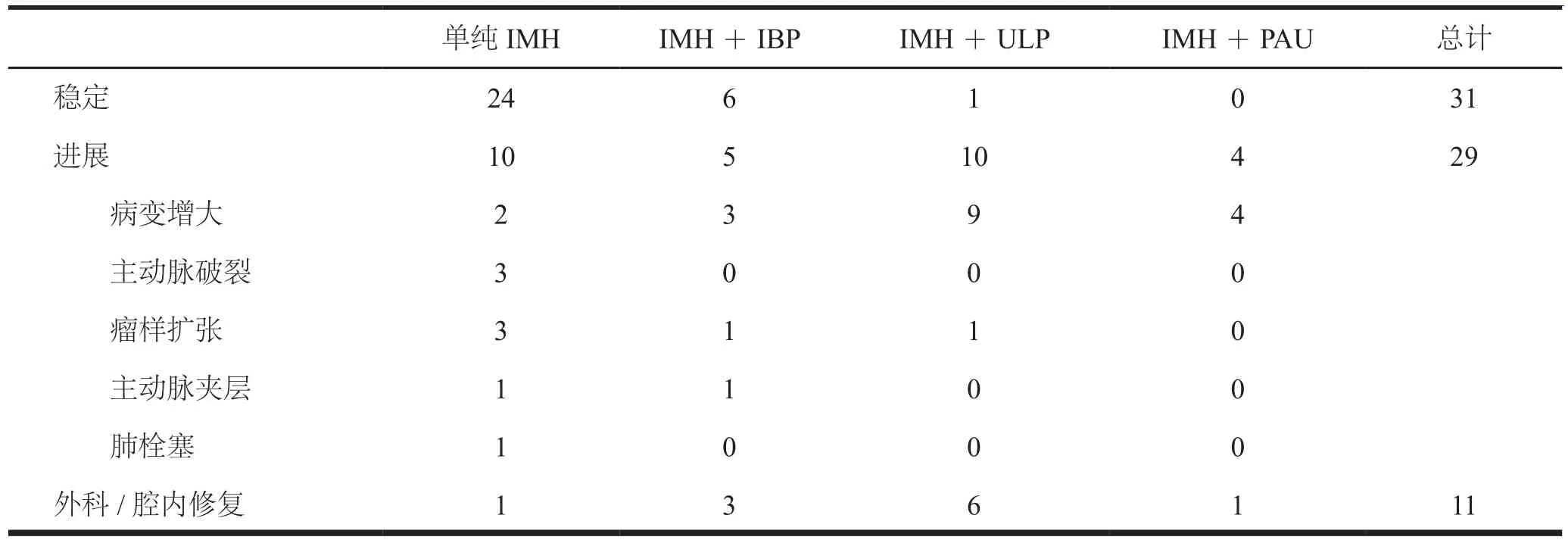
表1 患者临床预后
患者1:因胸背痛急诊入院,CTA显示单纯Stanford B型IMH,保守治疗1个月后大部分血肿吸收,出院2个月后急诊入院,CTA示左肺动脉肺栓塞,于降主动脉植入覆膜支架1枚,随后抗凝治疗,肺动脉栓塞解除,随访至今患者一般情况良好(图1)。
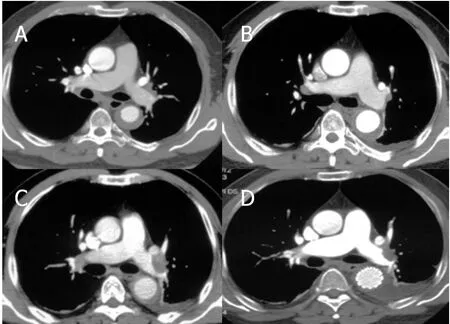
图1 单纯Stanford B型IMH的CTA图像(患者1)
患者2:因胸痛急诊入院,CTA示单纯Stanford A型 IMH,保守治疗5 d后血压控制不稳定,复查主动脉CTA示新发10处IBP,胸腔积液明显增多,于亚急性期行bentall+Sun's手术治疗。术后1个月随访,CTA示术中支架段IBP隔绝完全,但支架远端IBP持续增大,患者拒绝进一步腔内治疗,坚持随访(图2)。
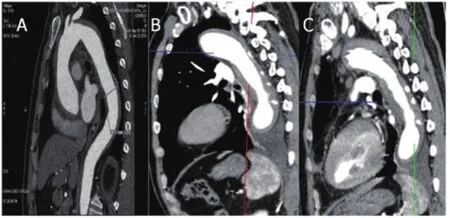
图2 单纯Stanford A型IMH的CTA图像(患者2)
患者3:因突发胸痛入院,急诊CTA示Stanford B型IMH,保守治疗5 d后再发剧烈胸痛,急诊CTA示A型主动脉夹层形成(图3)。
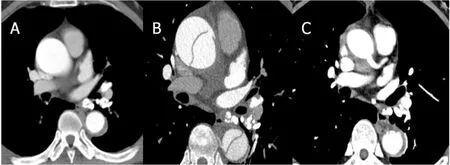
图3 单纯Stanford B型IMH的CTA图像(患者3)
3 讨论
IMH具有潜在的致死性,严重威胁着患者的生命健康,保守治疗期间可以完全吸收,或者进展为主动脉夹层、主动脉瘤样扩张等,影像学检查可以发现血肿内强化血池影。近年来,越来越多的临床试验对壁内血肿的危险因素进行研究,Ganaha[4]与Sueyoshi等[5]的研究提出,PAU与ULP为IMH不良预后的危险因素。Wu等[6]研究提出,IMH合并IBP保守治疗后,血肿大部分可被吸收,提示IBP并非是IMH不良预后的危险因素,应与PAU及ULP进行区别。
本研究对60例急性单纯IMH进行随访观察,随访期间42例(70%)血肿可见明显吸收或完全吸收,与Kaji等[7]的研究相一致。合并出现IBP11例(18.3%),ULP11例(18.3%),PAU4例(6.7%)。对比单纯IMH与IMH +IBP、IMH+ULP及IMH+PAU的临床预后,结果发现,随访中出现ULP及PAU强烈预示不良预后的发生,与Ganaha[4]和Sueyoshi等[5]的结论一致。随访中出现IMH+ IBP,最终进展并不一定是不良预后,应将IBP与ULP及PAU加以区分,与Wu等[6]的结论相一致。单纯IMH的临床预后明显优于IMH合并各种血肿内强化血池病变,但仍可能存在主动脉破裂、主动脉夹层、瘤样扩张等严重并发症,因此严格的影像学随访对患者预后转归至关重要。
IMH的发病机制尚不明确,但如今普遍接受的原因为滋养动脉破裂和内膜斑块破裂。由此可见,IBP的发病机制与PAU及ULP不同,就内膜破损而言,PAU及ULP为由内向外,具有明确且较大的内膜破损,而IBP为由外向内,伴或不伴内膜的破损。与PAU及ULP相比,IBP有较好的预后,可能有以下原因:⑴ IBP病变的深度和宽度小于ULP及PAU;⑵ 与ULP及PAU相比,IBP血池距主动脉腔内较远,中间较多内膜成分;⑶ 更小的内膜破口减少血流沟通。但随访发现,IBP病变仍可见数量明显增多及大小增加,可能提示主动脉壁不稳定,临床应对此提高警惕。
虽然临床尚未有IMH腔内治疗或外科手术干预指征的指南。但随着研究的开展,临床普遍接受ULP与PAU病变宽度>20 mm,深度>10 mm作为需要干预的指征[8]。但尚没有针对IBP大小的影像学指标。随访观察发现,初次出现的IBP大小普遍小于ULP及PAU,但出现数量普遍多于二者。随访发现,IBP大小可以明显增大(图4)。本研究观察,5例(45.5%)IMH合并IBP患者临床预后不良,故需要更多的试验对IBP大小、数量与临床不良预后关系进行研究。

图4 IBP增大者的CTA图像
随访期间,IMH常出现血肿内血池样强化,本研究中26例(43.3%)患者出现IBP、ULP及PAU影像学表现。急诊起病至CTA提示血肿内血池样强化的平均间隔时间为(10±8.5)d,因此发病后第1次随访应在20 d内进行,如出现较大的PAU及ULP应手术干预,若出现IBP及单纯的IMH仍应进行密切随访观察。
[1]Yamada T, Tada S, Harada J. Aortic dissection without intimal rupture: diagnosis with MR imaging and CT[J]. Radiology,1988, 168 (2): 347-352.
[2]Kruse MJ, Johnson PT, Fishman EK, et al. Aortic intramural hematoma: review of high-risk imaging features[J]. J Cardiovasc Comput Tomogr, 2013, 7 (4): 267-272.
[3]Song JK. Aortic intramural hematoma: aspects of pathogenesis 2011[J]. Herz, 2011, 36 (6): 488-497.
[4]Ganaha F, Miller DC, Sugimoto K, et al. Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer: a clinical and radiological analysis[J]. Circulation, 2002, 106 (3): 342-348.
[5]Sueyoshi E, Matsuoka Y, Imada T, et al. New development of an ulcerlike projection in aortic intramural hematoma: CT evaluation[J]. Radiology, 2002, 224 (2): 536-541.
[6]Wu MT, Wang YC, Huang YL, et al. Intramural blood pools accompanying aortic intramural hematoma: CT appearance and natural course[J]. Radiology, 2011, 258 (3): 705-713.
[7]Kaji S, Akasaka T, Katayama M, et al. Long-term prognosis of patients with type B aortic intramural hematoma[J]. Circulation, 2003, 108 (Suppl 1): II307-311.
[8]Gutschow SE, Walker CM, Martínez-Jiménez S, et al. Emerging concepts in intramural hematoma imaging[J]. Radiographics, 2016, 36 (3): 660-674.
Mid-term follow-up study of the prognosis of intramural aortic hematoma
LIU Hao WU Wen-hui PU Jun-zhou HAN Xiao-feng ZENG Qing-long ZHU Jun-ming HUANG Lian-jun*
Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China
Objectives To explore the imaging findings and clinical prognosis of intramural aortic hematoma (IMH). Summary the outcome characteristics of IMH in order to provide references for clinical follow-up and treatment strategy chosen. Methods From June 2014 to June 2015, 60 patients with simple IMH were admitted in Beijing Anzhen Hospital. Conduct regular follow-up to all the patients and analyze the image characteristics and prognosis. The average follow-up time was (10.0±4.6) months. Results During the follow up, 11 cases (18.3%) combined with intramural blood pools. 11 cases(18.3%) with ulcer-like projection and 4 cases (6.7%) with perforating ulcer. 42 cases of hematoma were evidently absorbed or completely absorbed. 31 cases with favorable prognosis, 29 cases with disease progress. Among 29 cases with disease progress, lesions enlarged in 18 cases, aortic rupture happened in 3 cases, aortic aneurysm expansion in 5 cases, dissection in 2 cases, pulmonary embolism in 1 cases; 11 cases underwent endovascular repair and surgical intervention. Conclusions During the follow-up of intramural aortic hematoma, most hematomas were absorption, however, complications may occur in most patients. Therefore, strict imaging follow up is required for IMH patients.
intramural aortic hematoma; complications; rigorous imaging follow up
R543.5
A
10.19418/j.cnki.issn2096-0646.2016.05.12
黄连军,E-mail:huanglianjun2008@163.com

