细胞外调节蛋白激酶信号通路对蛛网膜下腔出血大鼠神经元自噬及早期脑损伤的影响①
刘俊杰,赵雅宁,刘仁杰,丁家杉,陈禹廷,徐继伟,李建民,田景瑞
细胞外调节蛋白激酶信号通路对蛛网膜下腔出血大鼠神经元自噬及早期脑损伤的影响①
刘俊杰1,赵雅宁1,刘仁杰1,丁家杉1,陈禹廷1,徐继伟1,李建民2,田景瑞3
目的探讨细胞外调节蛋白激酶(ERK)信号通路在蛛网膜下腔出血(SAH)后早期脑损伤及海马区神经细胞自噬中的作用。方法成年雄性Sprague-Daw ley大鼠48只,随机数字表法分为假手术组(Sham组)、SAH组、SAH+二甲基亚砜(DMSO)组和SAH+U0126组,每组各12只。采用血管内穿刺法制作SAH模型。造模前30m in,SAH+U0126组经尾静脉注射U0126 0.05mg/ kg,Sham组和SAH组注射等体积生理盐水,SAH+DMSO组注射等体积DMSO,24 h后处死。干湿重法测量脑组织水含量,HE染色观察海马CA1区神经细胞形态结构,免疫组化及Western blotting检测海马区磷酸化ERK(p-ERK)及Beclin-1和LC3-Ⅱ表达水平。结果与Sham组比较,SAH组脑组织含水量增加(P<0.05),大鼠海马CA 1区神经元数量明显减少(P<0.05),p-ERK及Beclin-1和LC3-Ⅱ的表达升高(P<0.05)。与SAH组相比较,SAH+U0126组脑组织含水量升高(P<0.05),海马CA1区神经元数量减少(P<0.05),p-ERK及Beclin-1、LC3-Ⅱ的表达降低(P<0.05);SAH+DMSO组各项无显著性差异(P>0.05)。结论ERK信号通路的激活可能通过对自噬的调控减轻SAH后的早期脑损伤。
蛛网膜下腔出血;早期脑损伤;自噬;细胞外调节蛋白激酶;大鼠
1 材料与方法
1.1实验动物及分组
清洁级雄性Sprague-Daw ley大鼠48只,体质量350~400 g,购于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003。饲养于华北理工大学动物实验中心,自由进食水。适应性喂养2周。
采用随机数字表法将大鼠分为假手术组(Sham组)、蛛网膜下腔出血组(SAH组)、蛛网膜下腔出血+二甲基亚砜组(SAH+DMSO组)和蛛网膜下腔出血+ ERK抑制剂组(SAH+U0126组),每组12只。
1.2试剂与仪器
二甲基亚砜、ERK抑制剂U0126:美国SIGMA公司。磷酸化ERK(p-ERK)抗体:美国CST公司。微管相关轻链蛋白3(LC3)-Ⅱ、BCL-2相关蛋白(Beclin-1):日本MBL公司。内参Tubulin:美国ABCAM公司。二抗及显色用品:美国KPL公司。其他免疫组化及Western blotting辅助用品:武汉博士德生物技术有限公司。
820-Ⅱ型切片机:德国LEICA公司。TP-1型摊片机:天津天利机电公司。大鼠脑立体定向仪:上海奥尔科特生物科技有限公司。Motic-6.0图像采集及分析系统、BHS显微镜:日本OLYMPUS公司。摄影生物光学显微镜:日本NIKON公司。低温离心机:江苏省金坛市医疗仪器厂。酶标仪:北京普天新桥技术有限公司。电泳仪、电转槽、化学发光显色系统:美国BIO-RAD公司。
1.3模型制备及分组干预
参考K lein等文献[8]所述,采用血管内穿刺的方法制作大鼠SAH模型。大鼠术前禁食水6 h,10%水合氯醛4 m l/kg常规麻醉,仰卧位固定大鼠,颈部剃毛,消毒铺巾。沿颈部中线逐层剪开皮肤、皮下组织,显露右颈总动脉分叉处。血管夹阻断颈外动脉,于血管夹近端剪开颈外动脉,插入4-0单股尼龙线进入颈内动脉,从颈总动脉分叉部开始,刺入18~20 mm后感觉阻力存在,继续插入约3mm,刺破大脑中动脉和大脑前动脉分叉处,停留穿刺线15 s后撤出,关闭缝合。
造模成功判定标准:剥离脑部时肉眼可见有血性液体散在分布于脑底基底池部位。
Sham组当穿刺线刺入感到阻力时退出,不刺破大脑前动脉与大脑中动脉分叉,其余操作均与SAH组相同。SAH+U0126组于造模前30m in经尾静脉注射U0126 0.05mg/kg。Sham组和SAH组均注射等体积生理盐水。SAH+DMSO组注射等体积的DMSO,注射体积为0.5m l/只。
1.4脑组织含水量测定
造模成功后24 h,随机选取各组大鼠6只,以10%水合氯醛4m l/kg麻醉,迅速冰上断头取脑,迅速剥离双侧海马组织(留做Western blotting检测),取剩余大脑皮质200mg,精确到1mg的电子天平称湿重后置于105℃恒温干燥箱内干燥48 h至恒重,称干重后按Elliot公式计算脑含水量。

1.5病理组织学检查
每组取剩余6只大鼠,10%水合氯醛4m l/kg麻醉,4%多聚甲醛经左心室灌注固定后取脑,截取视交叉平面至大脑橫裂脑组织,常规石蜡包埋后连续冠状切片,片厚5μm。分别取2张切片做HE染色。光学显微镜(400×)下观察海马CA1区神经元形态变化,每张切片取6个视野,Motic-6.0图像采集及分析系统记录高倍视野下存活与坏死神经细胞数量并计算均值。
1.6p-ERK、Beclin-1和LC3-Ⅱ蛋白免疫组化
每个因子分别取2张切片做免疫组织化学染色。切片常规脱蜡水化,3%过氧化氢去离子水孵育10 min,阻断内源性过氧化氢酶,柠檬酸盐高压热修复90 s,分别滴加兔抗p-ERK抗体(1∶400)、兔抗Beclin-1抗体(1∶200)、兔抗LC3-Ⅱ抗体(1∶300),湿盒中4℃过夜;滴加山羊抗兔二抗(PV60001),37℃孵育30 min,DAB显色,脱水、透明、中性树胶封片。PBS代替一抗阴性对照。镜下观察并摄片,每张切片在海马CA1区随机选取5个视野,运用Image Pro Plus6.0测量平均OD值,对结果进行半定量分析。
1.7Western blotting检测
每组随机选取6个上述检测脑组织水含量分离出的海马组织。RIPA裂解液加入PMSF及磷酸酶抑制剂,裂解匀浆组织,提取蛋白;以BSA为标准品进行蛋白浓度测定。20μl体系SDS-PAGE电泳,湿转法转移至PVDF膜上,10%脱脂牛奶室温抗原封闭1 h。p-ERK一抗(1∶2000)、Beclin-1一抗(1∶1000)、LC3-Ⅱ一抗(1∶1000)孵育4℃过夜。TBST洗膜后,辣根过氧化物酶标记的二抗室温孵育1 h,洗膜后滴加ECL发光液,化学发光显影,以Tublin和β-actin为内参,采用Quantity One软件分别计算出p-ERK/Tublin、Beclin-1/β-actin、LC3-Ⅱ/β-actin相对灰度值。
1.8统计学分析
所有数据均采用Excel建立数据库,SPSS 13.0统计分析软件进行分析。所有计量资料均以(xˉ±s)表示,组间比较采用单因素方差分析,采用SNK法进行组间两两比较。显著性水平α=0.05。
2 结果
造模成功后大鼠精神萎靡,畏光,鼻腔、眼睛分泌物增多,进食进水量明显减少,取材过程中发现基底池、大脑脚有明显的血凝块。实验期间,手术过程中死亡4只大鼠,3只术后24 h之内死亡,另外2只大鼠取材过程中未发现明显的血凝块,共9只大鼠剔除实验,均以备用大鼠补齐。
2.1脑组织含水量
与Sham组比较,SAH组脑组织含水量升高(P<0.05);与SAH组比较,SAH+DMSO组无显著性差异(P<0.05);SAH+U0126组脑组织含水量升高(P<0.05)。见表1。

表1 各组脑组织含水量比较(%)
2.2HE染色
Sham组大鼠海马CA1区神经细胞结构正常,排列整齐,分为3~4层,胞核大而圆,核仁明显。SAH组大鼠海马区出现部分神经元失去正常形态,可见细胞间质水肿,神经元细胞核固缩、核深染,可见大量三角锥形的死亡神经细胞。SAH+U0126组可见大量变性坏死的神经细胞,神经细胞呈空泡状或海绵状,神经元细胞出现核固缩、碎裂和核仁消失现象。SAH+DMSO组细胞形态与SAH组类似。见图1。
与Sham组相比,SAH组各时间点海马CA1区神经元数量减少,死亡细胞数量增加(P<0.05);与SAH组相比,SAH+U0126组神经细胞数量减少,死亡细胞数量增加(P<0.05);SAH组与SAH+DMSO组无显著性差异(P>0.05)。见表2。
2.3p-ERK1/2的表达结果
p-ERK1/2在Sham组中有胞浆胞核弱表达,而在SAH组的胞浆胞核中有强阳性表达,染色呈棕黄色,阳性细胞数量较Sham组增多(P<0.05);SAH+U0126组染色较SAH组浅,阳性细胞数量减少(P<0.05),而SAH+DMSO组与SAH组阳性细胞数量无显著性差异(P>0.05)。见图2、表3。

图1 各组大鼠海马CA1区神经元细胞形态变化(HE染色,400×)

图2 各组大鼠海马CA1区神经元细胞ERK 1/2表达结果(免疫组织化学染色,400×)

表2 各组大鼠海马CA1区神经元数量的比较

表3 各组大鼠海马CA1区ERK 1/2免疫阳性细胞数量比较
Western blotting进一步定性分析显示,与Sham组相比较,SAH组p-ERK1/2的表达明显增高(P<0.05),SAH+U0126组中p-ERK1/2的表达较SAH组有所降低(P<0.05),而SAH+DMSO组与SAH组p-ERK1/2表达量无显著性差异(P>0.05)。见图3、表5。
2.4Beclin-1及LC3-Ⅱ的表达结果
Beclin-1免疫组化染色呈棕黄色,主要表达在神经元细胞包浆中。Sham组偶见免疫阳性细胞,淡染,神经细胞排列整齐,结构正常,核仁明显。与Sham组比较,SAH组细胞出现明显损害,可见大量坏死神经元,染色均增强,免疫阳性细胞数均增加(P<0.05)。与SAH组比较,SAH+U0126组神经细胞损害程度进一步加重,但其染色减弱,免疫阳性细胞数减少(P<0.05)。SAH+DMSO组在染色深浅以及免疫阳性细胞数量方面与SAH组比较无显著性差异(P>0.05)。见图4、表4。

图3 各组大鼠海马区p-ERK 1/2的Western blotting结果
LC3-Ⅱ在Sham组中有胞浆弱表达,而在SAH组的胞浆中有强阳性表达,染色呈棕黄色阳性细胞数量较Sham组增多(P<0.05)。与SAH组比较,SAH+ U0126组神经细胞损害程度进一步加重,但其染色减弱,免疫阳性细胞数减少(P<0.05)。SAH+DMSO组在染色深浅以及免疫阳性细胞数量与SAH组无显著性差异(P>0.05)。见图5、表4。
Western blotting显示,与Sham组相比较,SAH 组Beclin-1、LC3-II的表达增高(P<0.05),SAH+ U0126组表达较SAH组有所降低(P<0.05),而SAH+ DMSO组与SAH组表达无显著性差异(P>0.05)。见图6、表5。

图4 各组大鼠海马CA1区神经元细胞Beclin-1表达结果(免疫组织化学染色,400×)

图5 各组大鼠海马CA1区神经元细胞LC3-Ⅱ表达结果(免疫组织化学染色,400×)

表4 各组大鼠海马CA1区Beclin-1和LC3-Ⅱ免疫阳性细胞数量比较

表5 各组大鼠海马区蛋白Western blotting定量结果(n=6)
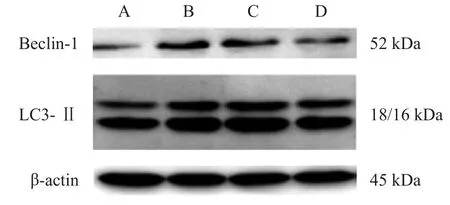
图6 各组海马区Beclin-1和LC3-Ⅱ的Western blotting结果
3 讨论
ERK是AMPK家族中的一类,其信号通路遵循AMPK信号转导通路的三级激酶级联反应,即Ras-Raf-MEK-ERK通路。细胞外刺激因子作用于细胞膜,激活受体酪氨酸酶或者G蛋白偶联受体,逐级活化ERK信号通路,磷酸化的ERK进入细胞核,激活多种转录因子,产生效应蛋白发挥生物学效应[9]。
多种神经系统疾病均证实有ERK信号通路的激活。王耀岐等利用沙土鼠复制前脑缺血再灌注模型,发现海马CA3区p-ERK表达明显增高,而细胞凋亡明显减少,表明脑缺血后可以通过ERK信号通路的激活减少神经细胞的凋亡,从而起到神经保护作用[10]。Wang等应用血管内穿刺的方法制造SAH大鼠模型,模型制造成功后立即给与右旋美托嘧啶,发现ERK磷酸化水平上调,脑水肿程度减轻,血脑屏障的通透性降低;而应用ERK通路抑制剂PD98095后,ERK磷酸化水平下调,神经功能损伤加重。提示ERK信号通路参与SAH后早期脑损伤阶段的神经保护[11]。
本研究中选择p-ERK作为ERK信号通路激活的指标,结果显示,SAH模型大鼠p-ERK明显升高,ERK信号通路激活,脑组织含水量明显增加。而应用ERK信号通路抑制剂U0126处理后p-ERK的表达明显下降,而脑组织含水量较模型组更为增加。提示抑制ERK信号通路可能导致SAH后早起脑损伤更为严重。但ERK是通过何种途径参与的神经保护作用目前尚不明确。有研究显示,在脑缺血再灌注动物模型中,ERK被激活,可明显降低N-甲基-D-天冬氨酸(NMDA)受体活性,并有效抑制了细胞内钙离子的内流,从而起到神经保护作用[12]。也有研究显示,在脑缺血再灌注模型中,ERK通路的激活可以激活神经细胞的自噬,抑制细胞凋亡,减少神经细胞丢失,从而起到神经保护作用。
自噬是细胞一种程序性死亡的方式,可以消化破坏衰老的细胞器,用以降解、回收、重新利用[13]。已有研究证实,脑神经细胞同样存在自噬现象,并且适度的自噬有利于异常大分子及受损细胞器的清除,能够提高神经细胞的存活率;相反过度的自噬则会诱导神经元死亡,对机体产生有害的作用[13-14]。LC3-Ⅱ及Beclin-1是检测自噬必不可少的指标[15]。因此本实验选用LC3-Ⅱ和Beclin-1作为检测自噬水平的指标。相关文献报道,SAH损伤后,24 h自噬的表达达高峰,48 h后恢复,因此本实验选择24 h为时间节点取材,进行蛋白水平的检测。
本实验结果显示,SAH后LC3-II和Beclin-1的水平显著升高,而U0126干预后其水平又明显下降,提示SAH后神经细胞自噬可能是ERK通路依赖性的。SAH后损伤可能是通过ERK信号通路调节自噬参与细胞损伤与修复的调节。Zhao等应用雷帕霉素激活自噬,发现SAH大鼠皮质区LC3-Ⅱ及Beclin-1的表达增多,而皮质区神经元凋亡减少,脑水肿及血-脑屏障的破坏减轻,相反3-甲基腺嘌呤抑制自噬后,加重神经功能的损害[16]。Jing等认为自噬通路激活后抑制凋亡途径,从而产生神经保护作用[17]。
本实验病理学检测及脑组织水含量的检测结果显示,SAH组海马CA1区出现大量死亡的神经细胞,脑组织含水量增加;U0126干预后,海马死亡神经细胞数量较SAH组更为明显,脑组织含水量较SAH更大,提示抑制ERK信号通路可能使SAH后早期脑损伤阶段神经损伤加重,ERK信号通路的激活可能参与神经细胞的保护。多项研究显示p-ERK和Beclin-1表达呈平行关系,如Ni等应用MEK的特异性阻滞剂U0126干预可以降低细胞自噬的活化[18]。自噬是具有两面性的病理生理过程,其在不同的机体环境以及不同的疾病状态可能存在不同的作用,在大量SAH动物实验早期脑损伤阶段都倾向于适度的自噬具有神经保护作用。本实验显示,应用U0126抑制ERK信号通路后自噬水平下调,SAH后的早期脑损伤加重。
本实验没有涉及自噬的激活剂干预。后期我们会引入自噬及上游通路的激活剂进一步探讨自噬在SAH早期脑损伤阶段的作用。
综上所述,本实验结果显示ERK信号通路参与SAH后早期脑损伤阶段自噬水平的调节,其激活后可起到一定的神经保护作用。本实验为SAH后的治疗及药物的开发提供了新思路。
[1]Dodel R,Winter Y,Ringel F,etal.Costof illness in subarachnoid hemorrhage:a German longitudinal study[J].Stroke,2010,41(12):2918-2923.
[2]le Roux AA,Wallace MC.Outcome and cost of aneurysmal subarachnoid hemorrhage[J].Neurosurg Clin N Am,2010,21(2):235-246.
[3]Lauritzen M,Dreier JP,FabriciusM,etal.Clinical relevance of cortical spreading depression in neurological disorders:migraine,malignant stroke,subarachnoid and intracranial hemorrhage,and traumatic brain injury[J].JCereb Blood Flow Metab,2011,31(1):17-35.
[4]Dai Y,Zhang W,Zhou X,et al.Inhibition of c-Jun N-term inal kinase ameliorates early brain injury after subarachnoid hemorrhage through inhibition of a Nur77 dependent apoptosis pathway[J].Neurochem Res,2014,39(8):1603-1611.
[5]Pluta RM,Hansen-Schwartz J,Dreier J,et al.Cerebral vasospasm follow ing subarachnoid hemorrhage:time for a new world of thought[J]. NeurolRes,2009,31(2):151-158.
[6]Lee YJ,ChoiSY,Yang JH.AMP-activated protein kinase is involved in perfluorohexanesulfonate-induced apoptosis of neuronal cells[J].Chemosphere,2016,149:1-7.
[7]Tang J,Hu Q,Chen Y,et al.Neuroprotective role of an N-acetyl serotonin derivative via activation of tropomyosin-related kinase receptor B after subarachnoid hemorrhage in a ratmodel[J].Neurobiol Dis,2015,78:126-133.
[8]K lein JP,Craner MJ,Cumm ins TR,etal.Sodium channel expression in hypothalam ic osmosensitive neurons in experimental diabetes[J].Neuroreport,2002,13(11):1481-1484.
[9]Mebratu Y,TesfaigziY.How ERK1/2 activation controls cell proliferation and cell death:Is subcellular localization the answer?[J].Cell Cycle,2009,8(8):1168-1175.
[10]王耀岐.MAPK家族在异氟烷大鼠心肌预处理延迟相保护中的作用及机制[D].沈阳:中国医科大学,2007.
[11]Wang Y,Han R,Zuo Z.Dexmedetomidine post-treatment inducesneuroprotection via activation of extracellular signal-regulated kinase in rats with subarachnoid haemorrhage[J].Br JAnaesth,2016,116(3):384-392.
[12]杨偲.降钙素基因相关肽在脑缺血再灌注后对神经元细胞死亡和MAPKs通路的作用及机制的研究[D].长春:吉林大学,2013.
[13]Codogno P,Meijer AJ.Autophagy and signaling:their role in cell survival and cell death[J].Cell Death Differ,2005,12(Suppl 2):1509-1518.
[14]Shintani T,K lionsky DJ.Autophagy in health and disease:a double-edged sword[J].Science,2004,306(5698):990-995.
[15]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[16]Zhao H,Ji Z,Tang D,etal.Role of autophagy in early brain injury after subarachnoid hemorrhage in rats[J].Mol Biol Rep,2013,40(2):819-827.
[17]Jing CH,Wang L,Liu PP,et al.Autophagy activation is associated with neuroprotection against apoptosis via am itochondrial pathway in a ratmodel of subarachnoid hemorrhage[J].Neuroscience,2012,213:144-153.
[18]NiBB,LiB,Yang YH,etal.The effectof transforming grow th factor beta1 on the crosstalk between autophagy and apoptosis in the annulus fibrosus cells under serum deprivation[J].Cytokine,2014,70(2):87-96.
Effectof Extracellular Regulated Protein Kinases Signaling Pathway on Early Brain Injury and NeuronsAutophagy in Ratswith Subarachnoid Hemorrhage
LIU Jun-jie1,ZHAO Yɑ-ning1,LIU Ren-jie1,DING Jiɑ-shɑn1,CHEN Yu-ting1,XU Ji-wei1,LI Jiɑn-min2,TIAN Jing-rui3
1.North China University of Scienceand Technology,Tangshan,Hebei063000,China;2.Departmentof Neurosurgery,A ffiliated Hospitalof North China University of Science and Technology,Tangshan,Hebei063000,China;3.HebeiKey Laboratory for Chronic Diseases,Tangshan Key Laboratory for Preclinicaland Basic Research on Chronic Diseases,School of Basic Medical Sciences,North China University of Science and Technology,Tangshan,Hebei063000,China
Correspondence to LIJiɑn-min.E-mail:zyning789@126.com
Objective To explore the effectof extracellular regulated protein kinases(ERK)signaling pathway on early brain injury and autophagy of nerve cell in hippocampus area in ratswith subarachnoid hemorrhage(SAH). Methods Forty-eightadultmale Sprague-Dawley ratswere random ly divided into sham group,SAH group,SAH+dimethylsulfoxide(DMSO)group and SAH+U0126 group,with 12 rats in each group.The SAH modelwas established with puncture of internal carotid artery.The SAH+U0126 group was injected with U0126 0.05mg/kg;the sham group and SAH group were injected with normalsaline,and the SAH+DMSO group was injected with DMSO 30m inutes beforemodeling.They were sacrificed 24 hours aftermodeling.The brain water contentwasmeasured with wetand drymethod.The morphology changes of neural cells in hippocampus CA1 were observed by HE staining.The expression of phosphorylation ERK(p-ERK),Beclin-1 and LC3-Ⅱwere detected with immunohistochemicalmethod and Western blotting.Results Compared with the sham group,the brain water content increased(P<0.05),the number of survivalneurons decreased(P<0.05),the expression of p-ERK,Beclin-1 and LC3-Ⅱincreased in SAH group(P<0.05).Compared with SAH group,the brain water content increased,the number of survivalneurons decreased (P<0.05),the expression of p-ERK,Beclin-1 and LC3-Ⅱdecreased in SAH+U0126 group(P<0.05);and no significant difference was found in SAH+DMSO group(P>0.05).Conclusion The activation of ERK signaling pathwaymay alleviate early brain injury after SAH by regulation of autophagy.
subarachniod hemorrhage;early brain injury;autophagy;extracellular regulated protein kinases;rats
10.3969/j.issn.1006-9771.2016.10.002
R743.3
A
1006-9771(2016)10-1121-06
1.河北省重大医学课题(No.ZD2013093);2.唐山市科技计划项目(No.14130220B);3.河北省大学生创新创业训练计划项目(No. 201610081029)。
1.华北理工大学,河北唐山市063000;2.华北理工大学附属医院神经外科,河北唐山市063000;3.华北理工大学基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,河北唐山市063000。作者简介:刘俊杰(1990-),男,汉族,河北保定市人,硕士研究生,主要研究方向:脑损伤与脑保护。通讯作者:李建民,男,博士,主任医师,主要研究方向:神经损伤与神经保护。E-mail:zyning789@126.com。
[本文著录格式]刘俊杰,赵雅宁,刘仁杰,等.细胞外调节蛋白激酶信号通路对蛛网膜下腔出血大鼠神经元自噬及早期脑损伤的影响[J].中国康复理论与实践,2016,22(10):1121-1126.
CITEDAS:Liu JJ,Zhao YN,Liu RJ,etal.Effectof extracellular regulated protein kinasessignaling pathway on early brain injury and neuronsautophagy in ratswith subarachnoid hemorrhage[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(10):1121-1126.
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是最常见的脑血管疾病之一,主要由动脉瘤破裂,动静脉畸形出血等导致[1]。随着影像技术、显微神经外科技术、介入放射技术的发展,其病死率有所降低,但其发病率及致残率仍较高[2]。目前临床治疗方法主要针对脑血管痉挛及再出血两方面,并没有改善患者的预后。近年来国外研究显示,早期脑损伤(early brain injury)对患者的预后起决定性作用[3],但其发生的机制尚未明确。早期脑损伤是指SAH发病后72 h内,全脑出现的整体性损伤,涉及所有病理、生理过程[4]。国外学者认为其发生机制可能有微循环障碍、炎性改变、神经细胞凋亡与自噬等[5]。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是丝裂原活化蛋白激酶(m itogen-activated preteinkinases,MAPK)家族中的一类[6]。研究表明,ERK的异常激活不仅加重SAH后神经细胞的炎症反应,还可以诱导神经细胞的自噬与凋亡[7]。但其在早期脑损伤阶段激活的意义尚不明确。
本研究通过建立SAH大鼠模型,探讨ERK信号通路对SAH后神经细胞自噬的调控作用及其意义,以探寻SAH后早期脑损伤的可能机制和治疗SAH的新策略。
(2016-06-13
2016-07-19)

