基于智能手机的纸微流控电化学农药检测芯片的研究
杨文韬 张琳 刘宏 顾忠泽

摘 要 纸质微流控装置的出现为低成本化学分析提供了一种简单而实用的平台。本研究开发了一种基于浓差电池原理的新型电化学检测纸质芯片,通过智能手机的辅助实现了农药的检测。检测芯片由色谱纸喷蜡打印制作而成。加入样品与芯片上的预加试剂反应5 min,然后将丝网印刷的电极层置于芯片上,利用模具的重力作用使电极层与纸芯片的两极紧密接触,再通过智能手机的USB读取装置获取芯片的电位,并由电位农药浓度关系得到检测结果。使用此芯片实现了农药敌百虫(三氯磷酸酯)的快速、简便、可自供电的电化学定量检测,检出限为0.89 μmol/L。
关键词 智能手机; 浓差电池; 纸微流控芯片; 乙酰胆碱酯酶; 农药检测
1 引 言
作为一种新型检测手段,基于智能手机的现场快速检测技术近年来引起了广泛关注。2008年,Martinez等以智能手机作为检测平台,通过手机检测色彩强度,并以彩信(MMS)或电子邮件的方式将图片上传,进行深度比色检测分析[1]。目前,已有越来越多的检测技术与智能手机结合,实现了定量检测,如通过手机摄像头检测沙门氏菌的核酸[2]和酶标记物[3], 通过拍摄荧光和明场照片来进行血细胞计数[4]。电化学阻抗谱法也应用到了基于智能手机的检测中,检测信号可通过蓝牙的方式传输至智能手机[5]。上述方法大都使用手机的照相功能,图像的标准化处理成为检测的难点[6]。相比较而言,电化学检测同时具有成本低、灵敏度高、可定量检测等优点。但是,电化学检测需要特定的电极[7]、稳定的电源和专业的检测仪器,限制了它在快速现场检测的应用[8~12]。
为解决上述问题,本研究提出了一种基于浓差电池原理的电化学检测技术,并结合纸基微流控芯片实现了有机磷农药敌百虫(三氯磷酸酯)的快速定量检测。此检测方案与现有的检测手段相比具有明显的优势。首先,此芯片不需要传统电化学检测所需的Ag/AgCl参比电极,仅需要丝网印刷的石墨电极,简化了电极制作过程,降低了成本;其次,与之前所报导过的电流法检测技术[13]不同,本研究采用电位法检测,检测设备得以简化,只需要一个手机USB的电位读取装置,即可进行定量检测;第三,此方法耗能较少,由手机USB直接供电,无需外部稳压电源;此外,此芯片采用3D打印模具,解决了纸芯片和电极之间的接触稳定性问题,提高了检测结果的重复性。
2 实验部分
2.1 仪器与试剂
8570N喷蜡打印机(美国Fuji Xerox公司);Form1光固化型3D打印机(美国Formlabs公司)。基于智能手机USB接口的电位检测器为本实验室自制。1级色谱纸(英国Whatman公司);导电银胶(美国Alfa Aesar公司);PP2910透明胶片(美国3M公司)。
K3Fe(CN)6、K2Fe(CN)6、氯化硫代乙酰胆碱(ATCh)、乙酰胆碱酯酶(AChE,来自电鳗)、三氯磷酸酯(敌百虫)、磷酸盐缓冲盐(pH 7.4)均购于SigmaAldrich公司,未经纯化直接使用;实验用水为二次蒸馏水。
2.2 微流控芯片的总体设计
芯片包含两个部分。第一部分是表面喷蜡打印了图案的色谱纸。从进样口分出两个逐渐分离的通道形成浓差电池的两极,其末端通过一条很窄的通道相连,起到盐桥作用。第二部分是3D打印的外壳,可拆分成两部,如图1所示。底端部分有凹槽结构和支架以固定和支撑纸张,上端部分类似印章的用途,通过重力作用使电极紧贴浓差电池的两极,可获取电压信号。
图1 使用智能手机实现农药检测的过程示意图(a)试剂预加载在喷蜡打印过的纸芯片上,
(b)芯片放置在3D打印的外壳中由进样口滴加样品,(c)合上装置的盖子,开始检测。(d)芯片与检测系统实物图
2.3 3D打印外壳
使用软件SolidWorks设计外壳,将零件文件转变为STL格式,由3D打印机使用光固化树脂材料打印出外壳。打印完成后,再将其浸入异丙醇中,直至完全凝固。为了使外壳更加坚固,可以在紫外光下照射10 s。
2.4 纸芯片和电极层的制作
使用软件CorelDraw 12设计纸芯片的图案,将疏水的部分用100%黑色表示,吸水通道用白色表示。使用富士施乐喷蜡打印机在色谱纸上打印出该图案。完成打印后,将色谱纸放置在125℃的热台上加热1 min,使表面蜡层渗透到纸内。
参照文献[14]的方法,在透明胶片上制作丝网印刷石墨电极,室温下干燥,在电极末端通过导电银胶连接两根铜导线,以连接电压检测装置,导线和石墨电极的导电银胶连接处用丙烯酸AB胶进行固定。
2.5 试剂配比
配制100 mmol/L K3Fe(CN)6与40 mmol/L氯化硫代乙酰胆碱的混合溶液以及52 U/mL乙酰胆碱酯酶溶液。如图1a所示,在通道两侧分别滴加0.30 μL混合试剂,在其中一侧滴加0.30 μL 乙酰胆碱酯酶溶液,然后在室温下充分干燥,待用。
2.6 基于智能手机的检测
检测时,首先将芯片放置在3D打印的支架外壳上,由进样口添加待测样品进行反应。5 min后,将电极层置于芯片上方,石墨电极末端对准芯片上电池的两极,然后盖上打印的“印章”模具,通过重力使电极层与纸上浓差电池的两极相接触以获取电压信号(图1b)。信号通过铜导线传输至检测装置,检测装置内部包括差分放大器、滤波器、AD转换、USB控制传输等几个重要模块,可以采样输入端的电压信号转化为数据并以USB方式传输至智能手机。手机上安装了配套的检测软件,以接收和处理检测装置的数据,并将结果显示在屏幕上(图1c)[15]。
3 结果与讨论
3.1 检测原理
样品由进样口加入后,分别进入两边的反应通道,仅在一条通道中预加了乙酰胆碱酯酶。乙酰胆碱酯酶可催化氯化硫代乙酰胆碱的水解反应,三氯磷酸酯农药可以抑制其催化活性。而氯化硫代乙酰胆碱的水解产物硫代胆碱(Thiocholine)具有还原性,可以将溶液中[Fe(CN)6]3
Symbolm@@ 还原为[Fe(CN)6]4
Symbolm@@ 。反应一段时间后,两条通道内有不同浓度的[Fe(CN)6]3
Symbolm@@ 和[ Fe(CN)6]4
Symbolm@@ 离子,并由“盐桥”连接,形成浓差电池。该电池的电压与[Fe(CN)6]3
Symbolm@@ 和[ Fe(CN)6]4
Symbolm@@ 离子的浓度比相关,因此与乙酰胆碱酯酶的活性以及样品中农药浓度相关。
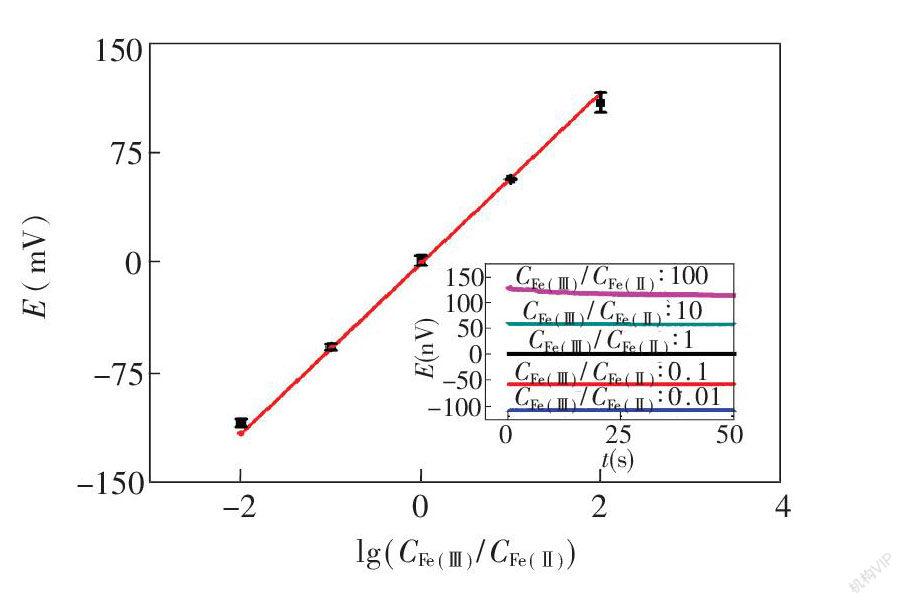
图2 在K3[Fe(CN)6]与K4[Fe(CN)6]不同的浓度比例时芯片的电极电位(E)。电解质溶液为0.01 mmol/L磷酸盐缓冲液(pH 7.4),含有不同浓度比例的K3[Fe(CN)6]与K4[Fe(CN)6]。图中直线为能斯特公式计算出的电极电位与浓度比例的关系。插图为不同检测过程中电压(E)随时间(t)变化的关系曲线。
Fig.2 Influence of concentration ratio of[ Fe(CN)6]3
Symbolm@@ to[ Fe(CN)6]4
Symbolm@@ on electrode potential. Electrolyte solution is 0.01 mol/L phosphate buffered saline (pH 7.4) containing[ Fe(CN)6]3
Symbolm@@ and[ Fe(CN)6]4
Symbolm@@ at different concentration ratio. The straight line represents potential calculated using Nernst equation as a function of concentration ratio. Inset: potential as a function of time measured in different electrolyte solutions.
3.2 实验条件的优化
浓差电池的电位取决于氧化还原电对的浓度差,在已知氧化还原电对的浓度前提下可以通过能斯特公式计算出电极电位。首先在芯片上的一条通道中预加入0.30 μL含有100 mmol/L K3Fe(CN)6和100 mmol/L K4Fe(CN)6的磷酸盐缓冲液(0.010 mmol/L,pH 7.4)溶液;在另一侧同样加入该混合溶液,K3Fe(CN)6和K4Fe(CN)6的浓度分为5组:1和100 mmol/L,10和100 mmol/L,100和100 mmol/L,100和10 mmol/L,100和1 mmol/L,即两者的浓度比值为0.01, 0.1, 1, 10, 100。试剂避光充分干燥后,加入磷酸盐缓冲液,使用智能手机检测纸芯片的电极电位。如图2所示,实验结果与能斯特方程的计算结果基本相符。
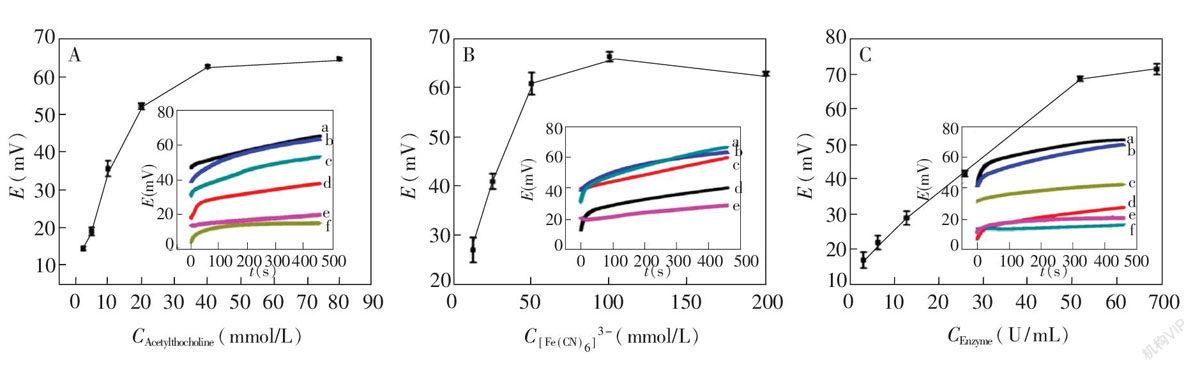
对影响实验结果的3个主要参数,即底物(氯化乙酰硫代胆碱)、电活性物质(K3Fe(CN)6)和酶(乙酰胆碱酯酶)的浓度进行了优化。当电活性物质和酶的浓度足够高时,酶的催化反应受到底物浓度的影响[16]。如图3A所示,维持电活性物质浓度为200 mmol/L,酶的浓度为52 U/mL时,测定电位随着底物浓度的增加而增大,在底物浓度为40 mmol/L时达到最大值64 mV。因此,后续实验中底物浓度确定为40 mmol/L。
如图3B所示,K3[Fe(CN)6]对电位的影响趋势与底物浓度相似,但是电极电位对K3Fe(CN)6浓度的变化更加敏感。此外,当K3[Fe(CN)6]的浓度超过100 mmol/L时,电极电位开始下降。因此,后续实验中K3[Fe(CN)6]浓度选择为100 mmol/L。
确定了最适的底物浓度和电活性物质浓度后,考察了乙酰胆碱酯酶浓度对电压的影响。如图3C所示,初期的电极电位随着酶浓度的增加而增大,在52 U/mL时电位达到最大值68 mV;酶浓度继续升高,电位略降。后续实验中酶浓度选择为52 U/mL。
图3 (A)底物浓度对检测电位的影响。200 mmol/L K3Fe(CN)6,52 U/mL乙酰胆碱酯酶以及不同浓度的氯化乙酰硫代胆碱(a, 80; b, 40; c, 20; d, 10; e, 5; f, 2.5 mmol/L); (B)电活性物质浓度对检测电位的影响。40 mmol/L氯化乙酰硫代胆碱,52 U/mL乙酰胆碱酯酶以及不同浓度的K3Fe(CN)6 (a, 100; b, 200; c, 50; d, 25; e, 12.5 mmol/L) ; (C)酶浓度对检测电位的影响。200 mmol/L K3Fe(CN)6, 40 mmol/L氯化乙酰硫代胆碱以及不同浓度的乙酰胆碱酯酶(a, 69; b, 52; c, 26; d, 13; e, 6.5; f, 3.2 U/mL)。插图为检测过程中电压随时间变化的曲线, 电解质溶液为0.01 mol/L的磷酸缓冲盐(pH 7.4)。
3.3 对农药的检测性能
使用乙酰胆碱酯酶等检测农药含量的方法已有文献报道[17,18],其基本原理是乙酰胆碱酯酶可催化水解硫代乙酰胆碱生成具有电活性的硫代胆碱,而有机磷农药抑制乙酰胆碱酯酶的活性,使生成的硫代胆碱量减少,通过恒电位仪检测硫代胆碱,进而实现对农药的检测;或利用光学检测法,检测酶催化产物对紫外可见光的吸收,实现农药的检测。与文献方法不同,本研究提出了基于智能手机和电化学纸芯片定量检测农药三氯磷酸酯的方法,如图4所示。采用本法测定三氯磷酸酯农药,测得的电极电位与三氯磷酸酯农药浓度的对数呈线性关系,相关系数R=0.98,线性检测范围为1.6~400.0 μmol/L,检出限为0.89 μmol/L(S/N=3)。本方法具有简单、快速、成本低的特点。
电化学体系中参比电极多为Ag /AgCl电极,不利于现场快速检测[19]。为了解决这一问题,本研究构建了基于浓差电池的检测体系,所使用的丝网印刷石墨电极无需额外的处理即可满足使用要求。本传感器工作时采用智能手机供电,无需额外的外部电源,适合现场快速检测。与常见的分层结构的纸质微流控芯片不同, 本方法中芯片固定在3D打印外壳结构中,确保溶液在纸上的流动免受其它层的影响,而在检测电极电位时,利用3D打印印章的重力使电极与芯片接触,保证了检测结果的重现性。本方法中的丝网印刷电极可以重复使用[20]。此外,芯片装置制造过程不需要热处理,因而避免了试剂失活等问题。
4 结 论
基于浓差电池原理的电位检测法,采用3D打印的外壳装置,通过智能手机辅助实现了对三氯磷酸酯农药的快速定量检测,检出限达到0.89 μmol/L。装置制备过程简单且成本低廉,有望应用于现场快速检测,以满足资源有限的偏远地区的检测需求,具有良好的应用前景。
References
1 Martinez A W, Phillips S T, Carrilho E, Thomas S W, III, Sindi H, Whitesides G M. Anal. Chem., 2008, 80(10): 3699-3707
2 Fronczek C F, Park T S, Harshman D K, Nicolini A M, Yoon J Y. Rsc Adv., 2014, 4(22): 11103-11110
3 Thom N K, Lewis G G, Yeung K, Phillips S T. RSC Adv., 2014, 4(3): 1334-1340
4 Zhu H, Sencan I, Wong J, Dimitrov S, Tseng D, Nagashima K, Ozcan A. Lab Chip, 2013, 13(7): 1282-1288
5 Jiang J, Wang X, Chao R, Ren Y, Hu C, Xu Z, Liu G L. Sens. Actuator B, 2014, 193: 653-659
6 Park T S, Li W, McCracken K E, Yoon J Y. Lab Chip, 2013, 13(24): 4832-4840
7 Novell M, Guinovart T, Blondeau P, Xavier Rius F, Andrade F J. Lab Chip, 2014, 14(7): 1308-1314
8 Govindarajan A V, Ramachandran S, Vigil G D, Yager P, Boehringer K F. Lab Chip, 2012, 12(1): 174-181
9 Houghtaling J, Liang T, Thiessen G, Fu E. Anal. Chem., 2013, 85(23): 11201-11204
10 Martinez A W, Phillips S T, Whitesides G M, Carrilho E. Anal. Chem., 2010, 82(1): 3-10
11 Renault C, Anderson M J, Crooks R M. J. Am. Chem. Soc., 2014, 136(12): 4616-4623
12 Yetisen A K, Akram M S, Lowe C R. Lab Chip, 2013, 13(12): 2210-2251
13 Liu H, Xiang Y, Lu Y, Crooks R M. Angew. Chem. Int. Ed., 2012, 51(28): 6925-6928
14 Nie Z, Deiss F, Liu X, Akbulut O, Whitesides G M. Lab Chip, 2010, 10(22): 3163-3169
15 Zhang L, Yang W, Yang Y, Liu H, Gu Z. Analyst, 2015, 140(21): 7399-7406
16 Miao Y, Tan S N. Anal. Chim. Acta, 2001, 437(1): 87-93
17 Ge X, Tao Y, Zhang A, Lin Y, Du D. Anal. Chem., 2013, 85(20): 9686-9691
18 Duford D A, Xi Y, Salin E D. Anal. Chem., 2013, 85(16): 7834-7841
19 Novell M, Parrilla M, Crespo G A, Xavier Rius F, Andrade F J. Anal. Chem., 2012, 84(11): 4695-4702
20 Erkal J L, Selimovic A, Gross B C, Lockwood S Y, Walton E L, McNamara S, Martin R S, Spence D M. Lab Chip, 2014, 14(12): 2023-2032
Smartphonebased Paper Microfluidic Device for
Potentiometric Detection of Pesticide
YANG WenTao, ZHANG Lin, LIU Hong*, GU ZhongZe
(State Key Laboratory of Bioelectronics, School of Biological Science and Medical Engineering,
Southeast University, Nanjing 210096, China)
Abstract The paperbased microfluidic devices have emerged as simple yet powerful platforms for performing lowcost analytical tests. A novel paperbased microfluidic chip for potentiometric detection using the principle of concentration cell was developed and examined for smartphonebased pesticide detection. Paperbased device was fabricated via wax printing and preloaded with reagents. After sample introduction and reaction for 5 minutes, screenprinted electrodes were attached and assembled into a 3Dprinted holder for the potentiometric measurement using the smartphonebased reader. For the proofofconcept, a pesticide (trichlorfon) was quantitatively detected with a limit of detection of 0.89 μmol/L.
Keywords Smartphone; Concentration cell; Paperbased microfluidic chip; Acetylcholinesterase; Pesticide detection
(Received 27 February 2016; accepted 3 March 2016)
This work was supported by the National Natural Science Foundation of China (No. 21405014) and the Natural Science Foundation of Jiangsu Province, China (No. BK20140619)

