肾康注射液调控ERK1/2/MMPs信号通路促进肾衰竭模型鼠细胞外基质降解的作用和机制
杨晶晶+毛志敏+万毅刚+吴薇+黄燕如+石格+韩文贝+姚建
[摘要]探讨肾康注射液(Shenkang injection,SKI)在体内调控细胞外信号调节激酶(extracellular-signal regulated protein kinase,ERK)1/2/基质金属蛋白酶(matrix metalloproteinases,MMPs)信号通路而改善肾衰竭模型鼠细胞外基质(extracellular matrix,ECM)降解的作用和机制。将20只大鼠随机分为假手术组、模型组、SKI组、马来酸依那普利(enalapril maleate,EM)组。采用腺嘌呤灌胃联合单侧输尿管结扎术(unilateral ureteral obstruction,UUO)建立肾衰竭模型。造模后,SKI组和EM组大鼠分别经腹腔注射或灌胃给予SKI或EM悬浊液,其余2组大鼠经灌胃给予蒸馏水,共3周;其间,检测各组大鼠24 h尿蛋白排泄量(urinary protein excretion,Upro)和尿N-乙酰-β-D-氨基葡萄糖苷酶(urinaryN-acety1-β-D-glucosaminidase,UNAG);给药3周后,处死全部大鼠,抽取血液,摘除双肾,观察肾组织形态特征,检测血清生化指标和肾组织IV型胶原(collagen type IV,CIV),MMP-2,MMP-9,金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinase,TIMP)-1,ERK1/2以及磷酸化ERK1/2(phosphorylated-ERK1/2,p-ERK1/2)蛋白表达量。结果表明,经SKI干预后,模型鼠血清肌酐(serum creatinine,Scr),血清尿素氮(blood urea nitrogen,BUN),尿酸(uric acid,UA),白蛋白(albumin,Alb),Upro,UNAG以及肾脏组织形态均得到不同程度的改善,这些作用与EM相仿;SKI还可以调节模型鼠肾组织MMP-2,MMP-9,TIMP-1蛋白表达,下调p-ERK1/2蛋白表达,这些作用不同于EM。总之,SKI在体内可能是通过调控肾组织ERK1/2信号通路活性,干预MMPs/TIMP-1表达,促进ECM降解,延缓肾衰竭进展。
[关键词]肾康注射液; 肾衰竭; 细胞外基质; 基质金属蛋白酶; 细胞外信号调节激酶1/2信号通路
[Abstract]This study aimed to clarify preliminarily the effects and mechanisms of Shenkang injection(SKI)promoting extracellular matrix(ECM)degradation via regulating extracellular-signal regulated protein kinase(ERK)1/2/matrix metalloproteinases(MMPs)signaling pathway in renal failure rats. Twenty rats were randomly divided into 4 groups:the Sham group,the Model group,the SKI group and the Enalapril maleate(EM)group. The model rats with renal failure were induced by intragastric administration of adenine and unilateral ureteral obstruction(UUO). After modeling, the rats in SKI group and EM group were intervened by intraperitoneal injection of SKI or intragastric administration of the EM suspension,while the rats in Sham group and Model group were administrated with distilled water respectively for 3 weeks. The 24 h urinary protein excretion(Upro)and urinaryN-acety1-β-D-glucosaminidase(UNAG)in all rats were tested after drug administration. All rats were sacrificed after drug administration for 3 weeks,blood and kidney were collected,renal morphological characteristics were observed. Furthermore,serum biochemical indices and the protein expressions of collagen type IV(CIV),MMP-2,MMP-9,tissue inhibitors of metalloproteinase(TIMP)-1,ERK1/2 and phosphorylated-ERK1/2(p-ERK1/2)in the kidney were evaluated respectively. The results indicated that,after the intervention of SKI,serum creatinine(Scr),blood urea nitrogen(BUN),uric acid(UA),albumin(Alb),Upro,UNAG and renal morphological change in model rats were improved at different levels,respectively. Moreover,these actions were similar to EM. In addition to these,SKI adjusted the protein expressions of MMP-2,MMP-9 and TIMP-1,and down-regulated the protein expressions of p-ERK1/2 in the kidney. Moreover,these actions were different from EM. In conclusion,SKI promotes ECM degradation and delays the progression of renal failure possibly through regulating ERK1/2 signaling pathway activation in the kidney and intervening MMPs/TIMP-1 expressions in vivo.
[Key words]Shenkang injection; renal failure; extracellular matrix; matrix metalloproteinases; regulating extracellular-signal regulated protein kinase1/2/matrix metalloproteinases signaling pathway
doi:10.4268/cjcmm20162016
研究表明,肾衰竭(renal failure,RF)的进展速度与肾间质纤维化(renal interstitial fibrosis,RIF)程度密切相关[1-2]。RIF的病理特征主要表现为“肾小管萎缩、肾间质炎症细胞浸润、成纤维细胞分化、增生以及细胞外基质(extracellular matrix,ECM)主要成分(胶原)在肾间质的大量沉积”[3],其中,胶原沉积是ECM生成和降解失衡的直接后果,因此,促进ECM降解,就可以减轻胶原沉积,改善RIF,延缓肾衰竭进展。ECM降解主要依赖于机体内降解酶系统的调控,其中,基质金属蛋白酶(matrix metalloproteinases,MMPs)发挥着核心作用。MMPs属于锌离子依赖的内肽酶大家族,几乎能选择性分解所有ECM成分,其中,MMP-2主要降解I和IV型胶原,MMP-9主要降解IV型胶原[4]。MMPs的活性和表达水平受控于金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases,TIMPs)[5],并且,与其上游的转化生长因子(transforming growth factor,TGF)-β1/Smads以及细胞外信号调节激酶(extracellular-signal regulated protein kinase,ERK)1/2等信号通路的活性密切相关[6-7]。因此,调控MMPs相关信号通路活性,干预MMPs/TIMPs表达等措施可以成为临床上促进ECM降解的有效手段。
肾康注射液(Shenkang injection,SKI)是慢性肾脏病(chronic kidney disease,CKD)治疗领域中“补肾活血法”的代表性中药复方静脉制剂,它由“黄芪、丹参、红花、大黄”等中药组成,具有“益气(肾)活血,通腑利湿,降逆泄浊”的功效[8]。国内的临床和药理研究表明,SKI可以改善慢性肾衰竭(chronic renal failure,CRF)患者和动物模型的肾功能,其机制与调控TGF-β1/Smad3信号通路而抑制肾脏纤维化和氧化应激损伤有关[9-11]。笔者团队的前期研究表明,对于腺嘌呤灌胃联合单侧输尿管结扎术(unilateral ureteral obstruction,UUO)而建立的肾衰竭大鼠模型,其肾功能减退、RIF病变不仅非常明显,而且,肾组织中MMP-2和MMP-9蛋白表达水平降低,TIMP-1和磷酸化ERK1/2(phosphorylated-ERK1/2,p-ERK1/2)蛋白表达水平增高;经典的血管紧张素转换酶抑制剂——依那普利不仅可以改善肾功能,减轻模型鼠RIF,还能够调节肾组织MMP-2,MMP-9,TIMP-1以及p-ERK1/2蛋白表达水平[12-13]。基于此,笔者进一步推测,SKI延缓肾衰竭进展,促进ECM降解的作用还可能与其调控肾组织ERK1/2信号通路活性,干预MMPs/TIMP-1表达有关。
1 材料
1.1 动物
20只8周龄左右的雄性Sprague Dawley大鼠(SPF)购自南京军区总院动物中心(批号SLXK2011-02),饲养于南京大学医学院附属鼓楼医院(简称鼓楼医院)动物实验中心,所有大鼠均喂予标准饲料,并自由饮水,大鼠购回后适应性饲养1周。
1.2 药物和试剂
腺嘌呤(adenine)购自Sigma公司,将1 g腺嘌呤溶解于50 mL牛奶中,配制成20 g·L-1的腺嘌呤悬浊液;肾康注射液(含生药0.3 g·mL-1)购自西安世纪盛康药业有限公司(批准文号Z20040110);马来酸依那普利(enalapril maleate,EM)购于扬子江药业集团江苏制药股份有限公司(批准文号H32026568),将20 mg EM溶解于50 mL蒸馏水中,配置成0.4 g·L-1的EM悬浊液。全蛋白提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、蛋白相对分子质量Marker购自凯基公司;5×蛋白上样缓冲液购自碧云天公司;脱脂奶粉购自伊利公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、辣根过氧化物酶(horseradish peroxidase,HRP)显色液购自Millipore公司;小鼠抗大鼠IV型胶原(collagen type IV,CIV)单克隆抗体、小鼠抗大鼠MMP-2单克隆抗体、兔抗大鼠MMP-9单克隆抗体、兔抗大鼠TIMP-1单克隆抗体购自Abcam公司;兔抗大鼠ERK1/2和p-ERK1/2多克隆抗体、小鼠抗大鼠甘油醛磷酸脱氢酶(glyceraldehyde-3-phosphate dihydrogenase,GAPDH)单克隆抗体以及HRP标记的山羊抗兔IgG和山羊抗小鼠IgG抗体购自Bioworld公司。
2 方法
2.1 模型制作方法
采用腺嘌呤灌胃联合UUO的方法建立大鼠肾衰竭模型。在实验开始的第1~14天进行腺嘌呤(150 mg·kg-1)灌胃;第15天,行左侧输尿管结扎手术。腹腔注射氯胺酮和地西泮等体积混合液(3 mg·kg-1),麻醉后,将大鼠固定于手术板上,取仰卧位,常规消毒,左腹部切口1~1.5 cm,逐层切开皮肤、肌肉,暴露左肾,钝性分离肾周脂肪,沿肾门部位寻找输尿管,在输尿管上、下段结扎,并于中间处剪断;分层缝合切口,予每只大鼠青霉素钠(20万U)腹腔注射,连续3 d。假手术组大鼠在实验开始的第1~14天进行蒸馏水灌胃。第15天,手术时仅暴露左侧输尿管,缝合切口。
2.2 分组、给药方法
将20只大鼠按随机数字表分为4组:假手术组(蒸馏水灌胃)、模型组(蒸馏水灌胃)、SKI组(SKI腹腔注射)、EM组(EM悬浊液灌胃)各5只。体重60 kg患者的SKI临床治疗量为每天100 mL(相当于生药30 g),按动物标准换算公式,大鼠的有效量相当于每天5 g·kg-1。EM的临床治疗量为每天20 mg,按动物标准换算公式,大鼠的有效量相当于每天0.02 g·kg-1。SKI组大鼠及EM组于术后第2天开始药物干预,假手术组和模型组大鼠同时给予蒸馏水2 mL灌胃,每日1次,连续3周。各组大鼠自给药开始计时,第3周末,经腹腔注射氯胺酮麻醉,心脏穿刺处死,采集血液样本和肾组织而进行各项指标的检测。
2.3 观察指标及检测方法
2.3.1 尿生化指标 药物干预后第3周末,分别将各组大鼠放入金属代谢笼,禁食,自由饮水,收集24 h尿液,倍比稀释后,采用考马斯亮蓝法测定24 h尿蛋白排泄量(urinary protein excretion,Upro)。另外,采用比色法检测尿N-乙酰-β-D-氨基葡萄糖苷酶(urinaryN-acety1-β-D-glucosaminidase,UNAG)。在37 ℃环境和适当的pH条件下,UNAG水解2-氯-4-硝基苯基-N-乙酰-β-D-氨基葡萄糖苷(2-chloro-4-nitrophenyl-N-acety1-β-D-glucosaminidase,CNP-NAG)的糖苷键和2-氯-4-硝基苯基-β-D-半乳糖苷(2-chloro-4-nitrophenyl-β-D-galactosidase,CNP-GAL)的糖苷键,游离出2-氯-4-硝基苯基(2-chloro-4-nitrophenyl,CNP)。在400~415 nm波长下,观察释放出的CNP所引起的吸光度变化。将1 L尿液中NAG在每分钟内水解CNP-NAG所产生1 μmol的CNP作为1个酶单位活力,简称为U·L-1。
2.3.2 血清生化指标 药物干预3周后,在氯胺酮麻醉状态下解剖大鼠胸腔,经心脏采血。采用全自动生化分析仪检测大鼠血清生化指标,包括血清肌酐(serum creatinine,Scr)、血清尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)和白蛋白(albumin,Alb)等。
2.3.3 肾脏组织形态特征 解剖大鼠腹腔,自肾门处摘取两侧肾脏,肾脏摘除后,分离皮髓质,并取少量肾皮质(肾脏的上极或下极)固定于10%中性甲醛内,经脱水16 h后,石蜡包埋,切片3 μm,进行过碘酸雪夫(periodic acid schiff,PAS)染色和Masson染色;借助光学显微镜(光镜),观察肾间质ECM及胶原沉积程度;每张切片随机选取20个肾小球,采用病理图像分析系统Image-pro plus(IPP)计算肾间质ECM和胶原相对面积(ECM 或胶原面积/肾间质面积)。
2.3.4 肾组织CIV,MMP-2,MMP-9,TIMP-1,ERK1/2,p-ERK1/2蛋白表达 采用Western blot检测肾组织CIV,MMP-2,MMP-9,TIMP-1,ERK1/2,p-ERK1/2蛋白表达水平。从-80 ℃冰箱中取出100 mg肾组织,用剪刀剪碎;用PBS冲洗肾组织,放入4 ℃离心机,3 000 r·min-1离心5 min,反复冲洗,再离心,共3次;弃去PBS冲洗液,向肾组织中加入含蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的总蛋白裂解液,用电动匀浆机匀浆,在冰上放置30 min,每隔3 min震荡1次,最后,再次放入4 ℃离心机,12 000 r·min-1离心30 min,取上清液(即总蛋白),少量用于BCA法测定蛋白浓度,其余按4∶1与蛋白上样缓冲液混匀,在沸水中煮10 min进行蛋白变性,于-80 ℃冰箱保存备用。提取总蛋白后,配制分离胶和浓缩胶,分别加样,在电泳槽中加满电泳缓冲液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,PAGE-SDS)。电泳完毕,取下凝胶,根据目的蛋白的位置留取相应凝胶,并将凝胶上的蛋白电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用含10%脱脂奶粉的Tris buffered saline tween(TBST)缓冲液[20 mmol·L-1 Tris HCl,150 mmol·L-1 NaCl,0.05%聚环氧乙烷山梨糖醇单月桂酸酯(tween 20)]封闭2 h。分别向PVDF膜中加入相应的一抗(CIV,MMP-2,MMP-9,TIMP-1,ERK1/2,p-ERK1/2,GAPDH),室温孵育4 h,用TBST缓冲液洗涤约1 h。分别加入二抗(HRP标记的山羊抗兔IgG抗体),室温孵育2 h,再次用TBST缓冲液洗涤约1 h。取出PVDF膜,将HRP显色液均匀地涂在PVDF膜上,在暗室曝光,定影。用Quantity one 4.1.1软件进行光密度分析,结果分别与GAPDH光密度相对照,其比值表示蛋白相对表达量。
2.4 统计学分析
实验数据采用±s表示。组间比较在进行方差齐性检验后采用单因素方差分析,P<0.05 或P<0.01 表示差异有统计学意义(有显著性或非常显著性)。采用SPSS 16.0 统计软件进行统计学分析。
3 结果
3.1 SKI对模型鼠血清生化指标的影响
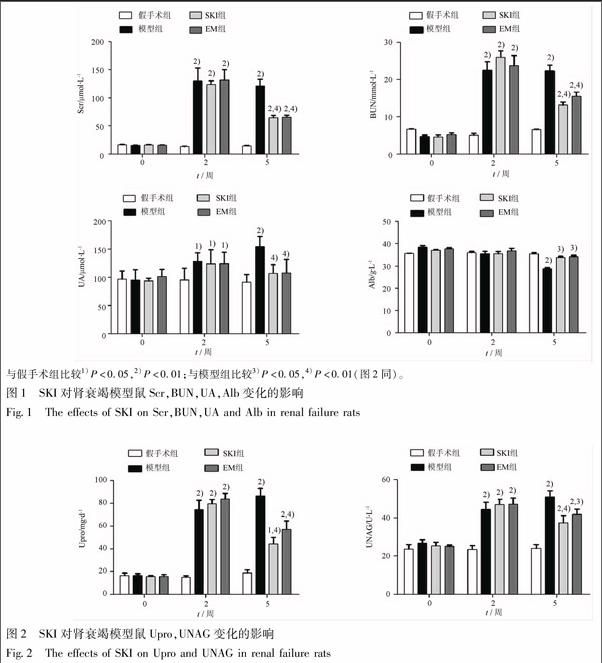
假手术组大鼠Scr,BUN,UA始终保持在较低水平,而模型组大鼠在手术前(第2周末)及处死前(第5周末)显著升高,与假手术组大鼠比较,其差异有统计学意义(P<0.01或P<0.05);经SKI或EM干预3周后(第5周末),模型鼠Scr,BUN,UA出现下降,与模型组大鼠比较,其差异有统计学意义(P<0.01);在第5周末,模型组大鼠Alb有所下降,与假手术组大鼠比较,其差异有统计学意义(P<0.01);经SKI或EM干预后,模型鼠Alb有所上升,与模型组大鼠比较,差异有统计学意义(P<0.05)(图1)。该结果说明,SKI能够改善肾衰竭模型鼠Scr,BUN,UA,Alb,其效果与EM相仿。
3.2 SKI对模型鼠尿蛋白的影响
假手术组大鼠Upro,UNAG始终保持在较低水平,而模型组大鼠在手术前(第2周末)及处死前(第5周末)显著升高,与假手术组大鼠比较,其差异有统计学意义(P<0.01);经SKI或EM干预3周后,模型鼠Upro,UNAG出现下降,与模型组大鼠比较,其差异有统计学意义(P<0.01或P<0.05)(图2)。该结果说明,SKI能够减少肾衰竭模型鼠尿蛋白,其效果与EM相仿。
3.3 SKI对模型鼠肾脏组织形态和CIV蛋白表达的影响
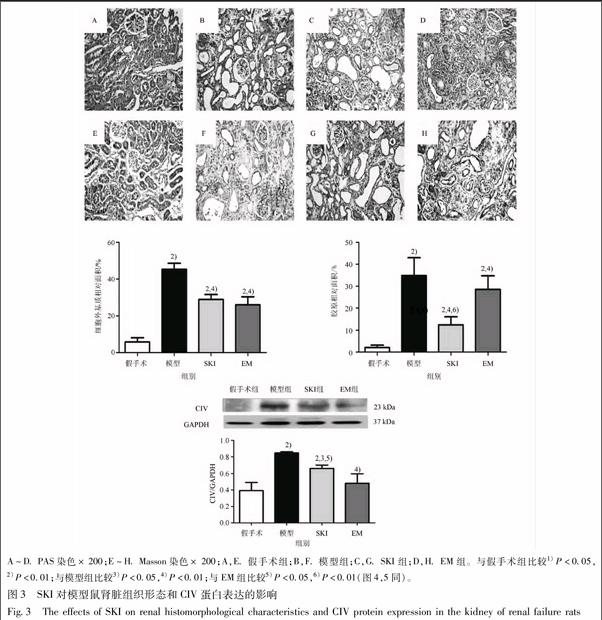
经光镜观察,造模后第3周末,假手术组大鼠肾小球毛细血管襻开放良好,肾小管上皮细胞排列整齐,未见肾间质ECM增宽、胶原沉积和明显的炎性细胞浸润(图3 A,E);模型组大鼠肾小管上皮细胞排列紊乱,肾小管萎缩、塌陷,大量炎症细胞浸润,肾间质内ECM及胶原相对面积增多(图3 B,F),与假手术组大鼠比较,其差异有统计学意义(P<0.01)。经SKI或EM干预后,肾小管上皮细胞排列比较整齐,肾小管萎缩、塌陷以及炎症细胞浸润有所改善,肾间质ECM及胶原相对面积明显减少(图3 C,G),与假手术组比较1)P<0.05,2)P<0.01;与模型组比较3)P<0.05,4)P<0.01(图2同)。
与模型组大鼠比较,其差异有统计学意义(P<0.01)。SKI组大鼠胶原相对面积明显减少,与EM
组大鼠比较,其差异有统计学意义(P<0.01)。此外,模型组大鼠肾组织CIV蛋白表达水平明显上调,与假手术组大鼠比较,其差异有统计学意义(P<0.01)。经SKI或EM干预后,CIV蛋白表达水平有所下调,与模型组大鼠比较,其差异有统计学意义(P<0.05或P<0.01)。但是,EM组大鼠CIV蛋白表达水平明显下调,与SKI组大鼠比较,其差异有统计学意义(P<0.05)(图3)。该结果说明,SKI可以改善肾衰竭模型鼠肾间质ECM、胶原相对面积以及CIV蛋白表达,其效果与EM相仿;但是,对于CIV蛋白表达,EM的改善作用优于SKI。
3.4 SKI对模型鼠肾组织MMP-2,MMP-9,TIMP-1蛋白表达的影响
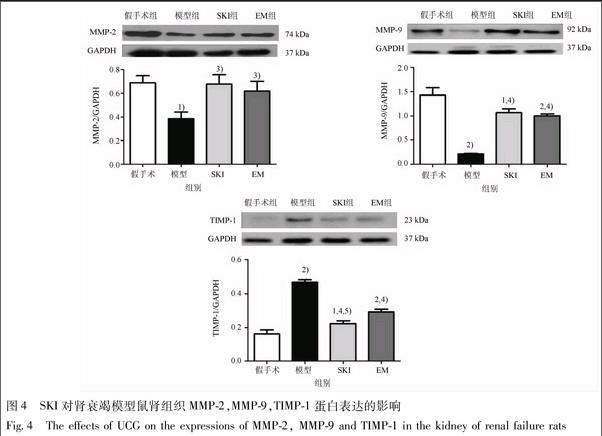
在造模后第3周末,模型组大鼠肾组织MMP-2,MMP-9蛋白表达水平明显下调,与假手术组大鼠比较,其差异有统计学意义(P<0.05或P<0.01);经SKI或EM干预后,MMP-2,MMP-9蛋白表达水平有所上调,与模型组大鼠比较,其差异有统计学意义(P<0.05或P<0.01);此外,模型组大鼠肾组织TIMP-1蛋白表达水平明显上调,与假手术组大鼠比较,其差异有统计学意义(P<0.01);经SKI或EM干预后,TIMP-1蛋白表达水平明显下调,与模型组大鼠比较,其差异有统计学意义(P<0.01);SKI组大鼠TIMP-1蛋白表达水平明显下调,与EM组大鼠比较,其差异有统计学意义(P<0.05)(图4)。该结果说明,SKI能够调节肾衰竭模型鼠肾组织MMP-2,MMP-9,TIMP-1蛋白表达;对于TIMP-1蛋白表达的改善作用,SKI优于EM。
3.5 SKI对模型鼠肾组织ERK1/2,p-ERK1/2蛋白表达的影响
在造模后第3周末,模型组大鼠肾组织p-ERK1/2蛋白表达水平明显上调,与假手术组大鼠比较,其差异有统计学意义(P<0.05);经SKI干预后,p-ERK1/2蛋白表达水平有所下调,与模型组大鼠比较,其差异有统计学意义(P<0.05);经EM干预后,p-ERK1/2蛋白表达水平亦有所下调,与模型组大鼠比较,其差异有统计学意义(P<0.01);SKI组大鼠p-ERK1/2蛋白表达水平明显下调,但是,与EM组大鼠比较,其差异无统计学意义(图5)。该结果表明,SKI能够下调模型鼠肾组织p-ERK1/2蛋白表达,其改善作用不同于EM,其变化趋势优于EM。
4 讨论
肾衰竭是CKD发展至终末期肾病的最终转归[14]。无论何种病因,在肾衰竭进展过程中RIF是其共同的病理基础之一,而RIF的病理形态学特征与中医学经典概念——“癥积(肾积)”极为相似[15]。基于国医大师张大宁的学术思想,笔者认为,肾衰竭属于中医学“虚劳(肾劳)”范畴,“劳”为“积”之盛,“积”为“劳”之渐。“积”之在肾,源于肾气不足,行血无力,络脉(肾脏微小血管)不畅,血瘀成积,酿生邪毒(浊毒或溺毒),毒损脏腑。这可能就是肾劳患者“因虚致瘀,因瘀致毒,因毒致劳”的病机演变规律。最为重要的是,这一“由积致劳”的病机假说与现代医学有关肾衰竭患者肾脏滤过功能减退而致氮质代谢产物、毒性中分子物质潴留的认识是一致的。因此,临床上治疗肾衰竭的原则当为“补虚、化瘀、解毒、防劳”,其中,“补肾活血”是基本的治法,而且,必须贯穿治疗始终。SKI由4味中药组成,其中,黄芪益气补肾,丹参、红花活血化瘀,大黄泄浊解毒,全方共奏“补肾活血,泄浊解毒”之功。在本研究中,对于肾衰竭动物模型,在“补肾活血法”代表性中药复方静脉制剂——SKI干预后,其Scr,BUN等代表肾小球滤过功能的指标的确得到明显改善,而且,其改善作用与EM相仿。这个结果提示,“补肾活血法”改善肾衰竭模型鼠肾功能的效果是肯定的。
为了阐明“补肾活血法”代表性中药SKI对肾积的改善作用,必须在肾衰竭动物模型中模拟出人类RIF的病理特征。笔者发现,模型鼠不但出现肾功能减退,而且,肾小管上皮细胞排列紊乱,肾小管萎缩、塌陷,大量炎症细胞浸润,肾间质ECM及胶原相对面积增多,肾组织CIV蛋白表达水平上调。这个结果提示,腺嘌呤灌胃联合UUO诱导的肾衰竭模型鼠不但初步具备人类RIF的病理特征,还表现出肾劳患者“虚、瘀、毒”的中医病理因素。在本研究中,笔者发现,经SKI干预后,模型鼠肾小管上皮细胞排列比较整齐,肾小管萎缩、塌陷以及炎症细胞浸润有所改善,肾间质ECM及胶原相对面积明显减少,CIV蛋白表达水平有所下调。这个结果提示,“补肾活血法”改善肾衰竭模型鼠RIF的效果也是肯定的。王清任在《医林改错》中曾有相关论述:“元气既虚,必不能达于血管,血管元气必停留而瘀”。笔者认为,这可能就是“补肾活血法”治疗肾积的中医理论基础。
研究表明,ECM降解与MMPs的表达和活性密切相关[4]。对于肾脏而言,MMPs家族在肾间质/小管表达的成员是MMP-2,3,7,9,14,24等,其中,MMP-2和MMP-9的作用主要是降解IV型胶原[5]。在本研究中,肾衰竭模型鼠肾组织MMP-2,MMP-9蛋白表达水平明显下调;经SKI干预后,模型鼠肾组织MMP-2,MMP-9蛋白表达明显改善。这个结果提示,SKI能够调节肾衰竭模型鼠肾组织MMPs表达而促进ECM降解。此外,MMPs特异性抑制物——TIMPs也会直接影响ECM降解[16]。在肾组织中,抑制MMPs活性的TIMPs主要是TIMP-1和TIMP-2,其中,TIMP-1能抑制MMP-9活性[17]。在本研究中,肾衰竭模型鼠肾组织TIMP-1蛋白表达水平明显下调;经SKI干预后,模型鼠肾组织TIMP-1蛋白表达明显改善。这个结果提示,“补肾活血法”的代表性药物——SKI能够调节肾衰竭模型鼠肾组织MMPs/TIMP-1表达而促进ECM降解,其中,对于TIMP-1蛋白表达的改善作用,SKI优于EM。
ERK1/2信号通路是调控MMPs表达和活性的重要通路之一[7]。对于脂多糖诱导的心肌纤维化模型,红花提取物可以促进心脏ECM降解,其作用是通过调控MMPs/ERK1/2信号通路而实现的[18]。Zhang等观察了UUO模型鼠中肾组织TGF-β1和ERK1/2蛋白表达特征,结果显示,TGF-β1和ERK1/2蛋白表达水平与肾脏纤维化程度密切相关[19]。在本研究中,笔者发现,随着肾衰竭模型鼠RIF的加重,其肾组织p-ERK1/2蛋白表达水平明显增加,ERK1/2信号通路活化;与EM不同的是,SKI能够明显下调模型鼠肾组织内p-ERK1/2蛋白表达水平,抑制ERK1/2信号通路活性。然而,在笔者团队的既往研究中,对于同样的肾衰竭动物模型,EM是通过经典的TGF-β1/Smads信号通路而影响ECM合成和降解的[12]。这个结果提示,虽然“补肾活血法”的中药复方制剂与血管紧张素转换酶抑制剂都能促进ECM降解,但是,其靶点和途径可能是不同的。
总之,对于腺嘌呤灌胃联合UUO诱导的肾衰竭动物模型,SKI能够改善模型鼠的肾功能和RIF,其效果与EM相仿;与EM不同的是,SKI可能是通过调控肾组织ERK1/2信号通路活性,干预MMPs/TIMP-1表达,促进ECM降解,延缓肾衰竭进展。在本研究中,笔者只是发现SKI的作用和机制与ERK1/2/MMPs信号通路有关,尽管如此,还有很多问题在活体模型中是无法得到明确答案的。
[致谢]本课题得到南京大学医学院附属鼓楼医院检验科罗浔阳副主任技师和科技处张乐助理研究员的帮助和指导。
[参考文献]
[1]Liu Y. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol,2011,7(12):684.
[2]Rodriguez-Iturbe B,Johnson R J,Herrera-Acosta J. Tubulointerstitial damage and progression of renal failure[J]. Kidney Int Suppl,2005(99):S82.
[3]佐藤有紀,柳田素子. 腎線維化の原因細胞と成因[J]. 日腎会誌,2015,57(7):1187.
[4]Catania J M,Chen G,Parrish A R. Role of matrix metalloproteinases in renal pathophysiologies [J]. Am J Physiol Renal Physiol,2007,292(3):F906.
[5]Lenz O,Elliot S J,Stetler-Stevenson W G. Matrix metalloproteinases in renal development and disease[J]. J Am Soc Nephrol,2000,11(3):574.
[6]Qi W,Chen X,Poronnik P,et al. The renal cortical fibroblast in renal tubulointerstitial fibrosis[J]. Int J Biochem Cell Biol,2006,38(1):1.
[7]Lin Y W,Lee L M,Lee W J,et al. Melatonin inhibits MMP-9 transactivation and renal cell carcinoma metastasis by suppressing Akt-MAPKs pathway and NF-κB DNA-binding activity[J]. J Pineal Res,2016,60(3):277.
[8]邓金华,张奉莲,王定勇,等. 肾康注射液治疗慢性肾衰竭的Meta分析[J]. 现代药物与临床,2015,30(5):595.
[9]万静芳,唐雪莲,卢晓梅,等. 肾康注射液治疗慢性肾脏疾病(CKD3~4期)的疗效观察[J]. 中国中西医结合肾病杂志,2014,15(11):968.
[10]Zhang Y U,Zhou N,Wang H,et al. Effect of Shenkang granules on the progression of chronic renal failure in 5/6 nephrectomized rats[J]. Exp Ther Med,2015,9(6):2034.
[11]Wu X,Guan Y,Yan J,et al. Shenkang injection suppresses kidney fibrosis and oxidative stress via transforming growth factor-β/Smad3 signalling pathway in vivo and in vitro[J]. J Pharm Pharmacol,2015,67(8):1054.
[12]Huang Y R,Wei Q X,Wan Y G,et al. Ureic clearance granule,alleviates renal dysfunction and tubulointerstitial fibrosis by promoting extracellular matrix degradation in renal failure rats,compared with enalapril[J]. J Ethnopharmacol,2014,155(3):1541.
[13]孙伟,尹雪皎,涂玥,等. 芪附汤调节ERK1/2信号通路改善UUO阳虚证模型肾间质纤维化的作用和机制[J]. 中国中药杂志,2014,39(21):4082.
[14]Zhang L,Wang F,Wang L,et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet,2012,379(9818):815.
[15]魏晴雪,万毅刚,赵青,等. 肾脏细胞外基质降解的分子机制及中药的干预作用[J]. 中国中药杂志,2013,38(4):533.
[16]Li Y Y,McTiernan C F,Feldman A M. Interplay of matrix metalloproteinases,tissue inhibitors of metalloproteinases and their regulators in cardiac matrix remodeling[J]. Cardiovasc Res,2000,46(2):214.
[17]Tan R J,Liu Y H. Matrix metalloproteinases in kidney homeostasis and diseases[J]. Am J Physiol Renal Physiol,2012,302(11):F1351.
[18]Han C K,Tien Y C,Jine-Yuan Hsieh D,et al. Attenuation of the LPS-induced,ERK-mediated upregulation of fibrosis-related factors FGF-2,uPA,MMP-2,and MMP-9 by Carthamus tinctorius L in cardiomyoblasts[J]. Environ Toxicol,2016,doi:10.1002/tox.22275.
[19]Zhang M,Guo Y,Fu H,et al. Chop deficiency prevents UUO-induced renal fibrosis by attenuating fibrotic signals originated from Hmgb1/TLR4/NFκB/IL-1β signaling[J]. Cell Death Dis,2015,doi:10.1038/cddis.2015.206.
[责任编辑 马超一]

