犀牛源性成分PCR检测方法的建立
邵建宏 赵福振 罗宝正 薄清如 沙才华 廖秀云 徐海聂
(珠海出入境检验检疫局,国家外来病检测重点实验室,珠海,519015)
犀牛源性成分PCR检测方法的建立
邵建宏 赵福振 罗宝正*薄清如 沙才华 廖秀云 徐海聂
(珠海出入境检验检疫局,国家外来病检测重点实验室,珠海,519015)
犀牛源性成分;
(Zhuhai Entry-Exit Inspection & Quarantine Bureau,State Key Laboratory of Exotic Animal Diseases,Zhuhai,519015,China)
根据国际上物种分类研究,犀牛归类于哺乳纲(Mammalia)奇蹄目(Perissodactyla)角型亚目(Ceratomorpha)犀科(Rhinocerotidae),现存犀牛包括白犀(Ceratotheriumsimum)、黑犀(Dicerosbicornis)、印度犀(Rhinocerosunicornis)、爪哇犀(Rhinocerossondaicus)、苏门答腊犀(Dicerorhinussumatrensis)5个物种。在生物学史上,犀牛曾遍布全球,其物种将近30个属[1]。两千多年来,犀牛被全人类视为珍稀药用动物,尤其是犀牛角,具有解热、凉血、解痉、解毒、定惊等奇效[2]。在巨大利益的驱使下,猎杀犀牛、贩卖犀牛角等非法行径在全球范围内广泛存在,犀牛数量急剧下降。国际动物保护组织已禁止犀牛角的交易,并将犀牛所有物种列入《濒危野生动植物种国际贸易公约》附录。国务院于1993年发布的第39号文件也明确禁止了犀牛角在我国的进出境、贸易、邮寄、携带、制药等行为。但是迄今为止,世界各国对于检测和鉴定犀牛源性样品的研究却非常有限。为进一步加强对现存犀科物种的保护,提高对非法贩卖犀牛角及其制品的打击力度,提升鉴定真假犀牛角及其制品的效率和准确性,建立一种更加合适的对来源于犀牛的可疑样品的检测方法十分必要。
目前国内外对于犀牛源性成分的分子生物检测主要是基于线粒体DNA的Cytb和12S RNA基因的研究[3-4],对犀牛角、犀牛皮的鉴定常局限于形态观察法[5]、显微镜观察比对法[6]、紫外灯荧光分析法[7]、红外光谱分析法[8]。上述各种方法均具有一定的代表性,但在某些情况下也存在自身的劣势,例如,形态观察法过于浅表、局限性大且受到主观因素和经验主义的影响,无法鉴定非原始形状的样品和微量样品;显微镜观察比对法无法满足快速和大批量检测的需要,同时对检验人员的要求较高,不易标准化和规范化;红外光谱分析法需要特定的参照物,对成分的判断和鉴定特异性较差;近年来也有利用DNA条形码对动物物种进行鉴定的技术[9-10],这种技术较为客观,准确性较高,但它受到DNA数据库中现有物种种类的限制,也可能由于种内最大遗传距离和种间最小遗传距离的重叠交叉导致得出错误的鉴定结论;而目前关于犀牛源性成分检测的分子生物学方法,其引物和扩增产物均只包含于一种基因区域,在某些情况下可能较难区分相近物种。本研究拟建立一种PCR方法用以快速、准确检测犀牛源性成分。
1 材料与方法
1.1 样品采集与保存
犀牛角样品1份,粉末状,为本实验室留存样品,使用标准方法(ZH2006-1,CNAS认可标准)扩增测序确认为白犀,用作阳性对照。
参考动物样品13份,为鲜肉、熟肉、角制品和熟制标本,均为本实验室留存样品,使用标准方法(ZH2006-1,CNAS认可标准)扩增并测序,确认为黄牛(Bostaurus)、水牛(Bubalusbubalis)、野牦牛(Bosgrunniens)、斑羚(Naemorhedusgoral)、山羊(Capraaegagrushircus)、绵羊(Ovisaries)、野马(Equuscaballus)、驴(Equusasinus)、原麝(Moschusmoschiferus)、鹿(Cervidae)、野猪(Susscrofa)、貘(Tapiridae)和虎(Pantheratigris)。参考样品用于验证方法的特异性。
送检动物样品5份,为动物头角2份、骨骼1份、皮张2份,检测项目为犀牛源性成分。
1.2 主要试剂
DNA提取试剂盒:E.Z.N.A.TM Tissue DNA Kit,美国OMEGA公司产品。
PCR反应试剂:TianGenTaqPCR Mastermix,中国天根生化科技(北京)有限公司产品。
DNA Marker:DNA Marker DL 2000,日本TaKaRa公司产品。
1.3 主要仪器设备
PCR仪:Veriti 96-Well Thermal Cycler,美国Applied Biosystems公司产品。
凝胶成像分析系统:Alpha Imager HP,美国Alpha Innotech公司产品。
高速冰冻台式离心机:Sigma 3-18 K,德国Sartorius公司产品。
紫外分光光度计:NanoDrop ND - 1000 Spectrophotometer,美国 NanoDrop Technologies 公司产品。
1.4 DNA提取
使用经高温高压处理的镊子和药匙对样品取50 mg置于1.5 mL离心管中,使用DNA提取试剂盒对样品进行DNA提取。
1.5 PCR引物的设计与合成
GenBank中公布的犀科物种线粒体全基因序列共有6个,分别为白犀(GenBank:Y07726.1)、黑犀(GenBank:FJ905814.1)、印度犀(GenBank:X97336)、爪哇犀(GenBank:FJ905815.1)、苏门答腊犀(GenBank:FJ905816.1)和披毛犀(Coelodontaantiquitatis,GenBank:Y07726.1)。下载以上6个线粒体全基因序列,使用分子生物学软件DNAMAN8.0进行多序列比对,使用Oligo7.0在其保守区域设计1对特异性PCR引物,其中上游引物在ND2基因区域,下游引物横跨tRNA-Asn和tRNA-Ala基因区域。PCR产物横跨多个基因的设计方法,有利于遗传相近物种的区分。同时,上游引物中加入了兼并碱基,保证不同物种即使有序列差异,在扩增过程中效率也不会下降或者漏检。为了与鹿科动物和马科动物的区分,设计下游引物的时候,在3′端3个碱基中设计了1个犀科动物的特异性碱基,保证扩增的特异性。引物由上海辉睿生物科技有限公司合成,序列见表1。
表1 PCR引物序列

Tab.1 Sequences of primers for PCR
1.6 PCR检测方法建立
使用1.5中引物配制PCR反应体系:2×TaqPCR Master mix 12.5 μL、10 μmol/L的F-primer 1.0 μL、10 μmol/L的R-primer 1.0 μL、DNA模版2.0 μL,余补水至总容积25 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸5 min。PCR扩增结束后,取5 μL扩增产物置于2 %琼脂糖凝胶中,以110 V电压进行30 min电泳检测,电泳结束后使用凝胶成像分析系统记录结果。
1.7 PCR产物测序确认
将电泳后有目的条带的PCR产物送北京六合华大基因科技股份有限公司广州分公司进行测序,使用NCBI中BLAST功能对序列进行比对,确定物种来源。
1.8 PCR方法特异性试验
以13份参考动物样品提取的DNA为模板,采用上述方法进行PCR检测,验证所建立的PCR方法的特异性。
1.9 PCR方法灵敏度试验
将犀牛阳性对照样品PCR扩增目的条带送北京六合华大基因科技股份有限公司武汉分公司进行TA克隆,并以此重组质粒作为阳性标准品。将重组质粒用紫外分光光度计测定质粒浓度,根据阿伏伽德罗常数换算为目的基因拷贝数。提取阳性克隆质粒并测定浓度后,按10倍梯度倍比稀释,对经梯度稀释后的阳性对照进行PCR检测,所能检出的最低模板拷贝数为PCR方法的灵敏度。
1.10 样品检测和鉴定
以5份送检样品提取的DNA为模板进行PCR扩增和电泳检测,将电泳后有目的条带的PCR产物送北京六合华大基因科技股份有限公司广州分公司进行测序,使用NCBI中的BLAST功能对序列进行检索比对,确定样品物种。
2 结果与分析
2.1 PCR检测方法建立
使用设计的引物配制PCR反应体系,按照反应条件对阳性对照犀牛的DNA进行PCR扩增和凝胶电泳,得到了明显的电泳条带,产物大小约360 bp,与预期基本一致(图1)。
2.2 特异性试验
特异性试验的比对物种涵盖牛科、马科、鹿科、猪科、獏科和猫科。其中,牛科、鹿科(麝、獐除外)和本研究对象犀科涵盖了现存已知的所有有角哺乳动物(包括洞角、实角、叉角羚角、长颈鹿角、表皮角),马科、獏科和本研究对象犀科涵盖了现存已知的所有奇蹄目动物,所选特异性试验的比对物种具有高度代表性和广泛性。特异性试验结果显示,仅犀牛样品出现特异性的扩增条带,其他动物样品均未呈现扩增条带(图2)。
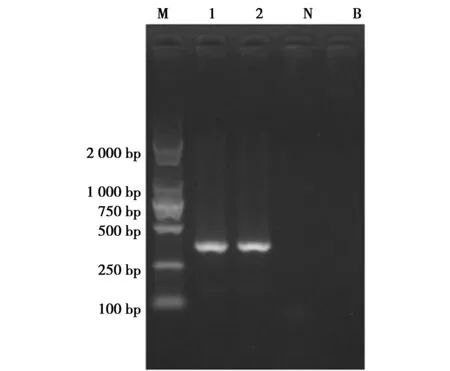
图1 犀牛样品PCR检测结果Fig.1 PCR Results for sample of rhinoceros 注:M:DNA Marker DL2 000;1:犀牛样品1;2:犀牛样品2;N:阴性对照;B:空白对照 Note:M:DNA Marker DL2 000;1:sample of rhinoceros 1;2:sample of rhinoceros 2;N:negative control;B:blank control

图2 PCR方法特异性试验Fig.2 Specificity assay for the PCR assay 注:M:DNA Marker DL2 000;1~14依次为犀牛、黄牛、水牛、牦牛、羚羊、山羊、绵羊、马、驴、麝、鹿、猪、獏、虎;N:阴性对照;B:空白对照 Note:M:DNA Marker DL2 000;1 to 14:the sample of rhinoceros,scalper,buffalo,yak,antelope,goat,sheep,horse,donkey,musk,deer,pig,tapirus and tiger by order;N:negative control;B:blank control
2.3 灵敏度试验
灵敏度试验结果显示犀牛样品在100个拷贝仍呈现较明显的扩增条带,10 拷贝所呈现的扩增条带微弱,判定该方法灵敏度为100个拷贝(图3)。
2.4 样品检测
样品检测结果显示,有2份样品呈现特异性扩增条带,即判定为含有犀牛源性成分,另外3份样品未呈现扩增条带,则判定为不含有犀牛源性成分(图4)。检测阳性的2份样品经PCR产物测序结果证实均为白犀。
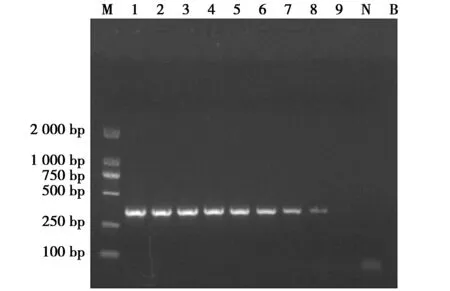
图3 PCR方法灵敏度试验Fig.3 Sensitivity assay for the PCR assay 注:M:DNA Marker DL2 000;1~9依次为109、108、107、106、105、104、103、102、101拷贝;N:阴性对照;B:空白对照 Note:M:DNA Marker DL2 000;1 to 9:109,108,107,106,105,104,103,102 and 101 copies of recombinant plasmids by order;N:negative control;B:blank control
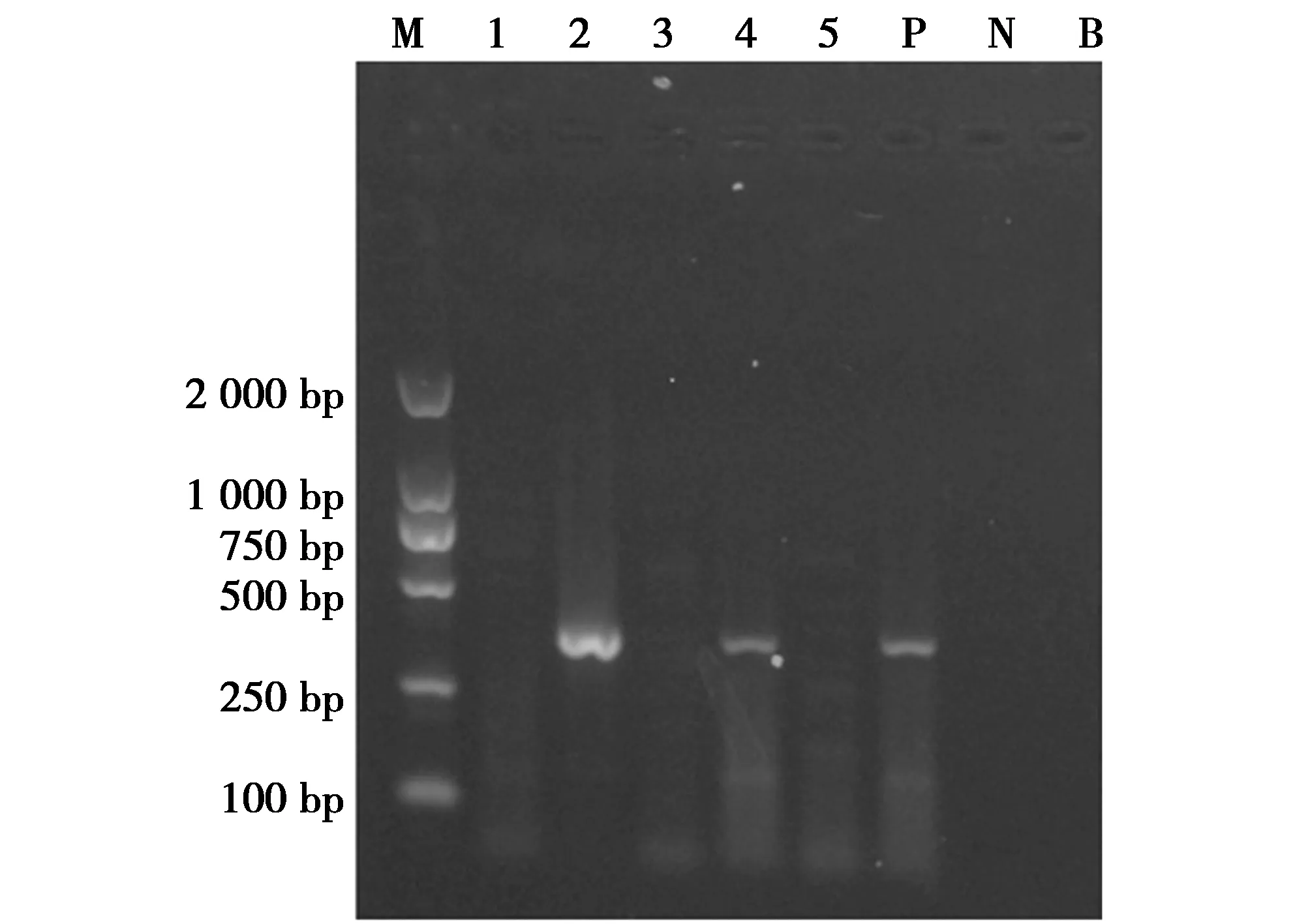
图4 样品检测Fig.4 Sample detection 注:M;DNA Marker DL2 000;1~5:5份待检测样品;P:阳性对照;N:阴性对照;B:空白对照 Note:M:DNA Marker DL2 000;1 to 5:the samples to be tested;P:positive control;N:negative control;B:blank control
3 讨论
PCR技术以其能将微量DNA大幅扩增且高特异性、高灵敏度的特点,普遍被应用于分子生物学领域的检测[11-14]。无论是古生物化石、残骸,还是若干前遗留的毛发、皮肤或血液等所有“微量证据”,只要能够在DNA完全分解前(DNA半衰期为521 a)对其进行分离提取,结合所设计的特异性引物,通过PCR技术的应用都能对其进行扩增,并通过后续的电泳、测序、比对流程对目标样品的成分进行准确鉴定。
本研究所建立的方法对犀牛样品的检测结果显示,样品DNA序列与GenBank中白犀的线粒体序列同源性最高为100 %,准确性高。从扩增条带判断,本方法在现存已知的所有有角哺乳动物、现存已知的所有奇蹄目动物当中都具有高度特异性,与其他常见偶蹄动物如猪科的猪、野生保护动物如猫科的老虎也能有效进行区分,所能检出的最低模板为100个拷贝,具有较高灵敏度。
本方法可用于动物、动物产品、加工工艺品等物品中犀牛源性成分的检测和鉴定,在动物保护、取缔各类非法行径和打击假冒伪劣产品方面都具有显著的实际意义。值得注意的是,我们在引物设计的时候,包括了犀科的所有物种,包括已经灭绝1万年的披毛犀。所以在司法鉴定需要的时候可以进行PCR产物测序,确认截获到该物种再出具相应的检测报告。本方法检测过程中需要取样,将会对物品本身产生一定破坏,故对部分名贵物品、观赏品的取样过程应谨慎操作或应进一步对其可能产生的破坏情况做出预评估。同时,由于犀牛样品的稀缺,本研究未能收集到所有犀科物种的样品,需要在检测中进一步验证。
[1] 刘元.地球上的犀牛[J].野生动物,1997,18(1):3-5.
[2] 甄权.药性论[M].安徽:安徽科学技术出版社,2006.
[3] Hsieh H M,Huang L H,Tsai L C,et al.Species identification of rhinoceros horns using the cytochromebgene[J].Forensic Science International,2003,136(1-3):1-11.
[4] 赵竹,宋云,许瑾,等.基于COI基因对犀角工艺品真伪的鉴别[J].植物检疫,2013,27(2):68-71.
[5] 李正勇.伪品犀角的鉴别[J].西北药学杂志,1990,5(2):17-18.
[6] 周晶梅,金煜,胡红.犀牛角及其制品的快速鉴定方法[J].东北林业大学学报,2010,38(5):140-141.
[7] 周晶梅.犀牛角及其制品鉴定识别方法的研究[D].哈尔滨:东北林业大学,2010:1-41.
[8] 李圣清.犀牛角及其仿制品的研究[D].昆明:昆明理工大学,2011:1-57.
[9] 彭居俐,王绪桢,何舜平.DNA条形码技术的研究进展及其应用[J].水生生物学报,2008,32(6):916-919.
[10] 杜启艳,常童杰.DNA条形码在鉴定物种中的应用[J].生物学教学,2010,35(12):60-61.
[11] Ilhak O I,Arslan A.Identification of meat species by polymerase chain reaction(PCR)technique[J].Turkish Journal of Veterinary and Animal Sciences,2007,31(3):159-163.
[12] Porter J S,Skibinski D O F,Leamon J,et al.Technique for analysis of bryozoan mitochondrial DNA[J].Molecular Ecology Notes,2001,1(1-2):103-105.
[13] Rensen G J,Smith W L,Jaravata C V,et al.Development and evaluation of a real-time FRET probe based multiplex PCR assay for the detection of prohibited meat and bone meal in cattle feed and feed ingredients[J].Foodbourne Pathogens & Disease,2006,3(4):337-346.
[14] 周用武.DNA技术鉴定动物物种研究评述[J].通化师范学院学报,2008,29(2):48-51.
Rhinoceros-derived ingredients;
Establishment of PCR Assay for the Detection ofRhinoceros-Derived Ingredients
Shao Jianhong Zhao Fuzhen Luo Baozheng*Bo Qingru Sha Caihua Liao Xiuyun Xu Hainie
To effectively identify rhinoceros-derived ingredients,we designed specific PCR primers using software Oligo 7.0 based on the mitochondrial DNA sequence of rhinoceros.We established PCR assay for the detection of rhinoceros-derived ingredients with newly designed primers.The sample of rhinoceros was amplified using rhinoceros-specific PCR primers,and specific bands were observed after gel electrophoresis.The assay had high specificity and results for all other thirteen samples were negative.This assay method was highly sensitive:the minimum amount of DNA detectable was 100 copies of recombinant plasmid DNA template.Five samples were examined with this assay.Two samples were positive and three were negative,which was consistent with the result of DNA sequencing.The result indicated that this newly established assay can be used for detecting rhinoceros-derived ingredients in samples.
稿件运行过程
2016-04-22
修回日期:2016-06-01
发表日期:2016-11-10
PCR;
检测
PCR;
Detecting
Q953+.5
A
2310-1490(2016)04-316-05
为了对犀牛源性成分进行有效鉴定,根据犀科(Rhinocerotidae)动物线粒体DNA(mitochondrial DNA)序列,使用分子生物学软件Oligo 7.0设计了特异性引物,用来建立PCR检测犀牛源性成分的方法。结果显示,建立的PCR方法可以对犀牛阳性样品进行扩增,凝胶电泳呈现特异性条带。方法特异性好,13份其他物种的样品均为阴性结果。方法灵敏度较高,可检测到100拷贝重组质粒DNA模板。对5份送检样品检测发现2份犀牛样品,与测序结果一致。结果表明,新建立的方法可应用于样品中犀牛源性成分的检测。
国家质检总局科技项目(项目编号2014IK234)资助
邵建宏,男,33岁,学士,兽医师;主要从事动物源性成分检测方向研究。
*通讯作者:罗宝正,E-mail:bzluo@163.com

