益心酮对急性酒精性肝损伤小鼠肝细胞Bcl-2、Bax表达的影响
马 申,白晶晶,刘月球,高凤玉,范 博,李素婷
(1.承德医学院2013级临床医学本科,河北承德 067000;2.承德医学院2014级临床医学本科,3.指导教师)
学生园地
益心酮对急性酒精性肝损伤小鼠肝细胞Bcl-2、Bax表达的影响
马申1,白晶晶1,刘月球1,高凤玉1,范博2,李素婷3
(1.承德医学院2013级临床医学本科,河北承德 067000;2.承德医学院2014级临床医学本科,3.指导教师)
益心酮;Bcl-2;Bax;酒精性肝损伤
酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒导致的肝脏疾病,包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化及肝硬化。近年来研究表明,酒精作为肝细胞凋亡诱导剂,诱发肝细胞异常凋亡在ALD的发生发展中起着重要作用[1]。在众多凋亡相关基因中,Bcl-2家族与肝细胞凋亡关系密切。Bcl-2和Bax分别作为Bcl-2家族中抗凋亡和促凋亡的代表基因,在肝细胞凋亡的基因调控中起中心作用[2]。本研究建立小鼠急性酒精性肝损伤模型,观察了益心酮对凋亡相关基因Bcl-2、Bax表达的影响,以探讨益心酮对酒精性肝损伤保护作用的机制。
1 材料与方法
1.1 材料
1.1.1 动物:昆明种小鼠,雄性,清洁级,体重22g±2g,石家庄实验动物管理中心提供。
1.1.2 主要试剂与仪器:益心酮片(山楂叶总黄酮制剂,每片含山楂叶总黄酮32mg),购于山西振东泰盛制药有限公司;56%红星二锅头白酒,北京红星酿酒厂生产;TUNEL细胞凋亡原位检测试剂盒,β-actin、Bcl-2、Bax兔抗小鼠多克隆抗体,辣根过氧化物酶标记羊抗兔IgG,均购于南京凯基生物科技发展有限公司;Olympus显微镜,日本Olympus株式会社;组织切片机,德国Leica公司。
1.2 方法
1.2.1 动物造模与给药[3]:雄性昆明种小鼠60只随机分为正常组、模型组、益心酮低(40mg/kg)、高(80mg/kg)剂量组,每组15只。正常组每天给予蒸馏水0.4ml灌胃,模型组和益心酮组按8ml/kg/次灌胃给予56°二锅头白酒,2次/d,连续10d天造模结束。自造模第1天起,益心酮组在每日13:00灌胃给药一次,正常组和模型组同时灌服等体积蒸馏水。实验期间各组小鼠自由饮水、进食。最后一次灌胃结束后,禁食不禁水16h,断头处死小鼠,取出肝脏。部分肝脏-80℃冻存待测,部分肝脏置于10%甲醛溶液固定。
1.2.2 检测肝细胞凋亡:肝组织10%甲醛溶液固定,石蜡包埋,切片,TUNEL法检测肝细胞凋亡情况。以肝细胞核呈棕黄色或棕褐色染色为阳性细胞,即凋亡细胞。每例标本选取5个高倍视野(400倍)观察凋亡细胞,计算凋亡细胞核数占该视野肝细胞核总数的百分比,取均值作为凋亡指数(apoptosis index,AI)。
1.2.3 Western Blotting法检测肝脏Bcl-2和Bax蛋白的表达:取新鲜肝组织100mg提取总蛋白,BCA蛋白定量试剂盒进行蛋白定量。取50 μ g肝组织蛋白行8% SDS-聚丙烯凝胶电泳,电转移至PVDF膜上,5%脱脂奶粉封闭,室温下一抗(1:200稀释)孵育2h,羊抗兔IgG/HRP二抗(1:3000稀释)室温孵育1.5h,按照ECL免疫检测试剂盒进行曝光、显影、洗片。以β-actin(1:200稀释)作为内参照,胶片扫描后获得图像。采用Quantity One 4.4分析软件测定条带灰度值,以Bcl-2、Bax蛋白条带灰度值/内参照β-actin蛋白条带灰度值作为目的蛋白的相对表达水平。
1.2.4 统计分析:采用SPSS 17.0软件进行统计学分析,数据以(±s)表示,计量资料多组间比较采用方差分析,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 益心酮对酒精引起小鼠肝细胞凋亡的保护作用
正常组小鼠肝细胞无或偶见凋亡,模型组小鼠肝组织中可见大量棕黄色、棕褐色凋亡细胞核,散在分布于肝小叶内。与正常组比较,模型组小鼠肝细胞AI值明显升高(P<0.01);与模型组比较,益心酮低剂量组、高剂量组肝细胞AI值明显降低(P<0.01,P<0.05)。见附表。
2.2 益心酮对肝组织Bcl-2、Bax蛋白表达的影响 与正常组比较,模型组小鼠肝组织Bcl-2表达明显降低、Bax表达明显升高(P<0.01);给予益心酮灌胃后,小鼠肝组织Bcl-2表达明显升高、Bax表达明显降低(P<0.01,P<0.05)。见附表:
附表 各组小鼠肝细胞AI值和肝组织Bcl-2、Bax蛋白的表达情况(±s,n=15)
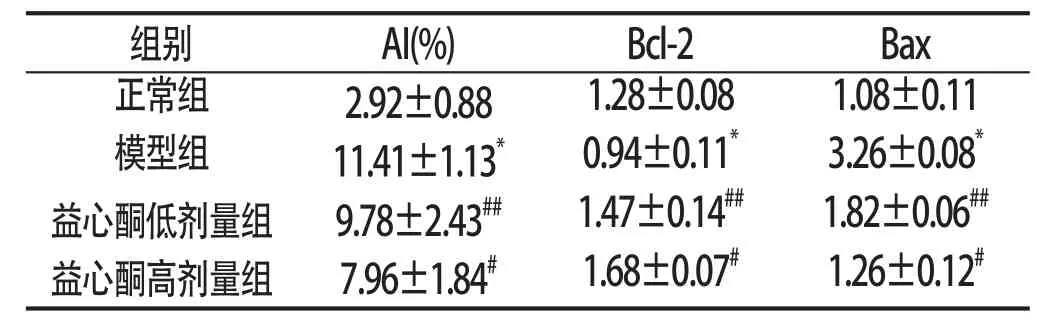
附表 各组小鼠肝细胞AI值和肝组织Bcl-2、Bax蛋白的表达情况(±s,n=15)
与正常组比较:*P<0.01;与模型组比较:#P<0.01,##P<0.05
组别AI(%)Bcl-2Bax正常组2.92±0.881.28±0.081.08±0.11模型组11.41±1.13*0.94±0.11*3.26±0.08*益心酮低剂量组9.78±2.43##1.47±0.14##1.82±0.06##益心酮高剂量组7.96±1.84#1.68±0.07#1.26±0.12#
3 讨论
凋亡(apoptosis)是细胞在一定的生理或病理信号刺激下遵循自身程序,由基因控制的主动死亡行为。生物体通过凋亡机制完成对衰老细胞和畸形细胞的清除,但过度凋亡则会引起组织损伤,进而导致功能障碍。近年来研究表明,病毒感染、毒性物质、酒精等均可诱发肝细胞异常凋亡,引起各种急慢性肝损伤。酒精作为肝细胞凋亡诱导剂,介导的肝细胞凋亡在ALD的发生与发展中发挥重要的促进作用[4]。
肝细胞凋亡机制较为复杂,目前认为线粒体凋亡途径最为重要。Bcl-2基因家族作为线粒体凋亡途径中最有效的调控执行者,与肝细胞凋亡关系最为密切[5]。Bcl-2是凋亡抑制基因,它编码的蛋白位于线粒体外膜、内质网膜和核膜上,其抗凋亡作用的机制是抗氧化、调节线粒体的通透性、防止细胞色素C及凋亡诱导因子的释放,使凋亡效应蛋白酶链不能激活,从而阻止细胞凋亡。Bax是Bcl-2家族中目前研究最广泛的促凋亡基因,正常细胞中Bax定位于细胞质,当受到损伤或刺激后,激活的Bax结合在线粒体膜上,建立线粒体膜通道,介导细胞色素C的释放,从而诱导细胞凋亡。因此,Bcl-2与Bax表达水平的平衡结果决定了凋亡信号刺激后细胞的存活或凋亡。一切干预细胞凋亡的因素都可最终归结为对Bcl-2、Bax的改变,发挥促进或抑制细胞凋亡的作用[6]。
本研究显示,模型组小鼠肝细胞凋亡指数明显升高,表明酒精介导肝细胞凋亡是导致肝损伤的主要原因;给予益心酮干预后,肝细胞凋亡指数明显降低,表明益心酮可通过抑制肝细胞凋亡起到保肝作用。本研究同时发现,模型组小鼠肝组织Bcl-2表达明显降低、Bax表达明显增高,给予益心酮干预后,Bcl-2表达明显升高、Bax表达明显降低,表明益心酮可通过上调抑凋亡基因Bcl-2表达、下调促凋亡基因Bax表达,发挥抗凋亡作用,这可能是益心酮对酒精性肝损伤具有保护作用的重要机制之一。
[1]朱传龙,高人焘,李宜.凋亡及其调控基因Bcl-2家族在肝脏损伤中的作用[J].实用肝脏杂志,2008,11(3):206-209.
[2]靳雅玲,欧士钰.Bcl-2、Bax与肝纤维化关系的研究进展[J].临床医学工程,2013,20(1):124-126.
[3]赵敏,池莉平,王凤岩,等.小鼠急性酒精性肝损伤模型的建立及应用[J].华南预防医学,2005,31(1):14-17.
[4]安红姬,金武丕.乙醇诱发肝细胞凋亡的发病机制[J].吉林医学,2007,28(10):1155-1157.
[5]郭晨,李丹,林纳,等.表达HBVX基因的小鼠模型的建立及对肝细胞凋亡因子的影响[J].世界华人消化杂志,2011,19(12):1225-1230.
[6]朱玉山,卢铁元,王蕊,等.Bcl-2家族蛋白调控线粒体膜通透性和细胞色素C释放的新机制[J].生命科学,2011,23(11):1076-1080.
(学生园地栏目编辑:张 健)
R944.4
A
1004-6879(2016)02-0170-03
(2016-01-05)

