麻黄强化泡沫分离甘草酸的工艺研究
丁琳琳, 王延吉, 吴兆亮, 刘海倩, 李 瑞, 刘 伟
麻黄强化泡沫分离甘草酸的工艺研究
丁琳琳, 王延吉, 吴兆亮, 刘海倩, 李 瑞, 刘 伟
(河北工业大学化工学院, 天津 300130)
为了提高泡沫分离甘草中甘草酸的分离效果,开发了甘草麻黄配伍泡沫分离工艺,并就麻黄对浸提液泡沫性能的影响进行了研究。结果表明,麻黄强化了甘草酸的提取,但降低了浸提液中甘草苷的浓度,使得浸提液的泡沫性能发生变化而影响泡沫分离甘草酸的分离效果。以甘草酸的富集比和回收率为评价指标,研究了温度、气体体积流量、甘草酸初始浓度和甘草麻黄质量配比对分离效果的影响。结果表明当温度为40℃、气体体积流量为100 mL×min-1、甘草酸初始浓度为0.2 g×L-1和甘草麻黄质量配比为5:3时,获得甘草酸的富集比和回收率分别为8.34和62.5%。与单独泡沫分离甘草中甘草酸相比,甘草酸的富集比提高了121.7%,而回收率并未明显降低。因此,麻黄的引入有效地提高了泡沫分离甘草酸的分离效果。
泡沫分离;甘草;甘草酸;麻黄
1 前 言
甘草是豆科植物甘草()的干燥根及根茎,常做佐使药入多种中药复方。其味甘性平,归肺、心、胃、脾经并具有补脾益气、祛痰止咳、清热解毒、缓急止痛、调和诸方等功能,在临床中的应用极为广泛。其主要成分甘草酸(glycyrrhizic acid)在甘草根茎中含量达 3.63%~13.06%,具有镇咳,抗炎,抗癌,抗病毒,提高免疫功能等药理作用[1~5]。甘草酸的传统提取分离方法包括水提、醇提或超声提取[6,7],进而利用树脂吸附[8,9]进行纯化,此工艺分离效果好,但缺点是分离成本高。泡沫分离技术因其效率高、成本低和无污染等优点[10],在降低中药有效成分分离成本方面具有极大的潜力。由于甘草酸属于皂苷类成分,是一种天然的表面活性物质,目前已有研究通过泡沫分离技术对甘草酸进行富集,但其富集比多在3 左右[11~13],富集效果仍有待提高。麻黄()为麻黄科植物的茎,主要含有麻黄碱、伪麻黄碱、甲基麻黄碱等多种成分。麻黄碱具有松弛支气管平滑肌、平喘等药理作用[14],常在临床中与甘草一同入药使用,即配伍使用[15]。在中药的临床使用中,经常通过药物配伍达到增强疗效、扩大治疗范围以及减少不良反应等用药目的。目前,关于配伍药物的研究主要集中在调整剂量、改善药效等方面,对于利用药物配伍提高有效成分泡沫分离效果的研究尚未见报道。因此,通过药物配伍提高有效成分的富集效果将有效地简化后续纯化过程进而提高纯化效果,所以利用药物配伍提高有效成分泡沫分离效果将对拓展泡沫分离技术在中药有效成分分离中的应用有重要的意义。
为了提高泡沫分离甘草酸的分离效果,本文开发了将甘草麻黄配伍合煎所得提取液作为泡沫分离初始原料液进行泡沫分离甘草酸的工艺。在研究麻黄对甘草酸和甘草苷浓度随时间变化影响的基础上,以甘草酸的富集比和回收率为评价指标,研究温度、气体体积流量、甘草酸初始浓度和甘草麻黄质量配比对甘草酸分离效果的影响。
2 实 验
2.1 实验试剂
甘草和麻黄均购于北京同仁堂天津药店。甘草酸标准品和甘草苷标准品均购于上海晶纯生化科技有限公司。其他实验试剂均购于天津康科德科技有限公司。
2.2 实验仪器
752紫外光栅分光光度计,上海精密科学仪器有限公司;AC0-318型电磁式空气压缩机,广东海利集团有限公司;LZB-3WB型玻璃转子流量计,天津河东五环仪表厂;CS501型超级恒温器,上海实验仪器厂有限公司;GB11A型高效液相色谱仪,安捷伦科技有限公司;JYW-200B型自动界面张力仪,承德试验机责任有限公司;DFA100型泡沫分析仪,德国克吕士公司。
2.3 实验装置
实验装置如图 1 所示。全塔高 850 mm,入口处内径 36 mm,椭球部分出现在 400 ~ 750 mm 处,中心处内径 72 mm,由玻璃制成。塔底部安装有多孔聚乙烯膜气体分布器,孔径 0.425 mm。压缩空气由鼓泡口引入,通过气体分布器分散成气泡。随着泡沫的上升,泡沫间隙的液体会由于泡沫排液重新回流至主体液中,泡沫自塔顶流出,收集于消泡器中。分离塔外部紧紧缠绕硅胶管,硅胶管与超级恒温器相连接以控制塔内温度。温度监测的温度计附在柱上。所有的泡沫分离实验是在批处理模式下进行。

图1 实验装置示意图
1. gas distributor 2. container 3. inlet of circulating water 4. outlet of circulating water
2.4 甘草酸浓度的测量
采用DiamonsilTMC18(250 mm×4.6 mm,5 μm) 色谱柱,以0.1%(V)磷酸水溶液/乙腈 (63:37) 为流动相,在检测波长为250 nm、柱温为35℃、流量为1.0 mL×min-1条件下进行甘草酸的浓度测定,并制作标准曲线,经线性拟合后得:1= 155001+113.2,R2= 0.9995,线性范围为:0.24~1.23 g×L-1,1为吸光值,1(g×L-1)为甘草酸溶液的浓度。将甘草酸标准品、甘草单煎液和麻黄单煎液在上述检测条件下进行对比,发现麻黄的加入不影响甘草酸浓度的测定。
2.5 甘草苷浓度的测量
采用上述色谱柱,以0.5%(V)磷酸水溶液/乙腈 (83:17) 为流动相,在检测波长为276 nm、柱温为35℃、流量为1.0 mL×min-1条件下进行甘草苷的浓度测定,并制作标准曲线,经线性拟合后得:2= 385612+90.6,R2= 0.9995,线性范围为:0.076~0.38 g×L-1,2为吸光值,2(g×L-1)为甘草苷溶液的浓度。将甘草苷标准品、甘草单煎液和麻黄单煎液在上述检测条件下进行对比,发现麻黄的加入不影响甘草苷浓度的测定。
2.6 甘草酸水溶液表面张力、起泡高度和泡沫半衰期的测量
移取50 mL 甘草酸和甘草苷标准品混合水溶液于样品槽中,在甘草酸浓度0.3 g×L-1和温度40℃的条件下,通过自动界面张力仪分别测定不同甘草苷浓度的混合水溶液的表面张力。在上述实验条件和气体体积流量100 mL×min-1条件下,移取50 mL甘草酸和甘草苷标准品混合水溶液于样品槽中,调节鼓气时间为 15 s,通过泡沫分析仪分别测定其泡沫高度和泡沫半衰期。
本实验以泡沫高度来表征甘草麻黄合煎液的起泡性,以泡沫半衰期表征其泡沫的稳定性。取一定量甘草酸和甘草苷混合水溶液于样品槽中,通过泡沫分析仪分别测定混合水溶液的泡沫高度和泡沫半衰期。
2.7 泡沫分离效果的评价指标
在甘草酸泡沫分离效率由富集比g和回收率g(%)两个参数进行评价,其定义如下:


其中,g0和gf分别为原料液和消泡液中甘草酸的浓度,g×L-1;g0和gf分别为原料液和消泡液的体积,L。
3 结果和讨论
3.1 麻黄对甘草中甘草苷浓度随时间变化的影响
实验条件为甘草酸初始浓度0.2 g×L-1、提取温度80℃、甘草麻黄合煎质量配比5:3、提取溶剂体积200 mL,取此条件下同等质量的甘草,在甘草一次单煎与甘草麻黄一次合煎过程中,每20 min取一次样,检测甘草苷的浓度,绘制甘草苷浓度随时间变化曲线。麻黄对甘草中甘草苷浓度随时间变化的影响如图 2 所示。
图 2 结果表明,甘草单煎液中甘草苷的浓度在 80 min时基本达到平衡,而甘草麻黄合煎液中甘草苷的浓度较甘草单煎明显下降,降低了22.1%。这是由于甘草中的甘草苷与麻黄中生物碱类成分在合煎过程中发生了化学反应生成沉淀,从而导致甘草麻黄合煎液中甘草苷浓度较甘草单煎液低,此实验结果与孟翔宇等[15]所得结论相一致。
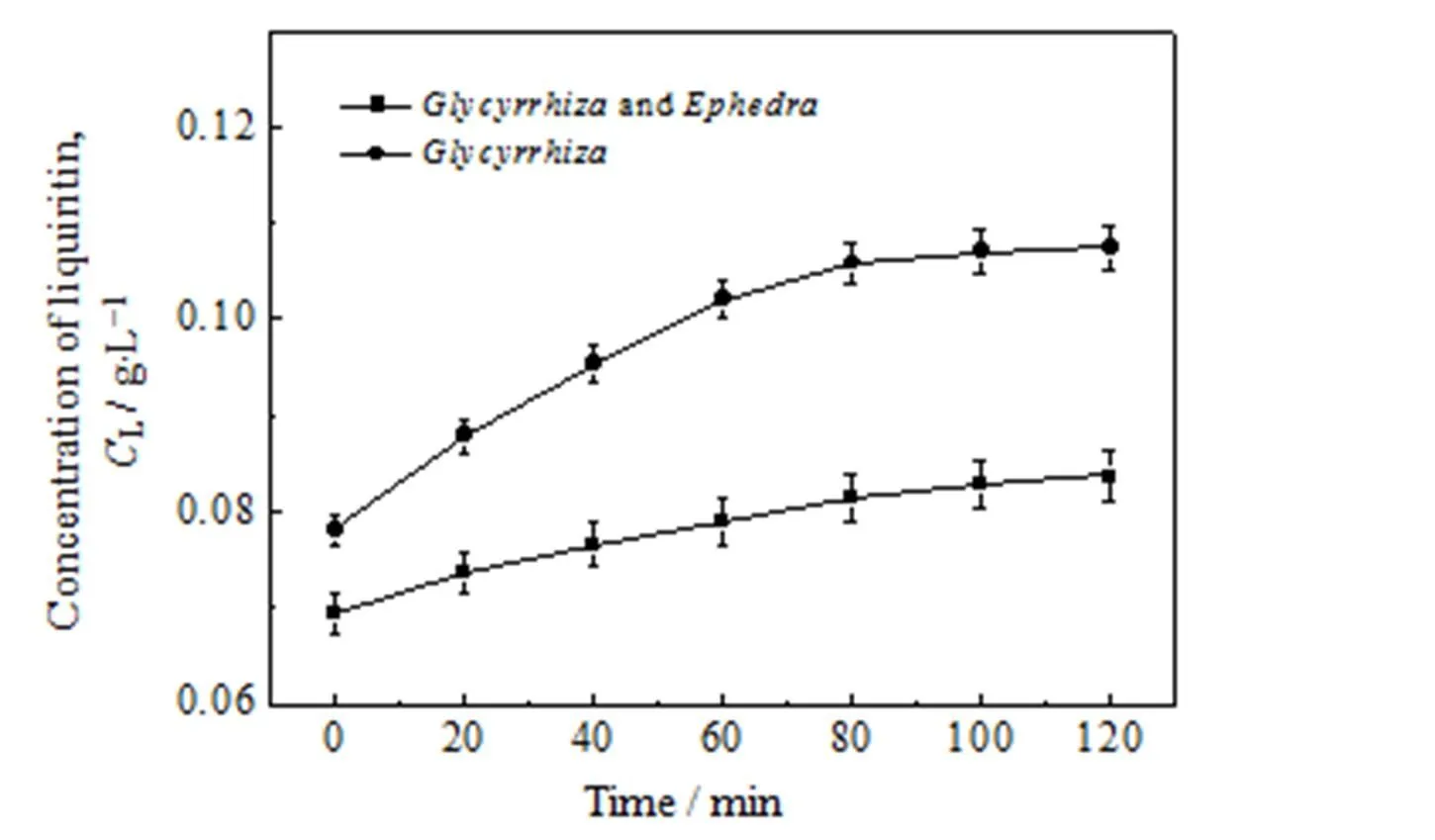
图2 甘草一次单煎与甘草麻黄一次合煎甘草苷浓度随时间的变化
3.2 麻黄对甘草中甘草酸释放的影响
按上述相同实验条件检测甘草酸的浓度,绘制甘草酸随时间变化曲线。麻黄对甘草中甘草酸浓度随时间变化的影响如图 3 所示。
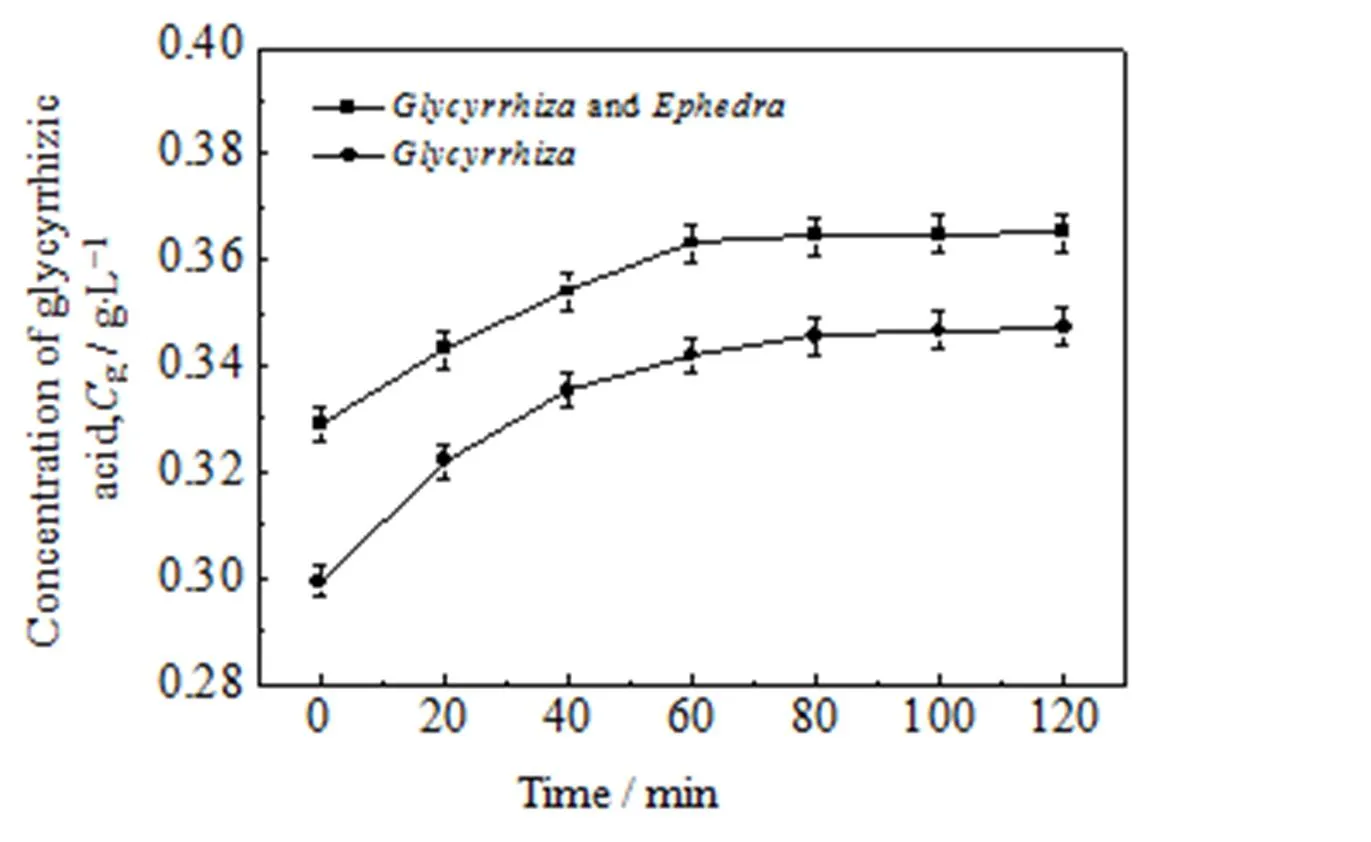
图3 甘草一次单煎与甘草麻黄一次合煎甘草酸浓度随时间的变化
3.3 甘草苷对甘草酸水溶液表面张力、起泡高度和泡沫半衰期的影响
研究不同甘草苷浓度对甘草酸水溶液表面张力的影响,在甘草酸浓度0.3 g×L-1和温度40℃条件下进行,甘草苷浓度分别为0.1、0.2、0.3、0.4、0.5 g×L-1。研究不同甘草苷浓度对甘草酸水溶液起泡高度和泡沫半衰期的影响,在甘草酸浓度0.3 g×L-1、温度40℃和气体体积流量100 mL×min-1条件下进行,甘草苷浓度0.1~0.5 g×L-1。结果如表1所示。

表1 甘草苷对甘草酸水溶液泡沫性能的影响
由表1可知,随着甘草苷浓度的升高,甘草酸水溶液的表面张力逐渐降低,其起泡高度和泡沫半衰期逐渐升高。这是由于随着甘草苷浓度的增加,溶液的粘度也随之增加,从而降低了泡沫的排液速率,提高了泡沫的稳定性,因此,在泡沫分离甘草酸过程中甘草苷可起到稳泡的作用。由此可知,由于甘草麻黄配伍使得提取液中甘草苷的浓度降低,泡沫的稳定性降低,从而强化了泡沫的排液效果。
3.4 温度对泡沫分离效果的影响
提高温度是促进泡沫排液的有效方法[17]。在气体体积流量200 mL×min-1、甘草麻黄质量配比5:3、甘草酸的初始浓度0.3 g×L-1条件下,研究不同温度对泡沫分离效果的影响。温度为30~50℃。结果如图4 所示。

图4 温度对泡沫分离效果的影响
3.5 气体体积流量对泡沫分离效果的影响
气体体积流量会显著影响泡沫分离过程中的界面吸附和泡沫排液[18]。研究不同气体体积流量对泡沫分离效果的影响,在温度40℃、甘草麻黄质量配比5:3、甘草酸的初始浓度0.3 g×L-1条件下进行。气体体积流量50~250 mL×min-1。结果如图5 所示。
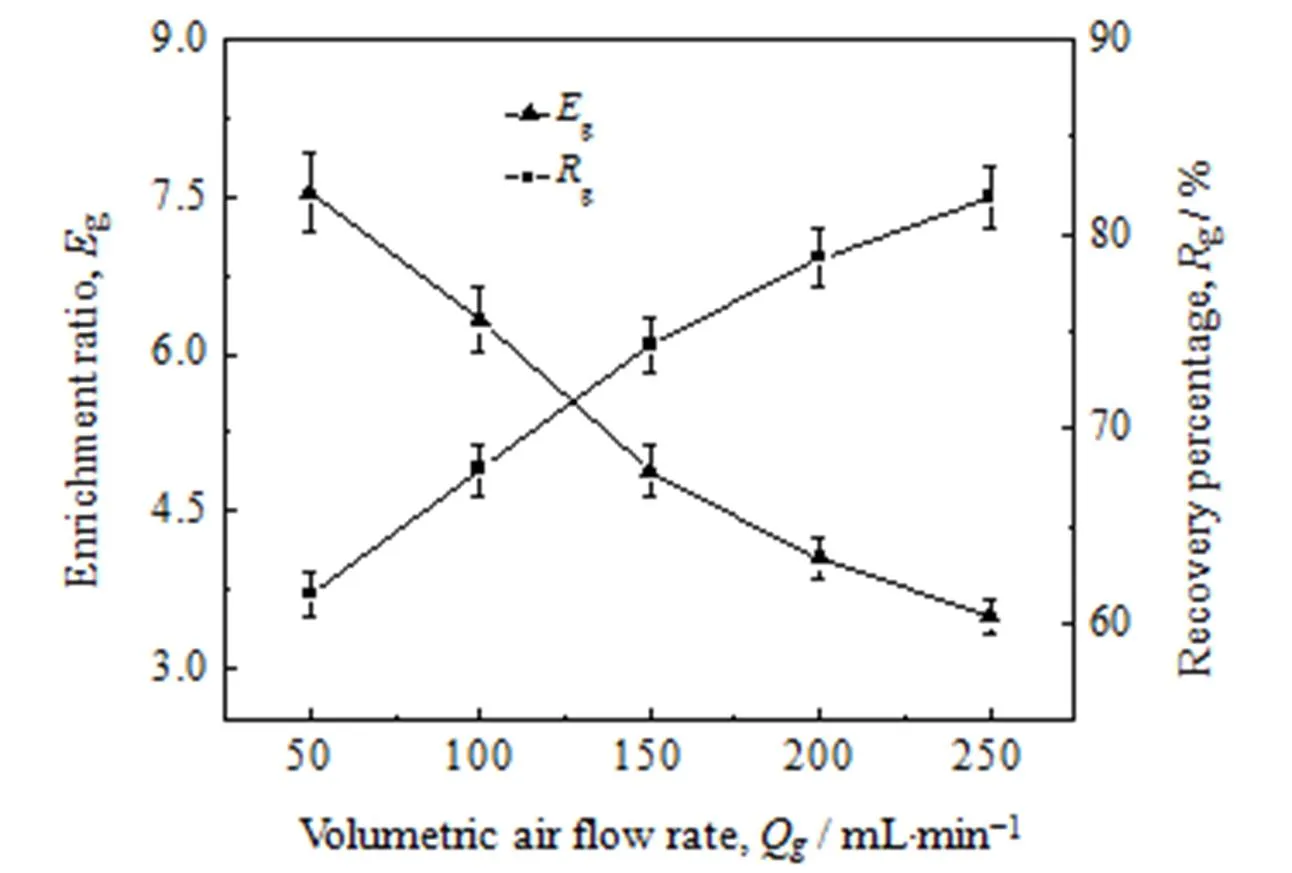
图5 气体体积流量对泡沫分离效果的影响
3.6 甘草麻黄质量配比对泡沫分离效果的影响
在温度40℃、气体体积流量100 mL×min-1、甘草酸的初始浓度0.3 g×L-1条件下,研究不同甘草麻黄质量配比对泡沫分离效果的影响。甘草麻黄质量配比范围为5:1至5:5。结果如图6 所示。
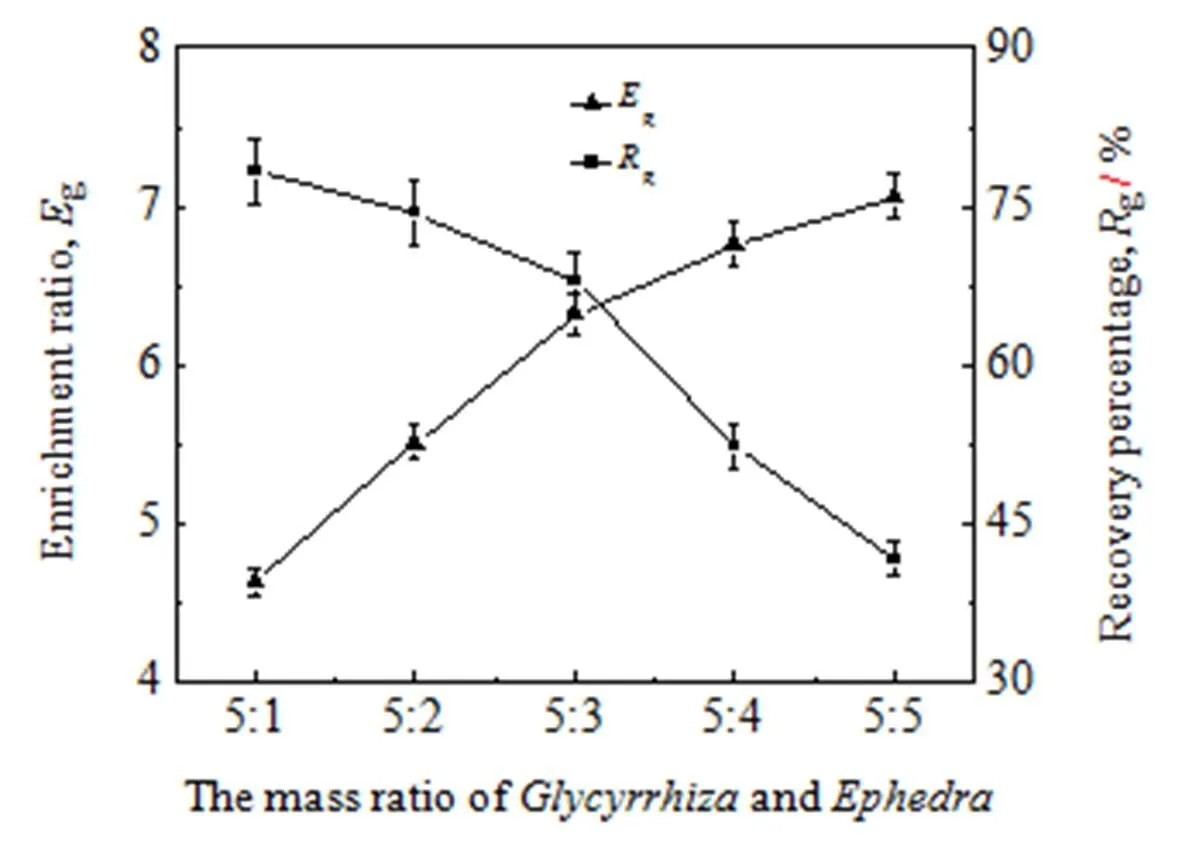
图6 甘草麻黄质量配比对泡沫分离效果的影响

图7 甘草酸初始浓度对泡沫分离效果的影响
3.7 甘草酸初始浓度对泡沫分离效果的影响
原料液浓度是影响泡沫分离性能的重要参数[20]。在温度40℃、气体体积流量100 mL×min-1、甘草麻黄质量配比5:3条件下,研究不同甘草酸初始浓度对泡沫分离效果的影响。甘草酸初始浓度0.1 ~0.5 g×L-1。结果如图7 所示。
图7 结果表明,随着甘草酸初始浓度的增加,泡沫分离甘草酸的富集比由 8.9 降低至 4.1,而其回收率由 53.5% 升高至 79.4%。表面活性物质的初始浓度过低所形成的泡沫不稳定,容易聚集并破碎,致使泡沫夹带液回到主体液相中,从而导致甘草酸的回收率减少;但是泡沫间隙液的减少导致泡沫液膜变薄,收集到的泡沫变干,因此获得的甘草酸的富集比升高。随着溶液初始浓度的增加,溶液的表面张力下降,表面活性物质在气-液界面上的吸附增强,泡沫的稳定性增强,泡沫排液困难,因此,获得的甘草酸回收率升高,但由于泡沫夹带液增多,泡沫液膜变厚,泡沫变湿,最终获得的甘草酸的富集比降低。综合考虑,本研究选择0.2 g×L-1为最适甘草酸初始浓度。
4 结 论
本文开发了甘草麻黄配伍泡沫分离工艺,甘草麻黄配伍提高了甘草酸在浸提液中的浓度,降低浸提液的表面张力,进而提高了浸提液的起泡性能。同时,甘草麻黄配伍降低了甘草酸泡沫的稳定性,能有效降低泡沫的含水量,因而甘草麻黄配伍能有效提高甘草酸的泡沫分离效果。在甘草酸初始浓度 0.2 g×L-1,甘草麻黄质量配比5:3,温度40℃,气体体积流量100 mL×mim-1条件下,甘草酸的富集比和回收率分别为 8.34和 62.5%。而在相同实验条件下,单独泡沫分离甘草中甘草酸的富集比和回收率分别为3.73和59.6%,由此可见,麻黄的引入有效地提高了泡沫分离甘草酸的分离效果。此外,将甘草酸标准品和甘草麻黄配伍泡沫分离甘草酸所得消泡液进行红外光谱分析,结果表明,甘草麻黄配伍泡沫分离得到的甘草酸的纯化程度较高。
符号说明:

A1¾甘草酸标准品溶液吸光值CL¾提取液中甘草苷浓度,g×L-1 A2¾甘草苷标准品溶液吸光值Eg¾甘草酸富集比 C1¾甘草酸标准品溶液浓度,g×L-1R¾相关系数 C2¾甘草苷标准品溶液浓度,g×L-1Rg¾甘草酸回收率,% Cg¾提取液中甘草酸浓度,g×L-1Vgf¾消泡液体积,L Cgf¾消泡液中甘草酸浓度,g×L-1Vg0¾原料液体积,L Cg0¾原料液中甘草酸浓度,g×L-1
参考文献:
[1] Pompei R, Flore O, Marccialis M A,. Glycyrrhizic acid inhibits virus growth and inactivates virus particles [J]. Nature, 1979, 281(5733): 689-690.
[2] Hoever G, Baltina L, Michaelis M,. Antiviral activity of glycyrrhizic acid derivatives against SARS-coronavirus [J]. Journal of Medicinal Chemistry, 2005, 48(4): 1256-1259.
[3] Lin J C. Mechanism of action of glycyrrhizic acid in inhibition of Epstein-Barr virus replication in vitro [J]. Antiviral Research, 2003, 59(1): 41-47.
[4] Lampis G, Deidda D, Pinza M,. Enhancement of anti-herpetic activity of glycyrrhizic acid by physiological proteins [J]. Antiviral Chemistry and Chemotherapy, 2001, 12(2): 125-131.
[5] Crance J M, Scaramozzino N, Jouan A,. Interferon, ribavirin, 6-azauridine and glycyrrhizin: antiviral compounds active against pathogenic flaviviruses [J]. Antiviral Research, 2003, 58(1): 73-79.
[6] Shen S, Chang Z, Liu J,. Separation of glycyrrhizic acid and liquiritin from Glycyrrhiza uralensis Fisch extract by three-liquid-phase extraction systems [J]. Separation and Purification Technology, 2007, 53(3): 216-223.
[7] Tian M, Yan H, Row K H. Extraction of glycyrrhizic acid and glabridin from licorice [J]. International Journal of Molecular Sciences, 2008, 9(4): 571-577.
[8] Fu B, Liu J, Li H,. The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid [J]. Journal of Chromatography A, 2005, 1089(1): 18-24.
[9] Charpe T W, Rathod V K. Separation of glycyrrhizic acid from licorice root extract using macroporous resin [J]. Food and Bioproducts Processing, 2015, 93: 51-57.
[10] ZHANG Zhe (张哲), WU Zhao-liang (吴兆亮), LONG Yan (龙延),. Enhancement of interfacial adsorption of SDS in foam separation columns with vertical sieve tray internal (垂直筛板构件强化SDS在泡沫分离液相吸附的研究) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2015, 29(3): 538-543.
[11] Ma J G, Xiu Z L, Zhang D J,. Concentration and separation of glycyrrhizic acid by foam separation [J]. Journal of Chemical Technology and Biotechnology, 2002, 77(6): 720-724.
[12] LAN Jie (兰洁), YANG Ming (杨明), HAN Li (韩丽),. Comparison between foam fractionation and conventional processing crafts for glycyrrhizic acid inclusion compound (泡沫分离法与常规方法制备甘草酸粗品的比较) [J]. West China Journal of Pharmaceutical Sciences (华西药学杂志), 2002, 22(1): 025-027.
[13] SU Yan-tao (苏艳桃), HAN Li (韩丽), MA Hong-yan (马鸿雁),. Separation of glycyrrhizic acid by intermittence foam fractionation (间歇式泡沫分离提取甘草中甘草酸的工艺研究) [J]. Chinese Traditional and Herbal Drugs (中草药), 2007, 38(3): 365-368.
[14] Blanc P D, Kuschner W G, Katz P P,. Use of herbal products, coffee or black tea, and over-the-counter medications as self-treatments among adults with asthma [J]. Journal of Allergy and Clinical Immunology, 1997, 100(6): 789-791.
[15] ZHAO Jie (赵杰). Basic reseach on the composition rules ofherbal pairs—-herbal pair (I) (麻黄类药对组成规律的基础研究——麻黄-甘草药对(I)) [D]. Guangzhou(广州): Southern Medical University (南方医科大学), 2012.
[16] MENG Xiang-yu (孟翔宇), PI Zi-feng (皮子凤), SONG Feng-rui (宋凤瑞),. Changes in the effective compounds and the anti-inflammatory activity before and after the decoction of ephedra and liquorite (麻黄-甘草药对配伍前后主要药效成分及抗炎活性的变化) [J]. Chinese Journal of Applied Chemistry (应用化学), 2009, 26(7): 801-806.
[17] ZHANG Yan-xia (张艳霞), WU Zhao-liang (吴兆亮), WU Zeng-jiang (武增江),. Effects of temperature on foam stability and separation efficiencies of foam formed by high concentration SDS aqueous solution during foam separation (温度对高浓度SDS水溶液泡沫稳定性及分离的影响) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2012, 26(3): 536-540.
[18] Boonyasuwat S, Chavadej S, Malakul P,. Surfactant recovery from water using a multistage foam fractionator: Part I. Effects of air flow rate, foam height, feed flow rate and number of stages [J]. Separation Science and Technology, 2005, 40(9): 1835-1853.
[19] HUANG Ying-jie (黄英杰). Reseach on the dosage of prescriptions and ralated issues of
[20] Chen Y C, Parlar H. Enrichment behavior of immunoglobulin by foam fractionation using response surface methodology [J]. Separation and Purification Technology, 2013, 107: 102-108.
Study onIntensified Foam Fractionation of Glycyrrhizic Acid
DING Lin-lin, WANG Yan-ji, WU Zhao-liang, LIU Hai-qian, LI Rui, LIU Wei
(School of Chemical Engineering, Hebei University of Technology, Tianjin 300130, China)
In order to improve foam fractionation performance of glycyrrhizic acid from, a novel technology for foam fractionation usingandwas developed and the effect ofon foaming performance of the leaching liquor was studied. The results show thatenhances extraction of glycyrrhizic acid. Furthermore,decreases the concentration of liquiritin in the leaching liquor and thus affects its foaming performance. Enrichment ratio and recovery percentage were used as the evaluation indexes and the effects of temperature, volumetric air flow rate, initial concentration of glycyrrhizic acid and mass ratio ofanda on foam fractionation performance were investigated. The results show that the enrichment ratio and the recovery percentage of glycyrrhizic acid are 8.34 and 62.5%, respectively, when studied under conditions of temperature 40℃, volumetric air flow rate 100 mL×min-1, initial concentration of glycyrrhizic acid 0.2 g×L-1and mass ratio ofanda 5:3.Compared to the technology of foam fractionation with, the method used increases the enrichment ratio by 121.7% and does not significantly reduce the recovery percentage. Therefore, the addition ofeffectively improves the foam fractionation performance of glycyrrhizic acid.
foam fractionation;; glycyrrhizic acid;
1003-9015(2016)05-1053-07
TQ028.8;R284.2
A
10.3969/j.issn.1003-9015.2016.05.010
2016-02-28;
2016-05-13。
国家自然科学基金(21236001);河北省重点基础研究项目(16964002D)。
丁琳琳(1983-),女,河北邢台人,河北工业大学博士生。通讯联系人:吴兆亮,E-mail:zhaoliangwu_hebut@163.com

