卵巢恶性肿瘤风险预测值联合超声检测在女性盆腔良恶性肿瘤诊断中的临床研究
曲波,杜盟盟,刘红,王蓉蓉,马守叶,王海琳*
(1.甘肃省人民医院,甘肃 兰州 730000;2.兰州大学第一临床医学院,甘肃 兰州 730000)
卵巢恶性肿瘤风险预测值联合超声检测在女性盆腔良恶性肿瘤诊断中的临床研究
曲波1,杜盟盟2,刘红2,王蓉蓉2,马守叶2,王海琳1*
(1.甘肃省人民医院,甘肃兰州730000;2.兰州大学第一临床医学院,甘肃兰州730000)
目的探究卵巢恶性肿瘤风险预测(ROMA)值联合超声检测在女性盆腔良恶性肿瘤诊断中的临床应用价值。方法回顾性分析甘肃省人民医院妇科2014年2月至2015年3月298例因盆腔包块住院接受手术的患者资料,收集同期46例在我院健康体检者的血清HE4、CA125值以及彩色多普勒超声结果,计算ROMA值,以术后临床病理诊断为标准,通过比较灵敏度、特异性探讨各指标的临床应用价值。结果(1)卵巢恶性肿瘤组血清HE4、CA125水平和ROMA值均较卵巢良性肿瘤组与健康女性组高,两两比较差异有显著性(P<0.05);血清HE4、CA125水平,ROMA值在卵巢良性肿瘤组与健康女性组间,差异无显著性(P>0.05)。(2)HE4对卵巢恶性肿瘤的特异性最高(97.44%),但其他诊断性能不高,尤其是灵敏度(67.19%)。(3)ROMA诊断特异性、阴性预测值较HE4、CA125高,分别为90.60%、92.98%。(4)彩色多普勒超声诊断符合率较高,达87.58%。(5)ROMA值联合彩色多普勒超声诊断卵巢恶性肿瘤时,灵敏度及阴性预测值明显高于单独检测,分别达84.38%、95.12%。结论ROMA值联合彩色多普勒超声检测可发挥二者优势,提高卵巢恶性肿瘤的检出率,具有临床推广价值。
卵巢恶性肿瘤风险预测值;超声;卵巢恶性肿瘤
卵巢恶性肿瘤早期不易发现,预后不良,病死率高。因此,寻找一种有效的卵巢恶性肿瘤诊断方法迫在眉睫。近期,国内外多项临床分析发现,结合患者绝经状态及血清HE4、CA125值得到的卵巢恶性肿瘤风险预测(risk of ovarian malignancy algorithm,ROMA)值可用于评估女性盆腔包块患者患卵巢恶性肿瘤的风险[1,2]。此外,彩色多普勒超声可明确病变部位,根据所测盆腔包块体积、形状、回声强度、血流信号等判断病变性质,是筛查盆腔良恶性肿瘤的常用方法。本研究通过收集盆腔包块性质待查患者和健康人群血清HE4、CA125水平以及超声报告,以术后病理诊断结果作为评判标准,回顾性分析血清HE4、CA125水平,ROMA值联合超声检测在盆腔良恶性肿瘤诊断中的临床价值。
1 资料与方法
1.1研究对象
选择2014年2月至2015年3月因盆腔包块在甘肃省人民医院妇科住院行手术治疗的患者298例,病理学确诊卵巢恶性肿瘤64例,盆腔良性疾病234例(其中子宫内膜异位症82例、畸胎瘤25例、囊腺瘤或纤维腺瘤40例、囊肿54例、输卵管良性疾病33例)。另收集同期在我院健康体检者46例,作为对照。.
1.2血清HE4、CA125、ROMA检测方法及评价指标
所有纳入者均在空腹状态下采集静脉血,由我院检验科统一检测血清CA125、HE4水平。
参照国内相关判读标准:HE4:40~70 pmol/L,CA125:0~35 U/ml。
应用Fujirebio公司肿瘤标记物风险软件计算绝经前后ROMA值[3],公式如下:
绝经前预测指数:Predictive index(PI)=-12.00+2.38×LN(HE4)+0.062 6×LN(CA125)
绝经后预测指数:Predictive index(PI)=-8.09+1.04×LN(HE4)+0.732 0×LN(CA125)
ROMA index=Exp(PI)÷[1+Exp(PI)]×100%
LN代表自然对数,Exp代表指数函数。将自然绝经时间≥1年定义为绝经后状态,其余为未绝经状态。根据Fujirebio公司肿瘤标记物风险软件说明判断,ROMA的截断值绝经前≥7.4%为高风险,绝经后≥25.3%为高风险。
1.3超声检查方法及评价指标
我院采用GE_LOGIQE9彩色多普勒超声诊断仪,探头频率3.0~5.5 MHZ,经腹或经阴道常规探查,结果判断参考Timmerman[4]提出的标准,见表1。

表1 卵巢良恶性肿瘤超声诊断标准
以术后病理诊断结果作为金标准将患者分为卵巢恶性肿瘤组、卵巢良性肿瘤组、健康女性组。计算各种检测方法在盆腔良恶性肿瘤诊断中的灵敏度(Se)、特异性(Sp)、阳性预测值(PPV)、阴性预测值(NPV)和诊断符合率(DAR),并评价ROMA值联合超声检测在临床中的实用价值。
1.4统计学方法
应用SPSS 22.0统计软件对数据进行分析处理,因所采集数据呈偏态分布,故用中位数及四分位数表示,同一指标两组间比较采用Wilcoxon秩和检验,多组间比较用非参数Kruskal-Wallis秩和检验,率的比较采用χ2检验,P<0.05表示差异有显著性。
2 结果
2.1血清HE4、CA125水平及ROMA值
经非参数Kruskal-Wallis秩和检验,3组血清HE4、CA125水平与ROMA值差异有显著性(χ2=65.274、82.009、74.567,P=0.000<0.05)。以非参数Mann-Whitney U检验进行两两比较,卵巢恶性肿瘤组HE4、CA125水平与ROMA值中位数分别为133.50 pmol/ml、243.21 U/ml、77.85%,与卵巢良性肿瘤组和健康女性组相比,明显偏高,差异具有显著性(P=0.000<0.05)。卵巢良性肿瘤组与健康女性组血清HE4、CA125水平,ROMA值比较,差异无显著性(P>0.05),见表2。
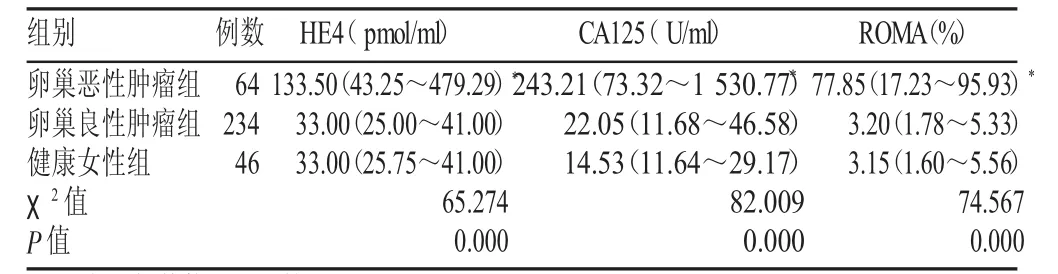
表2 3组血清HE4、CA125水平及ROMA值比较
2.2HE4、CA125、ROMA及超声检测在盆腔良恶性肿瘤中的表达与诊断性能(见表3~5)
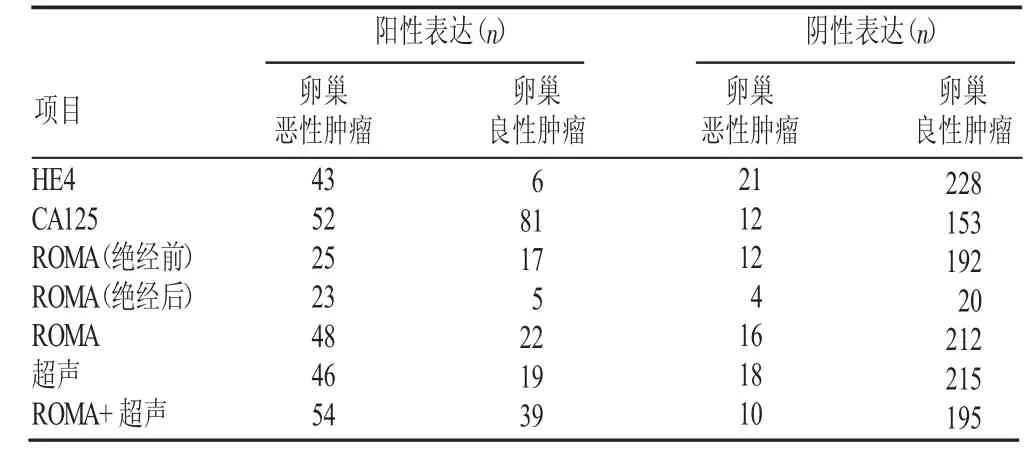
表3 HE4、CA125、ROMA及超声检测在盆腔良恶性肿瘤中的表达
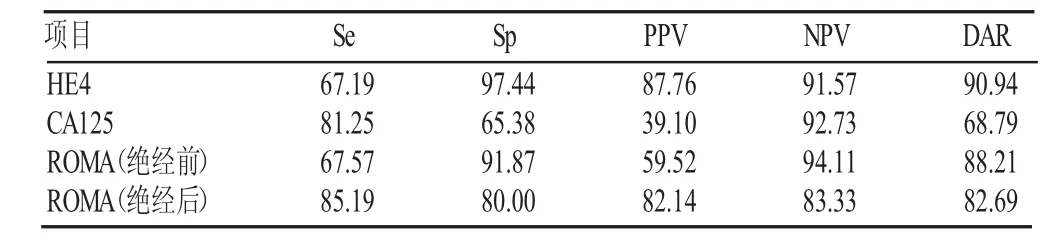
表4 HE4、CA125、ROMA对卵巢恶性肿瘤的诊断性能(%)

表5 ROMA、超声单独及联合检测对卵巢恶性肿瘤的诊断性能(%)
根据表4、5结果可得出,HE4在检测卵巢恶性肿瘤时特异性最高,达97.44%,CA125则具有较高的阴性预测值(92.73%)。ROMA的诊断性能与患者绝经状态有关,绝经前后ROMA的诊断性能明显不同。ROMA值联合超声检测较单项检测在灵敏度、阴性预测值方面均明显提高。
3 讨论
目前,卵巢恶性肿瘤致死率位于妇科恶性肿瘤之首,因在疾病早期缺乏有效筛查手段,导致检出率低,晚期广泛盆腹腔侵润转移,治疗效果差。然而,卵巢恶性肿瘤的预后很大程度上取决于临床诊断分期,相关数据显示[5,6],临床病理分期为Ⅰ、Ⅱ期的卵巢恶性肿瘤患者5年生存率可达90%,Ⅲ、Ⅳ期患者的5年生存率显著降低。
3.1HE4、CA125单独检测的不足之处及ROMA值联合超声检测的可行性
目前,血清HE4、CA125检测,已常规应用于盆腔包块患者临床筛查。但相关研究表明,CA125对卵巢恶性肿瘤缺乏特异性,在肺部疾病、乳癌、胰腺癌、胃癌时,均会出现不同程度的升高,且在卵巢良性肿瘤及正常卵巢表皮中亦有所增加,这使CA125在妇科恶性肿瘤诊断中具有特异性低、敏感性差的缺点[7,8]。HE4由国外学者Kirchhoff在人附睾远端上皮细胞中发现[9],通过cDNA微阵列研究发现其对应的mRNA在卵巢恶性肿瘤中高表达,在正常组织及卵巢良性肿瘤中低表达或不表达[10]。后续研究进一步证明HE4作为卵巢恶性肿瘤标记物,具有明显优势。但鉴于女性生理的特殊性,处于绝经状态是否会影响血清HE4水平有待进一步证实。
随着统计技术的发展与成熟,复杂的数学模型被应用于临床,使得利用多种标记物同时检测一种疾病成为可能。关于卵巢恶性肿瘤筛查及诊断的数学模型也相应诞生。Moore等[3]结合患者绝经状态以及血清HE4、CA125水平,运用公式计算RO-MA值,获得较为理想的效果。研究结果表明,其在诊断灵敏度、特异性方面明显优于单独及联合应用肿瘤标记物检测,较为成功的预测了盆腔包块患者中恶性肿瘤高风险者。但血清肿瘤标记物检测也有不足之处,如缺乏病变定位能力及难以了解疾病转移情况。
3.2彩色多普勒超声对卵巢肿瘤判读的局限性
彩色多普勒超声可连贯、动态地观察脏器,立体显示病灶,探查病灶血供、测定血流阻力指数,为发现卵巢恶性肿瘤的可靠手段。Timmerman等[4]在2008年提出的关于彩色多普勒超声诊断盆腔良恶性肿瘤的标准,为超声标准化诊断提供了依据。但超声诊断也存在局限性,如易受器材、个人主观因素等影响。Rehn等[11]认为,经腹超声探查盆腔恶性肿瘤,特别是诊断浆液性卵巢癌,准确率较CT高,但也存在不足之处,如成像质量受较多因素限制、对于结果的判读易受主观因素影响等。
3.3ROMA值与超声联合检测在女性良恶性肿瘤诊断中的优势
ROMA值与超声联合检测可达到优势互补,弥补二者的不足之处[12]。本研究结果表明:(1)卵巢恶性肿瘤组血清HE4、CA125水平与ROMA值均较卵巢良性肿瘤组和健康女性组高,两两比较差异有显著性(P均=0.000<0.05);血清HE4、CA125水平与ROMA值在卵巢良性肿瘤组与健康女性组间,差异无显著性(P>0.05),见表2。(2)从表4可看出,HE4对卵巢恶性肿瘤的特异性最高,达97.44%,但其他诊断性能不高,尤其是灵敏度,只有67.19%,这与沈宇欢[13]的研究结果一致。ROMA的诊断性能与患者绝经状态关系密切,不同绝经状态下ROMA诊断性能不同,这与Chudecka-Glaz[14]的研究结论相符。(3)ROMA对卵巢恶性肿瘤的特异性、阴性预测值较HE4、CA125高,分别达90.60%、92.98%。因此可认为,结合患者绝经状态以及ROMA值可提高HE4、CA125对盆腔良恶性肿瘤的诊断性能,帮助临床医师更加精准地评估患者卵巢恶性肿瘤患病风险,进而选择最适宜的治疗方案,具有较高的临床实用价值。(4)彩色多普勒超声对盆腔良恶性肿瘤的诊断符合率较高,达87.58%。(5)根据表5结果可知,ROMA值联合超声检测在诊断卵巢恶性肿瘤时,灵敏度及阴性预测值明显高于二者单独检测,特异性、阴性预测值分别达83.33%、95.12%,进一步说明多项联合检测比单项检测更具优势。本研究受人员及时间等限制,纳入的样本较少,未对不同临床分期及组织病理类型的卵巢恶性肿瘤血清HE4、CA125水平,ROMA值以及超声诊断结果做进一步统计学分析。
综上所述,肿瘤标记物因其操作简单、创伤小、灵敏度高、特异性强等特点,已成为卵巢恶性肿瘤早期筛查的理想工具,但单个肿瘤标记物检测很容易导致误判或漏诊。结合患者绝经状态及其血清HE4、CA125水平,通过Fujirebio公司肿瘤标记物风险软件计算ROMA值可明显提高卵巢恶性肿瘤的诊断阳性率。采用影像学方法——彩色多普勒超声,不仅能够确定肿瘤部位以及有无邻近脏器侵润,而且可通过回声强弱以及血流信号较为准确地判断肿瘤良恶性。我们认为,ROMA值联合超声检测可发挥二者优势,提高卵巢恶性肿瘤的诊断阳性率,具有临床推广价值。
[1]Moore R G,McMeekin D S,Brown A K,et al.A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass[J].Gynecol Oncol,2009,112(1):40-46.
[2]陈燕,林莺莺,郑瑜宏,等.血清HE4、CA125和ROMA指数评估卵巢癌风险性的初步评价[J].中国免疫学杂志,2013,29(2):168-174.
[3]Moore R G,Jabre-Raughley M,Brown A K,et al.Comparison of a novel multiple marker assay vs the Risk of Malignancy Index for the prediction of epithelial ovarian cancer in patients with a pelvic mass[J].Am J Obstet Gynecol,2010,203(3):226-228.
[4]Timmerman D,Testa A C,Bourne T,et al.Simple ultrasound-based rules for the diagnosis of ovarian cancer[J].Ultrasound Obstet Gynecol,2008,31(6):681-690.
[5]Goff B A,Mandel L S,Melancon C H,et al.Frequency of symptoms of ovarian cancer in women presenting to primary care clinics[J].JAMA,2004,291(22):2705-2712.
[6]Zhang Z,Bast R C Jr,Yu Y,et al.Three biomarkers identified from serum proteomic analysis for the detection of early stage ovarian cancer[J]. Cancer Res,2004,64(16):5882-5890.
[7]Havrilesky L J,Whitehead C M,Rubatt J M,et al.Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence[J].Gynecol Oncol,2008,110(3):374-382.
[8]Zhong W,Yu Z,Zhan J,et al.Association of serum levels of CEA,CA199,CA125,CYFRA21-1 and CA72-4 and disease characteristics in colorectal cancer[J].Pathol Oncol Res,2015,21(1):83-95.
[9]Kirchhoff C,Habben I,Ivell R,et al.A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors[J].Biol Reprod,1991,45(2):350-357.
[10]Schummer M,Ng W V,Bumgarner R E,et al.Comparative hybridization of an array of 21,500 ovarian cDNAs for the discovery of genes overexpressed in ovarian carcinomas[J].Gene,1999,238(2):375-385
[11]Rehn M,Perel P,Blackhall K,et al.Prognostic models for the early care of trauma patients:a systematic review[J].Scand J Trauma Resusc E-merg Med,2011(20):17.
[12]高淳.影像学联合肿瘤标志物对卵巢癌诊断的研究进展[J].医学综述,2014,20(5):894-896.
[13]沈宇欢.ROMA在女性盆腔包块良恶性鉴别诊断的前瞻性研究[D].杭州:浙江大学,2014.
[14]Chudecka-Glaz A M.ROMA,an algorithm for ovarian cancer[J].Clin Chim Acta,2015(440):143-151.
(*通讯作者:王海琳)
R737.3
B
1671-1246(2016)03-0148-03

