人参稀有皂苷Compound K混合胶束的处方优化及体外评价
钱 薇,于兆慧,朱云泽(.江苏省扬州五台山医院药械科,江苏扬州 5003;.南京中医药大学药学院,南京 003)
人参稀有皂苷Compound K混合胶束的处方优化及体外评价
钱薇1*,于兆慧2,朱云泽1(1.江苏省扬州五台山医院药械科,江苏扬州225003;2.南京中医药大学药学院,南京210023)
目的:优化人参稀有皂苷Compound K(CK)混合胶束的处方,考察其体外释放度和表观渗透系数(Papp)。方法:以大豆磷脂和维生素E聚乙二醇1000琥珀酸酯(TPGS)为辅料,采用溶剂挥发法制备CK混合胶束。以载药量、包封率、粒径为指标,采用正交试验优化投药量、大豆磷脂-TPGS比例、水化体积。考察最优处方所制胶束的形态、粒径、载药量、包封率、溶解度、体外释放度和在结肠腺癌Caco-2细胞模型中的Papp。结果:CK混合胶束的最优处方投药量为1.0 mg,大豆磷脂-TPGS比例为1∶1,水化体积为10 ml。所制混合胶束呈球形或类球形,平均粒径为(110±2.69)nm,载药量为(4.32±0.19)%,包封率为(92.23±2.76)%,溶解度为(469.21±0.024)μg/ml,150 h时累积释放度为(66.19±0.027)%(n=3)。CK原料药和CK混合胶束的Papp分别为26.20、3.78(n=6)。结论:优化的制备工艺可行,成功制得CK混合胶束。
人参稀有皂苷Compound K;混合胶束;正交试验;处方优化;结肠腺癌Caco-2细胞
人参稀有皂苷Compound K(CK)是天然人参二醇组皂苷在体内的主要代谢产物,是人参皂苷在体内发挥作用的成分[1-2]。由于其具有特殊的抗肿瘤活性[3-4],所以具有极高的药用价值。然而,CK在人参药材中的含量极低,且溶解性极差、外排性较大、生物利用度低[5-9]。
胶束作为药物载体,具有提高药物溶解度和安全性、降低毒副作用、增强药物疗效等优点[10-14]。维生素E聚乙二醇1000琥珀酸酯(TPGS)是维生素E琥珀酸酯(VES)的羧基与聚乙二醇(PEG)酯化而成的水溶性衍生物,其分子质量约为1 513,亲水亲油平衡值约为13~17。由于TPGS具有两亲性和良好的亲水性,因此常被用作亲脂性物质的非离子型表面活性剂。TPGS已载入《美国药典》,且在美国也已有以TPGS为辅料上市的药品,如安普那韦(AgeneraseTM)口服液和胶囊[15]。此外,已有研究报道,TPGS也可应用于脂质体、胶束、前体药物以及共聚物载体以提高制剂的溶解度、渗透性及稳定性[16-18],促进药物吸收。大豆卵磷脂是由疏水基脂肪酸链和亲水基磷酸及胆碱组成的两亲性表面活性剂,具有一系列胶体性质和明显的乳化性[19]。本研究以TPGS和大豆卵磷脂为联合载体制备了CK混合胶束,采用正交试验优化了处方工艺,并考察其体外性质。
1 材料
1.1仪器
Agilent 1260系列高效液相色谱(HPLC)仪、液质联用(LC-MS)系统(美国Agilent公司);Zetasizer-Nano-2S型激光粒度分析仪(英国Malvern公司);旋转蒸发仪(南京炳辉仪器仪表有限公司);JEM-1200EX型透射电镜(日本Jeol公司);RS-80型智能释放试验仪器(天津大学无线电厂);TGL-16G型离心机(上海安亭科学仪器厂)。
1.2药品与试剂
CK(南京中医药大学自制,批号:20141209,纯度:>90%);大豆卵磷脂(上海太伟药业有限公司,批号:20140701);人参皂苷Rg3(中国食品药品检定研究院,批号:11084-200603,纯度:>98%);DMEM培养基(南京凯基生物科技发展有限公司);TPGS(批号:101241196)、Hank’s平衡盐(HBSS)粉末(美国Sigma公司);0.5%聚山梨酯80(上海紫一试剂厂,批号:20120907);甲醇为色谱纯,水为高纯水,其余试剂均为分析纯。
1.3细胞
结肠腺癌Caco-2细胞,由美国休斯顿大学药学院药理和药物科学系Ming Hu博士馈赠。
2 方法
2.1CK混合胶束的制备及优化
2.1.1混合胶束的制备采用溶剂挥发法制备CK混合胶束。精密称取一定量的药物和大豆卵磷脂加入到装有10 ml无水乙醇的旋转蒸发瓶中,常压50下40 r/min旋转1 h;然后向其中加入一定量的表面活性剂TPGS,在相同条件下反应1 h;随后在减压条件下旋转蒸发除去反应溶剂,在旋转蒸发瓶底部形成一层透明薄膜;再向其中加入一定量预热的双蒸水,以100 r/min水化一段时间;经0.45 μm微孔滤膜过滤,得澄清乳蓝色的载药胶溶液,部分溶液冷冻干燥,得CK混合胶束的冻干粉。
2.1.2处方工艺的优化在单因素试验的基础上,固定药辅比为1∶20的情况下,选择投料量(A,mg)、大豆卵磷脂-TPGS的质量比(B)、水化体积(C,ml)作为考察因素,采用L9(34)正交表进行试验,以载药量(w1)、包封率(w2)、粒径大小(d)为指标对处方进行优化。根据各个指标对CK混合胶束的影响程度,确定其权重分别为0.4、0.4、0.2,计算综合评分(Z)=(w1i/ w1max×0.4+w2i/w2max×0.4-di/dmax×0.2)×100,式中w1i为载药量,w2i为包封率,d为平均粒径大小,w1max为最大载药量,w2max为最大包封率,dmax为最大平均粒径。
2.1.3验证试验分别精密称取10.0 mg CK,3份,分别按最优处方工艺制备3批样品,测定其载药量、包封率、粒径。
2.2CK混合胶束体外性质考察
2.2.1形态考察与粒径测定将CK混合胶束经适当稀释后,取一滴胶束溶液至铜网上(覆有硝基纤维素),自然晾干后滴加2%磷钨酸染色,用滤纸吸取多余的液体,放置10 min,自然干燥,使粒子在铜网上浓缩沉积,用透射电镜观察并拍照。另取CK混合胶束溶液适量,利用马尔文粒径测定仪测定混合胶束的粒径。
2.2.2载药量和包封率的测定采用HPLC法测定CK混合胶束中CK的含量。色谱柱:Zorbax SB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(0~8 min,40%A;8~35 min,64.3%A;35~45 min,40%A);流速:1.0 ml/min;检测波长:203 nm;柱温:30;进样量:20 μl。以质量浓度(c)为横坐标、峰面积(A)为纵坐标,进行线性回归。按相关方法操作,考察方法回收率、日内和日间精密度。由于CK的水溶性很差,所以未包封的药物主要是以颗粒形式存在于制得的胶束溶液中,离心过滤即可除去,游离在水中的CK的量可以忽略不计,因此离心过滤得到的胶束溶液(滤液部分)中的药物即为包封的药物量。将CK混合胶束溶液用乙醇稀释,离心过滤后的滤液用乙醇稀释,测定包封的药量。按公式计算包封率(%)=(mM/mF)×100%;载药量(%)=[mM/(mP+mM)]×100%,其中,mM为胶束包封的药量,mP为辅料的质量,mF为开始时CK的投料量。
2.2.3溶解度的测定取过量的CK混合胶束冷冻干燥粉分散于2 ml的蒸馏水中,置于37的气浴恒温振荡器中,以转速40 r/min振荡24 h,直至达到溶解平衡。将该溶液以13 000 r/min(离心半径12 cm)离心15 min,然后0.45 μm的微孔滤膜过滤,测定滤液中CK的含量,计算溶解度。每个试验平行3次。
2.2.4释放度考察采用浆法,转速为100 r/min,温度为(37± 0.5),溶出介质为经过超声脱气的pH 6.8的模拟肠液900 ml,加入0.5%的聚山梨酯80,将2 ml的CK混合胶束或CK原料药加入到透析袋中,将透析袋置于溶出杯中进行体外释放试验。CK混合胶束的取样时间分别为1、2、4、8、12、24、48、60、72、96、120、150 h,CK原料药的取样时间分别为1、2、4、8、12、24、48、60、72 h,取样量为2 ml,同时补加等体积的新鲜溶出介质。样品液过0.45 μm的微孔滤膜过滤,测定CK的含量,计算累积释放度,绘制释药曲线。每个试验平行3次。
2.2.5体外Caco-2细胞模型吸收特性评价试验前首先用37预热无菌的HBSS溶液(pH 7.4)洗涤Caco-2细胞单层3次,测定跨膜电阻,弃去跨膜电阻值不符合要求的。再加入预热的HBSS溶液,于37摇床中孵育1 h,吸弃HBSS溶液。对于药物从Caco-2细胞绒毛面Apical(A)侧到基底面Basolateral(B)侧的转运:将药物溶液2.9 ml加到A侧作为供给池,同时B侧加入空白HBSS溶液(pH=7.4)2.5 ml作为接收池;对于药物从B侧到A侧的转运:将药物溶液2.9 ml加到B侧作为供给池,空白HBSS溶液2.5 ml加到A侧作为接收池。把加好药物溶液和空白HBSS溶液的Transwell培养板,置于转速为50 r/ min的37恒温摇床中,分别在0、1、2、3、4 h吸取供给池溶液和接收池溶液各400 μl,同时补足相应的溶液。测定电阻和CK的含量,计算CK透过Caco-2细胞单层的表观渗透系数(Papp)=(dQ/dt)/SC,式中dQ/dt为接收池药物出现的速率,S为膜面积(4.2 cm2),C为药物的初始浓度。Papp值越大,通透率越高[9]。每个试验平行3次。
3 结果
3.1处方优化
因素与水平见表1,正交试验设计与结果见表2,方差分析结果见表3。

表1 因素与水平Tab 1 Factors and levels
由表2结果表明,各因素对CK混合胶束的制备影响顺序依次为A>C>B。由表3结果表明,A和C对CK混合胶束的制备有显著影响(P<0.01)。综合考虑,CK混合胶束的最优处方工艺为A3B2C1,即投料量为2.0 mg,大豆卵磷脂-TPGS的质量比为2∶1,水化体积为10ml。
3.2处方工艺验证
按“3.1”项最优处方制备3批样品。结果3批样品的平均粒径为(110±2.69)nm,平均包封率为(92.23±2.76)%,平均载药量为(4.32±0.19)%(n=3),见表4。
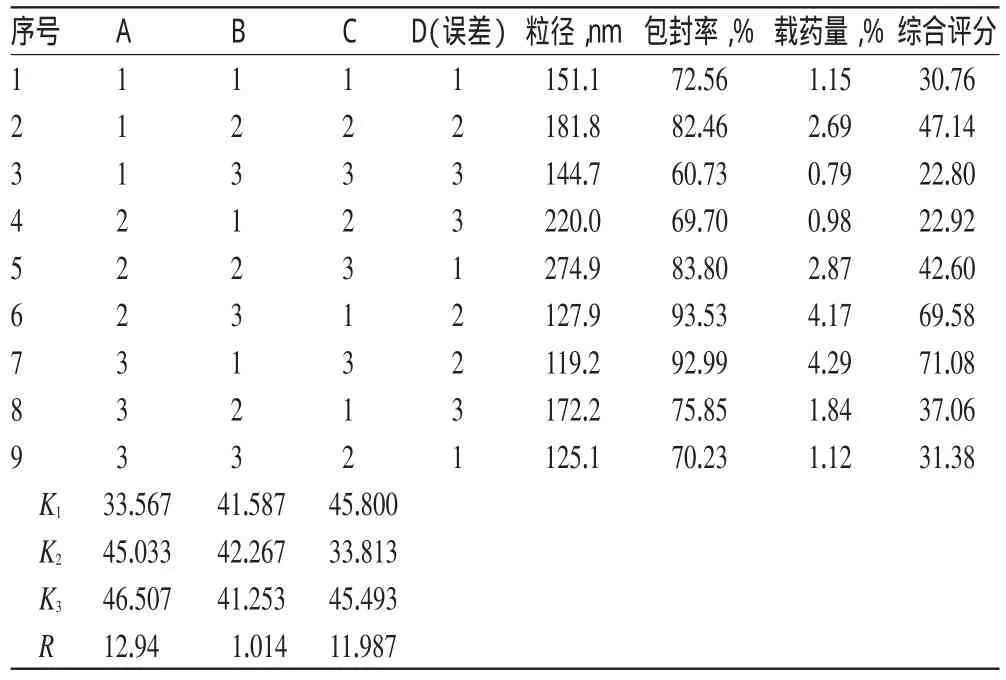
表2 正交试验设计与结果Tab 2 Design and results of orthogonal test
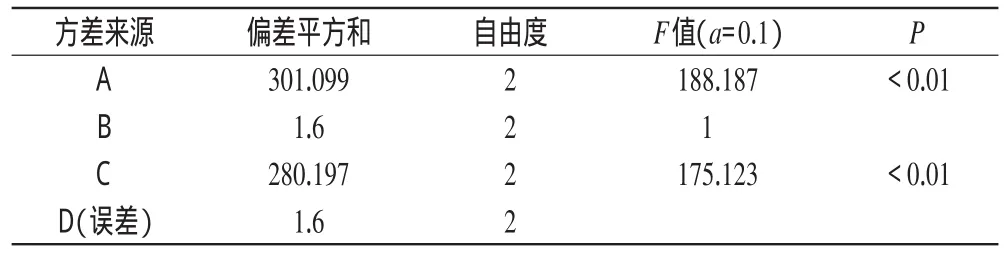
表3 方差分析结果Tab 3 Results of variance analysis

表4 验证试验结果Tab 4 Results of validation test
3.3CK混合胶束的形态和粒径
CK混合胶束的微粒子呈规则的球形或类球形,推测可能是大豆卵磷脂与TPGS共同作用形成外围结构将疏水药物CK包裹其中,混合胶束的粒径分布为31~1 000 nm。CK混合胶束的透射电镜图见图1,粒度分布图见图2。

图1 CK混合胶束的透射电镜图Fig 1 TEM image of CK mixed micelles
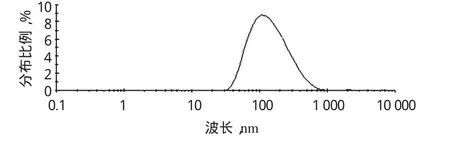
图2 CK混合胶束的粒径分布图Fig 2 Particle size distribution of CK mixed micelles
3.4CK混合胶束的溶解度
CK含量测定的回归方程为A=3.0408c+3.624(r2=0.9993);方法回收率为102.67%,日内、日间RSD均小于0.21%(n=5),符合含量的测定要求。CK混合胶束、CK原料药中CK的溶解度分别为468.69、469.21、469.72,35.21、35.17、35.24 μg/ml,平均值分别为(469.21±0.024)、(35.21±0.010)μg/ml,表明与CK原料药比较,CK混合胶束的溶解度大大增加,可能与TPGS与大豆卵磷脂及药物之间复杂的相互作用有关。
3.5CK混合胶束的体外释放度
CK原料药和CK混合胶束的体外释放曲线见图3。
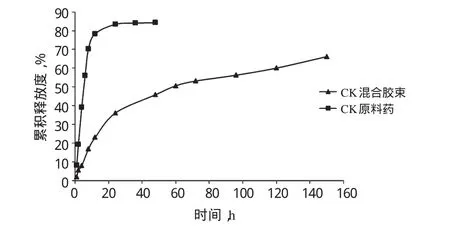
图3 CK原料药和CK混合胶束的体外释放曲线Fig 3 Drug release profiles of CK crude drug and CK mixed micelles in vitro
由图3可知,CK原料药在模拟肠液中释放的速度更快,而CK混合胶束释放的速度比较稳定。CK原料药12 h时的累积释放度就超过了70%,而CK混合胶束150 h时的累积释放度仅(66.19±0.027)%。结果表明,CK混合胶束具有一个特定的、在体外释放的缓释效应,可能是由于CK的高亲和力和胶束的疏水结构,使其从胶束粒子中低效释放。
3.6Caco-2细胞转运试验结果
试验前后Caco-2细胞的电阻未发生明显变化,测得各细胞样品溶液中跨膜电阻值RSD均小于5%(n=3),表明原料药和辅料均不影响Caco-2细胞的完整性。计算给药4 h时CK混合胶束对Caco-2细胞转运的影响,结果见表5。

表5 CK原料药和CK混合胶束的细胞渗透性能(n=3)Tab 5 Cell permeability of CK and CK mixed micelles(n=3)
由表5显示,与CK原料药比较,CK混合胶束从A→B的Papp显著增大(P<0.05),从B→A的Papp显著降低(P<0.05),外排比率(PappB→A/PappA→B)显著降低(P<0.05)。可知,CK混合胶束能有效提高CK的吸收并在很大程度上抑制了其外排。
4 讨论
混合胶束是疏水性药物输送的理想剂型,其具有芯-壳结构,难溶药物可以在胶束的疏水内芯内溶解。因此,胶束是一种可以提高难溶性药物疗效的有效途径。磷脂是两性化合物和细胞膜的一个重要组成部分,维持着细胞膜的流动性使药物更容易吸收;并且CK的C—OH可与磷脂形成氢键和TPGS的疏水性链段能聚合在核心,从而使亲脂性药物在生物介质中可形成有着疏水核心和亲水界面的水溶性胶束。TPGS是一种非离子型表面活性剂,具有较好的亲水性;与此同时,其作为一种天然的P-gP抑制剂,对于存在显著P-gP外排的药物,具有抑制外排的作用。对于本研究以TPGS和大豆卵磷脂为联合载体的人参稀有皂苷CK混合胶束而言,载体TPGS有效抑制P-gP外排、大豆卵磷脂较好的生物相容性及药物的芯-壳结构等几方面的共同作用,使CK的溶出得到了有效改善,促进了其吸收。
本研究采用溶剂挥发法联合使用辅料TPGS和大豆卵磷脂成功制备了CK混合胶束,大大提高了CK的最大溶解度,比CK原料药的溶解度增加了12倍;并且制备得到的混合胶束粒径小、均匀,可推测该胶束稳定易于吸收。在保持较好的包封率和载药量的情况下,原料药的细胞渗透性也显著增加,且能够缓慢地释放药物。因此混合胶束可以作为未来开发CK制剂的一个新的剂型,且本研究可以为CK口服制剂的开发提供一定的数据支撑。
[1]Qi LW,Wang CZ,Yuan CS.Isolation and analysis of ginseng:advances and challenges[J].Nat Prod Rep,2011,28(3):467.
[2]Kang JH,Song KH,Woo JK,et al.Ginsenoside Rp1 from panax ginseng exhibits anti-cancer activity by downregulation of the IGF-1R/akt pathway in breast cancer cells[J].Plant Foods for Human Nutrition,2011,66(3):298.
[3]Qi L,Wang C,Yuan C.Ginsenosides from American ginseng:chemical and pharmacological diversity[J].Phytochemistry,2011,72(8):689.
[4]Kim E,Wanderi C,Choi C,et al.Abstract 1009:cytotoxic effect of ginsenosides C-K and PPD on glioblastoma cells through cell cycle arrest and down-regulation of cell adhesion proteins[J].Cancer Research,2015,75(15 Supplement):1009.
[5]Park J.Anti-inflammatory mechanism of ginseng saponins in activated microglia[J].Journal of Neuroimmunology,2009,209(1/2):40.
[6]Kim JS.Development and validation of an LC-MS/MS method for determination of compound K in human plasma and clinical application[J].Journal of Ginseng Research,2013,37(1):135.
[7]Cuong TT.Glucocorticoid receptor agonist compound K regulates dectin-1-dependent inflammatory signaling through inhibition of reactive oxygen species[J].Life Sciences,2009,85(17/18):625.
[8]Yoo M.Production of aglycon protopanaxadiol via compound K by a thermostable β-glycosidase from Pyrococcus furiosus[J].Applied Microbiology and Biotechnology,2011,89(4):1019.
[9]Gao YL.Subchronic toxicity studies with ginsenoside compound K delivered to dogs via intravenous administration [J].Food and Chemical Toxicology,2011,49(8):1857.
[10]Tan BJ,Liu Y,Chang KL,et al.Perorally active nanomicellar formulation of quercetin in the treatment of lung cancer[J].International Journal of Nanomedicine,2012,7(9):651.
[11]Tan YN.Lecithin in mixed micelles attenuates the cytotoxicity of bile salts in Caco-2 cells[J].Toxicology in Vitro,2013,27(2):714.
[12]Craparo EF.Phospholipid-polyaspartamide micelles for pulmonary delivery of corticosteroids[J].International Journal of Pharmaceutics,2011,406(1/2):135.
[13]姚东刚,孙考祥,慕宏杰,等.环孢素mPEG-PLGA嵌段共聚物胶束的制备及大鼠药动学研究[J].药学学报,2009,44(12):1410.
[14]何典鸿,韩立炜,王媛,等.以胆盐/磷脂混合胶束制备技术提高葛根素溶解度的研究[J].中国中药杂志,2010,35(11):1395.
[15] 杜广盛,李德馨,魏振平.聚乙二醇1000维生素E琥珀酸酯在纳米制剂中的应用进展[J].沈阳药科大学学报,2012,29(12):981.
[16] 金鑫,张振海,陈玲玲,等.维生素E聚乙二醇1000琥珀酸酯对Caco-2细胞模型转运宝藿苷Ⅰ的影响[J].中草药,2011,42(12):2474.
[17]Zhang Z,Tan S,Feng S.Vitamin E TPGS as a molecular biomaterial for drug delivery[J].Biomaterials,2012,33(19):4889.
[18] 郑楠楠,吴琳华,唐景玲,等.聚乙二醇维生素E琥珀酸酯在药剂学中的应用进展[J].中国药学杂志,2014,49(16):1373.
[19]闫军,贾献慧,唐文照.丹皮酚脂质体的制备及质量控制方法研究[J].中国药房,2010,21(35):3299.
(编辑:邹丽娟)
Formulation Optimization and in vitro Evaluation of Rare Ginsenoside Compound K Mixed Micelles
QIAN Wei1,YU Zhaohui2,ZHU Yunze1(1.Dept.of Pharmacy and Medical Equipment,Yangzhou Wutaishan Hospital of Jiangsu Province,Jiangsu Yangzhou 225003,China;2.College of Pharmacy,Nanjing University of TCM,Nanjing 210023,China)
OBJECTIVE:To optimize the formulation of rare ginsenoside Compound K(CK)mixed micelle,and to investigate its in vitro release and apparent permeability coefficients(Papp).METHODS:Using soy lecithin and vitamin E polyethylene glycol 1 000 succinate(TPGS)as excipients,CK mixed micelle was prepared by solvent evaporation method.Using drug-loading amount,encapsulation efficiency and particle size as index,orthogonal test was adopted to optimize feeding amount,the ratio of granulesten to TPGS and hydration volume;the micelle prepared by optimal formulation was investigated in respects of form,particle size,drug-loading amount,encapsulation efficiency,solubility,in vitro release;Pappof colon adenocarcinoma Caco-2 cell model was also inspected.RESULTS:The optimal formulation was as follows as feeding amount 1.0 mg,the ratio of granulesten to TPGS 1∶1,hydration volume 10 ml.The mixed micelles were spherical or spheroidal;the average particle size was(110±2.69)nm,and drug-loading amount was(4.32±0.19)%,entrapment efficiency was(92.23±2.76)%,and average solubility was(469.21±0.024)μg/ml;150 h accumulative release rate was(66.19±0.027)%(n=3).Pappof CK crude drug and CK mixed micelle were 26.20 and 3.78(n=6).CONCLUSIONS:The optimized preparation technology is feasible,and CK mixed micelle is prepared successfully.
Rare ginsenoside Compound K;Mixed micelles;Orthogonal test;Formulation optimization;Colon adenocarcinoma Caco-2 cell
R943
A
1001-0408(2016)28-3988-04
10.6039/j.issn.1001-0408.2016.28.31
*药师。研究方向:人参稀有皂苷。电话:0514-87207259。E-mail:yuzhaohui0415@126.com
(2015-12-20
2016-03-29)

