人参醇提后药渣中人参酸性多糖的分离纯化工艺研究Δ
王贵金,杜红娜,乔 莉,毕 丹,贾继明(河北以岭医药研究院有限公司,石家庄 050035)
·制剂与工艺·
人参醇提后药渣中人参酸性多糖的分离纯化工艺研究Δ
王贵金*,杜红娜,乔莉,毕丹,贾继明#(河北以岭医药研究院有限公司,石家庄050035)
目的:以人参醇提后的药渣制备的喷雾粉为原料,优化人参酸性多糖的分离、纯化等工艺。方法:采用以D-半乳糖醛酸为对照品计的人参酸性多糖量等为指标,优化树脂分离纯化、脱盐、干燥等制备工艺中的方法及条件,并进行小试和中试工艺验证。结果:采用D900型阴离子交换树脂分离纯化人参酸性多糖,上样量为7.2 mg/g(多糖粗品/干树脂),径高比为1∶7;先用水再用0.3 mol/L的NaCl溶液以2倍柱体积(BV)/h的流速洗脱5 BV;超滤法脱盐,截留分子质量为1 kD;选择喷雾干燥方法制备人参酸性多糖粉末。小试验证试验中产品纯度为94.7%,中试验证试验中各指标的RSD≤2.42%(n=3)。结论:优化所得人参酸性多糖的分离、纯化工艺稳定可靠、简便易行,适合于工业化生产,且产品纯度较高。
人参;酸性多糖;D-半乳糖醛酸;分离;纯化;制备工艺
人参(Panax ginseng C.A.Mey)是我国的名贵中药,具有多种药效。《神农本草经》将人参列为上品,言其具有“主补五脏,安精神,定魂魄,止惊悸,明目,开心益智,久服有轻身延年之功效”。因此,人参的各种有效成分及其药理活性一直是国内外学者研究的热点,尤其是对人参皂苷的研究[1-3]。近年来研究发现,人参多糖中的人参果胶是人参中的另一种有效成分,其表现出多种生物活性,如增强机体免疫能力、辅助防治肿瘤、显著抑制肝损伤和降血糖等[4-6]。人参多糖是由糖醛酸及各种中性糖组成的酸性杂多糖,研究表明,糖醛酸本身或含有糖醛酸结构单元的低聚糖或多糖常表现出十分重要的生物活性[7-8]。
为了充分利用人参资源,笔者利用醇提后的人参药渣为原料,通过醇沉、酶解、脱色、树脂吸附、盐析和脱盐等方法,分离纯化出人参酸性多糖,并以D-半乳糖醛酸含量代替传统的葡萄糖含量为特征性指标对各工艺条件进行筛选,以得到纯度更高的人参酸性多糖。
1 材料
1.1仪器
Cary60型紫外-可见分光光度计(美国安捷伦科技公司);XP105DR型十万分之一电子天平(瑞士梅特勒-托利多仪器公司);YC-1800型实验室低温喷雾干燥机(上海雅程仪器设备有限公司);DD6M型离心机(湖南湘立离心机厂);超滤系统(美国PALL公司)。
1.2药材、药品与试剂
人参醇提后药渣经水提制成的喷雾粉(自制,人参多糖含量:>10%);D-半乳糖醛酸对照品(中国食品药品检定研究院,批号:111646-200301,供含量测定用);淀粉酶(邢台万达生物有限公司,批号:20150901,活性:2 000 U/g);活性炭(溧阳南山活性炭有限公司);AB-8和D101型大孔吸附树脂、D201型阴离子交换树脂、聚酰胺吸附树脂、JK008型阳离子交换树脂和D900型阴离子交换树脂(沧州宝恩吸附材料有限公司);四硼酸钠和间羟联苯(美国Sigma公司);水为蒸馏水,其他试剂均为分析纯。
2 方法与结果
2.1人参多糖粗品的制备
称取人参醇提后药渣经水提制备的喷雾粉100 g,加入20倍量的水充分溶解[9-10],经离心(4 000 r/min,15 min,离心半径20 cm,下同)去沉淀,上清液经减压浓缩,加入乙醇,使醇体积分数为60%[11]。醇沉过夜,离心,沉淀经60%乙醇洗脱2次后用水充分溶解,加入0.25%的中温淀粉酶,65酶解30 min。加入1%的多糖专用大孔径活性炭,脱色40 min,离心,去除活性炭。上清液经微孔滤膜过滤,滤液减压浓缩,加入乙醇,使醇体积分数为60%,醇沉过夜,离心。沉淀经60%乙醇洗脱2次,沉淀挥尽乙醇,得人参多糖粗品10g。
2.2间羟联苯法测定D-半乳糖醛酸方法的建立[12]
2.2.1对照品溶液的制备精密称取D-半乳糖醛酸15.54 mg,加水溶解并定容至100 ml量瓶中,制备成155.4 μg/ml的对照品溶液。
2.2.2线性关系考察精密量取D-半乳糖醛酸对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 ml于具塞试管中,加水至1.0 ml,在冰浴中预冷后加入12.5 mmol/L四硼酸钠硫酸溶液6 ml,摇匀,在沸水浴中煮沸10 min。取出以冰浴冷却至室温,分别加入0.15%间羟联苯溶液80 μl,摇匀,超声5 min,室温放置10 min。以1.0 ml水同上操作制得空白对照,于525 nm波长处测定吸光度(A)。以D-半乳糖醛酸质量浓度(c)为横坐标、A值为纵坐标进行线性回归,得回归方程A=0.013 4c+0.008 5(r=0.999 8),表明D-半乳糖醛酸检测质量浓度线性范围为15.54~54.39μg/ml。
2.2.3精密度考察精密称取同一份供试品溶液,吸取1.0 ml按“2.2.2”项下方法操作测定其吸光度,重复6次。结果RSD=0.16%(n=6)。
2.2.4加样回收率试验精密称取已知含量的人参多糖粗品3份,分别精密加入不同量的D-半乳糖醛酸,相应稀释过滤后制备成供试品溶液。按照“2.2.2”项下方法操作测定吸光度,代入回归方程,计算得平均回收率为100.41%(RSD=0.79%,n=3)。
2.3样品的树脂纯化工艺
2.3.1树脂的预处理 (1)阴离子交换树脂:用水浸泡24 h,再水洗至澄清,倾去水后加1 mol/L HCl溶液浸泡24 h,水洗至中性,最后加入1 mol/L NaOH溶液浸泡24 h,并用水洗至中性。(2)阳离子交换树脂:用水浸泡24 h,再水洗至澄清,倾去水后加1 mol/L NaOH溶液浸泡24 h,水洗至中性,加入1 mol/L HCl溶液浸泡24 h,用水洗至中性。(3)大孔吸附树脂和聚酰胺吸附树脂:95%乙醇浸泡24 h,并以95%乙醇洗至加等量的水无气泡产生,然后再水洗至无醇味。
2.3.2酸性多糖的树脂纯化工艺的确定 (1)树脂型号的筛选。精密称取多糖粗品0.4 g至200 ml量瓶中,加水稀释至刻度,制成质量浓度为2.0 mg/ml的多糖溶液。分别精密称取经预处理的6种干树脂约5.0 g,置于250 ml具塞锥形瓶中。分别精密加入2.0 mg/ml(c0)的多糖溶液25 ml,33下恒温振荡12 h,待树脂充分吸附后过滤,测定吸附残液中多糖质量浓度(c)。按下列公式计算各树脂的多糖吸附量q(mg/g)及多糖吸附率E(%):q=(c0-c)V/m;E=(c0-c)/c0×100%。式中:V为溶液体积(ml),m为加入树脂的质量(g)。6种树脂对多糖的静态吸附试验结果显示,D900型阴离子交换树脂对多糖的吸附能力高于其他树脂,以下试验均采用此树脂进行。不同类型树脂吸附多糖的结果具体详见表1。

表1 不同类型树脂吸附多糖的结果Tab 1 The results of adsorption of ginseng polysaccharides by different types of resins
(2)动态吸附试验。精密称取经预处理的树脂5.0 g,湿法装柱,将2.0 mg/ml的多糖粗品溶液由滴液漏斗向柱中滴流,控制流速为2 ml/min。每隔2 min收集过柱液并测定多糖质量浓度,以流出液质量浓度为上样液质量浓度的10%来确定泄漏点,随即停止上样。根据测试的多糖质量浓度,以A值为纵坐标,以收集多糖溶液累积体积量(ml)为横坐标,绘制树脂对多糖粗品溶液的动态吸附穿透曲线,确定上样量。结果显示,当上样量达18 ml时,流出液质量浓度为上样液质量浓度的10%。确定多糖粗品溶液上样量为≤18 ml,即上样量≤36 mg,即每1g树脂上样量≤7.2mg人参多糖粗品。
(3)洗脱剂的选择。精密称取经预处理的树脂约5.0 g,共6份,置于250 ml具塞锥形瓶中。分别加入25 ml 2.0 mg/ml的多糖粗品溶液,33下恒温振荡12 h后过滤,测定吸附残液中多糖含量,计算吸附量。在上述已知吸附量的6份树脂中,分别加入40 ml水以及0.1、0.2、0.3、0.5、1 mol/L NaCl溶液各40 ml进行洗脱,33下恒温振荡24 h。分别测定洗脱液中多糖含量,筛选出解吸率最高的洗脱剂。计算解吸率(D,%)=c×V/Q× 100%,c为解吸溶液中多糖的含量,V为解吸溶液的体积,Q为多糖的吸附量。结果,解吸率依次为0.96%、20.16%、60.32%、80.69%、75.34%、73.42%,表明随着NaCl浓度的增加,多糖的解吸率呈不断上升的趋势;0.3 mol/L NaCl溶液达到最高,之后随着NaCl浓度的继续增加,解析率略有下降。据此结果,且为了后期除盐方便,洗脱时可以先用水洗脱,再选择0.3 mol/L NaCl溶液为洗脱剂。
(4)洗脱剂用量的确定。精密称取经预处理的树脂5.0 g,湿法装柱,将2.0 mg/ml的多糖粗品溶液由滴液漏斗向柱中滴流,控制流速为2 ml/min,上样18 ml,静置12 h。以0.3 mol/L NaCl溶液洗脱,控制流速为2 ml/min,每3 min收集1次过柱液并测定多糖质量浓度,共收集42 ml。根据测得的多糖质量浓度,绘制树脂对多糖的动态解吸曲线,确定洗脱剂用量。结果显示,采用0.3 mol/L NaCl溶液进行解吸时,洗脱峰集中、对称,无明显拖尾现象。30 ml的体积基本上可以将多糖完全洗脱下来,约为5倍柱体积(BV),故确定洗脱剂用量为5BV。
(5)洗脱体积流量的确定。取树脂5.0 g湿法装柱,按动态吸附试验方法,取多糖粗品溶液18 ml上样,分别控制洗脱体积流量为1、1.5、2、2.5、3 BV/h,并用5 BV的0.3 mol/L NaCl溶液进行洗脱,绘制不同洗脱体积流量下多糖量的曲线。结果表明,随着洗脱体积流量的增大,树脂对人参多糖的吸附量减少,这可能是因为洗脱体积流量过大,NaCl与多糖分子之间未发生足够的接触而使离子交换不完全所致。因此,从是否洗脱彻底、节省时间及大生产的可行性等方面进行考虑,选择洗脱体积流量为2BV/h。洗脱体积流量-多糖量曲线见图1。
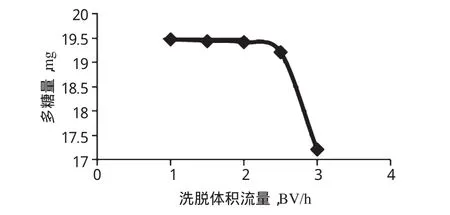
图1 洗脱体积流量-多糖量曲线Fig 1 Elution volume flow-polysaccharide content curve
(6)径高比的确定。取不同量的树脂,用直径为15 mm的玻璃色谱柱装柱,使径高比分别为1∶5、1∶7、1∶9,按最大上样量(每1 g树脂上样量≤7.2 mg多糖粗品)精密吸取多糖粗品溶液,以2 BV/h的体积流量过树脂,分别用3 BV的水洗脱,再用5 BV的0.3 mol/L NaCl溶液洗脱,收集洗脱液,测定多糖量,结果见表2。

表2 采用不同径高比条件下多糖量测定结果(mg)Tab 2 Polysaccharide contents in case of different diameter to height ratios(mg)
由表2可知,随着径高比的增加,树脂对多糖的吸附呈增加趋势。综合考虑多糖的吸附率及工业生产的可行性,选择树脂径高比为1∶7。
综上,酸性多糖的树脂纯化工艺为采用D900型阴离子树脂,流速为2 BV/h,径高比为1∶7,上样量≤7.2 mg/g(多糖粗品/树脂);先用水洗脱,再用0.3 mol/L NaCl溶液洗脱,洗脱体积为5BV。
2.4盐析方法的确定
取上述洗脱液,60减压浓缩至溶液变浑浊为止,浑浊液至冰箱中冷藏过夜,离心,收集沉淀,加入纯化水,加热使沉淀溶解至澄清。
2.5脱盐方法的确定
2.5.1脱盐方法的选择对上述盐析后的溶液,选择透析法与超滤法进行脱盐,以脱盐后的溶液经硝酸银溶液检测未见浑浊为终点。结果两种方法除盐效果均良好,考虑到大生产时透析法无法实现,故选择超滤法脱盐。
2.5.2超滤法脱盐截留分子质量的选择取5份盐析后的样品,每份含酸性多糖900 mg,分别选择截留分子质量为1、3、5、10、30 kD的不同超滤膜包进行脱盐。超滤洗脱溶剂为超纯水,超滤时的压力为进口2.5 bar、回流口1.8 bar,蠕动泵的转速为10 r/min,期间不断补充洗脱溶剂。检测溶剂为10%硝酸银溶液,超滤脱盐的终点为母液和流出液加入硝酸银溶液后均无浑浊发生。溶液回收并定容,分别测定不同溶液中酸性多糖量并计算纯度和酸性多糖损失率(P,%)=(M0-M)/M0× 100%,其中M0为超滤前样品中酸性多糖量(900 mg),M为超滤后酸性多糖量,结果见表3。

表3 不同截留分子质量超滤条件对酸性多糖量的影响Tab 3 Effects of acidic polysaccharide contents on ultra-filtration by different molecular weight cut-off
从表3可知,采用截留分子质量为3、5、10、30 kD的超滤膜包脱盐后酸性多糖的损失比较多,产品纯度也偏低,故将超滤截留分子质量选择为1kD。
2.6干燥方式的确立
综合比较减压干燥、冷冻干燥、喷雾干燥这3种方式的效果。结果,减压干燥后样品复溶性较差,冷冻干燥和喷雾干燥后样品复溶效果相近、颜色也比较接近。为了节能和工业化生产需要,故选择喷雾干燥为样品的干燥方式。
2.7小试工艺验证试验
按上述试验确定的方案,取树脂约400 g装柱(260 mm× 50 mm),按照阴离子交换树脂预处理方法处理备用。取多糖粗品3 g(相当于原喷雾粉30 g),溶于300 ml纯化水后上树脂柱,收集过柱液,控制洗脱体积流量为2 BV/h,然后用3 BV的水洗脱。合并过柱液和水洗液,定容后留样(水洗留样液),最后用5 BV、0.3 mol/L的NaCl溶液洗脱,控制洗脱体积流量为2 BV/h,收集洗脱液,得到酸性多糖的NaCl洗脱液。经盐析法纯化和超滤法除盐,最后喷雾干燥得酸性多糖粉末1.8 g。测定醇提药渣喷雾粉、多糖粗品、水洗留样液、酸性多糖粉末中酸性多糖量和纯度,计算转移率和出膏率:转移率=(M-M0)/ M0×100%,式中M为多糖粗品、水洗留样液、酸性多糖粉末中酸性多糖量,M0为药渣喷雾粉中酸性多糖量;出膏率=G/G0× 100%,其中G为多糖粗品、酸性多糖粉末的固形物量,G0为药渣喷雾粉的投料量,结果见表4。

表4 小试工艺验证试验结果Tab 4 The results of the lab-scale test
2.8中试工艺验证试验
按“2.7”项的试验方案,称取人参醇提后药渣经水提制备的喷雾粉3份各1 kg,按照多糖粗品制备工艺得多糖粗品110 g,经树脂纯化、盐析、除盐、喷雾干燥得酸性多糖粉末61、64、63 g。测定3批中试样品制备过程中醇提药渣喷雾粉、多糖粗品和干燥后酸性多糖粉末中酸性多糖的含量和纯度,以及转移率和出膏率,结果见表5。

表5 中试工艺验证试验结果(%%)Tab 5 The results of the pilot-scale test(%%)
由表5可知,将优化后的制备工艺进行放大试验,3批产品中各指标的RSD≤2.42%(n=3),且所得酸性多糖的纯度和转移率与小试试验结果相符,说明该工艺稳定可靠,可用于工业化大生产。
3 讨论
人参作为我国珍贵的植物资源虽被广泛使用,但在工业上多数都是将醇提后的人参皂苷用于制剂生产,而醇提后的药渣则被遗弃。本课题本着“变废为宝”的理念,以人参醇提后的药渣为原料对人参酸性多糖的制备工艺进行了研究。
在选择工艺中的脱色剂时,笔者首次使用多糖专用的大孔径活性炭,结果其对多糖溶液脱色作用明显;选择的D900型阴离子交换树脂可实现人参中中性多糖和酸性多糖的有效分离;脱盐采用超滤法代替传统使用的透析法,不仅可节约时间,而且适合产业化生产。
本工艺制备的人参酸性多糖,其纯度以D-半乳糖醛酸计,采用间羟联苯法测定结果在90%以上,而目前报道的人参多糖纯度以D-半乳糖醛酸计最高的仅达到了55%以上[13];而人参多糖纯度达到90%以上的都是以葡萄糖计采用苯酚-浓硫酸法测定计算而得的,但以葡萄糖计其中包含了较大比例的人参中性多糖,故并不全是酸性多糖的量。因此,本工艺采用以D-半乳糖醛酸计含量为评价指标,优化工艺所制备的产品中以人参酸性多糖为主要成分,其纯度也更高。
[1] 倪维华.人参多糖免疫活性及抗肿瘤作用[D].吉林:东北师范大学,2010:5.
[2]高文芹,贾力,赵余庆.人参的抗癌作用及其机制研究进展[J].药物评价研究,2011,34(1):53.
[3] 李建平,何轩,姜蓉,等.人参多糖对K562细胞基因表达谱的影响[J].中草药,2011,42(5):940.
[4]杨武韬.人参的化学成分和药理研究进展[J].中国医药指南,2014,12(3):33.
[5]宋利华,王红梅,萧伟.人参多糖的分级及其免疫活性初探[J].中国实验方剂学杂志,2012,18(14):162.
[6]李珊珊,金银萍,姚春林,等.人参多糖的结构与活性研究进展[J].中国中药杂志,2014,39(24):4709.
[7]Cheng H,Li S,Fan Y,et al.Comparative studies of the antiproliferative effects of ginseng polysaccharides on HT-29 human colon cancer cells[J].Med Oncol,2011,28(1):175.
[8]齐滨,刘莉,赵大庆,等.人参、西洋参和红参中糖类含量的比较研究[J].中国药房,2013,24(7):616.
[9]兰树敏,陶遵威.一种人参多糖提取工艺,中国:101323-873B[P].2011-08-10.
[10]宋利华,萧伟,鹿丽丽,等.正交试验优选人参多糖的提取工艺[J].中草药,2012,43(2):283.
[11]朱梅,毕宏涛,杨威,等.乙醇浓度对人参多糖分离的影响[J].东北师大学报:自然科学版,2009,41(2):154.
[12] 陈巧巧,万琴,王振中,等.人参多糖中糖醛酸含量测定方法的建立[J].中国实验方剂学杂志,2012,18(8):121.
[13] 俞丹,马龙,赵军,等.琐琐葡萄多糖中糖醛酸含量的测定[J].新疆医科大学学报,2009,32(5):533.
(编辑:刘萍)
Study on Separation and Purification Technology of Ginseng Acidic Polysaccharides in the Residue after Ethanol Extraction from Panax ginseng
WANG Guijin,DU Hongna,QIAO Li,BI Dan,JIA Jiming(Hebei Yiling Medicine Research Institute Co.,Ltd.,Shijiazhuang 050035,China)
OBJECTIVE:To optimize the separation and purification technology of ginseng acidic polysaccharides,with the spray powder made of the residue after ethanol extraction from Panax ginseng as the raw material.METHODS:Taking the content of ginseng acidic polysaccharides,which was calculated with D-galacturonic acid as the reference substance,as the index,the method and condition in the preparation technology including resin separation and purification,desalination and drying were optimized,and the lab-scale test and pilot-scale test were conducted for verification.RESULTS:The D900 anion resin was used to purify and separate ginseng acidic polysaccharides,where elution was made successively with water and 0.3 mol/L NaCl solution at a flow rate of 2 BV/h,with a sample amount of 7.2 mg/g(crude polysaccharide/dry resin),a diameter to height ratio of 1∶7 and an elution volume of 5 BV.The ultrafiltration method was used for desalination,where molecular weight cut-off was 1 kD.Spray drying was chosen for the preparation of ginseng acidic polysaccharides powder,the purity of which was 94.7%in the lab-scale test. In the pilot-scale test,the RSDs of all indexes were lower than or equal to 2.42%(n=3).CONCLUSIONS:The optimized separation and purification technology of ginseng acidic polysaccharides is stable,reliable,simple,easy,and it is suitable for industrialized production of high-purity products.
Panax ginseng;Acidic polysaccharides;D-galacturonic acid;Separation;Purification;Preparation technology
R285;R284.2
A
1001-0408(2016)28-3957-04
10.6039/j.issn.1001-0408.2016.28.21
国家重点基础研究发展计划(973计划)资助项目(No.2012CB518600)
*工程师,硕士。研究方向:新药开发。电话:0311-66703003。E-mail:guijinwang@126.com
正高级工程师,博士。研究方向:新药开发。E-mail:jiajiming@yiling.cn
(2016-01-08
2016-03-18)

