人脐带血CD34+细胞诱导小鼠缺血肢体血管生成
陈作观,刁永鹏,吴志远,闫 盛,李拥军
中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
·论 著·
人脐带血CD34+细胞诱导小鼠缺血肢体血管生成
陈作观,刁永鹏,吴志远,闫 盛,李拥军
中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
目的 观察体外增殖的人脐带血CD34+细胞对缺血肢体血管生成的影响,探讨CD34+细胞与血管生成的关系。方法 采集人脐血细胞并进行CD34+细胞的提取、培养。建立小鼠左后肢缺血模型并随机分为CD34+细胞增殖组(n=5)、CD34+细胞组(n=5)和空白对照组(n=5)3组。采用DiI标记CD34+细胞示踪显像和抗人核抗原抗体(HNA)免疫组织化学方法评估人CD34+细胞向缺血区域的迁移能力,肢体温度、CD31免疫组织化学方法和转化生长因子β1(TGF-β1)m RNA表达评估缺血肢体血流改善情况。结果 DiI标记示踪及HNA显色可见扩增的CD34+细胞出现在小鼠缺血下肢的肌肉组织中并分布在血管周围。注射液体后第14天(t=5.421,P=0.001;t=0.616,P=0.000)和第28天(t=10.780,P=0.000;t=12.123,P=0.000),CD34+细胞增殖组和CD34+细胞组的温度改变百分比均明显高于对照组。注射液体后第28天,CD34+细胞增殖组和CD34+细胞组毛细血管密度分别为592.3±24.6(t=26.386,P=0.000)和530.7±25.5(t=21.502,P=0.000),均明显高于对照组的219.7±19.9;CD34+细胞增殖组和CD34+细胞组的TGF-β1mRNA表达量分别为(0.578±0.050)(t=12.376,P=0.000)和(0.504±0.080)copies(t=7.098,P=0.000),均明显高于对照组的(0.224±0.040)copies。结论 体外培养的人脐带血CD34+细胞能向缺血区富集并诱导血管生成,促进血流复通,有望成为治疗下肢缺血的有效途径。
血管生成;CD34+细胞;脐带血干细胞;肢体缺血;动物实验
ActaAcadMedSin,2016,38(5):491-496
随着中国人口迅速老龄化,外周动脉性疾病(peripheral arteries disease,PAD)普遍增多[1]。PAD增加了心肌梗死、缺血性脑卒中发生率,并可导致功能障碍,影响生活质量[2]。尽管新药物、支架和搭桥技术迅猛发展,但对于治疗PAD合并慢性基础疾病的临床效果并不令人满意,重度下肢缺血患者截肢率和院内死亡率仍然较高[3]。因此人们开始寻求新的治疗方式,研究生长因子及干细胞促进血管生成的临床价值。
早期多种心肌缺血动物模型研究表明,高CD34+表达的内皮祖细胞能够向缺血区富集并促进新生血管形成,这种富集作用在某种程度上相当于向心肌梗死缺血区域直接注射该细胞[4]。2005年,Yoshioka等[5]在猴子模型中证实CD34+细胞能改善缺血区域的血流量。2006年,Kawamoto等[6]在小鼠模型中证实CD34+能提高缺血肢体的毛细血管密度。2007年,Zhang等[7]在猪模型中证实CD34+细胞能改善缺血心肌的心脏功能。2013年,Yip等[8]在鼠下肢缺血模型中证实CD34+的内皮祖细胞(CD34+)能参与血管生成并促进下肢血流的恢复。Tepekoylu等[9]研究证实,干细胞治疗对缺血性心脏病和下肢疾病都是可行的。此外,Lara-Hernandez等[10]开展了一项纳入28位严重下肢缺血患者的临床研究,结果显示CD34+内皮祖细胞植入能够提高组织灌注量并降低截肢率。因此,通过干细胞移植促进血管再生方式对缺血性疾病治疗具有巨大前景,而脐带间充质干细胞可以作为基于细胞的生物治疗的理想选择。
早期研究表明,当扩增的CD34+细胞被移植到亚致死照射的NOD/SCID老鼠体内,这些细胞可转移至骨髓中并分化成CD19+B细胞、CD33+髓样细胞、CD34+干/祖细胞、CD14+单核细胞和CD42+巨核细胞系,且扩增的细胞具有长期移植的潜能[11]。此外,当在NOD/SCID老鼠皮下植入附有扩增的脐带血CD34+细胞的多孔聚合板,可以发现CD34+在聚合板中启动了新生血管的形成[12]。本研究采用一种新的无血清体外培养脐带血细胞(umbilical cord blood,UCB)的方法,扩增后的细胞群以高量表达CD34+为特征并含有更多的原始干/祖细胞,观察了体外增殖的人脐带血CD34+细胞对缺血肢体血管生成的影响,探讨了CD34+细胞与血管生成的关系。
材料和方法
实验动物及分组 雌性ICR 小鼠15 只(北京维通利华实验动物技术有限公司),SPF 级,6 周龄,体质量25~30 g。按随机数字表法分为CD34+细胞增殖组、CD34+细胞组和空白对照组,每组5只。标准饲料分笼饲养,自由饮食,室温(22±2) ℃,相对湿度50%~ 70%,12 h 光照交替(光照:8:00~20:00;黑暗:20:00~次日8:00)。实验动物许可证号:SCXK (京) 2009- 0015。动物实验经北京协和医院实验动物伦理委员会批准。
UCB采集 北京协和医院行传染性疾病常规筛查(包括人类免疫缺陷病毒、乙型肝炎病毒、丙型肝炎病毒等)确认为健康的产妇,签署知情同意书后,在行剖宫产的过程中,采用标准脐带血采集盒经脐静脉收集UCB,标本在采集后2 h内处理。
CD34+细胞分离 UCB处理过程主要参照Rubinstein等[13]方法并做简单调整,具体为:通过加入质量体积分数6%羟乙基淀粉将红细胞移除后室温下培育45~60 min;收集富含白细胞的血浆成分,3000 r/min(r=10 cm)离心10 min后移除血浆上清液;在剩余细胞颗粒加入5~10 ml的裂解液,室温下放置8~10 min,然后用PBS和2%牛胎儿血清进行洗涤,剩下富含白细胞颗粒物将用于CD34+细胞分离。最后采用免疫磁珠法富集CD34+细胞。
CD34+细胞扩增 以StemlineTMStem Cell Expansion Medium作为基础培养基,加入干细胞因子、血小板生成因子和粒细胞集落刺激因子3种低浓度细胞因子(均为100 ng/ml)。无血清造血干细胞(hematopoietic stem cell,HSC)扩增培养基均在制备好1周内使用。加入CD34+细胞培育前,HSC需要在37 ℃、5% CO2条件下温育30 min。将新鲜富集的CD34+细胞(>75% CD34+)[14]用于CD34+细胞组模型建立。
将包含50万个CD34+细胞的13 ml无血清基质加入到T- 25组织培养瓶中,37 ℃、5% CO2的环境下培育7 d,随后采用细胞计数器计算CD34+细胞倍增数量,并配置于PBS+0.1%BSA的溶液中,CD34+细胞浓度以6.67×105个/0.1 ml为宜。
CD34+扩增细胞性能评价
DiI标记示踪:将培养扩增CD34+细胞进行DiI标记,采用显微镜检测DiI分布评估CD34+细胞迁移情况。
免疫组织化学检测:冰冻切片组织中加入单克隆小鼠抗人核抗原抗体(antihuman nuclear antigen antibody,HNA)并进行培育。经缓冲液封闭后,放置于第一抗体中,4 ℃下过夜保存。第2天,加入碱性磷酸酶标记羊抗鼠IgG免疫球蛋白二抗体,孵育后再用DAPI染细胞核。采用荧光显微镜观察DAPI染色情况,对于无DAPI显示区域用Leica共聚焦显微镜分析。
动物模型及分组 全麻下将 BALB/C小鼠左后肢股动脉进行结扎,右侧肢体血管不做处理。根据以往建模经验[15],术后7 d注射相应液体。实验分以下3组:(1)对照组:注入PBS+0.1%BSA混悬液0.1 ml,两侧后肢各0.05 ml。(2)CD34+细胞组:注入未经增殖的CD34+细胞悬液0.1 ml,约含72 610个CD34+细胞,两侧后肢各0.05 ml。(3)CD34+细胞增殖组:往小鼠后肢腓肠肌内注入增殖后的CD34+细胞悬液0.1 ml,约含6.67×105个CD34+细胞,两侧后肢各0.05 ml。因小鼠对缺血耐受有个体差异,本研究将小鼠数量增加至每组5只。本研究所有动物实验过程均按照医院动物管理委员会的要求进行。
小鼠肢体温度检测 采用红外线热像仪分别检测注射液体后第3、7、14及28天小鼠缺血侧与非缺血侧下肢温度变化情况,记录温度改变百分数,即缺血性肢体温度/非缺血肢体温度。
CD31免疫组织化学染色 注射液体后第28天后处死所有裸鼠,取下肢缺血的肌肉标本,标本经10%福尔马林固定24 h后包埋于石蜡中并切成4 μm薄片。采用小鼠抗小鼠的CD31抗体(1∶200 稀释)着色。在每个缺血肌肉标本中随机选择10个区域,200倍光学显微镜下对毛细血管进行计数。
RT-PCR检测 采用RT-PCR技术检测转化生长因子β1(transforming growth factor-β1,TGF-β1) mRNA表达水平,具体为:从各组中采集标本后分别用RNA试剂盒分离(Qiagen)提取mRNA,采用TaqMan反转录试剂盒进行逆转录,美国伯乐170- 9780IQ5PCR检测系统测定TGF-β1和β-actin mRNA的表达水平。25 μl反应混合物中包含:(1)12.5 μl PCRSYBR Green 染料;(2)10ngcDNA模板;(3)小鼠β肌动蛋白表达的正向5’-CGTCTTCCCCTCCATCG- 3’和反向5’-CTCGTTAATGTCACGCAC- 3’引物,小鼠TGF-β1 mRNA表达的正向5’-GCAACAATTCCTGGCGTTA- 3’和反向5’-GCCCTGTATTCCGTCTCCTT- 3’引物;以Ct值来进行测定。
统计学处理 采用SPSS 22.0统计软件,计量资料以均数±标准差表示,组间数据比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
脐血CD34+细胞体外扩增效率 富含CD34+的UCB在无血清培养基中培养7 d后,采用细胞计数器法评估有核细胞扩增效率,结果显示平均倍增 7.430±0.31(n=3)。
CD34+扩增细胞性能评价结果 注射液体后第28天,DiI分布检测结果显示,在缺血下肢的腓肠肌束和毛细血管周围可见DiI显影(图1)。HNA染色结果显示,在注射经扩增的CD34+细胞液体后28天,缺血性后肢腓肠肌束和毛细血管周围能发现HNA阳性细胞,且部分HNA阳性细胞融合在血管壁内(图2)。
血流复通结果 建模后3组小鼠缺血侧肢体温度均明显下降,3组间肢体温度差异无统计学意义(P均>0.05)。注射液体后随时间推移,3组小鼠缺血后肢温度逐渐上升,温度改变百分比逐步升高,以CD34+增殖组最明显,对照组最慢;注射后第14天(t=5.421,P=0.001;t=0.616,P=0.000)和第28天(t=10.780,P=0.000;t=12.123,P=0.000),CD34+细胞增殖组和CD34+细胞组温度改变百分比均明显高于对照组;CD34+细胞增殖组与CD34+细胞组间差异无统计学意义(t=0.000,P=1.000;t=0.660,P=0.528)(图3、4)。

红点为DiI标记的CD34+细胞(箭),蓝点表示肌束和毛细血管
Red dots indicate expanded CD 34+cells labelled with DiI dye (arrow) and blue dots indicate muscle bundle and capillary vessels
图 1 DiI标记的CD34+细胞示踪(×200)
Fig 1 CD34+cells traced by DiI dye(×200)
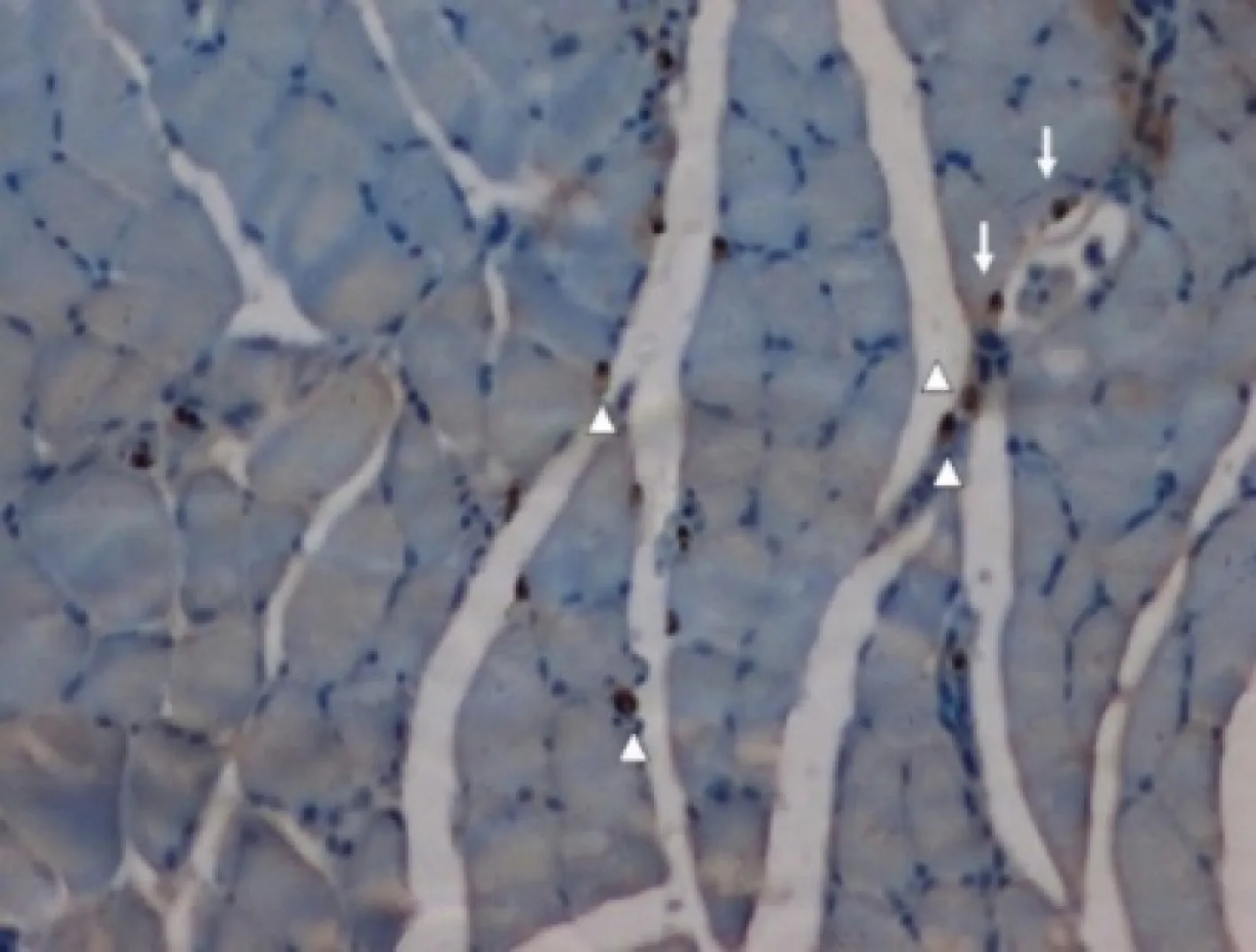
HNA:抗人核抗原抗体;血管周围HNA+细胞(箭头),融合在血管壁内的HNA+细胞(箭)
HNA:antihuman unclear antigen antibody;HNA+cells in the vicinity of the blood vessel and within infarcted muscle (arrowhead); HNA+cells incorporated in the endothelial lining of a small blood vessel (arrow)
图 2 HNA免疫组织化学分析(×200)
Fig 2 HNA immunohistochemical staining (×200)
各组小鼠CD31染色结果比较 注射液体后第28天,血管密度定性分析结果显示,CD34+细胞增殖组和CD34+细胞组缺血性后肢腓肠肌的毛细血管密度均高于对照组(图5)。在200倍显微镜下根据CD31染色情况进行毛细血管数量计数,结果显示,CD34+细胞增殖组和CD34+细胞组毛细血管密度分别为592.3±24.6(t=26.386,P=0.000)和530.7±25.5(t=21.502,P=0.000),均明显高于对照组的219.7±19.9;CD34+细胞增殖组和CD34+细胞组间差异无统计学意义(t=1.704,P=0.067)。非缺血侧肢体未见组间CD31染色差异。
TGF-β1mRNA的表达 CD34+细胞增殖组和CD34+细胞组TGF-β1mRNA表达量分别为(0.578±0.050)(t=12.376,P=0.000)和(0.504±0.080)copies(t=7.098,P=0.000),均明显高于对照组的(0.224±0.040)copies。CD34+细胞增殖组和CD34+细胞组间差异无统计学意义(t=1.697,P=0.128)。
讨 论
郝牧等[16]研究结果显示,UCB的内皮组细胞在促进缺血性肢体新生血管的形成及治疗缺血性疾病中有一定价值。大规模动物研究和临床试验证据也表明,UCB内皮祖细胞的各类细胞成分中以CD34+细胞为主,其诱导缺血组织新生血管生成的能力主要是通过CD34+细胞来实现的[17]。由于CD34+细胞来源并不丰富,因此人们尝试了不同的细胞扩增培养方法,结果发现,不同培养方法的CD34+细胞倍增数从3.4至10.61不等[12]。本研究采用了一种新的无血清体外培养基对CD34+细胞进行培养扩增,结果显示,CD34+细胞平均倍增数为7.430±0.31,且在该培养基下扩增的细胞并未加速衰老,说明该培养基扩增效率和质量的有效性,也保证了CD34+细胞用于后续模型研究的可行性。
有研究表明,当每只小鼠注射的CD34+细胞数量级达到105时,对促进缺血性肢体新生血管生成的意义较大[18]。因此在本研究中,CD34+细胞增殖组中每只小鼠注射6.68×105个扩增的CD34+细胞,CD34+细胞组中每只小鼠注射104数量级的CD34+,对照组未注射相应的细胞。本研究首先通过示踪DiI标记的扩增CD34+细胞发现,CD34+细胞主要分布于血管和肌肉束周围,而非随机分布于肢体缺血区域。随后的CD34+细胞增殖组缺血组织标本HNA免疫组织化学染色阳性结果表明,在小鼠体内出现了人的细胞,且主要分布于血管周围,甚至部分参与了血管壁的形成。因此,通过DiI示踪及HNA免疫组织化学结果均表明,CD34+细胞注射进入BALB/C裸鼠体内后具有向缺血区迁移并可能参与了新生血管生成的能力。此外,通过对3组间的缺血肢体温度改变和CD31免疫组化染色的比较可以发现,CD34+细胞数量越多,其肢体温度恢复越快,血管密度也越丰富,在一定程度上支持了CD34细胞有促进缺血肢体血流复通的作用,结果也证实了该105数量级的CD34+细胞对促进缺血肢体血流恢复的有效性。但对于人体CD34+细胞与小鼠体内自身干细胞之间的作用关系,及其对于缺血肢体血流复通的具体机制及影响因素并不清楚,当然也可能通过其他作用方式促进新生血管的生成,相关问题仍有待进一步研究阐明。

左侧为缺血肢体,不同颜色表示不同温度,红色表示最高温度,深蓝色表示最低温度
Left is ischemic limb,different perfusion values are presented in different color,with maximum perfusion values presented in red and minimum in deep blue
图 3 红外线热像仪检测小鼠下肢肢体温度
Fig 3 Infrared thermograph to detect the temperature of ischemic limb of mouse
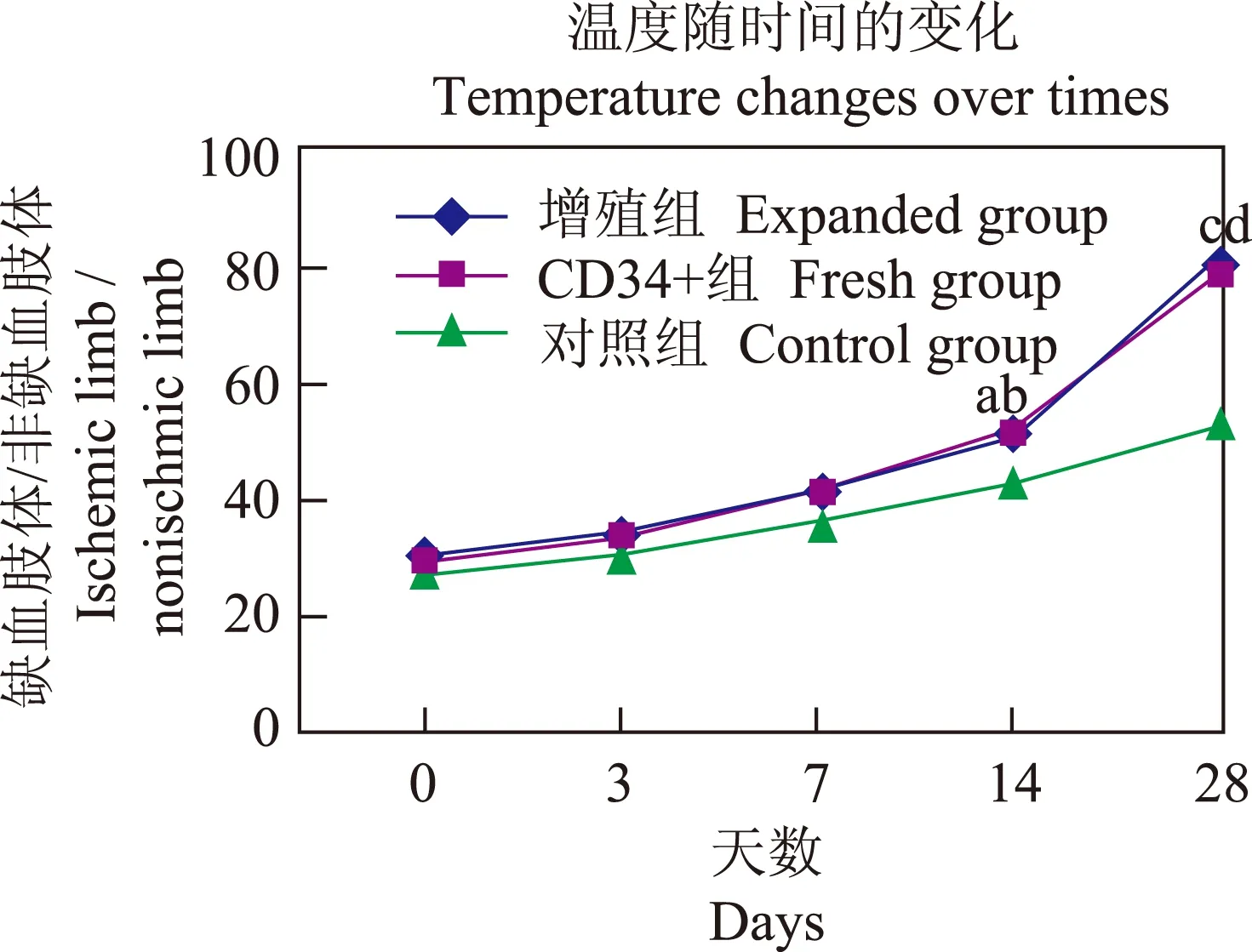
与对照组比较,at=5.421,P=0.001;bt=0.616,P=0.000;ct=10.780,P=0.000;dt=12.123,P=0.000at=5.421,P=0.001;bt=0.616,P=0.000;ct=10.780,P=0.000;dt=12.123,P=0.000 compared with control group
图 4 缺血肢体温度与非缺血肢体温度的比值变化(n=5)
Fig 4 The ratio change of ischemic limb temperature to normal limb(n=5)
TGF-β1的表达是重要复杂的信号转导途径,其通过Smad蛋白将信息从细胞表面传送到细胞核内,并控制着各类细胞的分子表达过程[19]。Veit等[20]在不同细胞模型中已经证实,细胞的迁移与TGF-β1信号通路的激活有关。Bai等[21]研究发现,在TGF-β1信号通路激活的情况下,SDF- 1可介导CD34+细胞的趋化作用并诱导CD34+细胞在缺血区的黏附应答。本研究结果显示,CD34+细胞增殖组的TGF-β1表达增加,CD34+细胞明显向缺血组织迁移,并显著增加血流的复通;而对照组,非注射CD34+细胞的缺血组织中TGF-β1mRNA表达并不显著,由此推测在局部缺血的肢体组织中,TGF-β1mRNA表达与CD34+细胞之间可能存在复杂的相互作用关系。
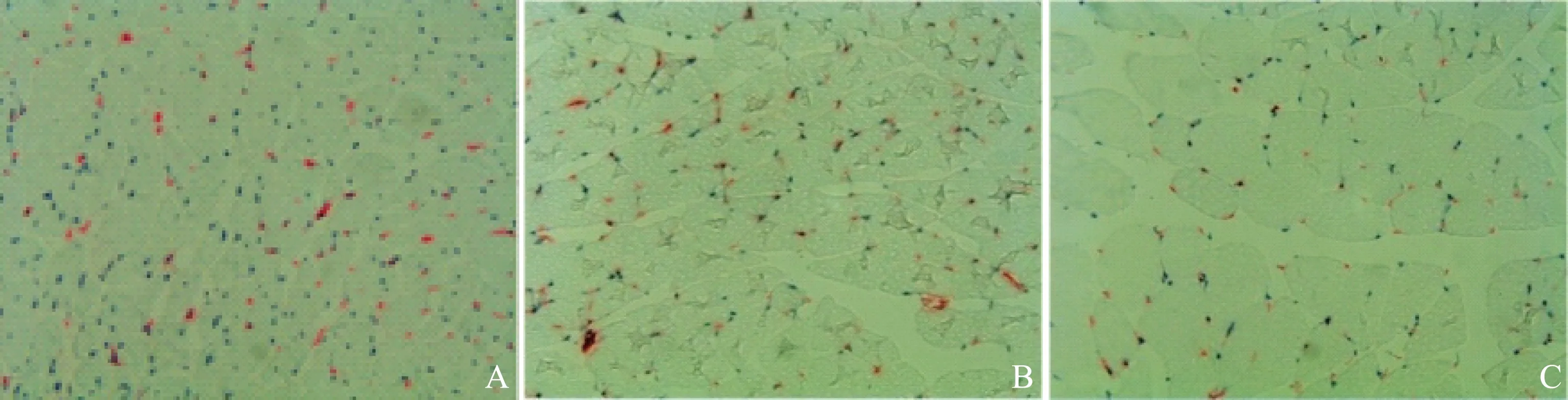
A.CD34+细胞增殖组;B.CD34+细胞组;C.对照组
A.expanded CD34+cells group; B.fresh CD34+cells group; C.control group
图 5 CD31免疫组织化学染色检测毛细血管密度(×200)
Fig 5 Capillary density revealed by CD31 staining(×200)
综上,本研究结果显示,无血清培养基体外扩增人脐血细胞能向缺血区富集并诱导血管生成,恢复血流再通,有望成为治疗下肢缺血性疾病的潜在方式。
[1]He Y,Jiang Y,Wang J,et al. Prevalence of peripheral arterial disease and its association with smoking in a population-based study in Beijing,China[J]. J Vasc Surg,2006,44(2):333- 338.
[2]Mueller T,Hinterreiter F,Luft C,et al. Mortality rates and mortality predictors in patients with symptomatic peripheral artery disease stratified according to age and diabetes[J]. J Vasc Surg,2014,59(5):1291- 1299.
[3]Malyar N,Furstenberg T,Wellmann J,et al. Recent trends in morbidity and in-hospital outcomes of in-patients with peripheral arterial disease:a nationwide population-based analysis[J]. Eur Heart J,2013,34(34):2706- 2714.
[4]Sekiguchi H,Ii M,Losordo DW. The relative potency and safety of endothelial progenitor cells and unselected mononuclear cells for recovery from myocardial infarction and ischemia[J]. J Cell Physiol,2009,219(2):235- 242.
[5]Yoshioka T,Ageyama N,Shibata H,et al. Repair of infarcted myocardium mediated by transplanted bone marrow-derived CD34+stem cells in a nonhuman primate model[J]. Stem Cells,2005,23(3):355- 364.
[6]Kawamoto A,Iwasaki H,Kusano K,et al. CD34-positive cells exhibit increased potency and safety for therapeutic neovascularization after myocardial infarction compared with total mononuclear cells[J]. Circulation,2006,114(20):2163-2169.
[7]Zhang S,Ge J,Zhao L,et al. Host vascular niche contributes to myocardial repair induced by intracoronary transplantation of bone marrow CD34+progenitor cells in infarcted swine heart[J]. Stem Cells,2007,25(5):1195- 1203.
[8]Yip HK,Sun CK,Tsai TH,et al. Tissue plasminogen activator enhances mobilization of endothelial progenitor cells and angiogenesis in murine limb ischemia[J]. Int J Cardiol,2013,168(1):226- 236.
[9]Tepekoylu C,Wang FS,Kozaryn R,et al. Shock wave treatmentinduces angiogenesis and mobilizes endogenous CD31/CD34-positive endothelial cells in a hindlimb ischemia model:implications for angiogenesis and vasculogenesis[J]. J Thorac Cardiovasc Surg,2013,146(4):971- 978.
[10]Lara-Hernandez R,Lozano-Vilardell P,Blanes P,et al. Safetyand efficacy of therapeutic angiogenesis as a novel treatment in patients with critical limb ischemia[J]. Ann Vasc Surg,2010,24(2):287- 294.
[11]Mata MF,Lopes JP,Ishikawa M,et al. Scaling up theexvivoexpansion of human circulating CD34(+)progenitor cells with upregulation of angiogenic and anti-inflammatory potential[J].Cytotherapy,2015,17(12):1777- 1784.
[12]OE,Lee BH,Ahn HY,et al. Efficient nonadhesiveexvivoexpansion of early endothelial progenitor cells derived from CD34+human cord blood fraction for effective therapeutic vascularization [J].FASEB J,2011,25(1):159- 169.
[13]Rubinstein P,Dobrila L,Rosenfield RE,et al. Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution[J]. Proc Natl Acad Sci USA,1995,92(22):10119- 10122.
[14]刘竞争,王前,郑磊,等. 脐带血CD34细胞免疫磁珠分选及其意义[J].医学临床研究,2008,25(3):399- 401.
[15]刁永鹏,李拥军,郭李龙,等. 神经生长因子基因转染对缺血肢体血管生成和骨骼肌纤维重塑的影响[J]. 中国普外基础与临床杂志,2015,22(2):166- 171.
[16]郝牧,漆佩静,李刚,等. 人脐带间充质干细胞对脐血CD34+细胞在NOD/SCID小鼠体内造血重建的影响[J]. 中国医学科学院学报,2010,32(1):71- 75.
[17]Asahara T,Murohara T,Sullivan A,et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science,1997,275(5302):964- 967.
[18]Kawamoto A,Masuda H,Tanaka R,et al. Vasculogenic conditioning of peripheral blood mononuclear cells promotes endothelial progenitor cell expansion and phenotype transition of anti-inflammatory macrophage and T lymphocyte to cells with regenerative potential[J]. J Am Heart Assoc,2014,3(3):e000743.
[19]Weiss A,Attisano L. The TGFbeta superfamily signaling pathway[J]. Wiley Interdiscip Rev Dev Biol,2013,2(1):47- 63.
[20]Veit C,Genze F,Menke A,et al. Activation of phosphatidylinositol 3-kinase and extracellular signal-regulated kinase is required for glial cell line-derived neurotrophic factor-induced migration and invasion of pancreatic carcinoma cells[J]. Cancer Res,2004,64(15):5291- 5300.
[21]Bai H,Xie YL,Gao YX,et al. The balance of positive and negative effects of TGF-beta signaling regulates the development of hematopoietic and endothelial progenitors in human pluripotent stem cells[J]. Stem Cells Dev,2013,22(20):2765- 2776.
Human Umbilical Cord Blood CD34+Cells Induced Angiogenesis in Ischemic Limb of Mice
CHEN Zuo-guan,DIAO Yong-peng,WU Zhi-yuan,YAN Sheng,LI Yong-jun
Department of Vascular Surgery,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
LI Yong-jun Tel:010- 69152500,E-mail:yongj_93@hotmail.com
Objective To observe the effect of the expanded human umbilical cord blood CD34+cells in ischemic limb of mice and analyse the relationship between the CD34+cells and angiogenesis. Methods Human umbilical cord blood was collected and CD34+cells were separated for expanding. Mice limbs ischemia models were established (n=15) and randomly divided into three groups:expanded CD34+cells group (n=5),fresh CD34+cells group (n=5),and control group(n=5). CD34+cells were detected by DiI dye tracing and antihuman nuclear antigen antibody(HNA) immunohistochemical staining. The improvement of blood reperfusion was evaluated by indicators including limb temperature,CD31 staining,and transforming growth factor-β1 (TGF-β1) mRNA expression. Results On days 14 (t=5.421,P=0.001;t=0.616,P=0.000) and 28(t=10.780,P=0.000;t=12.123,P=0.000),both expanded CD34+cells group and fresh CD34+cells group enjoyed better temperature improvement. Days 28 later,the vascular densities in the expanded CD34+cells group and the fresh CD34+cells group were 592.3±24.6 (t=26.386,P=0.000) and 530.7±25.5 (t=21.502,P=0.000),which were significantly higher than that in control group 219.7±19.9. The TGF-β1 mRNA expression in the expanded CD34+cells group and the fresh CD34+cells group were (0.578±0.050) copies (t=12.376,P=0.000) and (0.504±0.080) copies (t=7.098,P=0.000),both over control group [(0.224±0.040)copies]. ConclusionsInvitroculture of cord blood CD34+cells can emigrate to ischemic zone and induce angiogenesis to alleviate ischemia. Thus,it may provide a treatment option for lower limb ischemia.
angiogenesis; CD34+cells; umbilical cord blood stem cell; limb ischemia; animal experiment
国家自然科学基金(81270399)Supported by the National Natural Sciences Fundation of China(81270399)
李拥军 电话:010- 69152500,电子邮件:yongj_93@hotmail.com
R654.4
A
1000- 503X(2016)05- 0491- 06
10.3881/j.issn.1000- 503X.2016.05.001
2016- 04- 18)

