白皮松种质资源鉴定与评价
李 斌, 孟庆阳,2, 李言达,3, 董文攀, 郑勇奇
(1.中国林业科学研究院 林业研究所 林木遗传育种国家重点实验室,北京 100091; 2. 河南科技大学, 河南 洛阳 471023;3.北京大学 生命科学院, 北京 100871; 4.中国科学院 植物所, 北京 100093)
白皮松种质资源鉴定与评价
李 斌1, 孟庆阳1,2, 李言达1,3, 董文攀3,4, 郑勇奇1
(1.中国林业科学研究院 林业研究所 林木遗传育种国家重点实验室,北京 100091; 2. 河南科技大学, 河南 洛阳 471023;3.北京大学 生命科学院, 北京 100871; 4.中国科学院 植物所, 北京 100093)
采集白皮松3个新变异类型(盆仙白皮松、瑞王白皮松、9号树)、北京良种基地母树、北京市挂牌古树等共48个样品,应用SSR技术,对上述样品分别进行鉴定和多样性评价。结果表明:同一个变异类型的无性系与其原变异枝之间在所有位点上均不存在差异,说明其无性系及其原变异枝属于相同的基因型,“瑞王白皮松”和其母株(古树152)非变异枝间在SSR — Y5位点上存在差异,“瑞王白皮松”与“盆仙白皮松”在SSR — Y2位点上存在差异。“9号树”在Y2、Y5 2个位点上与“盆仙白皮松”、“瑞王白皮松”不同,而与其母树群体莽山良种基地的母树相同。可以通过上述位点的检测来鉴定3个不同的变异类型。“盆仙白皮松”、“瑞王白皮松”和“9号树”、古树群组、莽山群组间的遗传距离分别为0.0211、0.0114、0.0813、0.0638。 “瑞王白皮松”与“盆仙白皮松”间、“瑞王白皮松”与古树间存在遗传上的差异。参试样品的有效等位基因数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei’s多样性指数(Nei’s)的平均值分别为1.230、0.302、0.221、0.189、0.197。多样性水平略高于白皮松人工群体而与白皮松天然群体接近,说明参试样品具有较高的遗传多样性水平,具有选择利用的遗传基础较好。
白皮松; 种质资源; SSR; 鉴定
种质资源是国家的重要战略资源,开展种质资源鉴定、评价与遗传多样性研究是植物遗传育种和资源开发利用的前提和基础,对于发掘和利用我国种类丰富的植物种质资源有重要意义。然而,由于植物种内变异丰富,种质资源复杂多样,它们的许多重要性状和种内变异类型还没有得到鉴定、评价和发掘利用,特别是近20年来,一批有价值的植物种质资源得到了保存,当然也有一些具有重要价值的种质资源仍然处于野生状态,对人工保存种质以及具有潜在价值的野生种质,如何通过鉴定、评价并发掘其利用价值,以及如何进一步对它们提出科学合理的保存与利用策略,是植物种质资源工作者今后迫切需要研究的问题。传统的种质资源鉴定、评价与遗传多样性研究的方法是通过建立野外试验林,进行长期观测。该方法已应用于很多树种的相关研究中,可以有效用于分析和评价树种种质资源。另一方面,近几十年迅速发展起来的分子标记技术,直接从DNA水平上揭示种质多态性,并可提高种质资源评价分析效率。SSR(Simple Sequence Repeats)又称微卫星(Microsatellite),早在1974年,Skinner[1]研究寄居蟹的基因组时,就发现了SSR序列(AC)n/(TG)n的存在。Schafer做了进一步的研究使之发展成为新的DNA分子标记。随着分子标记技术的不断改进和完善,尽管出现了诸如AFLP、ISSR、SCAR、SRAP、STS等新的标记方法。但SSR分子标记因具有诸多的优越性,在动、植物种质资源的遗传分析中得到了广泛应用[2-3]。
白皮松(Pinusbungeana)天然分布在山西、陕西、甘肃、河南、四川、湖北等地[4],其树形优美,极具观赏价值,是我国华北地区广受欢迎的园林绿化树种,在陵园、寺庙可见到数百年甚至上千年仍然郁郁葱葱的白皮松古树。白皮松与银杏、柏木、国槐并称四大长寿命景观树种,在华北、西北等地园林绿化中的应用日渐增加,在其他国家如韩国也被列为重要的优良风景林树种和行道树种。白皮松是耐旱、耐低温和耐污染(SO2、烟尘,臭氧)很强的树种。此外,白皮松花粉具有保健作用,含有多种参与人体代谢的生理活性物质。近年,对白皮松天然群体种实形态多样性的研究[4]为揭示白皮松的群体遗传学提供了大量基础信息,在等位酶水平上研究白皮松群体保育遗传也有报道[5]。本研究使用SSR分子标记对白皮松变异类型、良种母树、古树进行鉴定分析,并对其遗传多样性水平进行评价,为更好的保护和利用白皮松种质资源提供科学依据。
1 材料与方法
1.1实验材料
实验共采集48个样品,包括来自北京昌平十三陵林场白皮松良种基地的样株30株,来自北京市挂牌保护的古树9株,还有以下3个变异类型及其原株:“盆仙白皮松”无性系2个及其原株共3个样(原株为整株变异);簇生变异类型“瑞王白皮松”无性系2个及其原株共3个样;密枝变异类型“9号树”无性系2个及其原株共3个样。试验样品中,“瑞王白皮松”母株与9株古树为同一批,栽植时间与地点相同,同属于一个小群落;“盆仙白皮松”原株和“9号树”原株均来自于昌平十三陵林场的白皮松良种基地,同属于一个小群落。
“盆仙”白皮松与“瑞王”白皮松在形态学上同属于短枝变异品种,在形态上表现为矮小、分支短而多,针叶短而稠密,没有明显的顶端优势,但具有很好的观赏性,是非常有潜力的盆景观赏品种,两者来源不同,但形态类似。“9号树”形态上与普通白皮松相似,但是树枝和针叶多而密实,生长较快,适合用作园林景观树种。
2013年采集叶片。叶片从树体取下后和硅胶一起放入自封袋中,带回试验室后放入-80 ℃冰箱保存。实验材料采集时间与地点见表1。

续表1 实验材料采集时间与地点ContinuedTab1 Theseclectedtimeandspotofexperi⁃mentmeteral编号样品名称采集人采集时间2013年(月-日)采集地点32良-P14李斌、刘建明05-17北京莽山33良-P9 李斌、刘建明05-17北京莽山③34良-P24李斌、刘建明05-17北京莽山35良-P20李斌、刘建明05-17北京莽山36良-P19李斌、刘建明05-17北京莽山37良-P18李斌、刘建明05-17北京莽山38良-P17李斌、刘建明05-17北京莽山39良-P30李斌、刘建明05-17北京莽山40良-P1 李斌、刘建明05-17北京莽山41良-P11李斌、刘建明05-17北京莽山42C3 李斌、刘建明05-17北京昌平④43C3’ 李斌、刘建明05-17北京昌平④44C3-1 李斌、刘建明05-17北京昌平⑤45C2 李斌、刘建明05-17北京昌平⑥46C2’ 李斌、刘建明05-17北京昌平⑥47C9 李斌、刘建明05-17北京昌平⑦48C9’ 李斌、刘建明05-17北京昌平⑦ 注:①“瑞王”白皮松母株(非变异枝);②“瑞王”白皮松原变异枝;③9号树原株;④“盆仙”白皮松无性系;⑤“盆仙”白皮松原株;⑥“瑞王”白皮松无性系;⑦9号树无性系。
1.2实验方法
1.2.1 SSR分析 DNA样品提取采用天根植物基因组提取试剂盒提取;提取后采用琼脂糖电泳方法检测总DNA。DNA条带不够清晰的样品重新提取。
从松属相关文献中共查询到309对SSR引物,然后对搜索到的引物进行PCR扩增和检测,选出扩增效果较好并且具有1条或2条条带的引物。用所选出的引物对不同种源的8个白皮松DNA样品进行扩增,然后进行毛细管电泳检测,选出适合白皮松遗传分析的7对SSR引物[7]。扩增引物采用赵罕筛选的7对引物序列,其特性见表2和表3。
引物合成采用合同方式委托“上海生工”合成,合成引物包括7对普通引物+不带荧光的M13尾巴序列(5’ — TGT AAA ACG ACG GCC AGT — 3’)和1条5’端标有CY5荧光标记的M13 尾巴引物(CY5 — TGT AAA ACG ACG GCC AGT),便于荧光分析。
PCR扩增采用两步法,优点是可以节省成本和提高效率,缺点是增加试验时间。第1步扩增不添加荧光引物,第2步扩增添加荧光引物。
PCR第1步扩增程序为:95°预变性5 min;95°变性30 s,55°退火30 s,72°延伸45 s,30个循环;第2步扩增程序为:95°变性30 s,53°退火30 s,72°延伸45 s,8个循环;72°延伸10 min。

表2 引物序列Tab2 Primersequence编号名称序列IDY136567-992-FCCAGACAACCCAAATGAACAGAATCAGGCGTCCAAT36567-992Y2RPtest9-FCCAGACAACCCAAATGAAGGGCCTGCTATCGAATCCAGAAContig1667Y3919347-FTCGCCTGGGCTTTGTCTGGCGGGTTGCATATTTGGTG9193-167Y4ssrPt_ctg8767-FTGGGGAAAAATGGCATACATGGAGCAGACACCCATGGACTContig8767Y551113-3237-FTCCAGACAACCCAAATGACAGGCGTCCAATACCAGA51113-3237Y648044-7700-FTACGGTGGTCTGTTCTGCAGGCTTCTCCTGGTCTCC48044-7700Y7PtSIFG_6058RAAGAGGTTGCTCCTCACCAAGCTCCATTTCAGAGCAGGTCCO361898
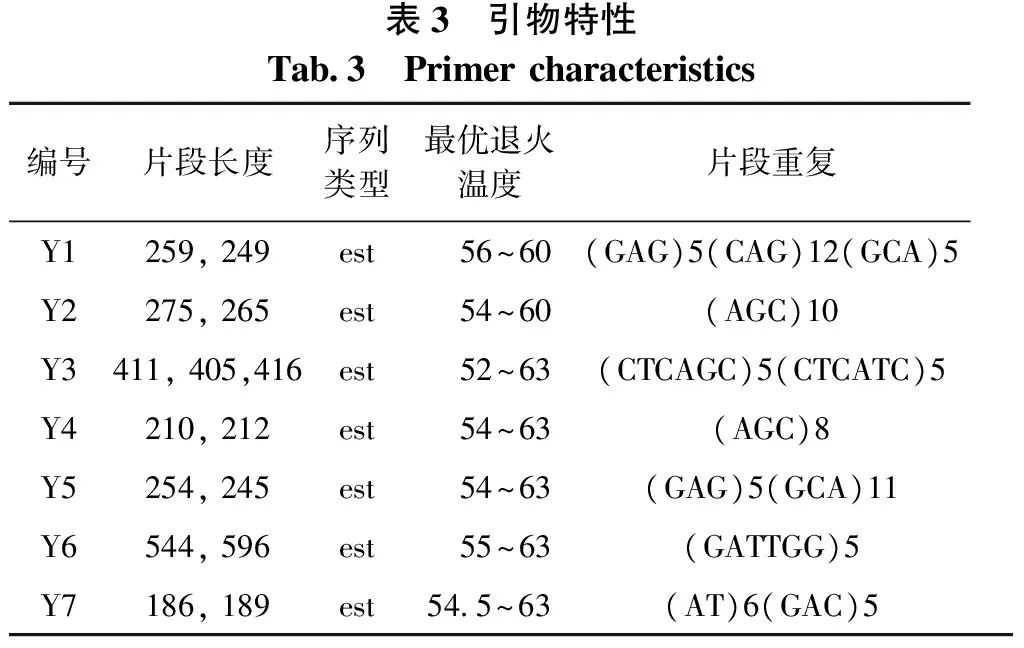
表3 引物特性Tab3 Primercharacteristics编号片段长度序列类型最优退火温度片段重复Y1259,249est 56~60(GAG)5(CAG)12(GCA)5Y2275,265est 54~60(AGC)10Y3411,405,416est 52~63(CTCAGC)5(CTCATC)5Y4210,212est 54~63(AGC)8Y5254,245est 54~63(GAG)5(GCA)11Y6544,596est 55~63(GATTGG)5Y7186,189est545~63(AT)6(GAC)5
SSR毛细管电泳:将甲酰胺与分子量内标按100∶1的体积比混匀后,取15 μL扩增产物加入上样板中,再加入0.4 μL PCR产物。然后使用BECKMAN CEQ8000遗传分析仪进行毛细管电泳。
通过BECKMAN CEQ8000将毛细管电泳峰值图按照无峰,有峰的规律自动转换为0,1数据, 再将0,1数据按照每个引物作为1个等位基因位点看待,转换成AA、AB、BB格式的基因型数据。
1.2.2 SSR多样性参数分析 多样性参数使用POPGENE32软件计算:①观测等位基因数Na;②有效等位基因数Ne;③Shannon's信息指数 I;④期望杂合度(Ho)与观测杂合度(He);⑤Nei’s期望杂合度(1987);⑥遗传距离和遗传一致度。根据遗传相似度与遗传距离,利用软件NTSYS — pc2.1,以UPGMA方法,绘制各群体聚类分析图。
2 结果与分析
2.1变异位点和多态性
使用7对EST — SSR引物在48个白皮松样品中共检测到14个多态性位点。总的来说,白皮松种内多态性变异不很丰富,这可能与白皮松在松树中属于比较保守的原始种类有关。
2.2优良种质资源鉴定
白皮松的优良变异类型“瑞王白皮松”(C2)松针短硬而密集,颜色深绿,枝条粗短,生长缓慢,其无性系产生花芽,具有观赏价值。“盆仙白皮松”(C3)与“瑞王白皮松”(C2)形态特征类似,松针短硬而密集,颜色浓绿,枝条粗短,生长缓慢,其无性系不产生花芽,整个树冠更像“一个仙人球”,具有观赏价值。“9号树”(C9)是从白皮松良种基地挑选出来的,其树冠比其周围的白皮松树冠浓密,枝叶密实,生长正常,能正常开花结实。经过DNA检测,结果如下。
(1) 通过beckman毛细管电泳可以看出,同一个变异类型的2个无性系及其原变异枝间在所有位点均不存在差异,说明同一变异类型的2个无性系及其原变异枝属于相同的基因型。
(2) “瑞王白皮松”与其母株的非变异枝间在1个位点上存在差异,“瑞王白皮松”在Y5位点上呈BB纯合子型,而母株的非变异枝为AB杂合子型,其余样品在这个位点均呈现AB型或AA型。在Y2位点,“瑞王白皮松”呈现AB杂合型,这与“盆仙白皮松”AA不同,而与其他样品相同(见图1、2、3)。
(3) “盆仙白皮松”在Y2位点呈AA纯合型,Y5位点呈BB杂合型,这与良种基地的样品不同(见图1、2、3)。
(4) “9号树”在Y2,Y5 2个位点均呈现杂合型。在Y6位点,“9号树”呈杂合型,良种基地群体其余样本呈AA纯合型或杂合型(见图1、2、3)。
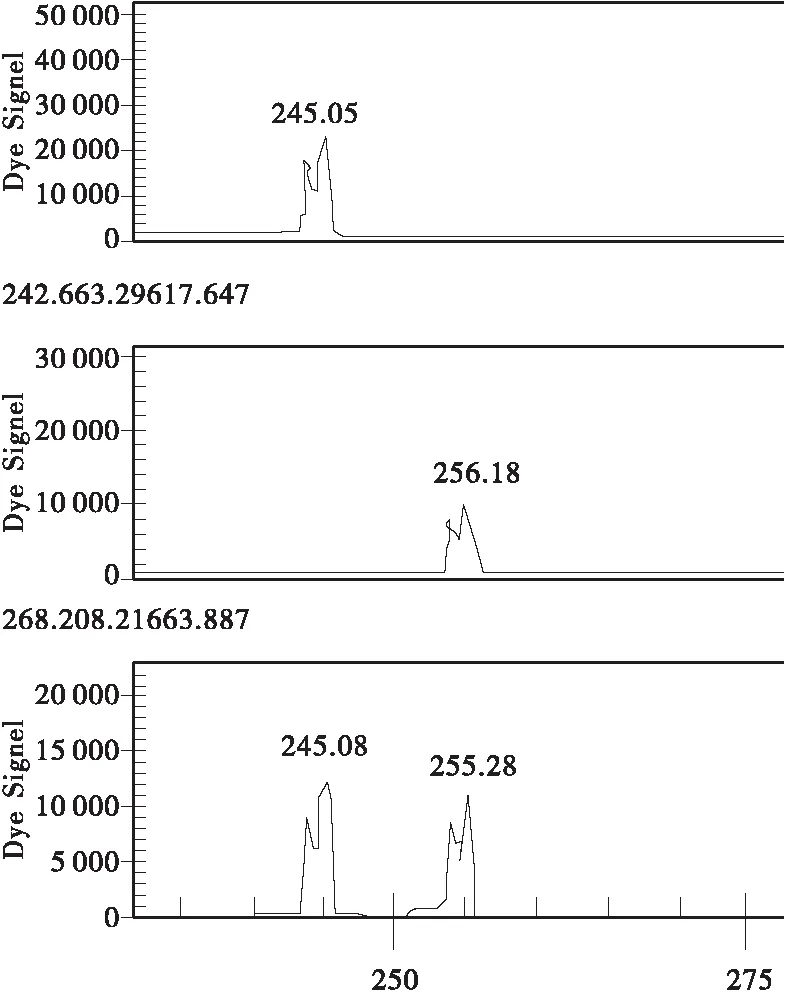
图1 Y5位点(中为“瑞王”变异无性系、“盆仙”无性系及其原株基因型,下为“瑞王”母株无变异枝及9号树的基因型,上为普通类型)Fig.1 Locus Y5(Top: common type; Center: “Ruiwang bungeana” variation clone, “Penxian bungeana ” clone and its original tree; Bottom: “Ruiwang bungeana” clone and “ancient tree No.9” )
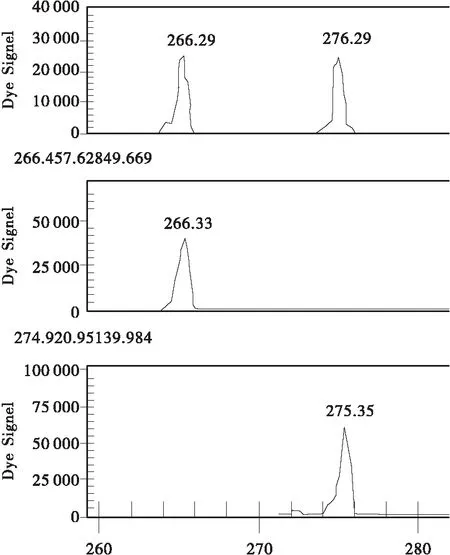
图2 Y2位点(上为“9号树”基因型,中间为“盆仙”无性系及其原株基因型,下为“瑞王”无性系及其母株无变异枝基因型,良种基地的样品为上下2类基因型)Fig.2 Locus Y2(Top: “ancient tree No.9”; Center: “Penxian bungeana ” clone and its original tree; Bottom: “Ruiwang bungeana” clone and its mother tree stick. The sample of certified seed base as same as top and bottom)
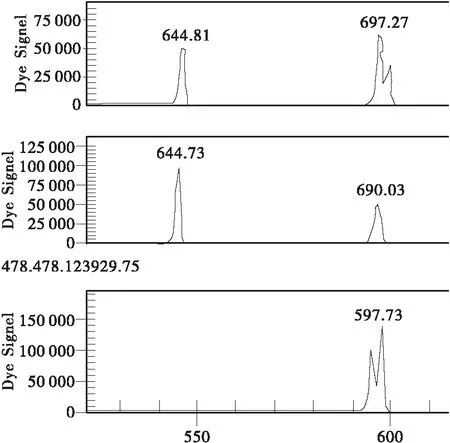
图3 Y6位点(上为“9号树”基因型,中间为“盆仙”无性系及其原株基因型,下为“瑞王”无性系及其母株无变异枝基因型,良种基地其他样品分别为中、上2类)Fig.3 Locus Y6(Top: “ancient tree No.9”; Center: “Penxian bungeana ” clone and its original tree; Bottom: “Ruiwang bungeana” clone and its mother tree stick. The samples of certified seed base as same as top and center)
2.3变异类型之间及其与古树群体、良种基地莽山群体的遗传相似度、遗传距离及聚类
将各无性系及其原变异枝分别定义为一组,用C2、C3、C9分别代表“瑞王白皮松”、“盆仙白皮松”和“9号树”。GS代表古树群体,MS代表良种基地莽山群体。
从表4可看出: C2与GS遗传相似度高、遗传距离小,C2与C9组遗传相似度最低、遗传距离最大。C3与C9遗传相似度较高、遗传距离较小,C3与GS组相似度最低,遗传距离最大。这说明C3在遗传进化上与C9较近,而与GS相距最远。C9与MS遗传相似度非常高、遗传距离非常小,C9与GS组相似度最低,遗传距离最大。C9可能存在遗传变异的证据不充分。
聚类结果(图4)表明: 9与MS首先聚在一起,证明了两者最相似;然后两者与C3聚在一起,说明C3,C9,MS可能存在相同的起源。事实上C9的原变株就是MS组中的一份子良 — P9。C2与GS在现实距离上最近,而与MS最远,因为C2的原变种就是GS组中的G152,聚类结果反应了这一现实。
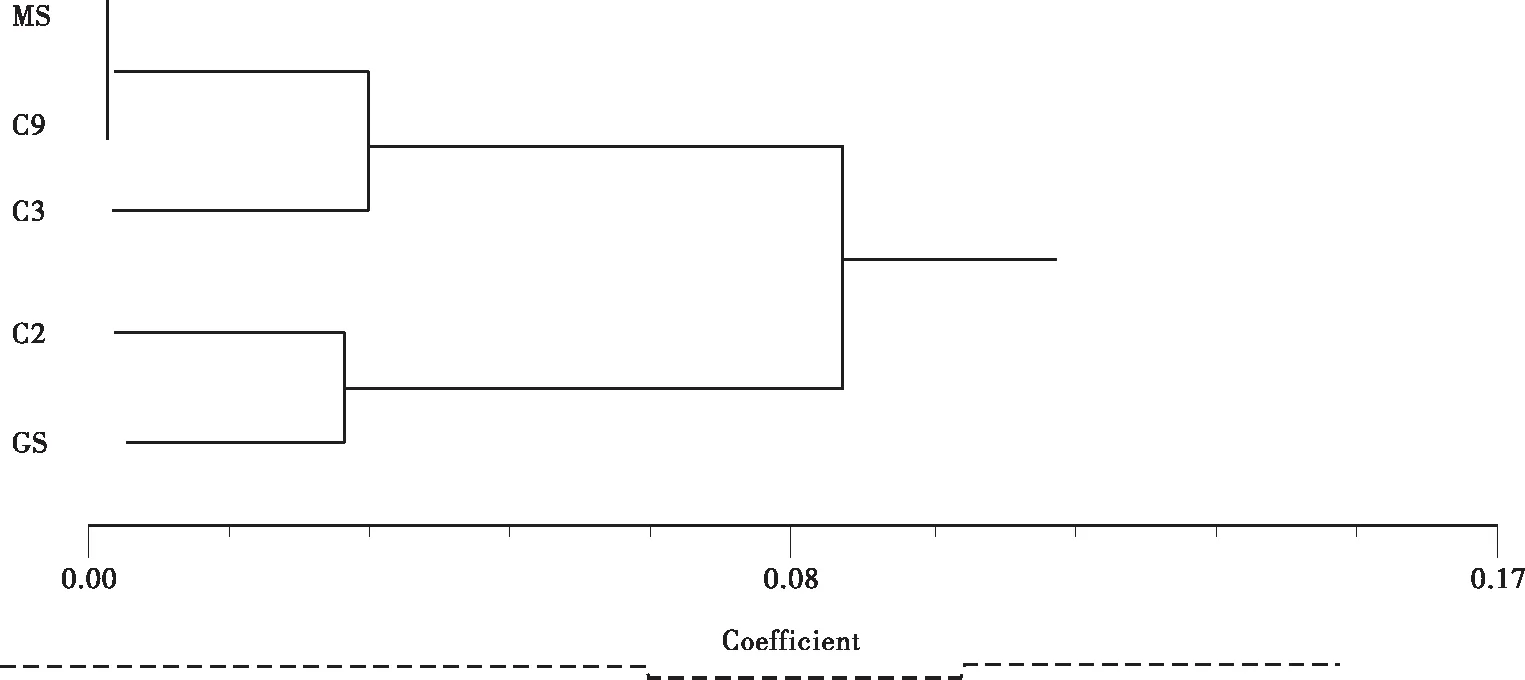
图4 白皮松种质资源遗传距离聚类图Fig.4 Genetic distance cluster figure of germplasm resource of Pinus bungeana
2.4遗传多样性评价
根据检测到的14个多态性位点进行多样性统计分析表明,48个参试样品的有效等位基因数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei’s多样性指数(Nei’s)的平均值分别为1.230、0.302、0.221、0.189、0.197。根据赵罕等2012年分析结果[7],白皮松种质资源收集保存项目中人工栽培群的有效等位基因数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei’s多样性指数(Nei’s)的平均值分别为1.2263、0.2466、0.1935、0.1511、0.1487[7]。白皮松天然群体的有效等位基因数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei’s多样性指数(Nei’s)的平均值分别为1.3097、0.3127、0.2214、0.1994、0.1963[7]。相比而言,参试样品的遗传多样性参数略高于人工群体,与白皮松天然群体多样性水平接近,说明参试样品具有较高的遗传多样性水平和较好的选择利用的遗传基础。
3 结论与讨论
3.1遗传多样性评价
SSR是一种灵敏度较高的分子标记[3],也是一种共显性标记,广泛用于种质鉴定甚至亲子鉴定,也用于遗传多样性评价。参试样品的有效等位基因数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei’s多样性指数(Nei’s)的平均值分别为1.230、0.302、0.221、0.189、0.197[7]。参试样品多样性水平略高于白皮松人工群体而与白皮松天然群体接近,说明其具有较高的遗传多样性水平,具有较好的选择利用的遗传基础。
“盆仙白皮松”、“瑞王白皮松”和“9号树”、古树群组、莽山群组间的遗传距离分别为0.0211、0.0114、0.0813、0.0638。说明“瑞王白皮松”与“盆仙白皮松”间、“瑞王白皮松”与古树间存在遗传上的差异。
3.2白皮松变异类型鉴定的遗传依据
同一个变异类型的2个无性系及其原株(原变异枝)间在所有位点均不存在差异,说明其无性系及其原株(原变异枝)属于相同的基因型,“瑞王白皮松”和其母株(古树152)非变异枝间在SSR — Y5位点上存在差异,“瑞王白皮松”与“盆仙白皮松”在SSR — Y2位点上存在差异。
“瑞王白皮松”、“盆仙白皮松”、“9号树”相互之间均存在遗传差异。该研究的结论可为今后开展白皮松育种和新品种选育利用提供遗传背景信息,也可为防止种苗调拨混淆进行苗木早期鉴定提供依据[11-12]。
3.3白皮松优良种质资源保护与利用策略
参试的白皮松优良种质资源遗传多样性水平较高,首先必须对其进行有效保护,可以建立专门的收集保存圃,进行集中保护,防止其遗传资源丢失[13-15];然后开展合理利用,以利用促进保护,但利用过程中要防止对母树、原株等的人为破坏。白皮松扦插繁殖生根困难,建议采取嫁接繁殖。今后需进一步探索白皮松穗条生根机理,突破白皮松扦插繁殖瓶颈,促进其高效可持续利用[4]。
“盆仙”白皮松等几个白皮松优良基因型,是目前在白皮松中发现的非常罕见的具有重要开发价值的变异品种,是开展相关研究的好材料,而且“盆仙”白皮松已经培育了10多年,继代繁殖了10多年,但是未发现开花结实,没有顶端优势,因此,很可能在激素基因水平上的形成通路上出现障碍或变异,建议在加强保护与合理开发利用的同时,开展基因水平的深入探索[8-10]。
[1] Kimura M,Crow J F.The Number of Alleles That Can Be Maintained in a Finite Population[J].Genetics,1964,49(7),25-38.
[2] 李义良,赵奋成,张应中,等.分子标记在松树遗传与进化研究中的应用[J].分子植物育种,2009,7(5):1004-1009.
[3] 程小毛,黄晓霞. SSR标记开发及其在植物中的应用[J].中国农学通报,2011,27(05):304-307.
[4] 李斌,顾万春.白皮松分布特点与研究进展[J].林业科学研究,2003,16(2):225-232.
[5] 李斌,顾万春,周世良.白皮松的保育遗传学、基因保护分析[J].生物多样性,2003,11(1):28-36.
[6] Nei M.Molecular Evolutionary Genetics.New York:Columbia University Press,1987,190-191.
[7] 赵罕. 白皮松遗传资源评价及保存策略研究[D]. 北京:中国林业科学研究院,2012,1-122.
[8] 沈洁. DNA序列、ISSR标记在药用植物种质鉴别中的应用[D]. 南京:南京师范大学,2005,1-121.
[9] 谢小雪,陈昌生,徐燕,等. DNA 序列标记在坛紫菜种质鉴定中适用性的比较分析[J]. 期应用海洋学学报, 2013,32(3):404-410.
[10] Hebert P D N,Cywinska A,Ball S L,et al. Biological identifications through DNA barcodes [J]. Proceedings of the Royal Society of London Series B-Biological Sciences,2003,270: 313-321.
[11] CBOL Plant Working Group. A DNA barcode for land plants [J]. Proceedings of the National Academy of Sciences of USA,2009,106( 31) : 12 794-12 797.
[12] 何燕,李斌,姜英淑,等.白皮松种源苗期变异与选择[J].林业科技通讯,2001(6):5-8.
[13] 李斌,顾万春,卢宝铭.白皮松天然群体种实性状表型多样性研究[J].生物多样性,2002,10(2):181-188.
[14] 赵罕, 郑勇奇, 李斌, 等. 白皮松生长差异及适应性的种源变异分析[J]. 林业实用技术, 2013, 4:7-11.
[15] 周惠娟, 赵鹏, 刘占林.濒危植物白皮松遗传多样性及遗传结构研究[D]. 西安:西北大学,2008.
[16] 王铁燕, 王晓冰. 白皮松研究进展[J]. 山西农业科学, 2009,37(6):79-81.
IdentificationandevaluationofgermplasmresourcesofPinusbungeana
LI Bin1, MENG Qingyang1,2, LI Yanda1,3,DONG Wenpan3,4, ZHENG Yongqi1
(1.State Key Laboratory of Tree Breeding and Forest Genetics / Research Institute of Forestry,Chinese Academy of Forestry ,Beijing 100091, China;2.Henan University of Science and Technology, Luoyang 471023, China;3.School of Life Sciences, Peking University, Beijing 100871, China;4.Institute of Botany,Chinese Academy of Sciences, Beijing 100093, China)
In this paper, a total of 48 samples including threePinusbungeanavariations “Penxianbungeana”, “Ruiwangbungeana” and “ancient tree No. 9”)with their parent strain, mother trees in certified seed base and listed ancient trees in Beijing were selected to make SSR identification and diversity evaluation through SSR technology. The result showed that: There was no difference between all sites of two clones and their original strains (original variation sticks) of a same variation type, which meant the clones and the original strains (original variation sticks) were of a same genotype. There was a difference between “Ruiwangbungeana” and the non-variation stick of locus Y5its mother plants (ancient tree No. 152), and there was also a difference between “Ruiwangbungeana” and the locus Y2of the “Penxianbungeana”. Differences also appeared between the locus Y2of “Tree No. 9” and “ Fairy BallPinusbungeana”, locus Y5of “Tree No. 9” and “Ruiwangbungeana”, while the locus Y2and locus Y5of “Tree No. 9” were the same as the certified seed base in Mountain Mang, which was their parent group. Three different variation types can be detected through the above loci. The genetic distance between “Penxianbungeana”, “Ruiwangbungeana” and “Tree No. 9”, listed tree group and tree group in Mountain Mang were: 0.0211, 0.0114, 0.0813, 0.0638, respectively. The results further show that there were differences between “Pinusbungeana” and “Penxianbungeana”, the same between “Ruiwangbungeana” and the listed trees. The averages of effective number of alleles (Ne), Shannon's information index (I), observed heterozygosity (Ho), expected heterozygosity (He) and Nei’s diversity heterozygosity (Nei’s) of the tested numbers were 1.230, 0.302, 0.221, 0.189, 0.197, respectively. Diversity levels slightly higher than artificial groups ofPinusbungeanaand close to natural populations ofPinusbungeana, indicating that the tested sample had a higher level of genetic diversity and a better genetic basis which can be chosen from and used.
Pinusbungeana; germplasm resources; SSR; identification
2016-01-28
国家自然科学基金项目“白皮松种质资源鉴定与评价”(31370667);十二五科技支撑计划“林木种质资源发掘与创新利用”(2013BA001B06)。
李 斌(1969-),男,博士,副研究员,湖南省张家界市人,长期从事林木遗传资源收集、保存、整理、评价和利用研究。
郑勇奇。
S 791.243
A
1003 — 5710(2016)02 — 0001 — 07
10. 3969/j. issn. 1003 — 5710. 2016. 02. 001
(文字编校:唐效蓉)

