氩氦刀治疗小鼠肺腺癌后瘤周注射树突状细胞对冷冻免疫效应的影响
尹天泉,张 米,何新华
(首都医科大学附属北京朝阳医院 急诊科,北京100020)
氩氦刀治疗小鼠肺腺癌后瘤周注射树突状细胞对冷冻免疫效应的影响
尹天泉,张 米,何新华
(首都医科大学附属北京朝阳医院 急诊科,北京100020)
目的 探讨氩氦刀治疗小鼠肺腺癌后,在瘤体周围注射树突状细胞(dendritic cells,DCs)是否可提高冷冻免疫效应。方法 38只T739荷瘤小鼠(LA795肺腺癌,瘤体位于右后肢皮下,直径7±0.5 mm)随机分成2组(19只/组)。实验组:双循环氩氦冷冻消融后于瘤周注射DCs;对照组:双循环氩氦冷冻消融。术后第3、7、14d脱颈处死小鼠,眼眶采血(3只/组/时间点),流式细胞术微球阵列法检测细胞因子IL-12,IFN-γ,IL-4,IL-10浓度;流式细胞术检测CD4+T、CD8+T细胞比例;每组10只小鼠用于观察生存时间。结果 实验组在各时间点IL-12、IFN-γ浓度均高于对照组,IL-4、IL-10浓度均低于对照组;实验组CD4+T细胞比例在各时间点均高于冷冻治疗组,CD8+T细胞在术后第7、14 d均高于对照组。以上所有差异均具有统计学意义(P<0.05)。在术后第3 d,实验组CD8+T细胞比例高于对照组,但其差异无统计学意义(P>0.05)。实验组生存率高于对照组,其差异具有统计学意义(P<0.05)。结论 氩氦冷冻消融术后在瘤周注射DCs可显著提高冷冻治疗的抗肿瘤免疫效应,并延长生存时间。
氩氦冷冻消融;肺腺癌;冷冻免疫效应;树突状细胞
(ChinJLabDiagn,2016,20:1631)
肺癌是目前世界上发病率及死亡率最高的恶性肿瘤。其中腺癌所占比例在近30年来有一定的上升趋势[1]。由于早期诊断不足,多数患者就诊时已丧失手术机会。氩氦靶向冷冻消融系统(简称氩氦刀)的出现为减轻晚期肺癌患者的肿瘤负荷、延长患者生存期提供了新的手段。氩氦冷冻消融是利用Joule-Thompson效应,使组织在60秒内迅速降至-140℃左右,从而使组织发生凝固性坏死的微创治疗方法。目前已广泛应用于肺癌、肝癌、前列腺癌、肾癌、乳腺癌、骨肿瘤等实体瘤的治疗[2-8]。由于坏死肿瘤组织滞留体内并释放肿瘤相关抗原(tumor associated antigens,TAAs)及肿瘤特异性抗原(tumor specific antigens,TSAs),氩氦冷冻消融还具有激发机体抗肿瘤免疫反应的潜能(即冷冻免疫效应),因此,有学者认为冷冻治疗同时也是一种免疫治疗[9]。大量实验室及临床研究表明冷冻治疗后机体内可检测到抗肿瘤免疫反应的发生。然而,单纯依靠冷冻免疫效应对抗肿瘤的复发及残余瘤的消除,临床上并未取得显著的治疗效果。本研究旨在探讨氩氦冷冻消融治疗肺腺癌后,在瘤周注射DCs是否可增强机体的抗肿瘤免疫反应。
1 材料和方法
1.1 T739小鼠LA795肺腺癌模型的建立
LA795肺腺癌细胞系(由协和医科大学肿瘤研究所提供)复苏后,于含10% 胎牛血清的RPMI 1640培养基中培养至对数生长期,胰酶收获后,PBS重悬制备细胞悬液,按5×105/0.2 ml/只,接种于6W龄T739小鼠(海军总医院动物实验中心提供)右后肢背侧皮下。1W后瘤体直径增至7±0.5 mm时用于实验。
1.2 DCs的培养
DCs的培养参照文献方法并加以改进[10]。取健康6W龄T739小鼠股骨和胫骨骨髓细胞,过筛后,培养于含10% 胎牛血清的RPMI 1640培养基中,按1 000 U/mL浓度分别加入重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF,R&D)和重组小鼠白细胞介素4(rmIL-4,R&D),隔日加入等量的rmGM-CSF和rmIL-4,培养7天后收集备用。
1.3 分组及治疗方法
1.3.1 分组 38只荷瘤小鼠随机分成2组,每组19只。实验组:双循环氩氦冷冻消融术后在冷冻区边缘外侧注射DCs;对照组:只进行双循环氩氦冷冻消融治疗。
1.3.2 氩氦冷冻消融肿瘤 10%水合氯醛腹腔注射麻醉小鼠(0.2 ml/只),固定后,备皮,消毒,采用氩氦冷冻消融设备(美国Endocare公司)实行冷冻手术。将2 mm氩氦刀冷冻刀头,插入肿瘤中央,采用双循环冷冻方法:温度降低至-120℃,冷冻10 s,复温至0℃,再次重复上述冻融循环。
1.3.3 DCs的注射 离心法收集DCs,PBS洗涤三次后调整细胞浓度至1×106/ml,1 ml注射器抽取0.2 ml细胞悬液,注射于冷冻区边缘外侧皮下(2×105/只)。
1.4 取材及检测
1.4.1 取材 于治疗后第3、7、14 d取材, 3只/组/时间点,脱颈法处死小鼠,眼眶采血,每组10只用于观测生存时间。
1.4.2 流式细胞术微球阵列法检测细胞因子IL-12、IFN-γ、IL-4、IL-10浓度 Cytometric Bead Array(CBA) Flex Set IL-12、IFN-γ、IL-4、IL-10试剂盒均为美国BD公司产品,按照试剂盒说明进行稀释、孵育。FACSCalibur流式细胞仪检测(BD公司),BD CBA软件进行分析。具体方法参考文献[11]。
1.4.3 流式细胞术检测血CD4+T及CD8+T细胞 小鼠抗体CD4-FITC、CD8a-PE及CD3e-PerCP均购于美国BioLegend公司,按试剂说明进行操作,采用FACSCalibur流式细胞仪(BD公司)进行检测。
1.5 生存时间
以治疗当天为第0天,按小鼠自然死亡时间记录生存时间并进行生存分析。
1.6 统计学处理
GraphPad 5.0软件进行统计分析及作图。组间比较采用t检验,数据以均数±标准差表示。生存分析采用Kaplan-Meier曲线及Log- Rank法检验。
2 结果
2.1 血IL-12,IFN-γ,IL-4,IL-10浓度比较
如表1所示,在各时间点实验组IL-12、IFN-γ浓度均高于对照组,其差异均有统计学意义(P<0.05);在各时间点实验组IL-4,IL-10浓度均低于对照组,其差异有统计学意义(P<0.05)。
2.2 血CD4+T,CD8+T细胞比较
如表2所示,在各时间点实验组CD4+T细胞比例均高于对照组(P<0.05);在术后第3 d,实验组CD8+T细胞比例高于对照组,但其差异无统计学意义(P>0.05);在术后第7、14 d,实验组CD8+T细胞比例高于对照组,其差异有统计学意义(P<0.05)。
2.3 生存分析
如图1所示,实验组小鼠生存率显著高于对照组,其差异具有统计学意义(P<0.05)。
3 讨论
冷冻免疫效应的提出缘于Soanes等人在前列腺癌患者身上发现冷冻治疗原发病灶后,其肺部转移瘤可缩小[12]。其后大量的研究证实了冷冻免疫效应的存在,然而,也有一些实验没有观察到明显的冷冻免疫效应,甚至还有少数研究者认为冷冻具有免疫抑制效应[13-15]。机体的抗肿瘤免疫效应主要是通过肿瘤特异性的CTLs实现的。冷冻抗肿瘤免疫效应的成功诱导应包括以下几个环节:(1)肿瘤抗原(肿瘤相关抗原/肿瘤特异性抗原)的充分释放;(2)抗原提呈细胞(antigen presenting cells,APCs)对抗原的摄取及提呈;(3)初始Th淋巴细胞的激活;(4)肿瘤特异性 CTLs的活化。其中APCs是连接冷冻治疗及免疫反应的桥梁,而DCs是体内抗原提呈功能最强大的APCs,也是唯一能够激活初始Th淋巴细胞的抗原提呈细胞。有研究表明,肿瘤的发展与瘤体周围浸润性DCs的数量减少及功能下降相关[16]。由于冷冻治疗后滞留体内的坏死肿瘤组织可提供充足的肿瘤抗原,因而,不同患者(或实验动物)自身DCs的数量及功能差异,是产生冷冻免疫效应差异的重要因素之一。Machlenkin A等应用液氮冷冻治疗联合瘤体内注射DCs,有效提高了小鼠的抗肿瘤免疫反应,本实验得到了与其相一致的结果[17]。为了充分模拟目前的临床治疗模式,本实验采用了双循环氩氦冷冻消融治疗;DCs的注射位点选取了瘤体周围,一方面考虑接近抗原释放位置,另一方面考虑瘤体外未坏死的组织利于DCs在体内的存活及归巢。本实验通过对细胞因子及T细胞亚型的检测,证实该方法可显著提高Th1型细胞因子的分泌及CTLs的比例。生存分析显示实验组动物的生存时间显著延长,提示该方法具有临床应用的潜在价值。进一步的研究应致力于DCs在体内的存活、归巢及功能状态的研究。此外,最小及最佳 DCs注射数量及其相关因素的研究,可为该方法走上临床应用提供重要实验数据。

表1 血细胞因子浓度(pg/mL)
*P<0.05**P<0.01***P<0.001
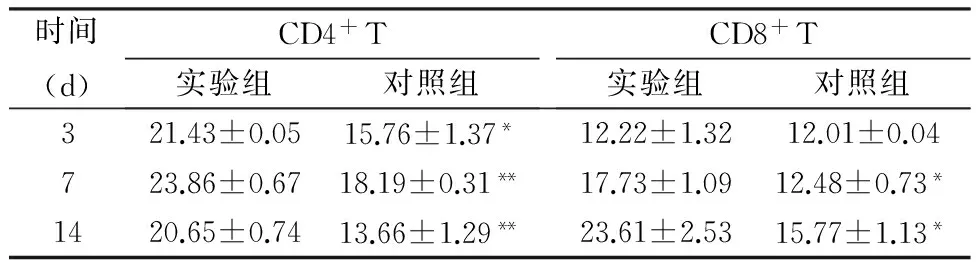
表2 血T细胞亚型比例(%)
*P<0.05**P<0.01

图1 Kaplan-Meier曲线:Log- Rank法检验实验组
[1]朱元珏,陈文彬.呼吸病学[M].第1版.北京:人民卫生出版社,2010:1011-70.
[2] Lizhi Niu,Kecheng Xu,Feng,et al.Cryosurgery for lung cancer[J].Journal of Thoracic Disease,2012,4:408.
[3]李 征,米登海,杨克虎,等.肝动脉化疗栓塞术联合氩氦刀治疗肝癌疗效及安全性的系统评价[J].中国循证医学杂志,2013,1:31.
[4]Liu YY,Chiang PH.Comparisons of Oncological and Functional Outcomes Between Primary Whole-Gland Cryoablation and High-Intensity Focused Ultrasound for Localized Prostate Cancer[J].Ann Surg Oncol,2016,23(1):328.
[5]Zargar H,Atwell TD,Cadeddu JA,et al.Laparoscopic Cryoablation for Renal Cell Carcinoma:100-Month Oncologic Outcomes-A Single Institution Experience[J].J Urol,2015,23(15):03851.
[6]Panizza PS,de Albuquerque Cavalcanti CF,Yamaquchi NH,et al.Percutaneous CT-Guided Cryoablation as an Alternative Treatment for an Extensive Pelvic BoneGiant Cell Tumor[J].Cardiovasc Intervent Radiol,2016,39(2):299.
[7]Sabel MS,Nehs MA,Su G,et al.Immunologic response to cryoablation of breast cancer [J].Breast Cancer Res Treat,2005,90(1):97.
[8]de Baere T,Tselikas L,Woodrum D,et al.Evaluating Cryoablation of Metastatic Lung Tumors in Patients-Safety and Efficacy:The ECLIPSE trial-Interim analysis at 1-Year[J].J Thorac Oncol,2015,10(10):1468.
[9] Sidana A.Cancer immunotherapy using tumor cryoablation[J].Immunotherapy,2014,6(1):85.
[10]Koji Teramoto,Yasuhiko Ohshio,Takuya Fujita,et al.Simutaneous activation of T helper function can augment the potency of dendritic cell-based cancer immunotherapy [J].J Cancer Res Clin Oncol,2013,139:861.
[11]李冰雪,段新亚,李明武,等.流式微球阵列法检测肺结核患者血清部分细胞因子的临床意义[J].细胞与分子免疫学杂志,2012,28(3):297.
[12]Ablin RJ,Soanes WA,Gonder MJ.Elution of in vivo bound antiprostatic epithelial antibodies following multiple cryotherapy of carcinoma of prostate [J].Urology,1973,2(3):276.
[13]Sabel MS.Cryo-immunology:A review of the literature and proposed mechanisms for stimulatory versus suppressive immune response[J].Cryobiology,2009,58(1):1.
[14]Ablin RJ.What of the clinical significance of the cryoimmune response[J].Dermatol Surg,1997,23(6):499.
[15]He XZ,Wang QF,Han S,et al.Cryo-ablation improves anti-tumor immunity through recovering tumor educated dendritic cells in tumor-draining lymph nodes[J].Drug Des Devel Ther,2015,9:1449.
[16]王 琪,林 苹.肿瘤浸润性树突状细胞的研究进展[J].中国癌症杂志,2005,2:185.
[17]Machlenkin A,Goldberger O,Tirosh B,et al.Combined dendritic cell cryotherapy of tumor induces systemic antimetastatic immunity[J].Clin Cancer Res,2005,11(13):4955.
Effect of Peri-tumoral Injection of Dendritic Cells Following Argon-Helium Crytherapy on Cryoimmune Response in the model of lung adenocarcinoma bearing mice
YINTian-quan,ZHANGMi,HEXin-hua.
(DepartmentofEmergency,BeijingChaoyangHospitalAfliatedtoCapitalMedicalUniversity,Beijing100020,China)
Objective To evaluate the effect of peri-tumoral injection of dendritic cells (DCs) following argon-helium cryoablation of lung adenocarcinoma on the cryoimmune response.Methods Thiety-eight LA795 lung adenocarcinoma bearing mice (tumor of 7±0.5mm in diameter was subcutaneous in the right hind femur) were randomly devided into 2 groups:experimental group(double-circled Argon-Helium cryoablation & peritumoral injection of DCs) and the control group(double-circled Argon-Helium cryoablation).Mice were excuted on day 3,7 and 14 after treatment (3mice/group/time point) for orbital blood sampling.Cytokines(IL-12,IFN-γ,IL-4,IL-10) and T lymphocyte subsets(CD4+T &CD8+T cells) in the blood were tested by Cytometric Bead Array(CBA) flow cytometry (FCM) respectively.Ten mice in each group were used to evaluate survival time.Results Compared with the control group,the experimental group has higher concentration of IL-12 and IFN-γ; while has lower concentration of IL-4 and IL-10 at each time point.Percentage of CD4+T cells in the experimental group was higher at each time point; percentage of CD8+T cells in the experimental group was higher on day 7 and 14.All of the differences have statistical significance (P<0.05) .On day 7 post treatment,the percentage of CD8+T cells in the experimental group was higher than that in the control group,while the difference showed no statistical significance (P>0.05).Survival time of the experimental group was longer than that of the control group,and the difference was statistically significant (P<0.05).Conclusion Peri-tumoral injection of DCs following cryotherapy can effectively enhance the anti-tumor croyimmune effect and thus prolong the life span.
Argon-helium cryoablation; Lung adenocarcinoma; Cryoimmune effect; Dendritic cell
1007-4287(2016)10-1631-04
R734.2
A
2015-05-29)

