慢性乙型肝炎microRNA诊断标志物及其与乙型肝炎病毒复制相关性研究
陈霖 李沛然 黄雨欣 刘爱霞 陈伟蛟 张岚 郭桐生 李伯安
100039 北京,中国人民解放军第三○二医院临床检验医学中心
·论著·
慢性乙型肝炎microRNA诊断标志物及其与乙型肝炎病毒复制相关性研究
陈霖 李沛然 黄雨欣 刘爱霞 陈伟蛟 张岚 郭桐生 李伯安
100039 北京,中国人民解放军第三○二医院临床检验医学中心
目的 筛选慢性乙型肝炎(慢乙肝)microRNA(miRNA)诊断标志物,并揭示miRNA与乙型肝炎病毒(HBV)复制的相关性。方法 采用荧光定量PCR法,对50例慢乙肝患者和50例健康人血浆中10条miRNA进行定量检测,通过分析表达水平差异,获得慢乙肝miRNA诊断标志物,建立回归诊断模型。斯皮尔曼等级相关性分析方法对miRNA表达量及HBV-DNA病毒载量进行相关性分析。 结果 8条miRNA在慢乙肝患者和健康人间的表达水平差异显著,其中miR-451a在慢乙肝患者中表达水平显著下降,其他7条miRNA表达水平显著升高。选择miR-122-5p、miR-27a-3p和miR-451a建立回归模型,曲线下面积(AUC)达到1,敏感性和特异性均达到100%,具有显著诊断价值。分析miRNA与HBV的相关性,发现miR-122-5p与HBV病毒载量呈正相关。结论 miR-122-5p、miR-27a-3p和miR-451a在慢乙肝的发生与发展中起到重要作用,可作为慢乙肝诊断的新型标志物。
microRNA(miRNA)是一类调控基因表达的高度保守的非编码小RNA,长度为20-24nt, 参与调节细胞生命活动中众多的信号通路的调节,在细胞增殖、分化、凋亡、免疫反应及血管生成等一系列生理过程中发挥重要作用[1]。乙型肝炎病毒(HBV)是一类DNA病毒,感染后引起肝细胞坏死和炎症,导致慢性乙型肝炎(慢乙肝)的发生。多项研究表明[2,3], HBV的复制以及慢乙肝的发生与miRNA的异常表达密切相关。HBV可导致胞内多条miRNA表达水平变化,逃脱免疫系统排斥,创造有利于病毒复制的生理环境,最终导致慢乙肝的病发[2],其中20%-30%的慢乙肝患者可能发展为肝硬化及肝癌。
选择10个近年来国内外报道[4-8]较多的慢乙肝相关miRNA(let-7f-5p、miR-122-5p、miR-185-5p、miR-26a-5p、miR-27a-3p、miR-451a、miR-22-3p、miR-338-5p、miR-663、miR-433)作为研究对象,检测其在慢乙肝患者与健康人血清样本中表达水平的变化,筛选差异显著的miRNA建立拟合模型,得到诊断公式,最终获得慢乙肝miRNA标志物。同时揭示miRNA表达量与HBV复制的相关性,为HBV的致病机理研究以及慢乙肝的准确诊断提供新思路。
1 材料与方法
1.1 样本来源及采集方法 收集2014年6月至2015年6月中国人民解放军第三O二医院50例慢乙肝住院患者和50例健康人外周血样本,所有选取的受试者年龄均在18-70岁之间,慢乙肝住院患者平均年龄55.49,健康人平均年龄54.47年龄,并且平均年龄无差异, 男女比例为1∶1。采用 EDTA抗凝采血管采集外周静脉血5 ml,轻轻颠倒混匀,4-6 h内离心(4℃,950 g,7 min)收集血浆,分装于1.5 ml无RNA离心管中,存于-80 ℃。
1.2 miRNA提取 采用Total RNA提取试剂盒(购自美国OmegaBio-Tek公司)进行血浆样本提取,得到的总RNA样本置于-80 ℃条件下保存。
1.3 RNA质量检测 采用微量紫外可见分光光度计(NanoDrop@ 2000c)对所提取总RNA进行吸光度检测;要求RNA浓度大于5 ng/μl,A260与A280的比值介于1.8-2.0之间。
1.4 cDNA合成 miRNA的cDNA合成采用北京旷博生物技术股份有限公司生产的Quanto-miR cDNA合成试剂盒(货号:0960201),严格按照说明书操作进行。
1.5 Real-time PCR检测 miRNA的qPCR定量检测所有试剂均购自北京旷博生物技术股份有限公司,包括qPCR试剂盒(货号:0960211)、miRNA特异性上游引物以及通用下游引物(0960112);所有操作均严格按照说明书进行,采用ABI 7900 HT进行数据的读取及收集。qPCR反应条件为:95 ℃ 5 min;95 ℃ 15 s,56 ℃ 45 s,反应40个循环,56 ℃ 45 s退火阶段读取荧光信号。
1.6 统计学方法 miRNA的qPCR检测数据(Ct值)采用Real Time StatMiner (Integromics) 以及T test对慢乙肝组与健康组进行差异表达分析(P<0.05差异有统计学意义),筛选出慢乙肝miRNA候选诊断诊断标志物,进行回归分析,建立慢乙肝诊断模型。ROC曲线分析miRNA诊断标志物在慢乙肝及健康人组之间的诊断效果。采用斯皮尔曼等级相关性分析方法(Spearman rank correlation analysis)对miRNA表达量及HBV-DNA病毒载量进行相关性分析,P<0.05 (Mann-Whitney test) 差异显著。统计学分析采用SPSS 13.0,图表制作采用GraphPad Prism 5.0。
2 结果
2.1 miRNA提取质量检测 所有血浆样本提取的miRNA溶液经紫外可见分光光度计检测,A260与A280的比值均介于1.8-2.0之间,RNA浓度均大于5 ng/μl,样本的纯度及浓度均达到实验要求,保证检测结果准确。
2.2 miRNA在慢乙肝患者和健康人中差异表达分析 通过statminer软件和T test对qPCR定量检测数据分析,确定10条miRNA在慢乙肝和健康人中的差异表达情况。结果如表1显示,let-7f-5p和 miR-185-5p在慢乙肝和健康人之间P值大于0.05,差异无统计学意义;其他8条miRNA分子的P值均小于0.05,在慢乙肝和健康人间表达水平差异显著;其中miR-451a在慢乙肝患者中表达水平下调,而其余7条miRNA分子表达水平均上调(图1),特别是miR-122-5p、miR-27a-3p、miR-451a、miR-433、miR-26a-5p和miR-663,P值小于0.01,差异极显著,可作为慢乙肝的候选诊断标志物。
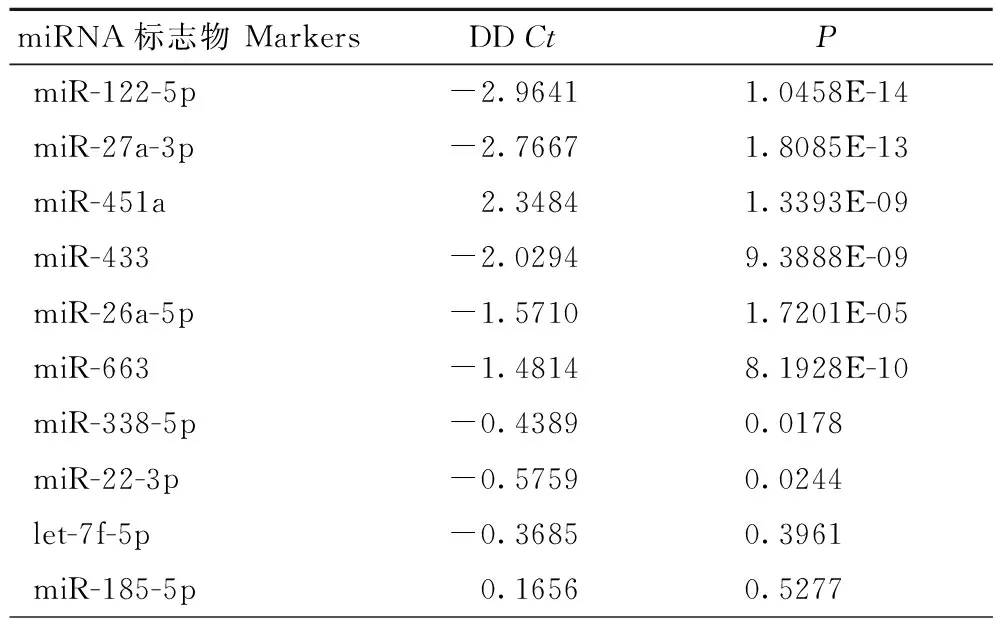
表1 miRNA在慢乙肝患者和健康人中差异表达分析

图1 miRNA在慢乙肝患者和健康人中的表达水平Fig.1 Expression of miRNAs in patients with chronic hepatitis B and healthy donors
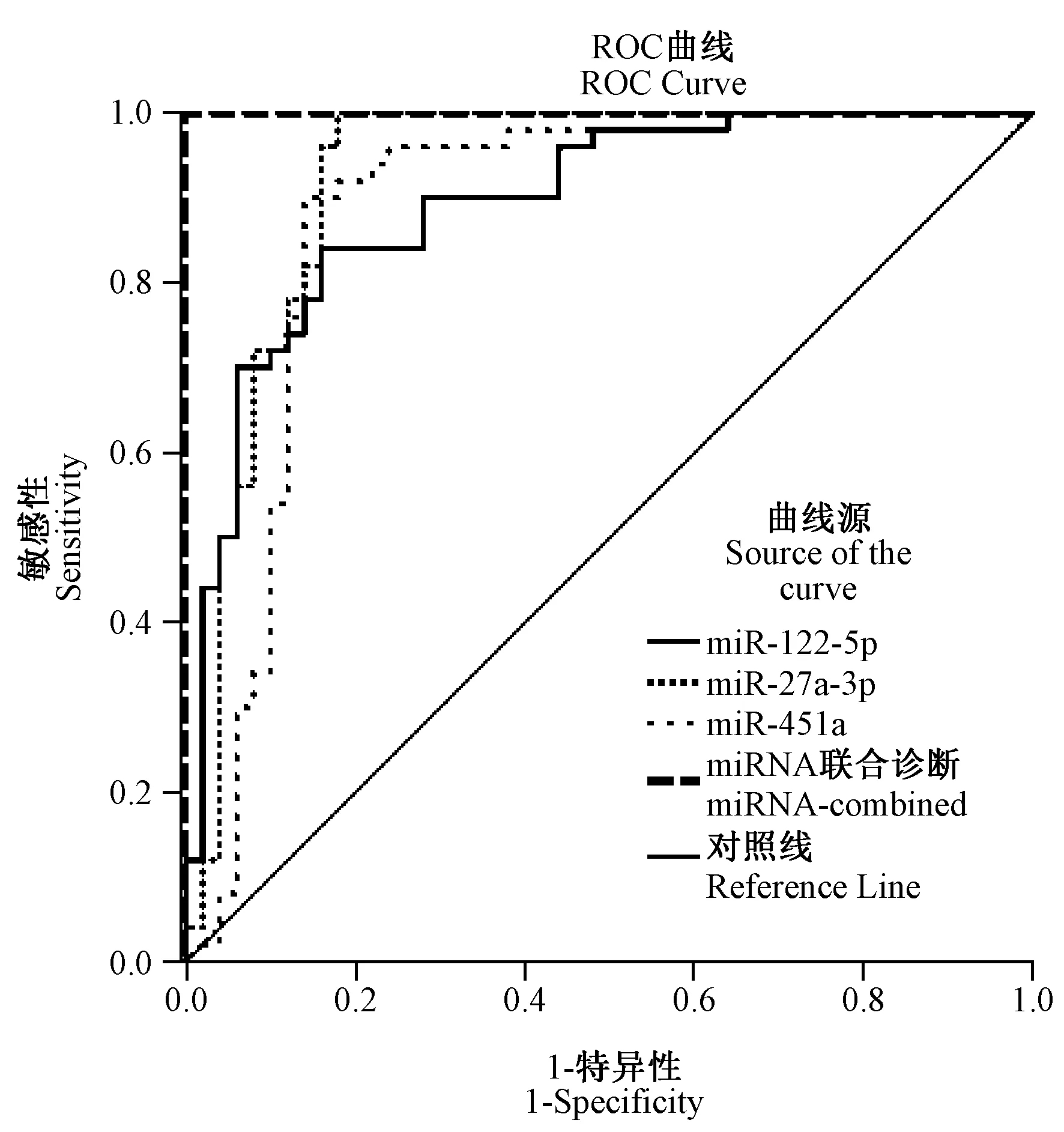
图2 慢乙肝miRNA诊断标志物的ROC曲线分析Fig.2 ROC curve of miRNA diagnostic markers for chronic hepatitis B
2.3 miRNA标志物可用于慢乙肝患者诊断 选择在慢乙肝患者和健康人中表达水平差异极显著的6条miRNA候选诊断标志物,综合组间Ct差值(DDCt)分析结果(表1),最终选择DDCt值最大,区分效果最优的3条miRNA:miR-122-5p、miR-27a-3p和miR-451a进行ROC曲线分析其诊断效果(图2):miR-122-5p、miR-27a-3p和miR-451a的AUC分别为0.894、0.924和0.882,组间区分效果较好,且3条标志物的敏感性和特异型均达到80%以上,满足临床诊断要求,可作为慢乙肝诊断标志物。为获得更优诊断效果,对诊断标志物miR-122-5p、miR-27a-3p和miR-451a进行回归分析,获得3条miRNA标志物的回归诊断模型:Logit (P=CHB)=-1.277 ×Ct-miR-122-5p-26.398 ×Ct-miR-27a-3p+16.992 × Ct-miR-451a+347.267,以0.5作为cut-off值,对本研究中100例样本进行分析,敏感性和特异性均达到100%。
2.4 miRNA与HBV病毒载量的相关性分析 为探索miRNA在HBV病毒复制等过程中的作用,对8条差异表达显著的miRNA与HBV病毒载量进行相关性分析。 结果如图3显示, miR-122-5p的表达水平与病毒载量的斯皮尔曼相关系数为0.478,P值0.005,两者密切相关,说明miR-122-5p在HBV复制中发挥了重要作用,其他7条miRNA与病毒载量无显著相关性。
3 讨论
miRNA是一类内生的非编码小RNA,是由70-90个碱基组成的单链miRNA前体(Pre-miRNA)经过Dicer酶剪切加工后生成。miRNA对生物体起到多种调节作用,单个miRNA可以参与多个信号通路的调节,而同一个信号通路或靶基因也可受多条miRNA的调节,由此构成一个复杂的miRNA信号调节系统。miRNA异常表达与人类癌症、炎症、心血管疾病、病毒感染,包括乙肝病毒感染等多种疾病的发生和发展密切相关。miRNA对于乙肝相关肝病不同阶段的诊断、致病机理的研究以及新的治疗方法的开发具有重要的意义。本研究利用qPCR定量的方法,考察10条miRNA在慢乙肝患者中表达量的变化,其中8条miRNA的表达具显著差异,且4个miRNA的组间DD Ct达到2以上。对miR-122-5p、miR-27a-3p和miR-451a建立回归模型,敏感性和特异性均达到100%,可作为慢乙肝诊断的一种新方法。与HBV的相关性分析中,发现miR-122-5p与HBV病毒载量呈正比,证明miR-122-5p参与了HBV病毒的复制的生理过程。
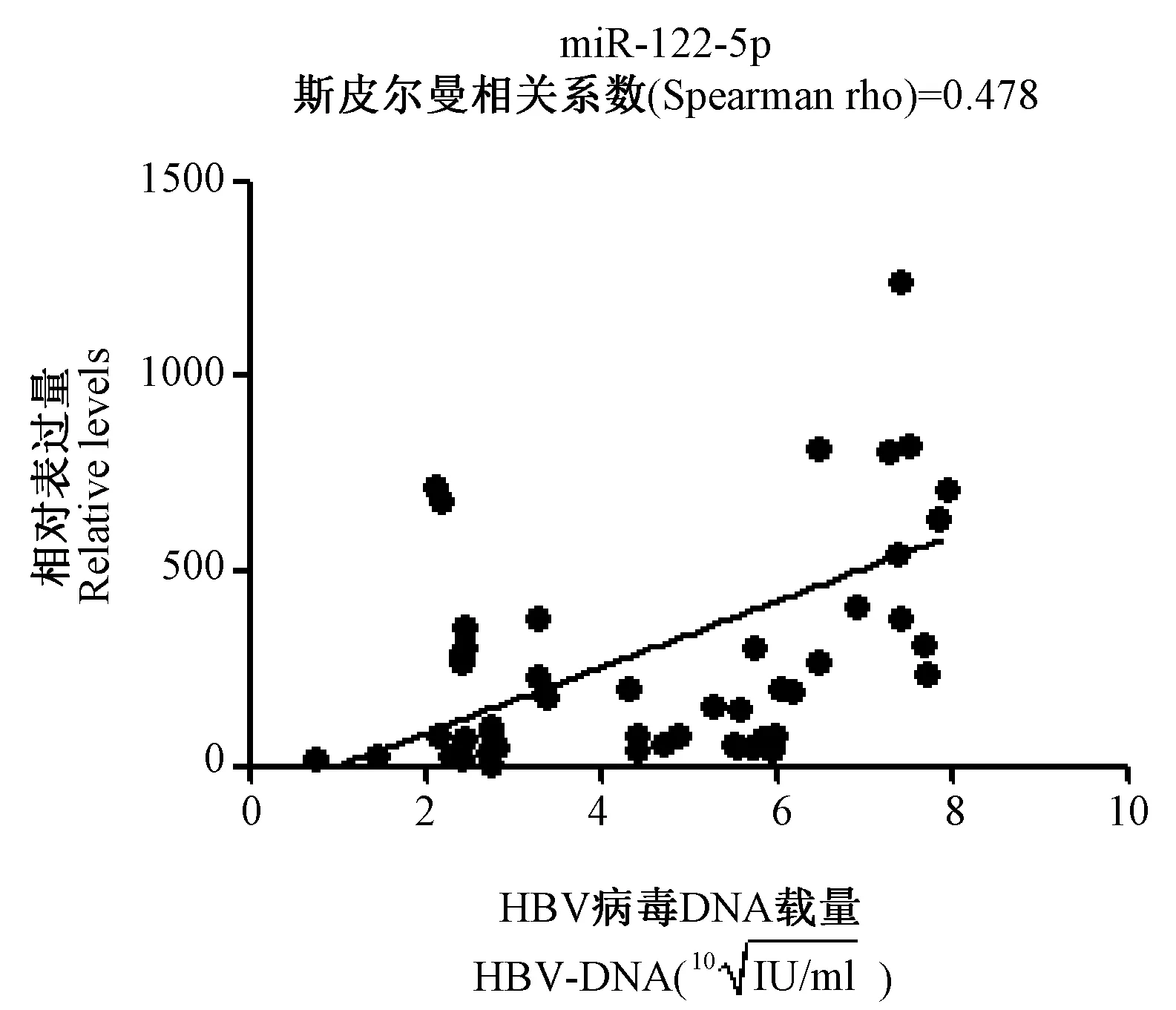
图3 miR-122-5p表达水平与HBV病毒载量的相关性分析Fig.3 Correlation between miR-122-5p expression and HBV viral load
miR-122-5p、miR-27a-3p和miR-451a不仅在慢乙肝的诊断中有重要意义,在肝脏的生理代谢及肝病的致病机理中也有广泛研究。miR-122是肝脏特异性miRNA,也目前研究最深入的肝病相关miRNA,表达量占到肝组织总miRNA的70%,与肝脏的新陈代谢、发育、生长和肿瘤性转化密切相关,通过与HBV的高度保守区序列结合,抑制HBV病毒的基因表达和复制[9]。 miR-27a-3p可以和肝脏二氢嘧啶脱氢酶特异性结合,调节肝脏中尿嘧啶的代谢[10]。同时,在乙肝相关肝癌的发展阶段,miR-27a-3促进乙肝相关肝癌细胞的增值、迁移和入侵,是典型的致癌miRNA[11]。miR-451a通过结合3’UTR抑制肝脏中致癌因子ATF2的表达,同时可抑制肝癌细胞HepG2和SK-Hep-1的迁移,是优良的抑癌miRNA,在肝癌治疗中有潜在的应用价值[12]。
[1] Bartel DP. MicroRNAs: Target Recognition and Regulatory Functions[J]. Cell. 2009, 136(2): 215-233. doi:10.1016/j.cell, 2009.01.002.
[2] Thirion, Muriel, Ochiya, et al. Roles of microRNAs in the Hepatitis B Virus Infection and Related Diseases [J]. Viruses, 2013, 5(11): 2690-2703. doi:10.3390/v5112690.
[3] 熊晓佳, 彭雁忠, 潘兴飞,等. 树突状细胞MicroRNA表达谱在HBsAg刺激后的变化 [J]. 中华实验和临床病毒学杂志, 2012, 26(5): 331-334. doi:10.3760/cma.j.issn.1003-9279.2012.05.004.
[4] Jin BX, Zhang YH, Jin WJ, et al. MicroRNA panels as disease biomarkers distinguishing hepatitis B virus infection caused hepatitis and liver cirrhosis [J]. Sci Rep, 2015, 5:15026. doi: 10.1038/srep15026.
[5] Arataki K, Hayes CN, Akamatsu S, et al. Circulating microRNA-22 correlates with microRNA-122 and represents viral replication and liver injury in patients with chronic hepatitis B [J]. J Med Virol, 2013, 85(5): 789-798. doi: 10.1002/jmv.23540.
[6] 章广玲, 王梅梅, 朱丽华,等. 筛选调节HBV增殖和HBsAg产生的宿主细胞的miRNA [J]. 第三军医大学学报, 2012, 34(1):44-48.
[7] Zhao JJ, Wang CM, Li MY,et al. Altered expression profiles of microRNAs in a stable hepatitis B virus-expressing cell line [J]. Chin Med J(Engl), 2009, 122(1):10-14. doi: 10.3901/JME.2009.11.010.
[8] Zhang H, Guan Y, Lu YY, et al. Circulating miR-583 and miR-663 Refer to ZHENG Differentiation in Chronic Hepatitis B [J]. Evid Based Complement Alternat Med, 2013, doi: 10.1155/2013/751341.
[9] Chen Y, Shen A, Rider P, et al. A liver-specific microRNA binds to a highly conserved RNA sequence of hepatitis B virus and negatively regulates viral gene expression and replication [J]. FASEB J. 2011, 25(12):4511-4521. doi: 10.1096/fj.11-187781.
[10] Offer SM, Butterfield GL, Jerde CR, et al. microRNAs miR-27a and miR-27b directly regulate liver dihydropyrimidine dehydrogenase expression through two conserved binding sites [J]. Mol. Cancer Ther, 2014, 13(3):742-751. doi: 10.1158/1535-7163.
[11] Wu XJ, Li Y, Liu D, et al. miR-27a as an oncogenic microRNA of hepatitis B virus- related hepatocellular carcinoma [J]. Asian Pac J Cancer Prev, 2013, 14(2):885-889. doi: http://dx.doi.org/10.7314/APJCP.2013.14.2.885
[12] Lv G, Hu Z, Tie Y, et al. MicroRNA-451 regulates activating transcription factor 2 expression and inhibits liver cancer cell migration [J]. Oncol Rep, 2014, 32(3):1021-1028. doi: 10.3892/or.2014.3296.
MicroRNA diagnostic markers for chronic hepatitis B and their relevance to the hepatitis B virus
ChenLin,LiPeiran,HuangYuxin,LiuAixia,ChenWeijiao,ZhangLan,GuoTongsheng,LiBoan
ClinicalLaboratoryCenter, 302HospitalofthePeople’sLiberationArmy,Bejing10003,China
GuoTongsheng,Email:gtsheng@sina.com;LiBoan,Email:lba@263.net
Objective To identity microRNA (miRNA) diagnostic markers for chronic hepatitis B (CHB) and analyze the potential correlation between miRNA expression level and hepatitis B virus (HBV) replication. Methods We analyzed the expression level of 10 miRNAs in plasma samples from 50 CHB patients and 50 healthy Donors by Fluorescence quantitative PCR. A miRNA expression panel for chronic hepatitis B was found out through analysis of expression differences, accordingly a regression diagnosis model was established. The relationship between the miRNAs expression level and HBV DNA viral load was also visualized by Spearman rank correlation analysis. Results The expression level of 8 miRNAs were significantly different between CHB patients and healthy controls. miR-451a was down-regulated and other 7 miRNAs were up-regulated. Logistic model based on data from miR-122-5p, miR-27a-3p and miR-451a showed that area under curve (AUC) was 1, and sensitivity and specificity of the diagnostics CHB from healthy sample reached 100% in these case. The expression level of miR-122-5p had a significantly positive correlation with HBV DNA load. Conclusions For diagnosis of CHB, miR-122-5p, miR-27a-3p and miR-451a could be used as new markers which play an important role in occurrence and development of CHB.
miRNA; Hepatitis B virus; Hepatitis B chronic
郭桐生,Email:gtsheng@sina.com;李伯安,Email:lba@263.net
10.3760/cma.j.issn.1003-9279.2016.05.001
miRNA;肝炎病毒,乙型;肝炎,乙型,慢性
2016-05-23)

