β地中海贫血引起的糖尿病1例并文献复习
俞灵莺++施鹏飞++傅晓丹+张楚
[摘要] 报告1例β地中海贫血造成铁超载继发血色病,血色病引起特殊类型糖尿病。本病江浙地区少见,复习相关文献,以期提高对本病的识别与鉴别诊断能力,早期诊断、改善患者预后。
[关键词] 糖尿病;血色病;地中海贫血;铁超负荷
[中图分类号] R556.61 [文献标识码] C [文章编号] 1673-9701(2016)23-0149-03
[Abstract] A case of specific type of diabetes due to hemochromatosis was presented and secondary to the beta-thalassemia after genic examination. The type of diabetes was rare in the areas of Jiangsu and Zhejiang. We reviewed the relate literatures,and then summarized the diagnosis,differential diagnosis and the treatment for the specific type of diabetes.
[Key words] Diabetes mellitus; Hemochromatosis; Thalassemia; Iron overload
地中海贫血造成铁超载可继发血色病,血色病累及胰腺引起的糖代谢紊乱是一种特殊类型糖尿病。本病江浙地区少见,本院新近诊断1例β地中海贫血引起血色病并糖尿病(diabetes mellitus,DM),结合文献复习报道如下。
1 病例资料
患者男性,62岁。入院时间2015年10月30日,因“皮肤色素沉着1年余,乏力半年,加重1个月余”入院。患者1年前无明显诱因出现皮肤色素沉着,不伴瘙痒,无出血、瘀点瘀斑。无关节肌肉肿痛,无胸闷气急、畏寒发热,未诊治。半年前起乏力,双下肢浮肿。1个月前乏力、浮肿进行性加重,伴下肢麻木、皮肤巩膜黄染,无头晕头痛,无黑朦晕厥,遂就诊当地医院,住院治疗未好转,乃转诊我院。起病以来,精神可,纳差,睡眠一般。大便无殊,小便色黄偏红,量如常。体重无明显增减。既往否认糖尿病、高血压、心肝肺和肾病史。无手术、中毒、输血史。个人史:吸烟40余年,半包/d,已戒1个月余;饮酒40余年,白/啤酒,4~5两/d。婚育史无殊。家族中一女儿有小细胞低色素性贫血。
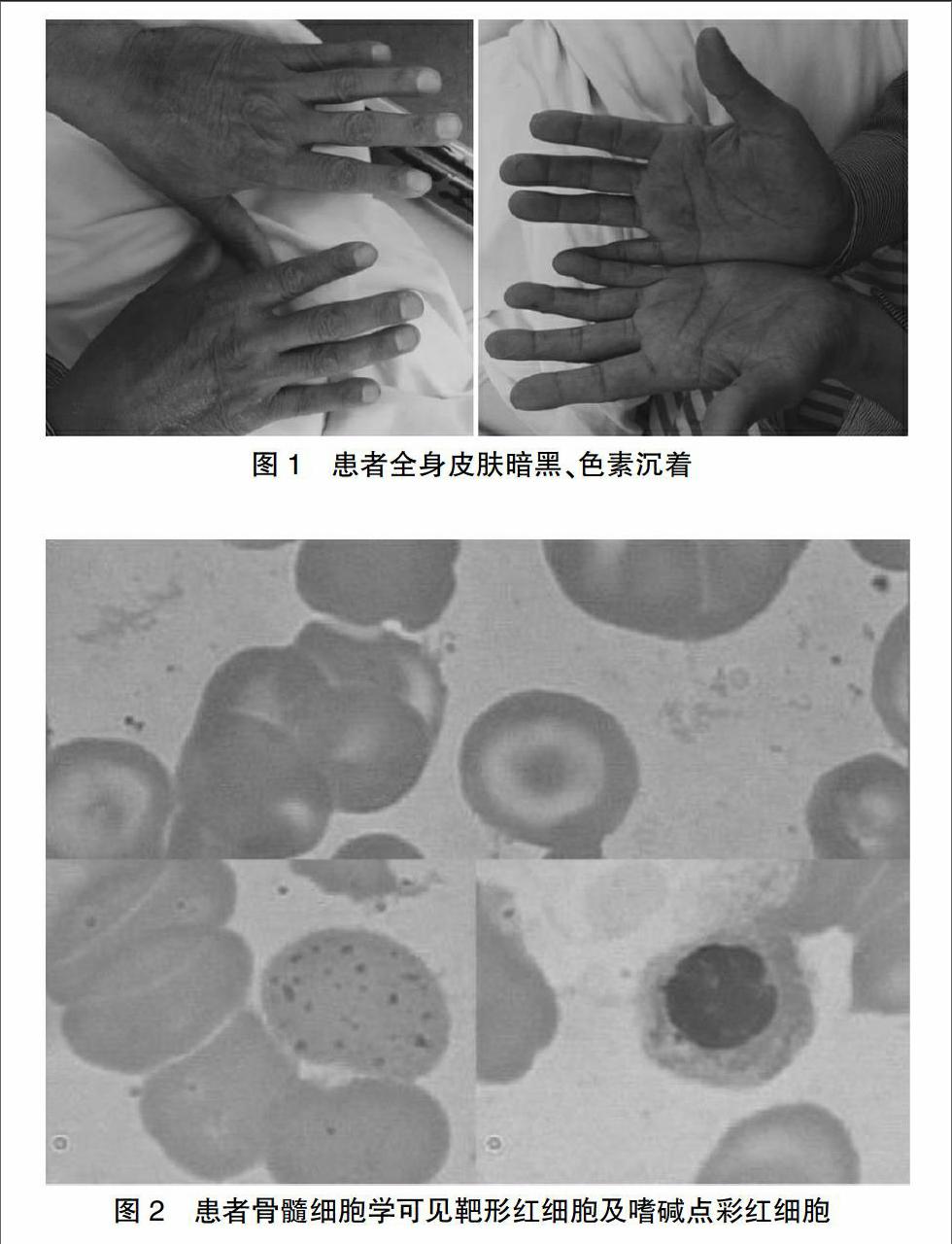
体格检查:T 36.4℃,P 60次/min,R 19次/min,BP 125/65 mmHg,神志清,精神可,周身皮肤暗黑(图1),颈软,无抵抗,颈静脉无充盈,肝颈返流征阴性。心肺听诊无殊。腹膨,叩诊浊音,无压痛及反跳痛,肝脾肋下触诊不满意。双下肢浮肿。神经系统病理征未引出。
实验室检查 (外院)生化:谷丙转氨酶(ALT)22 IU/L,谷草转氨酶(AST)94 IU/L,谷氨酰氨基转移酶(γGT)156 IU/L。血常规:血红蛋白(Hb)79 g/L。(本院)生化:ALT 21U/L(9~50),AST 70U/L(15~40),白蛋白(ALB) 29.5 g/L(40.0~55.0),总胆红素 162.1 μmol/L(3.4~20.5),葡萄糖(BG)11.36 mmol/L(3.9~6.1),肌酐79 μmol/L(41~111)。入院监测床边手指血糖空腹(7.2~7.6) mmol/L,餐后2 h血糖(10.1~18.0) mmol/L。血常规:Hb 71g/L(130~175),红细胞 2.68×1012/L(4.3~5.8),红细胞压积0.205(0.400~0.500),平均红细胞体积76.4fl(82.0~100),平均血红蛋白含量26.3 pg(27~34),平均血红蛋白浓度344 g/L(316~354);白细胞3.9×109/L(3.5~9.5),中性粒细胞49.1%(40.0~75.0),血小板 38×109/L(125~350)。凝血功能:凝血酶原时间20.7 sec(10.0~14.0),部分凝血活酶时间64.9 sec(24.0~40.0),凝血酶时间26.5 sec(14.0~21.0),纤维蛋白原0.92 g/L(2.00~4.00)。血清铁(SF)29.4 μmol/L(12.5~32.2),转铁蛋白饱和度(TS)98%(20~55),铁蛋白(FER)1546.3 μg/L(34.0~310.0)。骨髓细胞学:有核细胞增生活跃;粒系相对比下降,以晚幼、杆状及分叶为主;红系增生显著(占42.5%),以中晚为主,可见嗜碱性点彩,成熟红细胞大小不一,可见靶形红细胞及嗜碱点彩红细胞(图2);淋巴细胞占11.5%;全片共见51只巨核细胞,以颗粒型为主。β地中海贫血基因突变654杂合阳性。自身抗体、自身免疫肝病抗体、血管炎抗体及病毒性肝炎抗体均阴性。
辅助检查:外院B超:肝回声粗,脾肿大;腹腔积液。胃镜:浅表萎缩性胃炎,门脉高压性胃病,食道静脉显露。电子肠镜:门脉高压性肠病,结肠多发息肉。磁共振胰胆管成像:胆囊多发小结石伴慢性胆囊炎急性发作;肝脾轻度肿大伴含铁血黄素沉积可能,血色病?本院肺CT:慢性支气管炎、肺气肿。超声:后腹膜未见异常回声团块;双侧颈部、腋下、腹股沟多发淋巴结可及。肝脏磁共振(MRI):肝、脾轻度肿大伴肝、脾信号普遍减低,肝脏为著,考虑含铁血黄素沉积,血色病表现可符(图3)。
诊断:1.β地中海贫血,继发性血色病,特殊类型糖尿病;2.肝硬化,门脉高压;3.胆囊多发结石胆囊炎。
2 讨论
患者最初以发现血糖偏高就诊当地医院内分泌科,诊断为DM。因查体皮肤色素沉着,磁共振发现肝脏异常信号,拟诊血色病并DM转诊我院。
血色病诊断依据:①皮肤色素沉着、肝硬化、性功能不全、心力衰竭、糖尿病、关节痛;②实验室检查 SF>32 μmmol/L、TS>62%、FER>500 μg/L、去铁胺试验阳性;③CT和MRI反映肝铁含量增多;④脏器活检含铁血黄素沉积[1]。随着基因检测的出现以及MRI、CT对肝脏铁质沉积诊断的优势价值,肝脏活检作用逐渐由诊断疾病转向对已确诊患者进行预后评价[2]。该患者病史特点:男性,62岁;皮肤色素沉着1年余;查体全身皮肤暗黑;实验室检查高血糖,SF 29.4 μmol/L,TS 98%,FER 1546.3 μg/L;Child-Pugh评分10分,肝功能B级;MRI:肝脾含铁血黄素沉积表现,故符合血色病诊断。
广义血色病(Hemochromatosis,HC)是指铁过量沉积于肝脏、胰腺、心脏及其他实质器官,并对这些器官的结构和功能造成损害的疾病状态。原发性血色病又称遗传性血色病(hereditary hemochromatosis,HH)是先天性铁代谢异常造成上述结果的遗传性疾病,按病因分类,90%以上由于第6号染色体血色病基因(HFE基因)突变,最常见 C282Y 错义突变,纯合子型;其次C282Y/H63D 杂合子型;少见非HFE,包括多种铁调节基因,如铁调素(HAMP)、血幼素(HJV或称HFE2)、转铁蛋白受体2(TFR2)及膜转铁蛋白(FPN)等基因突变。继发性血色病是由于其他疾病或治疗措施导致体内铁过度沉积[2]。研究最多的是地中海贫血,简称地贫,属于珠蛋白基因缺陷所致遗传病,主要分α地贫和β地贫。我国以南方两广地区携带为主,本地区少见。
本例患者病史另一重要特点是贫血,呈中度小细胞低色素性贫血,外周血涂片及骨髓细胞学检查均可见靶形红细胞、嗜碱点彩等特征性表现;其女儿也有小细胞性贫血;最后经基因诊断明确为β地中海贫血。
血色病与糖尿病 HH曾被描述为DM、肝硬化和皮肤色素沉着三联征。近年一项报道HFE突变患者中DM患病率13%,IGT 15%,而野生型者DM未增加[3]。研究发现由于HH患者缺乏HFE蛋白,下调铁调素,引起FPN表达增加、肠道铁吸收不恰当增加[4]。HH小鼠模型显示继发于铁超载引起的氧化应激导致胰岛素分泌减少、β细胞凋亡增加[5]。
继发性血色病地贫患者由于无效造血,一部分红细胞未达到成熟即在骨髓内被破坏,外周病理性红细胞大部分在脾脏或单核巨噬细胞系统中破坏,而体内2/3的铁存在于血红蛋白内,慢性溶血引起铁负荷增加;长期慢性溶血、无效性红细胞生成进一步加重贫血;同时本病下调铁调素[6]基因引起小肠对铁吸收增加,但生物利用度下降,造成铁过度沉积。与HH不完全相同,地贫时胰岛素抵抗更为显著,伴随胰岛素分泌不足[7]。其中一个表现是高铁饮食小鼠模型脂联素水平显著下降[8]。脂联素是脂肪细胞分泌的脂肪因子,与增加胰岛素敏感性相关,通过改善胰岛素信号的传递促进肝脏和肌肉脂肪酸氧化[9]。一项大型研究显示铁蛋白水平与脂联素负相关,与脂肪细胞胰岛素抵抗相关[10]。
铁超载与糖尿病:①铁沉积干扰肝脏、肌肉胰岛素的利用。Cavallo-Perin等[11]研究显示地贫患者体内铁过载可能导致肝脏对胰岛素敏感度降低。Tsuchiya等[12]实验数据证实肝铁过载的患者大部分出现胰岛素抵抗。Moirand[13]在1997年提出“肝铁超负荷-胰岛素抵抗综合征”,认为肝铁超载患者绝大多数(95%)有胰岛素抵抗表现的一种或多种肥胖、高脂血症、糖代谢异常和高血压。②铁沉积引起胰腺中胰岛素合成和分泌减少。Choi等[14]实验显示铁过载引发胰岛素蛋白表达下降,同时胰岛素的合成也会下降。过量铁可能通过胰岛β细胞表面的二价金属转运体,使细胞产生氧化应激反应,造成胰岛素分泌下降,导致高血糖的产生。体外研究,转铁蛋白受体、葡萄糖转运子和胰岛素样生长因子均定位于细胞微粒体膜中。胰岛素刺激葡萄糖转运的同时可能伴随转铁蛋白向细胞膜的再分布,从而介导细胞对铁的摄取,致使细胞内铁超负荷[15]。胰岛素与铁潜在的相互作用形成了恶性循环,加重胰岛素抵抗和诱导糖尿病的发生。
本例患者起病时间短,入院1个月前诊断糖尿病,结合β地贫、血色病诊断明确,糖尿病病因继发于血色病可符。此外酒精性肝病也可引起糖代谢紊乱,容易引起空腹低血糖、餐后高血糖,患者有嗜酒史,可加重糖代谢紊乱;由于患者MRI“黑肝”表现典型[16],首先考虑血色病是其糖尿病的主要病因。
治疗:①血色病早期治疗可防止肝硬化。②早期发现。研究显示减少铁贮存可提高脂联素水平并降低DM风险[17]。对症状、体征或家族史提示血色病的患者应进行铁代谢和相关基因检查;建议该患者女儿行铁检测和地贫基因检测,以期早期干预,预防糖尿病等靶器官损害。③铁过载治疗,静脉放血术,螯合剂。根据美国肝病学会2011血色病诊疗指南,对于红细胞生成障碍综合征或慢性溶血性贫血等铁过度沉积的患者,建议给予甲磺酸去铁胺(deferoxamine mesylate)或地拉罗司(deferasirox)等铁螯合剂治疗[18];④糖尿病治疗,铁过载者驱铁治疗可改善胰岛素抵抗和胰岛细胞功能,2型DM模型放血治疗或低铁饮食可降低HbA1c[19-21]。基于胰岛素、C肽并非绝对缺乏,可根据病因给予胰岛素或药物降糖。
[参考文献]
[1] 陈灏珠,林果为. 实用内科学[M]. 第11版. 北京:人民卫生出版社,2009:1111-1112.
[2] 李丽,贾继东,王宝恩. 血色病的欧美诊断治疗规范[J]. 胃肠病学和肝病学杂志,2008,17(1):1-3.
[3] Hatunic M,Finucane FM,Brennan AM,et al. Effect of iron overload on glucose metabolism in patients with hereditary hemochromatosis[J]. Metabolism,2010,59(3):380-384.
[4] Nemeth E,Tuttle MS,Powelson J,et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J]. Science,2004,306(5704):2090-2093.
[5] Cooksey RC,Jouihan HA,Ajioka RS,et al. Oxidative stress,beta-cell apoptosis,and decreased insulin secretory capacity in mouse models of hemochromatosis[J]. Endocrinology,2004,145(11):5305-5312.
[6] 唐旭东,张路,刘锋,等. 铁过载治疗的新靶点:第56届美国血液学会年会报道[J]. 白血病·淋巴瘤,2015,24(4):211-213.
[7] Fernandez-Real JM,Lopez-Bermejo A,Ricart W. Cross-talk between iron metabolism and diabetes[J]. Diabetes,2002,51(8):2348-2354.
[8] Gabrielsen JS,Gao Y,Simcox JA,et al. Adipocyte iron regulates adiponectin and insulin sensitivity[J]. J Clin Invest,2012,122(10):3529-3540.
[9] Ruan H,Dong LQ. Adiponectin signaling and function in insulin target tissues[J]. J Mol Cell Biol,2016,8(2):101-109.
[10] Simcox JA,McClain DA. Iron and diabetes risk[J]. Cell Metab,2013,17(3): 329-341.
[11] Cavallo-Perin P,Pacini G,Cerutti F,et al. Insulin resistance and hyperinsulinemia in homozygous beta-thalassemia[J]. Metabolism,1995,43(3):281-286.
[12] Tsuchiya H,Ebata Y,Sakabe T,et al. High-fat,high-fructose diet induces hepatic iron overload via a hepcidin-independent mechanism prior to the onset of liver steatosis and insulin resistance in mice[J]. Metabolism,2013,62(1):62-69.
[13] Moirand R,Mortaji AM,Loréal O,et al. A new syndrome of liver iron overload with normal transferrin saturation[J].Lancet,1997,349(9045):95-97.
[14] Choi JS,Koh IU,Lee HJ,et al. Effects of excess dietary iron and fat on glucose and lipid metabolism[J]. J Nutr Biochem,2013,24(9):1634-1644.
[15] Jiang X,Wang H,Shi W. Hyperinsulinemia induces hepatic iron overload by increasing liver TFR1 via the PI3K/IRP2 pathway[J]. J Mol Endocrinol,2014,53(3): 381-392.
[16] 张倩,侯波,王璐,等. 磁共振成像技术定量检测铁过载的临床意义[J]. 中华血液学杂志,2015,36(3):302-306.
[17] Gamberini MD,Sanctis V,Gilli G. Hypogonadism,diabetes mellitus,hypothyroidism,hypoparathyroidism:Incidence and prevalence related to iron overload and chelation therapy in patients with thalassaemia major followed from 1980 to 2007 in the Ferrara Centre[J]. Pediatr Endocrinol Rev,2008,6(s1):158-169.
[18] Bacon BR,Adams PC,Kowdley KV,et al. Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases[J]. Hepatology,2011,54(1):328-343.
[19] Minamiyama Y,Takemura S,Kodai S,et al. Iron restriction improves type 2 diabetes mellitus in Otsuka Long-Evans Tokushima fatty rats[J]. Am J Physiol Endocrinol Metab,2010,298(6):E1140-E1149.
[20] Cooksey RC,Jones D,Gabrielsen S,et al. Dietary iron restriction or iron chelation protects from diabetes and loss of beta-cell function in the obese (ob/ob lep-/-) mouse[J].Am J Physiol Endocrinol Metab,2010,298(6):1236-1243.
[21] Houschyar KS,Lüdtke R,Dobos GJ,et al. Effects of phlebotomy-induced reduction of body iron stores on metabolic syndrome:Results from a randomized clinical trial[J]. BMC Med,2012,10:54.
(收稿日期:2016-05-12)

