不同脂肪和葡萄糖水平对大黄鱼生长性能、肝脏糖酵解和糖异生关键酶活性的影响
马红娜 周飘苹 陆 游 袁 野 侯迎梅 孙 蓬 丁立云 周歧存
(宁波大学海洋学院鱼类营养研究室,宁波315211)
不同脂肪和葡萄糖水平对大黄鱼生长性能、肝脏糖酵解和糖异生关键酶活性的影响
马红娜周飘苹陆游袁野侯迎梅孙蓬丁立云周歧存*
(宁波大学海洋学院鱼类营养研究室,宁波315211)
本试验旨在研究不同脂肪和葡萄糖水平对大黄鱼生长性能、肝脏糖酵解和糖异生关键酶活性、血清生化指标、糖原含量及消化酶活性等的影响。采用2×3双因素试验设计,其中脂肪设5%、10% 2个水平,葡萄糖设10%、20%、30% 3个水平,共配制6种试验饲料。每种饲料设3个重复,每个重复放养平均体重为(14.79±0.13) g的大黄鱼幼鱼50尾。试验期为8周。结果表明:饲料脂肪和葡萄糖水平的交互作用对大黄鱼增重率(WGR)、特定生长率(SGR)和饲料效率(FE)的影响不显著(P>0.05)。在饲料脂肪水平为5%时,WGR和SGR随饲料葡萄糖水平增加而降低,30%葡萄糖组的WGR和SGR显著低于10%葡萄糖组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼全鱼水分和粗脂肪含量的影响显著(P<0.05),而对全鱼粗蛋白质含量无显著影响(P>0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼肝糖原、肌糖原含量有显著影响(P<0.05)。在饲料脂肪水平为5%时,肝糖原含量随饲料葡萄糖水平的升高而升高,而肌糖原含量随着饲料葡萄糖水平的升高先升高后降低;在饲料脂肪水平为10%时,肝糖原含量随饲料葡萄糖水平的升高先降低后升高,肌糖原含量随着饲料葡萄糖水平的升高而升高。饲料脂肪和葡萄糖水平的交互作用对大黄鱼血清总蛋白(TP)、总胆固醇(TC)、甘油三酯(TG)、葡萄糖含量及丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性无显著影响(P>0.05);然而,在饲料脂肪水平相同时,血清葡萄糖含量随饲料葡萄糖水平的升高而升高,30%葡萄糖组血清葡萄糖含量显著高于10%葡萄糖组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼肝脏葡萄糖激酶(GK)、磷酸果糖激酶(PFK)、磷酸烯醇式丙酮酸羧激酶(PEPCK)活性有显著影响(P<0.05),而对丙酮酸激酶(PK)、1,6-二磷酸果糖酶(FBPase)、6-磷酸葡萄糖酶(G6Pase)活性无显著影响(P>0.05)。在饲料脂肪水平为10%时,随饲料葡萄糖水平的升高,肝脏GK、PFK活性升高,肝脏PEPCK活性先升高后降低。由结果可知,与饲料脂肪水平为10%时相比,在饲料脂肪水平为5%时,随饲料葡萄糖的水平的升高,大黄鱼能够通过调节糖代谢关键酶活性及肝糖原含量来维持血糖含量的平衡,有效利用饲料中的葡萄糖。综合本试验结果,建议大黄鱼幼鱼阶段饲料适宜的脂肪和糖水平分别为10%和20%。
大黄鱼;葡萄糖;脂肪;生长性能;糖酵解关键酶;糖异生关键酶
大黄鱼(PseudosciaenacroceaRichardson)隶属于鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Pseudosciaena),为暖温性近海中下层集群洄游性鱼类,主要分布在我国黄海南部、东海、台湾海峡及南海北部[1],因其肉质鲜美而深受人们喜爱,是我国传统“海洋四大经济鱼类”之一[2],具有很高的经济价值。目前,大黄鱼养殖在我国黄海南部、东海及台湾海峡已经形成规模。但目前大黄鱼养殖中多采用冰鲜小杂鱼投喂,人工配合饲料推广缓慢,这主要是由于其各个生长阶段营养需求数据库不完善以及适口性好的配合饲料缺乏所致,从而成为制约大黄鱼健康养殖的关键因素之一。
蛋白质是鱼类的必需营养物质,但也是水产饲料中成本最高的部分。饲料中添加适量的非蛋白质能量物质(脂肪和糖类)能够节约饲料蛋白质,提高饲料利用率,进而降低饲料成本[3]。脂肪是一种重要的能源物质,它既可以为鱼类生长发育提供必需脂肪酸,同时还可促进鱼体对脂溶性维生素的吸收和运输[4]。据研究,饲料中适宜的脂肪水平可以提高饲料利用率,促进鱼类生长,但脂肪水平过高则会增加鱼体脂肪沉积,抑制鱼类正常生长,还影响饲料的制粒和保存[5]。与蛋白质相比,糖类是鱼类饲料中的廉价能源物质,饲料中适宜糖水平能够减少蛋白质供能,并减轻氮排泄对养殖水体造成的污染[3,6-8]。与脂肪相比,糖类具有相对廉价、来源较为广泛的优势,饲料中添加适量的糖类还可以增加饲料的黏结性,有利于制粒[9],但饲料糖水平过高不仅会抑制鱼类的生长,降低饲料利用率,还会导致鱼类抗病力弱、死亡率高[10-11]。研究表明,饲料中糖水平能够调节糖代谢关键酶的活性和表达量,进而对血糖含量产生影响[12],目前在大菱鲆(Scophthalmusmaximus)[13]、舌齿鲈(Dicentrarchuslabrax)[14]、金头鲷(Sparusaurata)[15]、花鲈(Lateolabraxjaponicus)[16]、欧洲鳗鲡(Anguillaanguilla)[17]、瓦氏黄颡鱼(Pelteobagrusvachelli)[18]、鳡(Elopichthysbambusa)[19]和翘嘴红鲌(ErythroculterilishaeformisBleeker)[11]等鱼类中均有研究,研究这些酶活性及表达量的变化有助于了解鱼类糖代谢机制。
目前对大黄鱼的蛋白质、脂肪、氨基酸、饲料原料消化率和蛋白质源替代等方面均有研究[1-2,20-24],但有关糖类的研究较少。有鉴于此,本试验设计2个脂肪水平(5%和10%)、3个葡萄糖水平(10%、20%和30%),研究不同脂肪和葡萄糖水平对大黄鱼生长性能、肝脏糖酵解和糖异生关键酶活性、血清生化指标、糖原含量及消化酶活性等的影响,从而为大黄鱼资源节约型配合饲料的研制提供基础数据和理论参考。
1 材料与方法
1.1试验设计与试验饲料
本试验采用2×3双因素试验设计,以饲料脂肪和葡萄糖水平为影响因素。以葡萄糖为糖源,鱼粉和小麦蛋白粉为蛋白质源,鱼油、豆油和大豆卵磷脂为脂肪源,其中饲料脂肪水平分别为5%、10%,葡萄糖水平分别10%、20%、30%,共配制6种等氮饲料,即5/10、5/20、5/30、10/10、10/20、10/30,试验饲料组成及营养水平见表1。按照表1配方将所有原料粉碎后过80目筛网,维生素和矿物质预混料等微量组分采用逐级扩大法混合,再加入鱼油、豆油和大豆卵磷脂以及水混合均匀,用双螺杆挤条机(FⅡ-26,华南理工大学机械厂生产)制成粒径分别为2和4 mm的硬颗粒饲料,在烘箱中90 ℃熟化30 min,自然风干,饲料密封后保存在-20 ℃冰箱中备用。
1.2饲养管理
试验用大黄鱼鱼苗购于象山港湾水产苗种有限公司,并在浙江省宁波市象山县西沪港湾鱼排进行试验。正式试验前,所有鱼苗在大规格网箱(3.0 m×3.0 m×3.0 m)暂养2周,用普通商业饲料(健马牌大黄鱼饲料,福建天马饲料有限公司产品)饱食投喂。暂养结束后,挑选体格健壮、规格一致、初重为(14.79±0.13) g的大黄鱼鱼苗900尾,随机分配于18个小规格浮伐式网箱(1.5 m×1.5 m×2.0 m)中,每个网箱50尾,每种试验饲料随机投喂3个网箱的试验鱼,即每组3个重复,共6个组。试验期为8周。试验期间,每天饱食投喂2次(05:00和17:00),海水温度为26.5~31.5 ℃,盐度为32~36 g/L,溶解氧浓度不低于7.0 mg/L。
1.3样品采集与指标测定
养殖试验结束后饥饿24 h,将鱼捞出,用丁香酚(1∶10 000)麻醉,称重并记录每个网箱的大黄鱼尾数及总重,用于计算成活率(SR)、增重率(WGR)、特定生长率(SGR)和饲料效率(FE)。每个网箱随机选取3尾鱼作为全鱼样品,用于鱼体常规营养成分分析。每个网箱再随机取3尾鱼称重、量体长,取其肝脏、内脏并称重,用于计算肥满度(CF)、肝体比(HSI)、脏体比(VSI)。每个网箱另取4尾鱼,从尾部静脉抽取血样,注入1.5 mL离心管,静置于4 ℃冰箱过夜,3 500 r/min离心8 min取上清制得血清,置于-80 ℃冰箱备用。将部分取过血的大黄鱼肝脏、前肠(肠道组织前端1/3部分)剥离,放置于2 mL离心管中(取完立即放入液氮中),用于检测肝脏糖酵解和糖异生关键酶[葡萄糖激酶(GK)、6-磷酸果糖激酶(PFK)、丙酮磷酸激酶(PK)、葡萄糖-6-磷酸酶(G6Pase)、果糖-1.6-二磷酸酶(FBPase)、磷酸烯醇式丙酮酸羧激酶(PEPCK)]活性、肝糖原含量以及前肠淀粉酶和脂肪酶活性;取背部肌肉10 g左右,装于密封袋中,用于检测肌糖原含量。
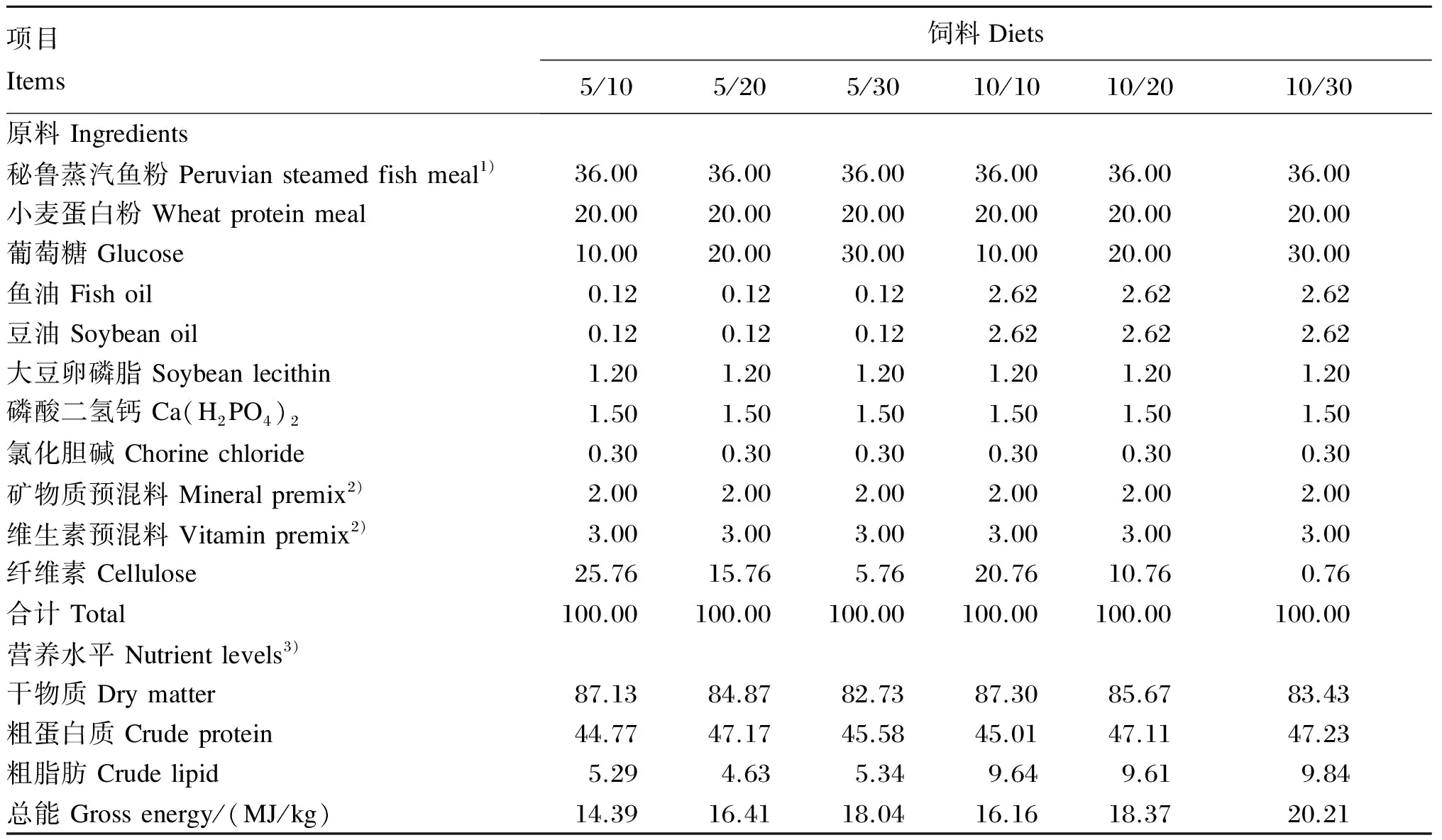
表1 试验饲料组成及营养水平(风干基础)
1)秘鲁蒸汽鱼粉粗蛋白质含量为660 g/kg,粗脂肪含量为85 g/kg。The contents of crude protein and crude lipid of Peruvian steamed fish meal were 660 and 85 g/kg, respectively.
2)矿物质预混料和维生素预混料参照Mai等[25]配制。Mineral premix and vitamin premix were prepared according to Mai, et al[25].
3)营养水平为实测值。Nutrient levels were measured values.
饲料和鱼体常规营养成分的分析参照AOAC(1995)[26]的方法。其中,粗蛋白质含量检测采用凯氏定氮法;粗脂肪含量检测采用索氏抽提法;水分含量检测采用105 ℃烘干恒重法。血清生化指标[总蛋白(TP)、总胆固醇(TC)、甘油三酯(TG)、葡萄糖、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]送往宁波大学医学院附属医院利用全自动生化分析仪(日立7600-110,日本)进行检测。肝糖原与肌糖原含量的检测参照Hassid等[27]的化学分析法,使用南京建成生物工程研究所生产的试剂盒检测。肠道淀粉酶活性采用南京建成生物工程研究所生产的试剂盒检测。肠道脂肪酶活性以及肝脏糖酵解和糖异生关键酶活性采用上海乔杜生物科技公司生产的酶联免疫吸附试验(ELISA)试剂盒检测。
1.4计算公式
增重率(%)=100×(Wt-W0)/W0;
特定生长率(%/d)=100×(lnWt-lnW0)/t;
成活率(%)=100×Nt/N0;
肝体比(%)=100×Wh/W;
脏体比(%)=100×Wv/W;
肥满度(g/cm3)=100×W/L3;
饲料效率=(Wt-W0)/F。
式中:W0为试验鱼初重(g);Wt为试验鱼末重(g);F为饲料摄入量(g);t为试验天数(d);Nt为试验结束时鱼数量(尾);N0为试验开始时鱼数量(尾);W为体重(g);L为体长(cm);Wh为肝脏重(g);Wv为内脏重(g)。
1.5数据统计与分析
所有数据采用SPSS 17.0软件对数据进行统计学分析,先以饲料脂肪和葡萄糖水平为影响因素进行双因素方差分析(two-way ANOVA),然后对相同脂肪水平的试验组采用Duncan氏法进行多重比较,最后对相同葡萄糖水平的试验组进行独立样本t检验(independent-samplesttest),P<0.05表示差异显著。数据采用平均值±标准差(mean±SD)表示。
2 结 果
2.1不同脂肪和葡萄糖水平对大黄鱼生长性能、形态学指标和饲料利用的影响
不同脂肪和葡萄糖水平对大黄鱼生长性能、形态学指标和饲料利用的影响结果见表2。在饲料脂肪水平为5%时,30%葡萄糖组的末重、增重率和特定生长率显著低于10%葡萄糖组(P<0.05);在饲料脂肪水平为10%时,30%葡萄糖组的末重、增重率和特定生长率显著低于10%和20%葡萄糖组(P<0.05)。在饲料葡萄糖水平相同时,10%脂肪组的末重、增重率和特定生长率高于5%脂肪组,但差异不显著(P>0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼的末重、增重率、特定生长率、成活率、肝体比、脏体比、肥满度和饲料效率的影响不显著(P>0.05)。

表2 不同脂肪和葡萄糖水平对大黄鱼的生长性能、形态学指标和饲料利用的影响
同行数据肩标不同小写字母表示同一脂肪水平下葡萄糖水平组间差异显著(P<0.05);同列数据肩标不同大写字母表示同一葡萄糖水平下不同脂肪水平组间差异显著(P<0.05)。下表同。
Values in the same row with different small letter superscripts indicated significant difference among different glucose level groups following the same lipid level (P<0.05); values in the same column with different capital letter superscripts indicated significant difference among different lipid level groups following the same glucose level (P<0.05). The same as below.
2.2不同脂肪和葡萄糖水平对大黄鱼全鱼常规营养成分的影响
不同脂肪和葡萄糖水平对大黄鱼全鱼常规营养成分的影响结果见表3。在饲料脂肪水平相同时,30%葡萄糖组全鱼粗脂肪含量显著低于10%和20%葡萄糖组(P<0.05),而全鱼水分含量在30%葡萄糖组最高,在饲料脂肪水平为5%时显著高于10%葡萄糖组(P<0.05),在饲料脂肪水平为10%时显著高于20%葡萄糖组(P<0.05)。在饲料葡萄糖水平相同时,10%脂肪组的全鱼粗脂肪含量显著高于5%脂肪组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼全鱼水分和粗脂肪含量的影响显著(P<0.05),而对全鱼粗蛋白质含量无显著影响(P>0.05)。

表3 不同脂肪和葡萄糖水平对大黄鱼全鱼常规营养成分的影响
2.3不同脂肪和葡萄糖水平对大黄鱼肝糖原和肌糖原含量的影响
不同脂肪和葡萄糖水平对大黄鱼肝糖原和肌糖原含量的影响结果见表4。在饲料脂肪水平为5%时,肝糖原含量随饲料葡萄糖水平的升高呈升高趋势,10%葡萄糖组大黄鱼肝糖原含量显著低于20%和30%葡萄糖组(P<0.05);在饲料脂肪水平为10%时,肝糖原含量随饲料葡萄糖水平的升高先降低后升高,10%葡萄糖组的大黄鱼肝糖原含量显著高于20%和30%葡萄糖组(P<0.05)。在饲料葡萄糖水平为10%时,10%脂肪组肝糖原含量显著高于5%脂肪组(P<0.05);而在饲料葡萄糖水平为20%或30%时,5%脂肪组肝糖原含量显著高于10%脂肪组(P<0.05)。在饲料脂肪水平为5%时,肌糖原含量随着饲料葡萄糖水平的升高先上升后降低,20%葡萄糖组大黄鱼肌糖原含量显著高于10%和30%葡萄糖组(P<0.05);在饲料脂肪水平为10%时,肌糖原含量随着饲料葡萄糖水平的升高而上升,30%葡萄糖组大黄鱼肌糖原含量显著高于10%和20%葡萄糖组(P<0.05)。在饲料葡萄糖水平为10%或20%时,5%脂肪组肌糖原含量显著高于10%脂肪组(P<0.05);而在饲料葡萄糖水平为30%时,10%脂肪组肌糖原含量显著高于5%脂肪组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼肝糖原、肌糖原含量有显著影响(P<0.05)。

表4 不同脂肪和葡萄糖水平对大黄鱼肝糖原和肌糖原含量的影响
2.4不同脂肪和葡萄糖水平对大黄鱼血清生化指标的影响
不同脂肪和葡萄糖水平对大黄鱼血清生化指标的影响结果见表5。在饲料脂肪水平相同时,血清葡萄糖含量随饲料葡萄糖水平的升高而升高,30%葡萄糖组血清葡萄糖含量显著高于10%葡萄糖组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼血清TP、TC、TG、葡萄糖含量及ALT、AST活性无显著影响(P>0.05)。

表5 不同脂肪和葡萄糖水平对大黄鱼血清生化指标的影响
2.5不同脂肪和葡萄糖水平对大黄鱼前肠消化酶活性的影响
不同脂肪和葡萄糖水平对大黄鱼前肠消化酶活性的影响结果见表6。在饲料脂肪水平相同时,前肠脂肪酶活性随饲料葡萄糖水平的升高先升高后降低,以20%葡萄糖组前肠脂肪酶活性最高,显著高于10%和30%葡萄糖组(P<0.05)。在饲料葡萄糖水平相同时,10%脂肪组脂肪酶活性显著高于5%脂肪组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼前肠脂肪酶活性有显著影响(P<0.05),而对淀粉酶活性无显著影响(P>0.05)。

表6 不同脂肪和葡萄糖水平对大黄鱼前肠消化酶活性的影响
2.6不同脂肪和葡萄糖水平对大黄鱼肝脏糖酵解和糖异生关键酶活性的影响
不同脂肪和葡萄糖水平对大黄鱼肝脏糖酵解和糖异生关键酶活性的影响结果见表7。在饲料脂肪水平为5%时,20%葡萄糖组大黄鱼肝脏GK活性显著低于30%葡萄糖组(P<0.05);而在饲料脂肪水平为10%时,10%葡萄糖组大黄鱼肝脏GK活性显著低于20%和30%葡萄糖组(P<0.05)。在饲料葡萄糖水平为20%或30%时,10%脂肪组大黄鱼肝脏GK活性显著高于5%脂肪组(P<0.05)。在饲料脂肪水平相同时,大黄鱼肝脏PFK活性随饲料葡萄糖水平的升高而升高,10%葡萄糖组大黄鱼肝脏PFK活性显著低于20%和30%葡萄糖组(P<0.05);而在饲料葡萄糖水平相同时,10%脂肪组大黄鱼肝脏PFK活性显著高于5%脂肪组(P<0.05)。在饲料脂肪水平为5%时,30%葡萄糖组大黄鱼肝脏PEPCK活性显著高于10%和20%葡萄糖组(P<0.05);而在饲料脂肪水平为10%时,20%葡萄糖组大黄鱼肝脏PEPCK活性显著高于10%葡萄糖组(P<0.05)。在饲料葡萄糖水平为10%或20%时,10%脂肪组大黄鱼肝脏PEPCK活性显著高于5%脂肪组(P<0.05);而在饲料葡萄糖水平为30%时,5%脂肪组大黄鱼肝脏PEPCK活性显著高于10%脂肪组(P<0.05)。饲料脂肪和葡萄糖水平的交互作用对大黄鱼肝脏GK、PFK和PEPCK活性有显著影响(P<0.05),而对PK、FBPase、G6Pase活性无显著影响(P>0.05)。

表7 不同脂肪和葡萄糖水平对大黄鱼肝脏糖酵解和糖异生关键酶活性的影响
3 讨 论
3.1不同脂肪和葡萄糖水平对大黄鱼生长性能、形态学指标和饲料利用的影响

本研究结果表明饲料脂肪和葡萄糖水平的交互作用对大黄鱼的成活率无显著影响,在鳡[19]和建鲤[34]的研究中获得了相似的结果。饲料中过高水平的葡萄糖尚未达到其最低的耐受限度,虽然导致生长性能的下降,但大黄鱼尚未表现出致死的效应。肝体比常被用于评价鱼类的营养状态,一般认为鱼类摄食高水平糖类的饲料后会导致鱼体肝脏脂肪的积累,从而引起肝体比的上升[39],但在本试验中发现,饲料葡萄糖水平对大黄鱼的肝体比无显著影响,这与在青鱼[40]、条纹鲈(Moroulsatatilis)[41]上得到的结果相似,且王猛强等[42-43]研究表明葡萄糖和小麦淀粉均不会引起大黄鱼肝体比的变化。究其原因,大黄鱼对葡萄糖的利用能力较低,由葡萄糖合成脂肪并在肝脏中沉积的能力较低。
3.2不同脂肪和葡萄糖水平对大黄鱼全鱼常规营养成分的影响
饲料脂肪和葡萄糖水平的交互作用对大黄鱼全鱼水分和粗脂肪含量的影响显著,而对粗蛋白质含量无显著影响。有研究表明鱼体粗蛋白质含量主要与鱼体规格和所处的生长阶段有关[44],饲料糖水平对鱼体的水分、粗蛋白质和肌糖原含量没有显著影响[45-49],对鱼体粗脂肪含量的影响显著,饲料糖类一定程度上可以转化为鱼体脂肪[50-51]。另一些研究发现,随饲料糖类与脂肪比值的升高,非洲鲇(Clariasgariepinus)[45]和星斑川鲽(Platichthysstellatus)[48]等鱼体粗脂肪含量降低,产生这种现象的原因主要是脂肪绝对摄入量的减少。本试验中,在饲料脂肪水平相同时,鱼体粗脂肪含量在饲料葡萄糖水平为10%与20%时差异不显著,而在30%时显著降低,与上述研究结果都不同。在饲料葡萄糖水平相同时, 10%脂肪组的鱼体粗脂肪含量显著高于5%脂肪组,表明当脂肪摄入较多时容易在大黄鱼体内沉积,这一结果与在黄颡鱼(Pelteobagrusfulvidraco)[52]上得出的结果相似。本试验结果表明,大黄鱼对脂肪的利用能力要高于糖类(葡萄糖),并将脂肪沉积于鱼体中。
海外业务不仅为五建赢得了可观的效益,也带来了观念的更新,而且为五建培养了一大批具有海外运作经验的专业人才。尽管在过程中有过巨大的挫折和沉痛的教训,但五建人坚强地挺下来、走过去了。目前,海外项目施工已占五建营业收入占比超过53%,利润占比超过70%。
3.3不同脂肪和葡萄糖水平对大黄鱼肝糖原和肌糖原含量的影响
饲料脂肪和葡萄糖水平的交互作用对大黄鱼的肝糖原和肌糖原含量有显著影响。在饲料脂肪水平为5%时,肝糖原含量随饲料葡萄糖水平的升高而显著升高,这与在欧洲舌齿鲈[53]、虹鳟(Salmogairdneri)[54]上的研究结果相同,表明高葡萄糖水平显著增加了肝糖原含量,而且本试验中10%葡萄糖组饲料纤维素含量较高,纤维素会延缓葡萄糖的吸收[31],导致10%葡萄糖组肝糖原含量明显低于其他各组。在饲料脂肪水平为10%时,10%葡萄糖组肝糖原含量显著高于20%和30%葡萄糖组,具体原因尚需要进一步探究。Moro等[55]的研究也认为,饲料中过多的糖类会转化为糖原储存在肝脏、肌肉中,导致肝糖原和肌糖原含量升高。本试验中,在饲料葡萄糖水平为10%时,10%脂肪组大黄鱼肝糖原含量显著高于5%脂肪组;在饲料葡萄糖水平为20%或30%时,5%脂肪组肝糖原含量均显著高于10%脂肪组。当糖源为糊精时,所得结果[52]与本试验相似,这表明大黄鱼利用糖的能力有限,当饲料低糖高脂时,鱼体更容易利用脂肪分解产物就如进入糖代谢循环,形成肝糖原。
3.4不同脂肪和葡萄糖水平对大黄鱼血清生化指标的影响
动物在正常生理状态下能够维持各项生理指标的动态稳定,而血液组成成分的变化在一定程度上能够反映动物此时的健康状态[56]。鱼类(尤其是肉食性鱼类)对糖类的耐受性较差,摄食添加有糖类的饲料后血糖含量通常持续偏高[48,57],且血糖含量与饲料糖类水平呈正相关[43]。本试验中,当饲料脂肪水平为5%时,血清葡萄糖含量随饲料葡萄糖水平的升高适应性升高;当饲料脂肪水平为10%时,血清葡萄糖含量在饲料葡萄糖水平为10%与20%时差异不显著,而在饲料葡萄糖水平为30%时则显著升高,表明与饲料脂肪水平为10%时相比,在饲料脂肪水平为5%时,大黄鱼能通过调节糖代谢及肝糖原含量来调节血糖含量平衡。
在饲料葡萄糖水平为30%时,10%脂肪组血清葡萄糖含量显著高于5%脂肪组,这可能是由于饲料葡萄糖水平过高使得过多的葡萄糖转化为脂肪,鱼体血液中脂肪达到一定量时其又会对此转化反应进行反馈抑制造成的。在饲料葡萄糖水平为20%或30%时, 5%脂肪组肝脏AST活性显著高于10%脂肪组,其中当肝脏受到损伤或坏死时,会引起血液中AST、ALT活性的升高[58-59],表明饲料葡萄糖水平的升高对大黄鱼肝功能有一定的负面影响,从而影响其生长。
饲料脂肪和葡萄糖水平的交互作用对大黄鱼前肠脂肪酶活性有显著影响,对淀粉酶活性无显著影响。已有研究表明,淀粉酶活性主要由遗传因素决定,饲料糖水平对其活性没有显著影响[60]。在饲料脂肪水平为5%时,大黄鱼前肠脂肪酶活性随饲料葡萄糖水平的升高先升高后降低,表明饲料中糖类对脂肪有一定的节约作用。在饲料葡萄糖水平相同时,10%脂肪组大黄鱼前肠脂肪酶活性显著高于5%脂肪组,这表明脂肪酶活性主要受到脂肪水平的影响,葡萄糖水平对脂肪酶活性的影响有限。
3.6不同脂肪和葡萄糖水平对大黄鱼肝脏糖酵解和糖异生关键酶活性的影响
糖酵解和糖异生在生理功能上分别是糖的分解与合成,其中糖酵解是所有生物体内葡萄糖代谢的唯一途径[61],糖异生是指将非糖物质转化成葡萄糖,主要在肝脏中进行,其关键酶有己糖激酶、GK、PFK、PK、G6Pase、FBPase和PEPCK。在本试验中,在饲料脂肪水平相同时,肝脏GK、PFK活性随饲料葡萄糖水平的升高而升高,表明葡萄糖水平升高使大黄鱼糖酵解能力增强。饲料糖水平对肝脏G6Pase活性的影响还存在争议,本试验中饲料葡萄糖水平对大黄鱼肝脏G6Pase活性无显著影响,与对瓦氏黄颡鱼[18]、大菱鲆[13]的研究结果相似。在饲料葡萄糖水平相同时,10%脂肪组的肝脏PFK活性显著高于5%脂肪组,表明PFK活性也受饲料脂肪水平的影响,这与在金头鲷[62]、虹鳟[63]上得出的结果不一致,其原因可能与试验鱼的种类不同相关。
4 结 论
在饲料脂肪水平为5%时,随饲料葡萄糖水平的升高,大黄鱼能够通过调节糖代谢关键酶活性及肝糖原含量来维持血糖含量的平衡,有效利用饲料中的葡萄糖;而在饲料脂肪水平为10%时,随饲料葡萄糖水平的升高,大黄鱼不能有效调节糖代谢关键酶活性及肝糖原含量,对葡萄糖的利用能力降低。综合本试验结果,建议大黄鱼幼鱼阶段饲料适宜的脂肪和糖水平分别为10%和20%。
[1]李会涛,麦康森,艾庆辉,等.大黄鱼对几种饲料蛋白原料消化率的研究[J].水生生物学报,2007,31(3):370-376.
[2]张帆.大黄鱼(PseudosciaenacroceaR.)脂类营养生理和饲料替代蛋白源的研究[D].硕士学位论文.青岛:中国海洋大学,2012.
[3]MOHSENI M,HASSANI M H S,POURALI F H,et al.The optimum dietary carbohydrate/lipid ratio can spare protein in growing beluga,Husohuso[J].Journal of Applied Ichthyology,2011,27(2):775-780.
[4]WATANABE T,OHTA M,KITAJIMA C,et al.Improvement of dietary value of brine shrimpArtemiasalivafor fish larvae by feeding them on ω3 highly unsaturated fatty acids[J].Bulletin of the Japanese Society of Scientific Fisheries,1982,48(12):1775-1782.
[5]TAN Q,XIE S,ZHU X,et al.Effect of dietary carbohydrate-to-lipid ratios on growth and feed utilization in Chinese longsnout catfish (LeiocassislongirostrisGünther)[J].Journal of Applied Ichthyology,2007,23(5):605-610.
[6]罗毅平,谢小军.鱼类利用碳水化合物的研究进展[J].中国水产科学,2010,17(2):381-390.
[7]黄鹤忠,丁磊,宋学宏,等.青鱼和草鱼葡萄糖耐量的比较研究[J].中国水产科学,2005,12(4):496-500.
[9]LI X F,WANG Y,LIU W B,et al.Effects of dietary carbohydrate/lipid ratios on growth performance,body composition and glucose metabolism of fingerling blunt snout breamMegalobramaamblycephala[J].Aquaculture Nutrition,2013,19(5):701-708.
[10]LI X F,LIU W B,LU K L,et al.Dietary carbohydrate/lipid ratios affect stress,oxidative status and non-specific immune responses of fingerling blunt snout bream,Megalobramaamblycephala[J].Fish & Shellfish Immunology,2012,33(2):316-323.
[11]戈贤平,刘波,谢骏,等.饲料中不同碳水化合物水平对翘嘴红鲌生长及血液指标和糖代谢酶的影响[J].南京农业大学学报,2007,30(3):88-93.
[12]ENES P,PANSERAT S,KAUSHIK S,et al.Nutritional regulation of hepatic glucose metabolism in fish[J].Fish Physiology and Biochemistry,2009,35(3):519-539.
[13]聂琴,苗惠君,苗淑彦,等.不同糖源及糖水平对大菱鲆糖代谢酶活性的影响[J].水生生物学报,2013,37(3):425-433.
[14]ENES P,PANSERAT S,KAUSHIK S,et al.Effect of normal and waxy maize starch on growth,food utilization and hepatic glucose metabolism in European sea bass (Dicentrarchuslabrax) juveniles[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2006,143(1):89-96.
[15]ENES P,PANSERAT S,KAUSHIK S,et al.Growth performance and metabolic utilization of diets with native and waxy maize starch by gilthead sea bream (Sparusaurata) juveniles[J].Aquaculture,2008,274(1):101-108.
[16]窦兵帅,梁萌青,郑珂珂,等.饲料中碳水化合物水平对鲈鱼生长、生理状态参数及体组成的影响[J].渔业科学进展,2014,35(1):46-54.
[18]张世亮.饲料中糖结构、糖水平及糖脂比对瓦氏黄颡鱼幼鱼生长及糖代谢的影响[D].硕士学位论文.青岛:中国海洋大学,2011.
[19]周华.饲料碳水化合物水平对鳡幼鱼生长、体成分及糖代谢酶活性的影响[D].硕士学位论文.武汉:华中农业大学,2011.
[20]林淑琴.不同生长阶段大黄鱼的蛋白质和蛋/能比营养研究[D].硕士学位论文.青岛:中国海洋大学,2013.
[21]何志刚.大黄鱼(PseudosciaenacroceaR.)和鲈鱼(Lateolabraxjaponicus)苏氨酸和苯丙氨酸营养生理研究[D].硕士学位论文.青岛:中国海洋大学,2008.
[22]申屠基康.大黄鱼对21种饲料原料表观消化率及色氨酸营养需要研究[D].硕士学位论文.青岛:中国海洋大学,2010.
[23]林利民,王秋荣,王志勇,等.不同家系大黄鱼肌肉营养成分的比较[J].中国水产科学,2006,13(2):286-291.
[24]周飘苹,金敏,吴文俊,等.不同养殖模式、投喂不同饵料及不同品系大黄鱼营养成分比较[J].动物营养学报,2014,26(4):969-980.
[25]MAI K S,WAN J L,AI Q H,et al.Dietary methionine requirement of large yellow croaker,PseudosciaenacroceaR[J].Aquaculture,2006,253(1/2/3/4):564-572.
[26]AOAC.Official methods of analysis[S].16th ed.Arlington:AOAC International,1995.
[27]HASSID W Z,ABRAHAM S.Chemical procedures for analysis of polysaccharides[J].Methods in Enzymology,1957,3:34-50.
[28]王庆萍,方春林.鱼类脂肪需求研究概述[J].江西水产科技,2010(4):7-9.
[29]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:44-45.
[30]DIAS J,ALVAREZ M J,DIEZ A,et al.Regulation of hepatic lipogenesis by dietary protein/energy in juvenile European sebass (Dicentrarchuslabrax)[J].Aquaculture,1998,161(1/2/3/4):169-186.
[31]NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academies Press,2011.
[32]谭肖英,罗智,刘永坚.鱼类对饲料中糖的利用研究进展[J].中国饲料,2007(6):19-23.
[33]AL-ASGAH N A,ALI A.Feeding of various carbohydrate sources on the growth performance and nutrient utilization in “Oreochromisniloticus”[J].Agribiological Research,1994,47(1):1-12.
[34]王菲,李向飞,李贵锋,等.不同糖脂比对建鲤幼鱼生长、体组成、消化及糖酵解能力的影响[J].水产学报,2015,39(9):1386-1394.
[35]COWEY C B,ADRON J W,BROWN D A,et al.Studies on the nutrition of marine flatfish.The metabolism of glucose by plaice (Pleuronectesplatessa) and the effect of dietary energy source on protein utilization in plaice[J].British Journal of Nutrition,1975,33(2):219-231.
[36]SHIMENO S,MING D C,TAKEDA M.Metabolic response to dietary carbohydrate to lipid ratios inOreochromisniloticus[J].Nippon Suisan Gakkaishi,1993,59(5):827-833.
[37]MOKOGINTA I,TAKEUCHI T,HADADI A,et al.Different capabilities in utilizing dietary carbohydrate by fingerling and subadult giant gouramyOsphronemusgouramy[J].Fisheries Science,2004,70(6):996-1002.
[38]ERFANULLAH E,JAFRI A K.Effect of dietary carbohydrate-to-lipid ratio on growth and body composition of walking catfish (Clariasbatrachus)[J].Aquaculture,1998,161(1/2/3/4):159-168.
[39]DENG D F,REFSTIE S,HUNG S S O.Glycemic and glycosuric responses in white sturgeon (Acipensertransmontanus) after oral administration of simple and complex carbohydrates[J].Aquaculture,2001,199(1/2):107-117.
[40]蔡春芳,陈立侨,叶元土,等.日粮糖种类和水平对青鱼生长性能和生理指标的影响[J].动物营养学报,2009,21(2):212-218.

[42]王猛强,周飘苹,黄文文,等.不同蛋白质水平下葡萄糖添加水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响[J].动物营养学报,2015,27(8):2431-2442.
[43]王猛强,黄文文,周飘苹,等.不同蛋白质和小麦淀粉水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响[J].水产学报,2015,39(11):1690-1701.
[44]LANARI D,POLI B M,BALLESTRAZZI R,et al.The effects of dietary fat and NFE levels on growing European sea bass (DicentrarchuslabraxL.).Growth rate,body and fillet composition,carcass traits and nutrient retention efficiency[J].Aquaculture,1999,179(1/2/3/4):351-364.
[45]ALI M Z,JAUNCEY K.Optimal dietary carbohydrate to lipid ratio in African catfishClariasgariepinus(Burchell 1822)[J].Aquaculture International,2004,12(2):169-180.
[47]LEE S M,LEE J H.Effect of dietary glucose,dextrin and starch on growth and body composition of juvenile starry flounderPlatichthysstellatus[J].Fisheries Science,2004,70(1):53-58.
[48]FURUICHI M,YONE Y.Changes in activities of hepatic enzymes related to carbohydrate metabolism of fishes in glucose and insulin-glucose tolerance tests[J].Bulletin of the Japanese Society of Scientific Fisheries,1982,48(3):463-466.
[49]LIN S C,LIOU C H,SHIAU S Y.Renal threshold for urinary glucose excretion by tilapia in response to orally administered carbohydrates and injected glucose[J].Fish Physiology and Biochemistry,2000,23(2):127-132.
[50]KESHAVANATH P,MANJAPPA K,GANGADHARA B.Evaluation of carbohydrate rich diets through common carp culture in manured tanks[J].Aquaculture Nutrition,2002,8(3):169-174.
[51]GAYE-SIESSEGGER J,FOCKEN V,BECKER K.Effect of dietary protein/carbohydrate ratio on activities of hepatic enzymes involved in the amino acid metabolism of Nile tilapia,Oreochromisniloticus(L.)[J].Fish Physiology and Biochemistry,2006,32(4):275-282.
[52]王丽娜,刘文斌,张春暖,等.饲料中非蛋白能源物质对黄颡鱼幼鱼生长及生理生化指标的影响[J].南京农业大学学报,2014,37(1):108-114.
[53]MOREIRA I S,PERES H,COUTO A,et al.Temperature and dietary carbohydrate level effects on performance and metabolic utilisation of diets in European sea bass (Dicentrarchuslabrax) juveniles[J].Aquaculture,2008,274(1):153-160.
[54]HILTON J W,ATKINSON J L.Response of rainbow trout (Salmogairdneri) to increased levels of available carbohydrate in practical trout diets[J].British Journal of Nutrition,1982,47(3):597-607.
[55]MORO G V,CAMILO R Y,MORAES G,et al.Dietary non-protein energy sources:growth,digestive enzyme activities and nutrient utilization by the catfish jundiá,Rhamdia quelen[J].Aquaculture Research,2010,41(3):394-400.
[56]DJANGMAH J S.The effects of feeding and starvation on copper in the blood and hepatopancreas,and on blood proteins ofCrangonvullgaris(Fabricius)[J].Comparative Biochemistry and Physiology,1970,32(4):709-731.
[57]HEMRE G I,MOMMSEN T P,KROGDAHL Å.Carbohydrates in fish nutrition:effects on growth,glucose metabolism and hepatic enzymes[J].Aquaculture Nutrition,2002,8(3):175-194.
[58]ZHOU Q C,WANG Y L,WANG H L,et al.Dietary threonine requirements of juvenile Pacific white shrimp,Litopenaeusvannamei[J].Aquaculture,2013,392-395:142-147.
[59]周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
[60]UGOLEV A M,EGOROVA V V,KUZ’MINA V V,et al.Comparative-molecular characterization of membrane digestion in fish and mammals[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1983,76(3):627-635.
[61]COWEY C B,WALTON M J.Intermediary metabolism[M]//HALVER E.Fish nutrition.New York:Academic Press,1989:259-329.
[62]CASERAS A,METN I,VIVES C,et al.Nutritional regulation of glucose-6-phosphatase gene expression in liver of the gilthead sea bream (Sparusaurata)[J].British journal of nutrition,2002,88(6):607-614.
[63]PANSERAT S,CAPILLA E,GUTIERREZ J,et al.Glucokinase is highly induced and glucose-6-phosphatase poorly repressed in liver of rainbow trout (Oncorhynchusmykiss) by a single meal with glucose[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,128(2):275-283.
(责任编辑菅景颖)
Effects of Different Lipid and Glucose Levels on Growth Performance, Hepatic Glycolysis and Gluconeogenic Key Enzyme Activities of Large Yellow Croaker(LarmichthyscroceaRichardson)
MA HongnaZHOU PiaopingLU YouYUAN YeHOU YingmeiUN PengDING LiyunZHOU Qicun*
(Laboratory of Fish Nutrition, School of Marine Science, Ningbo University, Ningbo 315211, China)
An 8-week feeding trial was conducted to evaluate the effects of different lipid and glucose levels on growth performance, hepatic glycolysis and gluconeogenic key enzyme activities, serum biochemical indices, glycogen contents and digestive enzyme activities etc. of large yellow croaker. Six experimental diets were formulated to contain two lipid levels (5% and 10%) and three glucose levels (10%, 20% and 30%) using 2×3 double-factor experimental design. Each diet was randomly assigned to 3 replicates of 50 juvenile large yellow croakers with the initial body weight of (14.79±0.13) g. The results showed that weight gain rate (WGR), specific growth rate (SGR) and feed efficiency (FE) were not significantly affected by the interaction of dietary lipid and glucose levels (P>0.05). When the dietary lipid level was 5%, the WGR and SGR were decreased with the increase of dietary glucose level, which in 30% glucose group were significantly lower than those in 10% glucose group (P<0.05). The interaction of dietary lipid and glucose levels had significant effects on the contents of crude lipid and moisture of whole body (P<0.05), but had no significant effects on the content of crude protein of whole body (P>0.05). The contents of hepatic glycogen and muscle glycogen were significantly affected by the interaction of dietary lipid and glucose levels (P<0.05). When the dietary lipid level was 5%, hepatic glycogen content was increased with the dietary glucose level increasing, while the muscle glycogen content was firstly increased and then down. But when the dietary lipid level was 10%, hepatic glycogen content was firstly increased and then decreased with the dietary glucose level increasing, while the muscle glycogen content was increased. The interaction of dietary lipid and glucose levels did not have significant effects on the contents of total protein, total cholesterol, triglyceride, glucose and the activities of alanine aminotransferase and aspartate transaminase in serum of large yellow croaker (P>0.05). However, when the dietary lipid level was the same, serum glucose content had an increase trend with dietary glucose level increasing, and that in 30% glucose group was significantly higher than that in 10% glucose group (P<0.05). Hepatic glucokinase, phosphofructokinase and phosphoenolpyruvate carboxy kinase activities were significantly affected by the interaction of dietary lipid and glucose levels (P<0.05), while there were no significant effects on pyruvate kinase, glucose-6-phosphatase and fructose-1,6-bisphosphatase activities (P>0.05). When the dietary lipid level was 10%, the hepatic glucokinase and phosphofructokinase activities were increased with dietary glucose level increasing, while the hepatic phosphoenolpyruvate carboxy activity was firstly increased and then decreased. These results demonstrate that, compared with the dietary 10% lipid level, when the dietary lipid level is 5%, large yellow croaker has the ability to maintain the balance of blood glucose content by adjusting hepatic glycogen contents, glucose metabolism key enzyme activities and effectively utilizes glucose in diets with the dietary glucose level increasing. The results of present study indicate that the optimal requirements of lipid and carbohydrate for large yellow croaker in the larval stage are recommended to be 10% and 20%, respectively.[ChineseJournalofAnimalNutrition, 2016, 28(10):3110-3122]
large yellow croaker (LarmichthyscroceaRichardson); glucose; lipid; growth performance; glycolysis key enzymes; gluconeogenic key enzymes
, professor, E-mail: zhouqicun@nbu.edu.cn
10.3969/j.issn.1006-267x.2016.10.013
2016-04-05
国家自然科学基金项目(31272670);宁波市农业科技攻关重大项目(2012C10025);国家科技部星火重大计划项目(2014GA701001);浙江省重中之重一级学科(水产)开放基金项目
马红娜(1994—),女,山西临汾人,硕士研究生,从事水生动物营养与饲料研究。E-mail: 121848841@qq.com
周歧存,教授,博士生导师,E-mail: zhouqicun@nbu.edu.cn
S963
A
1006-267X(2016)10-3110-13

