大叶朴种子休眠机制的初步研究*
刘玉洋,傅剑波,林富平,程雪梅,臧德奎
(1.山东农业大学 林学院,山东 泰安 271018;2.浙江滕头园林股份有限公司,浙江 宁波 315100)
大叶朴种子休眠机制的初步研究*
刘玉洋1,傅剑波2,林富平2,程雪梅2,臧德奎1
(1.山东农业大学 林学院,山东泰安 271018;2.浙江滕头园林股份有限公司,浙江宁波 315100)
大叶朴种子不经处理的情况下发芽率较低。为探讨大叶朴的休眠机制,对大叶朴种子进行了形态解剖观察,内果皮透水性测定,去壳种子和完整种子的萌发试验。同时,还通过对大叶朴的种胚和果皮的甲醇提取液处理白菜籽,研究其内源抑制物对白菜籽萌发率的影响。结果表明,大叶朴内果皮的石细胞化阻碍了种子的吸涨;大叶朴种子培养30、60天后,其带壳种子的发芽率为0%,去壳种子的发芽率为31.1%;白菜籽萌发试验结果表明,大叶朴种子各部分均含有抑制物质,抑制强度为内果皮大于种胚。
大叶朴;休眠;种壳透水性;萌发试验;抑制物质
大叶朴(Celtiskoraiensis)属于榆科(Ulmaceae)朴树属(CeltisL.),落叶乔木,广泛分布于我国华北、东北、西北区各省海拔100~1 500m的山坡和沟谷中[1]。大叶朴叶形奇特,有尾状尖头,耐干旱、瘠薄,对土壤质地要求不严,深根性,是典型的遮荫兼观叶的树种,树皮纤维可代替麻,果可榨油用作肥皂和润滑剂,是一种极具开发价值和应用前景的野生树种。而关于大叶朴的研究,国内外尚不多见,仅赵静利用四种改良的CTAB方法提取了大叶朴的DNA进行比较研究[2],对大叶朴育苗技术的研究尚属空白。目前,大叶朴的人工繁殖和栽培量极少,而且在常规播种条件下大叶朴的发芽率极低,加之国内外对大叶朴休眠方面的研究尚处空白,影响了大叶朴的开发利用。因此,探究大叶朴的休眠机制,从理论上阐述其休眠本质,可以为大叶朴播种育苗提供参考。
1 材料与方法
1.1供试种子来源
试验所用材料于2014年10月中旬采自山东泰山。果实采摘后在冷水中浸软,用手搓洗,去掉其果皮和果肉,采用水选法去掉残渣,去除空粒种子,挑选饱满的种子晾干备用。参试种子的平均千粒重为200.45g,含水量7.80 %。
1.2种子的结构形态观察
随机抽取3组上述备用种子,每组100粒,于清水中浸泡2天,使种子充分吸水,以便去除种壳(内果皮)。之后,用解剖刀剥离出完整的种胚,对种胚进行横向和纵向的解剖,观察种子内部形态结构,并记录[3]。
1.3种壳透水性测定
选取带有完整种壳的种子和去掉种壳的种子各30粒,分别称重,放入烧杯中用清水浸泡,于25℃条件下恒温吸涨,每隔12h称重1次,直至恒重。计算两个处理的吸水率,每个处理重复3次,取其平均值。
吸水率(%)=〔浸种后重量(W2)-浸种前重量(W1)〕/浸种前重量(W1)× 100%。
1.4种子萌发试验
选取室温下贮藏的种子,先将种子于清水中浸泡72h,使种子充分吸水,按试验设计对种壳进行处理。共有两种处理:A为带有完整种壳的种子,B为完全去除种壳(保留了种皮)的种子。各处理种子用1‰升汞消毒5min,75%医用酒精消毒10min,在无菌条件下接种到MS培养基(MS+8g/L蔗糖+30g/L琼脂)上,分别于光照(光照16h,黑暗8h,光强2 000~3 000Lx)或黑暗、25℃恒温条件下进行无菌萌发试验[4]。每个处理接种30粒种子,重复3次。每隔5天观察种子的发芽率及生长状况,30天时统计发芽率。种胚的萌发以幼根长度大于胚长为准。种子的发芽率=种子发芽数量/种子总量×100%[5]。
1.5抑制物质的生物测定
参考王小平等[6]的方法,略有改动。将大叶朴种子分为种壳(内果皮)和种胚两部分,分别取2g,液氮冷冻后,用 80%甲醇10mL研磨,置于4℃下充分浸提48h,重复浸提3次,混合浸提液,过滤掉残渣,减压浓缩后用蒸馏水定容至20mL,浓度为0.1g/mL。将原溶液分别稀释为0.02g/mL、0.04g/mL、0.06g/mL、0.08g/mL和0.1g/mL。分别取上述溶液5mL,加入直径为9cm的培养皿中(培养皿中预先铺设两层滤纸),每个培养皿中放50粒白菜种子(白菜种子预先在溶液中浸泡2h)进行发芽试验,以蒸馏水为对照,于光照(光强2 000~3 000 Lx)、25℃条件下培养,48h测定白菜籽的发芽率,72h测定其种子胚根长。每个处理重复3次,并进行差异性显著试验分析。
2 结果与分析
2.1大叶朴种子的外部形态特征
大叶朴果实为核果,种子(果核)呈宽倒卵形,种子的纵轴长为6.5~7.8mm,横轴长为5.5~6.0mm,厚度为5.4~6.8mm,先端圆钝,基部渐窄,截形,两侧有纵棱,表面灰白色。内果皮由一系列排列紧密的石细胞组成,骨质,厚度在0.5~0.7mm,内种皮厚可能是导致大叶朴休眠的原因之一。种皮膜质较薄,淡褐色,常紧贴种胚。
在解剖的100粒种子中,100%种胚发育完全,无胚乳,胚呈乳白色,两片子叶肥厚充满胚腔,多层折叠,油质,具有胚芽、胚轴和裸露的胚根。
2.2不同处理对种子透水性的影响
种皮、果皮等的机械障碍作用会影响种子的吸水、透气性,最终影响到种子的萌发[7]。图1表明,浸泡12h,带壳种子与去壳种子的吸水率均明显增加,去壳种子浸泡12h的吸水率达到11.6%,而带壳种子的吸水率只有2.4%,二者具有极显著差异。
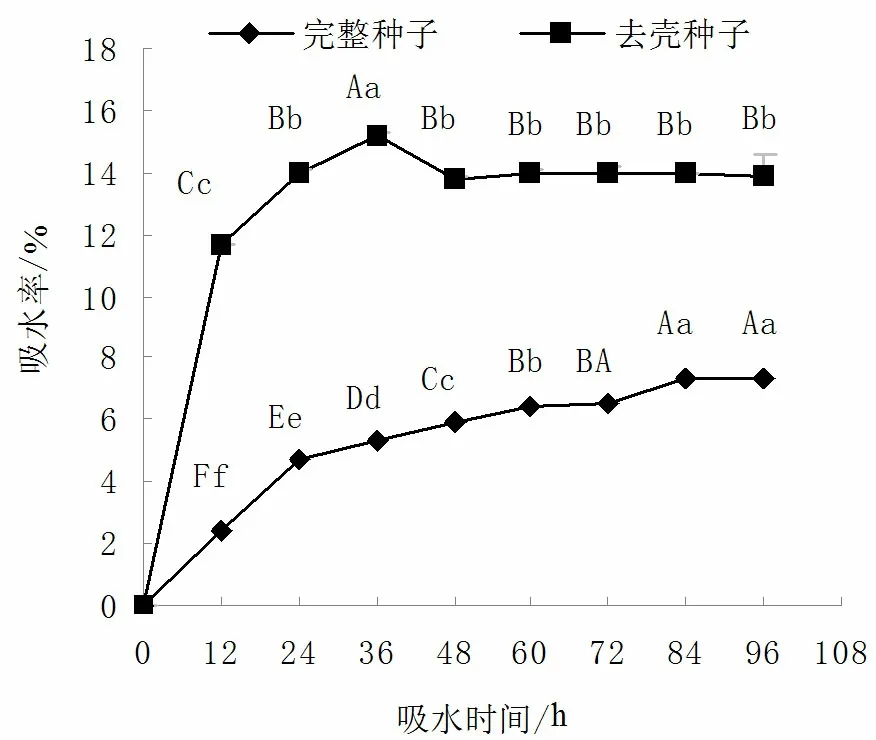
图1 不同种壳处理对大叶朴种子吸水率的影响 注:图中相同字母表示差异不显著,不同大写字母表示 差异极显著(p<0.01),不同小写字母表示差异显著 (p<0.05)。Fig.1 Effects of different husk treatments on water absorption rate of Celtis koraiensis seeds
浸泡36h,带壳种子的吸水率仍在增加,且达到显著水平,而去壳种子的吸水率出现了下降现象。这可能是由于大叶朴种子没有了种壳(内果皮)的保护,加之细胞外的水势高于细胞内,使得种子无限吸涨,质膜渗透压增加,最终导致种子破裂的结果[8]。
两处理的种子吸水都达到饱和后,带壳种子的吸水率比去壳种子的吸水率小7.39%,方差分析表明两处理的差异达到极显著水平(F=12 913.043,P=0.00<0.01)。带壳的大叶朴种子虽然能透水,但与去壳种子相比,带壳种子的内果皮对大叶朴的吸水存在一定的障碍。
2.3不同处理对种子萌发的影响
根据试验观察,完全去除内果皮的种子在空白培养基上培养5天时,就开始有种子萌动(表1,图2a)。
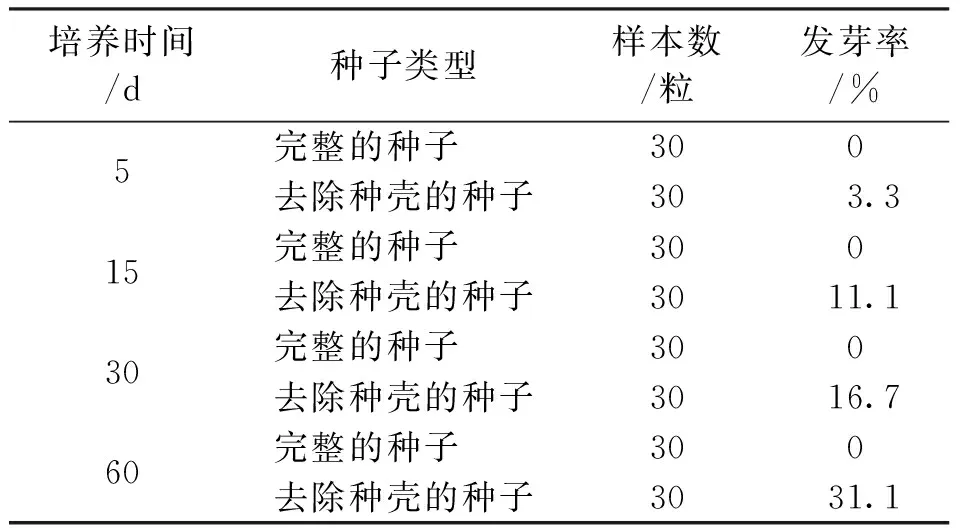
表1 不同外壳处理对种胚和种子萌发的影响Tab.1 Effects of different husk treatments on germination of embryos and seeds
由表1可知,去除种壳(内果皮)的种子培养60天的发芽率为31.1%,而完整种子的发芽率为0。综上所述,大叶朴内果皮有一定的机械束缚和透性障碍,这是导致大叶朴种子不能萌发的原因之一。
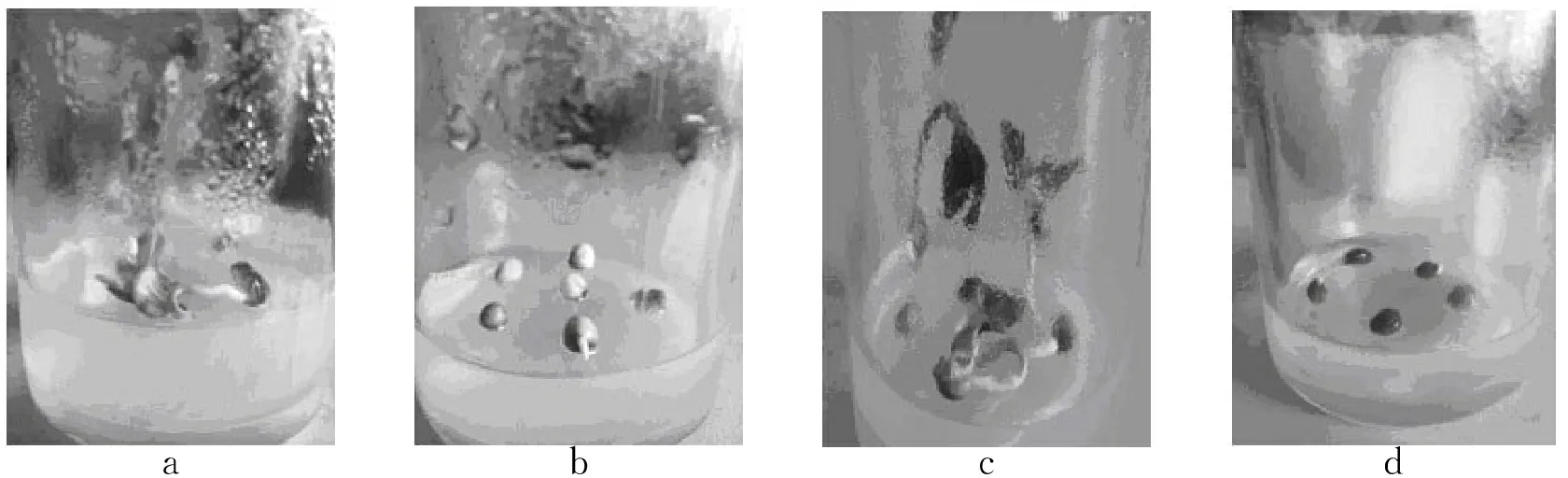
abcd
图2不同种壳处理对种子萌发的影响
a为去除种壳的种子培养5天;b为去除种壳的种子培养15天;c为去除种壳的种子培养30天;d为完整种子培养30天
Fig.2Effects of different husk treatments on seed germination
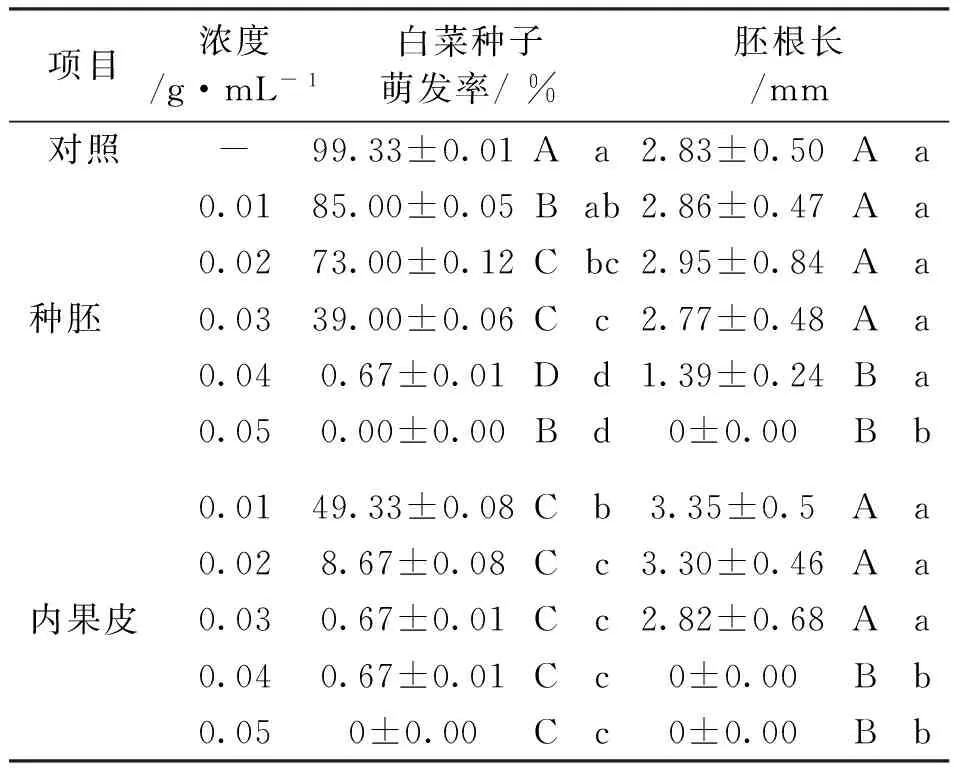
2.4内果皮和胚的甲醇提取液对种子萌发的影响
大叶朴种子种胚及内果皮甲醇浸提液对白菜籽萌发具有抑制作用(图3)。随着抑制物质浓度的增加,白菜籽的发芽率逐渐降低,种子胚根的长度缩短(表2),内果皮与种胚的甲醇提取液对白菜籽的萌发均有一定的抑制作用,其中以内果皮的抑制作用最强,浓度为0.03g/mL的内果皮甲醇浸提液对白菜籽的萌发达到了完全抑制的效果,而种胚的抑制活性较弱,0.04g/mL时种胚浸提液对白菜籽萌发才到达完全抑制的效果(表2)。据此可以初步推断大叶朴种子内果皮与胚中均含有抑制种子萌发的物质,抑制强度为内果皮>种胚。
白菜籽胚根长的方差分析结果表明内果皮和种胚浸提液浓度为0.04g/mL和0.05g/mL时对白菜籽胚根长的影响均达到了极显著水平(P<0.01)。
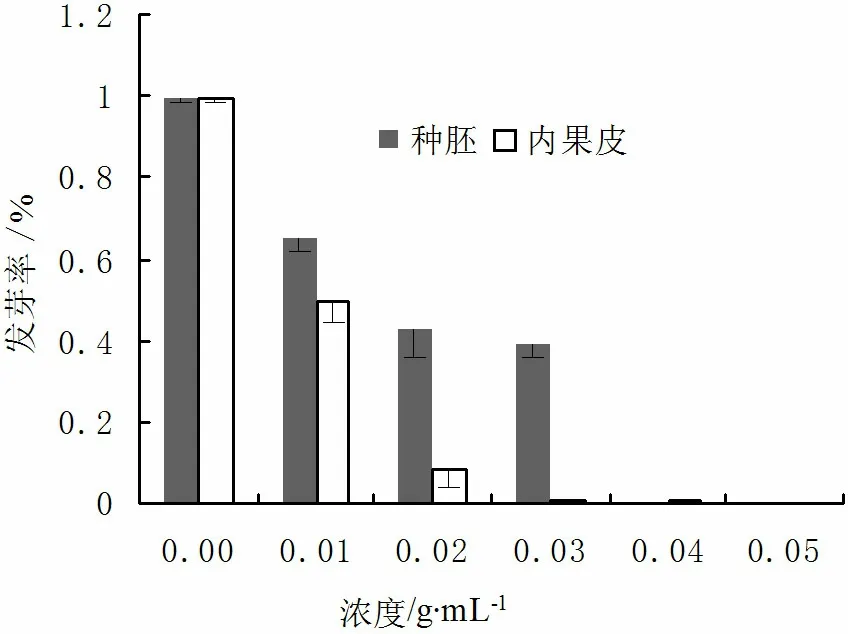
图3 大叶朴种子各部分不同浓度甲醇浸提液对 白菜种子发芽率的影响Fig.3 Effects of extracted methanol with different concentrations on germination rate of cabbage表2 大叶朴种子各部位甲醇浸提液对 白菜籽萌发的抑制作用Tab.2 Inhibitory effects of extracted methanol from different parts of Celtis koraiensis seeds on the cabbage germination
项目浓度/g·mL-1白菜种子萌发率/%胚根长/mm对照-99.33±0.01Aa2.83±0.50Aa种胚 0.0185.00±0.05Bab2.86±0.47Aa0.0273.00±0.12Cbc2.95±0.84Aa0.0339.00±0.06Cc2.77±0.48Aa0.040.67±0.01Dd1.39±0.24Ba0.050.00±0.00Bd0±0.00Bb内果皮0.0149.33±0.08Cb3.35±0.5Aa0.028.67±0.08Cc3.30±0.46Aa0.030.67±0.01Cc2.82±0.68Aa0.040.67±0.01Cc0±0.00Bb0.050±0.00Cc0±0.00Bb
注:表中相同字母表示差异不显著,不同小写字母表示差异显著p< 0.05,不同大写字母表示差异极显著p< 0.01。
3 讨论
种子的休眠是植物为抵御不良环境,维持自身发展而形成的一种生物学特性[9]。种子形成自然休眠的原因较为复杂,研究表明,种皮(包括果皮)坚硬致密,或有油脂、蜡质等原因使种子不透水不透气,从而阻碍种子萌发[10]。周晓峰对几种冬青属(IlexL.)植物研究也表明种皮透气性差是种子休眠的主要原因,种皮的机械障碍,种皮的透水性在一定程度上阻碍了种子的萌发[11]。李近雨在对核桃(Juglansregia)的研究中发现,核桃种壳的机械障碍是种子萌发慢的主要原因[12]。程广有等在对东北红豆杉(Taxuscuspidata)的研究中指出东北红豆杉种皮坚硬,表面角质化,透水透气性差,影响种子吸涨和萌发[13]。本研究中通过对大叶朴种子吸水率的研究发现:去掉内果皮的种子吸水率、萌发率远大于完整种子,内果皮坚硬阻碍了种子与外界环境的水汽交换,这在一定程度上阻碍了大叶朴种子的萌发,这可能是导致大叶朴种子休眠的原因之一。
Albertus Magus(1206—1280年)最早提出植物种子推迟发芽与其所含抑制物质有关[14],诸多研究也显示种子中含有的萌发抑制剂是种子休眠的重要原因。刘成功等在对南方红豆杉(Taxuschinensisvar.mairei)的研究中发现新鲜的种子中含有萌发抑制物质,甲醇浸提液的提取物对白菜籽的发芽率有极其显著的抑制作用[15]。李淑娴等在对乌桕(Sapiumsebiferum)种子休眠的研究中发现乌桕种子的种皮和胚乳浸提液对白菜种子发芽有显著抑制作用,种子的种皮及胚乳存在的内源抑制物质,可能是造成乌桕种子休眠的主要原因[16]。张少强在对芍药(Paeonialactiflora)种子的研究中也发现了抑制物质,且浓度越大,抑制作用越强[17]。韩月乔等对白藓(DictamnusalbusL.)种子的研究发现,白藓种皮存在萌发抑制物质[18]。罗登攀等对腊梅(Chimonanthuspraecox)的研究显示腊梅的萌发抑制物质主要存在于种仁中[19]。本研究结果显示大叶朴的内果皮和种胚均含有萌发抑制物质,且随着浓度的增加抑制作用更加显著,这些成分可能是导致种子休眠的原因,有关抑制物质成分的测定有待进一步研究。
大叶朴种子萌发试验表明室温下贮藏的种子,完全去除内果皮的种子萌发率提高,而具有完整内果皮的种子萌发受到抑制,且种子解剖过程中发现大叶朴种胚发育完全,不存在形态后熟,通过大叶朴种子萌发试验确定了内果皮对种子萌发的抑制作用,内源抑制物质的提取试验表明内果皮与种胚均具有抑制种子萌发的物质。因此,内果皮的机械抑制,种胚及果皮中内源抑制物的存在是大叶朴种子休眠的主要原因,这为生产上采用何种催芽技术提供了理论依据。
[1]中国科学院中国植物志编辑委员会.中国植物志22卷[M].北京:科学出版社,1979.
[2]赵静,叶欢,李雪松,等.四种改良CTAB法提取大叶朴基因组DNA比较研究[J].北方园艺,2010(1):165-168.
[3]GB 2772—1999 林木种子检验规程[S].北京: 国家质量技术监督局,2000.
[4]杨万霞,洑香香,方升佐.青钱柳种子的种皮构造及其对透水性的影响[J].南京林业大学学报(自然科学版),2011,29(5):25-28.
[5]尚旭兰,徐锡增,方升佐.青钱柳种子休眠机制[J].林业科学,2006,47(3):69-74.
[6]王小平,王九龄.白皮松种子内含物的提取、分离及生物测定[J].种子,1998,17(5):19-22.
[7]王友凤,马祥庆. 林木种子萌发的生理生态学机理研究进展[J].世界林业研究,2007,20(4):19-23.
[8]沈海龙,杨玲,张建瑛,等.花楸树种子休眠影响因素与萌发特性研究[J].林业科学,2006,42(10): 133-138.
[9]陈昕,曹珊珊,张红星.黄山花楸种子休眠解除技术及其解剖学观察[J].南京林业大学学报(自然科学版),2011,35(4):23-26.
[10]孟庆伟,高辉远主编.植物生理学[M].北京:中国农业出版社,2011: 317-318.
[11]周晓峰.几种冬青属树种子休眠原因及萌发特性研究[D].南京:南京林业大学,2010.
[12]李近雨.核桃种子烂种原因及发芽条件的研究[J].林业科学,1994,20(1):18-24.
[13]程广有,唐晓杰,高红兵,等.东北红豆杉种子休眠机理与解除技术探讨[J].北京林业大学学报,2004,26(1):5-9.
[14]叶长丰,戴心维.种子学[M].北京:中国农业出版社,1994.
[15]刘成功,陈黎,李燕,等.南方红豆杉种子休眠特性及催芽技术研究[J].西南林业大学学报,2015,35(3):25-29.
[16]李淑娴,刘菁菁,田树霞,等.乌桕种子休眠原因及解除方法研究[J].南京林业大学学报(自然科学版),2011,35(5):1-4.
[17]张少强.芍药种子萌发抑制物质的生物测定及分析鉴定[J].安徽林业科技,2015,41(3):17-20.
[18]韩月乔,于营,王志清,等.白藓种子休眠原因及解除方法研究[J].河北农业大学学报,2015,38(2):43-47.
[19]罗登攀,刘道风,马靖,等.腊梅种子休眠原因浅析及赤霉素对种子萌发的影响[J].北方园艺,2015(1):83-86.
Preliminary Study on Seed Dormancy Mechanism of Celtis koraiensis
LIU Yu-yang1,FU Jian-bo2,LIN Fu-ping2,CHENG Xue-mei2,ZANG De-kui1
(1.Forestry College,Shandong Agricultural University,Taian Shandong 271018,P.R.China;2.Tengtou Garden corporation,Ningbo Zhejiang 315100,P.R.China)
The germination rate ofCeltiskoraiensisseed is very low without any treatment.In order to discuss the dormancy characteristics ofCeltiskoraiensisseeds,anatomical structure observation,water permeability of endocarp, seed germination test were conducted in this research,and the influence of its endogenous inhibitors was also studied through different treatments of cabbage seeds with methanol extracted from embryo and peel ofCeltiskoraiensisseed.The result showed that sclereid of inner pericarp cell resulted in imbibition ofCeltiskoraiensisseed,germination rate ofCeltiskoraiensisseed with coat after 30 or 60 days’ cultivation were zero,and that of seed without coat raised to 31.1%.Germination test of cabbage seeds indicated that the inhibitors were distributed in all parts ofCeltiskoraiensisseed,and the inhibition of inner pericarp was stronger than that of embryo.
Celtiskoraiensis;seed dormancy;permeability of husk;germination test;inhibitors
10.16473/j.cnki.xblykx1972.2016.05.013
2015-10-25
山东省农业良种工程重大课题“林木种质资源收集保护与评价”(鲁农良字[2010]6号)。
刘玉洋(1991-),女,硕士生,主要从事园林植物种质资源及遗传育种研究。E-mail:liuyuyang20140485@163.com
简介:臧德奎(1966-),男,教授,博士,主要从事植物分类和种质资源研究。E-mail:zangdk@sdau.edu.cn
S 792.99
A
1672-8246(2016)05-0068-05

