微生物多糖胶质高产菌株的筛选与鉴定
郑梅霞,朱育菁,刘 波,*,潘志针,陈梅春,张连宝,2,黄素芳
(1.福建省农业科学院农业生物资源研究所,福建 福州 350003;2.厦门大学生命科学学院,福建 厦门 361005)
微生物多糖胶质高产菌株的筛选与鉴定
郑梅霞1,朱育菁1,刘 波1,*,潘志针1,陈梅春1,张连宝1,2,黄素芳1
(1.福建省农业科学院农业生物资源研究所,福建 福州 350003;2.厦门大学生命科学学院,福建 厦门 361005)
通过观察多糖胶质性状及以多糖胶质产量为指标进行初筛,从22 株可产多糖胶质的菌株中筛选获得一株多糖胶质的高产菌,多糖胶质产量为8.65 g/L;通过16S rDNA序列的同源性分析鉴定为地毯草黄单胞菌(Xanthomonas axonopodis)FJAT-10151。通过形态学观察、生理生化实验、革兰氏染色法鉴定该菌株为革兰氏阴性菌株,菌落较小、圆形、淡黄色、表面光滑且湿润、微隆、边缘整齐、不透明、具有迁移性。通过水提醇 沉法从其发酵液中提取多糖胶质,利用苯酚-硫酸法、咔唑法、考马斯亮蓝法测定多糖胶质中中性糖、酸性糖、蛋白质的含量,分别为36.81%、8.90%、15.27%。所产的粗多糖胶质经Sevag法除蛋白,通过完全酸水解、糖腈乙酸酯衍生化以及气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)研究分析表明,该多糖胶质的单糖组分含葡萄糖和甘露糖,物质的量比为1∶1.12。通过红外光谱、紫外光谱、GC-MS等手段初步鉴定该多糖胶质为黄原胶。通过黏度及质构剖面分析法(texture prof ile analysis,TPA)对该多糖胶质的凝胶特性进行研究,1 g/100 mL多糖胶质溶液在60 r/min条件下的黏度为408 mPa·s。TPA测试结果表明,与购买的结冷胶、黄原胶相比,本研究得到的黄原胶硬度小,弹性和黏着性较好,胶黏性和咀嚼性最好。研究表明该株地毯草黄单胞菌具有较大的潜在应用价值。
地毯草黄单胞菌;黄原胶;胶黏性
郑梅霞, 朱育菁, 刘波, 等. 微生物多糖胶质高产菌株的筛选与鉴定[J]. 食品科学, 2016, 37(15): 171-178. DOI:10.7506/ spkx1002-6630-201615029. http://www.spkx.net.cn
ZHENG Meixia, ZHU Yujing, LIU Bo, et al. Screening and identification of bacteria for enhanced production of polysaccharide gum[J]. Food Science, 2016, 37(15): 171-178. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615029. http://www.spkx.net.cn
多糖是以单糖为基本组成单位,按一定方式重复排列而成的聚合物。用于食品加工的多糖俗称为胶质,即多糖胶质。多糖胶质可来源于微生物、动物、植物[1]。微生物胞外多糖是指微生物在生长代谢活动中分泌到细胞壁外的多糖或多糖混合物。与其他多糖胶质相比,微生物多糖胶质的化学结构更加复杂,这也使其拥有更加特殊的性质,具有黏着性、稳定性、乳化性和凝胶性等特点,在食品、化工、医疗等多个领域都有广泛的应用。在食品领域可作为食品添加剂、凝结剂、保鲜剂等[2];在医药领域[3],随着分子生物学技术的引入,多糖在抗凝血、延缓衰老、抗癌防癌、疾病免疫等方面的功能也逐渐被揭示出来[4-5],Shiomi等[6]发现乳酸菌胞外多糖具有抗肿瘤活性,Maity等[7]发现黄原胶在药物释放方面的应用;在环境污水处理中多糖也起到了重要作用,可螯合污水中的重金属离子[8],作为重金属离子吸附剂[9];另外多糖作为生物活性物质[10]也被开发应用。微生物多糖胶质主要包括黄原胶(xanthan gum)、结冷胶(gellan gum)、威兰胶(Welan gum)、热凝多糖(curdlan)等。可产多糖胶质的微生物菌属有Sphingomonas、Agrobacterium、Xanthomonas等。Hou等[11]从农杆菌属(Agrobacterium)筛选到一株菌株可产胞外多糖,该胞外多糖是由葡萄糖、半乳糖和甘露糖构成;Yu等[12]研究发现农杆菌属在限氮的情况下可产由直链无分枝β-(1,3)-D-葡聚糖构成的热凝多糖;Zhang Jun[13]、Harding[14]等研究发现少动鞘脂单胞菌产结冷胶,该结冷胶是由鼠李糖、葡萄糖和葡萄糖醛酸构成;Kaur等[15]研究发现产碱杆菌属可产胞外多糖威兰胶,该威兰胶是由L-甘露糖、L-鼠李糖、D-葡萄糖和D-葡萄糖醛酸构成;Pollock[16]、Wibberg[17]等研究发现野油菜黄单胞菌(Xanthomonas campestris)可产黄原胶,该黄原胶是由D-葡萄糖、D-甘露糖、D-葡萄糖醛酸、乙酰基和丙酮酸构成。黄原胶成为重要的稳定剂、悬浮剂、乳化剂、增稠剂、黏合剂及具高附加值、高质量的加工原料[18],黄原胶的生产菌是野油菜黄单胞菌(亦名甘蓝黑腐病黄单胞杆菌)[19],另外研究发现,胡萝卜黄单胞杆菌、美人蕉枯叶黄单胞杆菌、菜豆黄单胞杆菌、地毯草黄单胞菌等也能产黄原胶[20-21]。国内黄原胶的生产虽有每年数千吨的产量,但产品质量离国际市场要求尚有较大的距离,主要存在的问题是菌种、工艺设备的自动控制、黄原胶的深加工和二次开发等方面[22]。为了获得高品质高效的黄原胶生产菌,需要筛选分离新的生产菌,本研究根据已报道可产多糖胶质的细菌属种,从菌种库中选择3 个属22 株菌,通过水提醇沉法和苯酚-硫酸法筛选获得一株多糖胶质高产菌。通过16S rDNA对该菌株进行鉴定;糖腈乙酸酯衍生化法对该多糖胶质的单糖组分进行初步鉴定;黏度计和质构剖面分析法(texture profile analysis,TPA)对多糖胶质的黏度性质及力学性能进行研究,筛选具有工业应用潜力的产高黏度微生物胞外多糖的菌株,为一种新型多糖生产菌的开发应用提供基础数据及参考,以期为该多糖胶质在生产实践中的应用提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1菌种及其来源
在福建省农业科学院农业生物资 源研究所菌种库中选择已报道可产多糖胶质菌属的22 株菌,具体如表1所示。

表1 实验用菌株Table 1 The experimental strains tested in this study
1.1.2培养基与试剂
NA培养基:牛肉膏3 g/L、蛋白胨5 g/L、葡萄糖10 g/L、酵母膏1 g/L,pH 7.2;LB培养基:蛋白胨10.0 g/L、酵母浸粉5.0 g/L、NaCl 5.0 g/L、琼脂17 g/L,pH 7.0~7.2;种子培养基:蔗糖 20 g/L、蛋白胨 5 g/L、酵母膏 5 g/L,pH 7.0;发酵培养基:葡萄糖30 g/L、蛋白胨3 g/L、酵母膏2 g/L、KH2PO41 g/L、MgSO40.1 g/L,pH 7.0。
结冷胶 上海金穗生物技术有限公司;黄原胶上海晶纯生物技术有限公司;正丁醇、氯仿、苯酚、硫酸、氢氧化钠、盐酸、无水乙醇、氯化钠、考马斯亮蓝G-250、牛血清白蛋白、磷酸、盐酸羟胺、三氟乙酸、吡啶、乙酸酐、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、DEAE纤维素DE-52 国药集团化学试剂有限公司。
1.2仪器与设备
GC6890/MS气相色谱-质谱联用仪 美国Agilent公司;UV2550紫外分光光度计 日本岛津公司;470FT-IR傅里叶变换红外光谱仪 美国Nicolet公司;NDJ-8S黏度计上海方瑞仪器有限公司;TA.XTplus Texture Exponent 32质地分析仪 英国SMS公司。
1.3方法
1.3.1出发菌株的分离筛选
将菌种经NA培养基活化后,挑取单菌落接入种子液培养基中,30 ℃、培养16 h后接入发酵培养基。以液体发酵法测多糖胶质产量为指标,选取相对高产菌种。
不同种类的细菌产生菌体生物量和多糖胶质的产量:菌株发酵液离心分离,收集沉淀物烘干,称干质量,以单位体积的菌体干质量为菌体生物量;上清液用3 倍体积的冰乙醇沉降多糖胶质,4 ℃静置过夜,离心分离,无水乙醇洗涤3 遍,氮气吹干,称质量,粉碎得多糖胶质产量。
1.3.2菌株FJAT-10151种类确认鉴定
1.3.2.1DNA提取及序列测定
DNA的提取及系列测定参照文献[23]进行。聚合酶链式反应(polymerase chain reaction,PCR)扩增产物由上海博尚生物技术有限公司进行测序。测序结果经美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)比对。
1.3.2.2高产菌株FJAT-10151生理生化及革兰氏染色实 验
对筛选获得的高产菌株FJAT-10151进行生理生化实验。另外,对菌株FJAT-10151进行革兰氏染色显微观察:以大肠杆菌为阴性对照和枯草芽孢杆菌为阳性对照。
1.3.3FJAT-10151的发酵液中粗多糖产物的提取
挑取FJAT-10151单菌落至种子液中,30 ℃、170 r/min培养16 h后,按2%的接种量接入发酵液中,30 ℃、190 r/min培养72 h,获得发酵液。离心分离,收集上清液,用3 倍体积的冰乙醇沉降多糖胶质,4 ℃静置过夜,离心分离,无水乙醇洗涤3 遍,氮气吹干,称质量,粉碎得粗多糖产物FJAT-10151-DTJZ(即由地毯草黄单胞菌FJAT-10151的发酵液中提取的黄 原胶),备用。
1.3.4FJAT-10151-DTJZ中中性糖、酸性糖、蛋白质含量的测定
采用苯酚-硫酸法[24]测定FJAT-10151-DTJZ中中性多糖的含量:0.4 mL FJAT-10151-DTJZ溶液,超纯水补足至1 mL,加入0.5 mL 6%苯酚溶液和3 mL浓硫酸,振荡混匀后沸水浴20 min,冷却至室温,在490 nm波长处测定吸光度,以葡萄糖为对照。
采用咔唑法测定FJAT-10151-DTJZ中酸性多糖的含量:1 mL FJAT-10151-DTJZ溶液,超纯水补足至4 mL,加入10 mL浓硫酸硼砂溶液,冰浴冷却至4 ℃,沸水浴10 min后冰浴冷却至4 ℃。再加入0.2 mL咔唑试剂,摇匀,沸水浴15 min后冰浴冷却至4 ℃,在530 nm波长处测定吸光度,以葡萄糖醛酸为对照。
采用考马斯亮蓝法测定FJAT-10151-DTJZ中蛋白质的含量:1 mL FJAT-10151-DTJZ溶液,加入5 mL的考马斯亮蓝G-250溶液,摇匀,放置5 min后,在580 nm波长处比色测定吸光度,以牛血清白蛋白为对照。
1.3.5FJAT-10151-DTJZ脱蛋白工艺
FJAT-10151-DTJZ采用Sevag法[25]脱蛋白,Sevag试剂为氯仿-正丁醇(4∶1,V/V),脱蛋白3 次后,旋转蒸发除去氯仿和正丁醇,加入3 倍体积的95%乙醇沉淀后得FJAT-10151-DTJZ样品。
1.3.6FJAT-10151-DTJZ的分离纯化
采用DEAE-52柱层析进行分级(Φ2.6 cm× 50 cm),分别用蒸馏水、0.1、0.2、0.3 mol/L NaCl梯度洗脱,流速1 m L/min,自动收集器每6 min收集1 管,用苯酚-硫酸法检测,得到洗脱曲线,收集各洗脱峰,浓缩、透析、干燥后得多糖各组分。
1.3.7紫外-可见光谱分析
配制1.0 mg/mL DEAE-52水洗脱多糖溶液,于紫外光谱仪上扫描,扫描波长范围200~400 nm。
1.3.8红外光谱分析
DEAE-52水洗脱多糖胶质样品经KBr压片,于傅里叶红外光谱仪上扫描分析,扫描波数范围4 000~400 cm-1。1.3.9 FJAT-10151-DTJZ的气相色谱-质谱(gas chromatographymass spectrometer,GC-MS)分析
由于糖类本身没有足够的挥发性,因此进行GC-MS分析之前必须先将其转化成易挥发、对热稳定的衍生物。通常采用的衍生化方法有:三甲基硅醚衍生物、糖肟三甲基硅醚衍生物、糖腈乙酸酯衍生物、糖醇乙酸酯衍生物和三氟乙酸酯衍生物等[26-27]。
多糖的水解:20 mg DEAE-52水洗脱多糖胶质溶于2 mL 2 mol/L三氟乙酸,封管,100 ℃水解6 h,减压蒸馏除去三氟乙酸。
本实验通过糖腈乙酸酯衍生化法[28]后进行GC-MS分析。在水解产物中加入20 mg盐酸羟胺和1 mL吡啶,封管于90 ℃反应30 min。冷却至室温,再加入1 mL乙酸酐,封管于90 ℃反应30 min,冷却后取出 上清液,减压浓缩至干,滴入0.5 mL氯仿溶解后进行GC-MS分析。同样方法制备标准单糖衍生物。
色谱条件:气相色谱柱HP-5MS柱(30 m× 0.25 mm,0.25 μm),气化室温度270 ℃,柱前压17.8 kPa,分流比10∶1,隔垫吹扫流量3 mL/min,进样量1 μL,升温程序:起始温度150 ℃保持6 min,以2 ℃/min升至220 ℃,保持2 min。
质谱条件:离子源EI;采集模式为全扫描;EMV模式为相对值;质量扫描范围:25~550 amu;MS离子源温度为230 ℃,MS四极杆温度150 ℃。
1.3.10FJAT-10151-DTJZ特性的研究
测定1 g/100 mL FJAT-10151-DTJZ在60 r/min条件下的黏度。FJAT-10151-DTJZ的力学性能通过TPA测试,得到硬度、凝聚性、弹性、回复性、黏附性、咀嚼性和脆性等相关质构参数[29]。以购买的结冷胶、黄原胶为对照。
样品制备:在室温下将FJAT-10151-DTJZ、结冷胶、黄原胶溶液分装在模具中,迅速置于冰盐水中冷却凝胶,在4 ℃冰箱中放置24 h后进行TPA测试。
测试参数:预压速率为1.0 mm/s,下压速率为1.0 mm/s,回复速率为1.0 mm/s,下压距离为4 mm,两次压缩之间的停留时间为5 s,触发力为5 g。每组测试均做5 次平行测定,实验结果为平均值。
2 结果与分析
2.1高产多糖胶质菌株

图1 FJAT-10151菌株的菌落形态(a)和乙醇提取多糖胶质的形态(bb)Fig. 1 Colony morphology (a) and form of exopolysaccharides (b) from strain FJAT-10151 precipitated by ethanol
先观察22 株菌的菌落大小、颜色、光泽度、菌落边缘特征是否明显、菌落是否透明、是否具有迁移性等形态学特征,观察菌株发酵液醇沉降的产物性状及计算产胶率,初步筛选获得一株多糖胶质的高产菌FJAT-10151。该菌菌落较小、圆形、淡黄色、表面光滑且湿润、微隆、边缘整齐、不透明、具有迁移性(图1a);所产粗多糖胶质FJAT-10151-DTJZ性状疏松透明呈果冻状(图1b)。

表2 菌体生物量及多糖胶质产量Table 2 Bacterial biomass and polysaccharide production

图2 多糖胶质产量/菌体生物量的聚类分析Fig. 2 Cluster diagram for the ratio of dry exopolysaccharide gum weight to dry cell weight
以表2菌株编号为样本,以多糖胶质产量、菌体生物量为指标,构建矩阵,用Within-Groups Linkage为聚类方法,Cosine为区间进行系统聚类。如图2所示:第1类,多糖胶质产量高于菌体生物量,共2 株即菌株FJAT-10151、FJAT-10174;第2类,多糖胶质产量/菌体生物量>0.45,共7 株即菌株FJAT-10625、FJAT-10754、FJAT-5444、FJAT-5627、FJAT-10617、FJAT-10714、FJAT-10628;第3类,多糖胶质产量/菌体干质量<0.45,剩余的13 株。细菌产生的菌体生物量和多糖胶质产量差异最大的是Sphingomonas paucimobilis FJAT-4703,菌体生物量(6.820 g/L)是多糖胶质产量(1.008 g/L)的6.76 倍;多糖胶质产量最高的是Xanthomonas axonopodis FJAT-10151,为8.648 g/L。
2.2FJAT-10151的菌株种类鉴定
筛选得到的高产多糖胶质菌株FJAT-10151的核苷酸序列有1 412 bp,16S rDNA序列经NCBI比对,高产多糖菌株FJAT-10151与Xanthomonas axonopodis亲缘关系最近,16S rDNA同源性为 100%,其次与Xanthomonas phaseoli同源性为99.79%,所以菌株FJAT-10151应属于是地毯草黄单胞菌属Xanthomonas axonopodis。与之前资源保存库所登记的记录相符。将同源性较高菌株的16S rDNA序列下载进行对比分析,构建系统发育树,应用MEGA软件中Neighbour-Joining方法,当Bootstrap值为1 000 次时,形成的系统发育树见图3,FJAT-10151与Xanthomonas axonopodis聚在同一个分支。

图3 16S rDNA序列构建的菌株FJAT-10151的系统发育树Fig. 3 Neighbour-Joining evolutionary tree of strain FJAT-10151
高产菌株FJAT-10151测定为革兰氏阴性菌株;其生理生化实验结果为:七叶苷、邻硝基苯-β-D-吡喃半乳糖苷(o-nitrophenyl β-D-galactopyranoside,ONPG)、半固体琼脂、葡萄糖半固体、葡萄糖铵和鸟氨酸脱羧酶为阳性;MR-VP、丙二酸盐、尿素酶、甘露醇、山梨醇、卫矛醇、乳糖、木糖、水杨苷、鼠李糖、棉子糖、木糖明胶、西蒙氏枸橼酸盐、赖氨酸脱羧酶和色氨酸肉汤为阴性。
2.3FJAT-10151-DTJZ黄原胶中中性糖、酸性糖、蛋白质含量测定
通过苯酚-硫酸法对22 株菌所产多糖胶质中性糖的含量进行测定,其中FJAT-10617、FJAT-10625、FJAT-10151、FJAT-10272、FJAT-504共5 株所产粗多糖胶质中中性糖的含量超过0.5 g/L,FJAT-10151可达3.2 g/L,说明FJAT-10151菌株产胞外多糖能力较强,后期就以FJAT-10151为主要实验菌株。该菌株所产多糖胶质FJAT-10151-DTJZ的中性糖、酸性糖、蛋白质含量如表3所示。Sevag法除蛋白后蛋白的含量为7.5%。

表3 FJAT-10151-DTJZ中性糖、酸性糖、蛋白质的含量Table 3 Neutral sugar, acid sugar and protein contents of FJAT-10151-DTJZ-DTJZ
2.4FJAT-10151-DTJZ的DEAE-52纤维素柱层析
用超纯水、0.1、0.2、0.3 mol/L NaCl溶液梯度洗脱,每隔6 min收集1 管,筛选某些管号进行硫酸-苯酚法测定,得到3 个洗脱峰(图4),分别收集得到3 个组分,其中超纯水和0.1 mol/L NaCl洗脱得到的多糖组分得率高。

图4 FJAT-10151-DTJZ在DEAE-52纤维素层析柱上的洗脱曲线Fig. 4 Chromatographic isolation of FJAT-10151-DTJZ on DEAE-cellulose column
2.5FJAT-10151-DTJZ黄原胶紫外光谱和红外光谱分析
配制0.1 mg/mL的FJAT-10151-DTJZ溶液,在紫外波长190~400 nm范围进行扫描,结果如图5所示。在200~400 nm之间未见明显的蛋白和核酸的吸收峰。
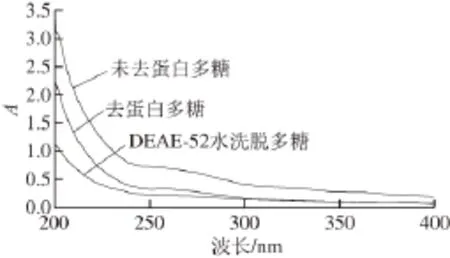
图5 FJAT-10151-DTJZ的紫外光谱Fig. 5 UV spectrum of FJAT-10151-DTJZ
由图6可知,在3 600~3 200、3 200~2 800、2 000~1 400、1 200~1 000 cm-1这4 个谱段内都出现了典型糖类物质的吸收峰。3 430 cm-1处的吸收峰强且宽,为分子间缔合羟基的伸缩振动;2 922 cm-1为C—H的伸缩振动吸收峰;1 624 cm-1处出现典型酰胺谱图;1 384 cm-1处吸收峰为酰胺中的C—N伸缩振动吸收峰,表明糖中残留蛋白质;1 163 cm-1处的吸收峰是环上C—O吸收峰;1 413 cm-1处吸收峰为=CH2的变形吸收峰;1 060 cm-1和1 020 cm-1处的吸收峰是醇羟基的变角振动吸收峰;895 cm-1是β-D-甘露吡喃糖环β-端基差向异构的C—H变角振动的特征吸收峰;795 cm-1是D-葡萄糖吡喃糖环C—O—C振动吸收峰,895 cm-1处的吸收峰,而在844 cm-1处没有特征吸收峰,说明该多糖组分里存在β型糖苷键;819 cm-1的弱吸收峰是甘露糖的特征吸收峰。通过对特征峰指认,确认分离纯化出来的FJAT-10151-DTJZ的组成为β-糖苷键型吡喃糖。
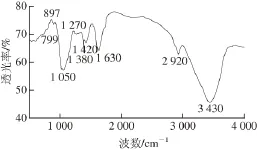
图6 FJAT-10151-DTJZ在DEAE-52水洗脱的红外光谱Fig. 6 IR spectrum of FJAT-10151-DTJZ with water elution on DEAE-cellulose column
2.6FJAT-10151-DTJZ黄原胶单糖组分分析
FJAT-10151-DTJZ的水解产物和标准单糖经糖腈乙酸酯衍生化后,利用GC-MS进行检测分析,结果如图7所示。各标准单糖出峰顺序和保留时间:甘露糖(27.472 min)和葡萄糖(27.987 min)。将多糖胶质水解产物衍生化图谱与标准单糖、黄原胶衍生化图谱对照,结合出峰时间及质谱结果初步将FJAT-10151-DTJZ鉴定为黄原胶,是由甘露糖和葡萄组成的杂多糖,其物质的量比为1∶1.12。
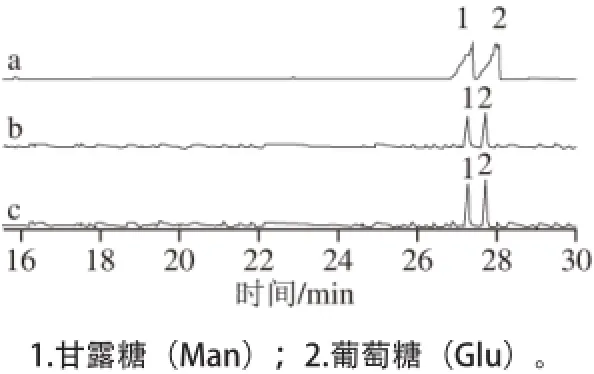
图7 标准单糖混合物(a)、黄原胶(b)和FJAT-10151-DTJZ(cc)的糖腈乙酸酯GC-MS总离子流图Fig. 7 GC-MS total ion current chromatograms of standard monosaccharides (a) and aldononitrile acetates (b) of xanthan and FJAT-10151-DTJZ (c)
2.7FJAT-10151-DTJZ黄原胶特性分析
FJAT-10151-DTJZ易溶于水,呈胶状、黏稠状。FJAT-10151-DTJZ、结冷胶和黄原胶的黏度分别为408、 266、436 mPa·s,即FJAT-10151-DTJZ的 黏度与黄原胶相当,是结冷胶的1.5 倍,表明FJAT-10151-DTJZ的胶性良好。
根据TPA测试得到的压缩-拉伸曲线求出相关的质构参数如表4所示。黏着性反映的是由于测试样品的黏着作用所消耗的功;胶黏性反映破碎胶态到可以咀嚼状态时所需的能量;咀嚼性是反映从可咀嚼状态到可吞咽状态所需要的能量;由表4可知,提取的粗胶多糖与购买回来的黄原胶、结冷胶相比:硬度小,弹性和黏着性较好,胶黏性和咀嚼性最好。

表4 多糖的黏度及相关质构参数Table 4 Viscosity and texture parameters of polysaccharides
3 结 论
本研究筛选获得一株高产多糖胶质的菌株Xanthomonas axonopodis FJAT-10151,FJAT-10151-DTJZ的多糖胶质产量可达8.65 g/L,优于白先放等[30]报道的2.35 g/L、de Jesus Assis等[31]报道的5.59 g/L 。
本研究通过水提醇沉法从菌株的发酵液中提取多糖胶质,再通过苯酚-硫酸法测定多糖胶质含量,筛选获得一株高产多糖胶质的菌株FJAT-10151,分离自福建省顺昌红心柚叶片,与工业生产菌野油菜黄单胞菌同为植物源微生物细菌[32-33]。通过形态学观察、生理生化实验和16S rDNA序列的同源性分析,该菌鉴定为地毯草黄单胞菌Xanthomonas axonopodis FJAT-10151。该菌株鉴定为革兰氏阴性菌株,与Zimaro等[34]报道一致;菌落较小、圆形、淡黄色、表面光滑且湿润、微隆、边缘整齐、不透明、具有迁移性,与Zaid 等[35]报道一致。
利用SPSS 16.0软件对22 株株菌发酵过程中菌体和多糖胶质的相关性进行研究,细菌产生的菌体生物量和多糖胶质产量差异最大的是Sphingomonas paucimobilis FJAT-4703,菌体生物量是多糖胶质产量的6.76 倍;多糖胶质产量最高的是X anthomonas axonopodis FJAT-10151,为8.648 g/L。多糖胶质的生产与细胞的生长有关,主要是在稳定期[36-37]。
FJAT-10151-DTJZ性状疏松透明呈果 冻状,纯度为45.71%(中性糖36.81%,酸性糖8.9%),经Sevag法去蛋白和糖腈衍生化后,GC-MS的分析结果表明FJAT-10151-DTJZ的单糖主要组分为甘露糖和葡萄糖,物质的量比为1∶1.12。通过红外光谱、紫外光谱、GC-MS等手段初步鉴定该多糖胶质FJAT-10151-DTJZ为黄原胶。黄原胶可具有增稠性、乳化性、稳定性等优点,在食品、化工、医药、石油等领域都有广泛的应用[38-40]。在同等条件下,FJAT-10151-DTJZ的黏度为408 mPa·s,与黄原胶相当,是结冷胶的1.5 倍。TPA测试结果表明,与购买的结冷胶、黄原胶相比,本研究得到的黄原胶硬度小,弹性和黏着性较好,胶黏性和咀嚼性最好,说明FJAT-10151-DTJZ的胶性质优良。
[1] CHEN J, ZHANG W, LI X. Preparation and characterization of a novel superabsorbent of konac glucomannan- poly (acrylic acid) with trimethylolpropane trimethacrylate cross-linker[J]. RSC Advances,2015, 5(48): 38417-38423. DOI:10.1039/C5RA04522C.
[2] TOMSHICH S V, KOMANDROVA N A, WILDMALM G, et al. Structure of acidic O-specific polysaccharide from the marine bacterium Cellulophaga baltica[J]. Bioorg Khim, 2007, 33(1): 83-87. DOI:10.1134/S1068162007010104.
[3] FEDOROV S N, ERMAKOVA S P, ZVYAGINTSEVA T N. Anticancer and cancer preventive properties of marine polysaccharides: some results and prospects[J]. Marine Drugs, 2013, 11(12): 4876-4901. DOI:10.3390/md11124876.
[4] KOBATA A. Glycobiology in the field of aging research introduction to glycogerontology[J]. Biochimie, 2003, 85(1/2): 13-24. DOI:10.1016/S0300-9084(03)00003-8.
[5] NAGAI Y. Glycobiology in the 21stCentury: coming developments in glycobiology[J]. Glycoconjugate Journal, 2002, 19(3): 161-163. DOI:10.1023/A:1024275322537.
[6] SHIOMI M, SASAKI K, MUROFUSHI M, et al. Antitumor activity in mice of orally administered polysaccharide from Kefir grain[J]. Japanese Journal of Medical Science Biology, 1982, 35(2): 75-80. DOI:10.7883/yoken1952.35.75.
[7] MAITY S, SA B. Ca-carboxymethyl xanthan gum mini-matrices: swelling, erosion and their impact on drug release mechanism[J]. International Journal of Biological Macromolecules, 2014, 68: 78-85. DOI:10.1016/j.ijbiomac.2014.04.036.
[8] PHILIPPIS R D, COLICA G, MICHELETTI E. Exopolysaccharideproducing cyanobacteria in heavy metal removal from water: molecular basis and practical applicability of the biosorption process[J]. Applied Microbiology Biotechnology, 2011, 92(4): 697-708. DOI:10.1007/s00253-011-3601-z.
[9] SLAVEYKOVA V I, PARTHASARATHY N, DEDIEU K, et al. Role of ectracellular compounds in Cd-sequestration relative to Cd uptake by bacterium Sinorhizobium meliloti[J]. Environmental Pollution,2010, 158(8): 2561-2565. DOI:10.1016/j.envpol.2010.05.016.
[10] CHANG Z Q, LEE J S, GEBRU E, et al. Mechanism of macrophage activation induced by beta-glucan produced from Paenibacillus polymyxa JB115[J]. Biochemical and Biophysical Research Communications, 2010, 391(3): 1358-1362. DOI:10.1016/ j.bbrc.2009.12.064.
[11] HOU C T, AHLGREN J A, BROWN W, et al. Production of an extracellular polysaccharide by Agrobacterium sp. DS3 NRRL B-14297 isolated from soil[J]. Journal of Industrial Microbiology,1996, 16(2): 129-133. DOI:10.1007/BF01570073.
[12] YU X Q, ZHANG C, YANG L P, et al. CrdR function in a curdlan-producing Agrobacterium sp. ATCC31749 strain[J]. BMC Microbiology, 2015, 15(1): 25-35. DOI:10.1186/s12866-015-0356-1.
[13] ZHANG J, DONG Y C, FAN L L, et al. Optimization of culture medium compositions for gellan gum production by a halobacterium Sphingomonas paucimobilis[J]. Carbohydrate Polymers, 2015, 115: 694-700. DOI:10.1016/j.carbpol.2014.09.029.
[14] HARDING N E, PATEL Y N, COLEMAN R J. Organization of genes required for gellan polysaccharide biosynthesis in Sphingomonas elodea ATCC 31461[J]. Journal of Industrial Microbiology and Biotechnology, 2004, 31(2): 70-82. DOI:10.1007/s10295-004-0118-9.[15] KAUR V, BERA M B, PANESAR P S, et al. Welan gum: microbial production, characterization, and applications[J]. International Journal of Biological Macromolecules, 2014, 65: 454-461. DOI:10.1016/ j.ijbiomac.2014.01.061.
[16] POLLOCK T J, MIKOLAJCZAK M, YAMAZAKI M, et al. Production of xanthan gum by Sphingomonas bacteria carrying genes from Xanthomonas campestris[J]. Journal of Industrial Microbiology and Biotechnology, 1997, 19(2): 92-97. DOI:10.1038/sj.jim.2900449.[17] WIBBERG D, ALKHATEEB R S, WINKLER A, et al. Draft genome of the xanthan producer Xanthomonas campestris NRRL B-1459(ATCC 13951)[J]. Journal of Biotechnology, 2015, 204: 45-46. DOI:10.1016/j.jbiotec.2015.03.026.
[18] 聂凌鸿, 周如金. 黄原胶的开发应用现状[J]. 粮油食品科技, 2004,12(6): 14-16. DOI:10.3969/j.issn.1007-7561.2004.06.006.
[19] TAO F, WANG X, MA C Q, et al. Genome sequence of Xanthomonas campestris JX, an industrially productive strain for xanthan gum[J]. Journal of Bacteriology, 2012, 194(17): 4755-4756. DOI:10.1128/ JB.00965-12.
[20] ROJAS R, NISHIDOMI S, NEPOMUCENO R, et al. Glutamate transport and xanthan gum production in the plant pathogen Xanthomonas axonopodis pv. citri[J]. World Journal of Microbiology Biotechnology, 2013, 29(11): 2173-2180. DOI:10.1007/s11274-013-1383-4.
[21] 吴国荃, 王金台, 罗书凯. 黄原胶的国内生产现状及趋势[J]. 化工技术经济, 2004, 22(10): 15-18. DOI:10.3969/ j.issn.1673-9647.2004.10.004.
[22] 刘清泉. 黄原胶产业的现状及发展趋势[J]. 中国食品添加剂,2002(6): 5-7. DOI:10.3969/j.issn.1006-2513.2002.06.002.
[23] 郑梅霞, 刘波, 葛慈斌, 等. 陕北土壤芽孢杆菌种类分布多样性研究[J]. 福建省农业学报, 2014, 29(4): 364-372. DOI:10.3969/ j.issn.1008-0384.2014.04.013.
[24] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determin ation of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ ac60111a017.
[25] 谢丽源, 张勇, 彭卫红, 等. 鲍氏针层孔菌菌丝体多糖脱蛋白方法研究[J]. 中药材, 2011, 34(2): 293-295. DOI:10.13863/ j.issn1001-4454.2011.02.018.
[26] RUIZ-MATUTE A I, HERNANDEZ-HERNANDEZ O,RODRIGUEZ-SANCHEZ S, et al. Derivatization of carbohydrates for GC and GC-MS analyses[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(17): 1226-1240. DOI:10.1016/j.jchromb.2010.11.013.
[27] PRICE N P. Acylic sugar derivatives for GC/MS analysis of13C-enrichment during carbohydrate metabolism[J]. Analytical Chemistry, 2004, 76(22): 6566-6574. DOI:10.1021/ac049198m.
[28] 李莉, 石俊英. 气相色谱-质谱联用分析肉桂多糖及脂类成分[J]. 中药材, 2013, 36(4): 578-580. DOI:10.13863/ j.issn1001-4454.2013.04.048.
[29] 刘兴余, 金邦荃, 气詹巍, 等. 猪肉质构的仪器测定与感官评定之间的相关性分析[J]. 食品科学, 2007, 28(4):245-248. DOI:10.3321/ j.issn:1002-6630.2007.04.056.
[30] 白先放, 李柱, 刘海东. 亚硝酸诱变选育黄原胶高产菌株初探[J]. 企业科技与发展, 2011(1): 32-34.
[31] de JESUS ASSIS D, BRANDAO L V, de SOUSA COSTA L A, et al. A study of the effects of aeration and agitation on the properties and production of xanthan gum from crude glycerin derived from biodiesel using the response surface methodology[J]. Applied Biochemistry and Biotechnology, 2014, 172(5): 2769-2785. DOI:10.1007/s12010-014-0723-7.
[32] BRUNINGS A M, GABRIEL D W. Xanthomonas citri: breaking the surface[J]. Molecular Plant Pathology, 2003, 4(3): 141-157. DOI:10.1046/j.1364-3703.2003.00163.x.
[33] GRAHAM J H, GOTTWALD T R, CUBERO J, et al. Xanthomonas axonopodis pv. citri: factors affecting successful eradication of citrus canker[J]. Molecular Plant Pathology, 2004, 5(1): 1-15. DOI:10.1046/ j.1364-3703.2004.00197.x.
[34] ZIMARO T, THOMAS L, MARONDEDZE C, et al. Insights into Xanthomonas axonopodis pv. citri biofilm through proteomics[J]. BMC Microbiology, 2013, 13: 186. DOI:10. 1186/ 1471-2180-13-186.
[35] ZAID A M, BONASERA J M, BEER S V. OEM: a new medium for rapid isolation of onion-pathogenic and onion-associated bacteria[J]. Journal of Microbiological Methods, 2012, 91(3): 520-526. DOI:10.1016/j.mimet.2012.09.031.
[36] BORN K, LANGENDORFF V, BOULENGUER P. Xanthan[M]. Weinheim, Germany: WILEY-VCH Verlag GmbH & Co. KGaA,2005: 535-573.
[37] ZHANG Z G, CHEN H Z. Fermentation performance and structure characteristics of xanthan produced by Xanthomonas campestris with a glucose/xylose mixture[J]. Applied Biochemistry and Biotechnology,2010, 160(6): 1653-1663. DOI:10.1007/s12010-009-8668-y.
[38] YANG F, YANG L, GUO X, et al. Production and purification of a no vel xanthan lyase from a xanthan-degrading Microbacterium sp. strain XT11[J]. Scientific World Journal, 2014, 2014: 368-434. DOI:10.1155/2014/368434.
[39] CADMUS M C, JACKSON L K, BURTON K A, et al. Biodegradation of xanthan gum by Bacillus sp.[J]. Applied and Environmental Microbiology, 1982, 44(1): 5-11.
[40] KHALIL M, MOHAMED JAN B. Herschel-Bulkley rheological parameters of a novel environmentally friendly lightweight biopolymer drilling fluid from xanthan gum and starch[J]. Journal of Applied Polymer Science, 2012, 124(1): 595-606. DOI:10.1002/app.35004.
Screening and Identification of Bacteria for Enhanced Production of Polysaccharide Gum
ZHENG Meixia1, ZHU Yujing1, LIU Bo1,*, PAN Zhizhen1, CHEN Meichun1, ZHANG Lianbao1,2, HUANG Sufang1
(1. Agricultural Bio-resources Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China;2. School of Life Sciences, Xiamen University, Xiamen 361005, China)
For the purpose of increasing the production of microbial polysaccharide gum, strain FJAT-10151, which showed a productivity of 8.65 g/L, was screened from 22 bacterial isolates conserved in our laboratory, which have been reported for the production of polysaccharide gum. The selected isolated was identified as Xanthomonas axonopodis by 16S rDNA sequence analysis. By morphology observation, physiological and biochemical tests and Gram staining, it was further identified as a Gram negative strain, and its colonies were small, round, yellowish, opaque and mobile, having a smooth,moist and slightly bulge surface and regular edge. Polysaccharide gum was isolated from the fermentation broth of the strain in water extraction and alcohol precipitated. As determined by phenol-sulfuric acid method, carbazole method and Coomassie brilliant blue method, the contents of neutral saccharide, acidic saccharide and protein in the exopolysaccharide gum were 36.81%, 8.90% and 15.27%, respectively. The polysaccharide gum was deproteinized by the Sevage method and then completely hydrolyzed for gas chromatography-mass spectrometry (GC-MS) analysis after derivatization to aldononitrile acetates. The analysis indicated that it mainly consisted of glucose and mannose at a molar ratio of 1:1.12. It was identified by FTIR, UV spectroscopy and GC-MS as a xanthan. Gelation properties of the polysaccharide gum were tested by viscosity and texture profile analysis (TPA). The viscosity of 1 g/100 mL polysaccharide gum solution was 408 mPa・s at 60 r/min. The TPA results indicated that the polysaccharide gum extracted from Xanthomonas axonopodis FJAT-10151 had excellent gel properties with the smallest hardness, better elasticity and stickiness, and the best adhesiveness and chewiness compared with commercial gellan and xanthan. In conclusion, this Xanthomonas axonopodis strain has potential applications.
Xanthomonas axonopodis; xanthan; gumminess
2015-09-28
国家农业部“948计划”项目(2014-Z48);福建省公益类科研院所专项(2015R1018-2);福建省农业科学院科技创新项目(2015CX-7)
郑梅霞(1986—),女,实习研究员,硕士,研究方向为微生物生物技术。E-mail:zhengmeixia2005@163.com
刘波(1957—),男,研究员,博士,研究方向为微生物生物技术与农业生物药物。E-mail:fzliubo@163.com
10.7506/spkx1002-6630-201615029
TS202
A
1002-6630(2016)15-0171-08
引文格式:

