Lactobacillus plantarum 163产细菌素食品级培养基筛选及发酵条件优化
胡美忠,党丽娟,陆兆新,*
(1.铜仁职业技术学院药学院,贵州 铜仁 554300;2.南京农业大学食品科技学院,江苏 南京 210095)
Lactobacillus plantarum 163产细菌素食品级培养基筛选及发酵条件优化
胡美忠1,2,党丽娟2,陆兆新2,*
(1.铜仁职业技术学院药学院,贵州 铜仁 554300;2.南京农业大学食品科技学院,江苏 南京 210095)
为获得Lactobacillus plantarum 163最佳食品级培养基,首先筛选出Lb. plantarum 163食品级培养基配方,即白菜汁200 mL/L、番茄汁50 mL/L、葡萄糖10 g/L、K2HPO42 g/L,蒸馏水补足至1 L。Plackett-Burman试验设计筛选出Lb. plantarum 163食品级培养基配方的关键因子,即接种量、K2HPO4添加量、pH值和大白菜汁添加量。通过Box-Behnken试验构建了Lb. plantarum 163食品级培养基二次多项式模型,得到理想发酵条件,即K2HPO41.89 g/L、大白菜汁341.5 mL/L、接种量3.56%、pH 6.95,其抑菌活性比优化前增加30%以上。
食品级培养基;优化;响应面;植物乳杆菌163
胡美忠, 党丽娟, 陆兆新. Lactobacillus plantarum 163产细菌素食品级培养基筛选及发酵条件优化[J]. 食品科学, 2016,37(15): 165-170. DOI:10.7506/spkx1002-6630-201615028. http://www.spkx.net.cn
HU Meizhong, DANG Lijuan, LU Zhaoxin. Screening of food-based medium and optimization of fermentation conditions for bacteriocin production by Lactobacillus plantarum 163[J]. Food Science, 2016, 37(15): 165-170. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615028. http://www.spkx.net.cn
随着社会进步,人们生活水平提高,人们对吃的要求概括为:健康、原生态和绿色,故现食品工业研究人员都在寻找天然安全的食品防腐剂借以制造绿色安全健康食品,而乳酸菌来源的食品添加剂研究是目前的一个热点[1]。
Lactobacillus plantarum 163筛选自贵州铜仁产发酵白菜(大白菜),前期研究发现其能产生两种活性细菌素,且对革兰氏阳性菌及革兰氏阴性菌均有较好的抑制效果,具有作为生物防腐剂应用于食品防腐的潜力,然而之前的研究Lb. plantarum 163的培养基为MRS培养基(非食品级),其培养出来的发酵物不适合直接用于食品防腐[2-3]。
本实验以Lb. plantarum 163发酵的MRS培养基为出发点,根据乳酸菌生长需要的氮源、碳源、无机盐、生长因子和水,选取可直接食用或GB 2760—2011《食品安全国家标准 食品添加剂使用标准》明确规定可使用的成分[4],以培养基配方组成简单,培养基原料来源广泛、价廉和细菌素产量高为前提[5-6],设计筛选Lb. plantarum 163食品级培养基,运用响应面法(response surface methodology,RSM)及回归方程得到Lb. plantarum 163食品级培养基组分配比。
1 材料与方法
1.1菌株、培养基与试剂
供试菌种:Lb. plantarum 163,从贵州省铜仁市酸白菜中分离纯化并鉴定,现保藏于GCMGC 8224。指示菌:Bacillus pumilus CMCC 63202。
牛肉膏蛋白胨培养基(NA);MRS培养基。
食品级培养基筛选配方编号及配方明细(各配方总体积1 L用蒸馏水补足,pH 6.5±0.2,白菜汁制备方法:大白菜(Chinese cabbage)洗净后,切成小条,九阳榨汁机榨汁,得白菜汁,番茄汁同)。
1)白菜汁80 mL/L、番茄汁30 mL/L、乙酸钠5 g/L、K2HPO42 g/L、酵母膏5 g/L、硫酸镁0.2 g/L、硫酸锰0.04 g/L、柠檬酸氢二铵2 g/L;2)白菜汁80 mL/L、番茄汁30 mL/L、乙酸钠5 g/L、K2HPO42 g/L、酵母膏5 g/L、硫酸镁0.2 g/L、硫酸锰0.04 g/L;3)白菜汁80 mL/L、番茄汁30 mL/L、乙酸钠5 g/L、K2HPO42 g/L、酵母膏5 g/L、硫酸镁0.2 g/L;4)白菜汁80 mL/L、番茄汁30 mL/L、乙酸钠5 g/L、K2HPO42 g/L、酵母膏5 g/L;5)白菜汁80 mL/L、番茄汁30 mL/L、酵母膏5 g/L;6)白菜汁80 mL/L、番茄汁30 mL/L;7)白菜汁200 mL/L、番茄汁50 mL/L、酵母膏5 g/L、K2HPO42 g/L、吐温-80 1 mL/L;8)白菜汁200 mL/L、番茄汁50 mL/L、酵母膏5 g/L、K2HPO42 g/L;9)白菜汁200 mL/L、番茄汁50 mL/L、酵母膏5 g/L、吐温-80 1 mL/L;10)白菜汁200 mL/L、番茄汁50 mL/L、吐温-80 1 mL/L;11)白菜汁200 mL/L、番茄汁50 mL/L、酵母膏7.5 g/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L、吐温-80 0.5 mL/L;12)白菜汁200 mL/L、番茄汁50 mL/L、酵母膏7.5 g/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L;13)白菜汁200 mL/L、番茄汁50 mL/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L、吐温-80 0.5 mL/L;14)白菜汁200 mL/L、番茄汁50 mL/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L、吐温-80 0.5 mL/L;15)白菜汁200 mL/L、番茄汁50 mL/L、蛋白胨10 g/L、K2HPO42 g/L、吐温-80 0.5 mL/L;16)白菜汁200 mL/L、番茄汁50 mL/L、蛋白胨10 g/L、K2HPO42 g/L;17)白菜汁200 mL/L、葡萄糖10 g/L、K2HPO42 g/L;18)白菜汁200 mL/L、葡萄糖10 g/L;19)番茄汁50 mL/L、葡萄糖10 g/L、K2HPO42 g/L;20)番茄汁50 mL/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L;21)白菜汁200 mL/L、番茄汁50 mL/L、葡萄糖10 g/L、K2HPO42 g/L;22)白菜汁200 mL/L、番茄汁50 mL/L、葡萄糖10 g/L;23)番茄汁50 mL/L、胡萝卜汁100 mL/L、蛋白胨10 g/L、葡萄糖10 g/L、K2HPO42 g/L;24)番茄汁50 mL/L、胡萝卜汁100 mL/L、葡萄糖10 g/L、K2HPO42 g/L。
1.2仪器与设备
YXQ.SG41.280手提式压力蒸汽灭菌锅 上海医用核子仪器厂;SW-CJ-IBU超净工作台 苏净集团安泰公司;Orion 3 STAR pH计 美国Thermo公司;PYX-DHS-50X65 隔水式电热恒温培养箱 上海跃进医疗器械厂;JYZ-F600九阳榨汁机 九阳股份有限公司。
1.3方法
1.3.1Lb. plantarum 163食品级培养基筛选
Lb. plantarum 163菌株接种于MRS培养基,37 ℃静置培养14 h后,按照体积分数2%分别接种于1~24号筛选培养基,37 ℃静置培养36 h后离心,得上清液,备用。
以短小芽孢杆菌(CMCC 63202)为指示菌(菌液OD600nm≈1,以液体培养基为对照),琼脂扩散法检测各筛选培养基发酵上清液的抑菌活性[2],抑菌活性以抑菌圈直径表示,结果取3 次平均值。
1.3.2Lb. plantarum 163食品级培养基Plackett-Burman设计
从Lb. plantarum 163食品级培养基筛选试验选择白菜汁、番茄汁、葡萄糖和K2HPO4为培养基成分的配方,Plackett-Burman试验对此配方进行关键因子筛选,其中X1~X4为培养基配方组分,X5~X8为发酵条件,响应值为抑菌圈直径,试验设计和数据分析采用JMP软件(Version 9.0.2,SAS Institute Inc.),每组试验设2 次重复,结果取平均值。
1.3.3Lb. plantarum 163食品级培养基响应面设计
从Plackett-Burman试验结果选择接种量、K2HPO4添加量、pH值和大白菜汁添加量4 个因子,采用Box-Behnken试验进行响应面法优化[7-8],以期获得影响该菌株发酵产细菌素的最佳培养基组成以及外部发酵条件,试验设计及分析采用Design-Expert(Version 8.05b)软件。
2 结果与分析
2.1Lb. plantarum 163食品级培养基筛选
从MRS培养基出发,以培养基配方组成简单,培养基成分安全易得、价廉,代谢产生的细菌素产量高为前提,设计了24 种筛选用培养基。结果见表1。培养36 h后,这24 种发酵液均出现乳白色絮状物质,表明培养基中有菌体产生;36 h后24 种培养基发酵液pH值在3.7~4.0之间,表明在发酵过程中,菌体代谢产生大量的有机酸。然而抑菌实验显示,这24 种培养基发酵液仅仅只有17~24号培养基产生抑菌圈,这表明Lb. plantarum 163虽然能在1~16号培养基中生长,但是并不能产生细菌素。
比较1~24号培养基可发现,1~10号培养基无葡萄糖,17~24号含葡萄糖,这可能是葡萄糖的代谢是合成细菌素的必要条件,有类似葡萄糖是某一代谢过程的关键因子[9-10]。而11~16号(除12号)培养基含有葡萄糖但是不表现抑菌活性,但是含有吐温-80。吐温-80是混浊剂,有利于细菌扩散,但是在某些场合下也会影响细菌素的产量[11],12号培养基含有葡萄糖、不含有吐温-80,但是也没有表现抑菌活性,但是12号培养基其他组分如酵母膏、蛋白胨等含量较高,不产细菌素可能是因为培养基营养过于丰富有关,因为细菌素的产生与细菌周围营养情况关系密切。
17~24号培养基均有抑菌效果,其中17、18、21、23号培养基抑菌效果较好,综合比较,21号培养基配方最为简单,抑菌效果也较好,故选择21号(白菜汁200 mL/L、番茄汁50 mL/L、葡萄糖10 g/L、K2HPO42 g/L)培养基作为后续发酵优化培养基。
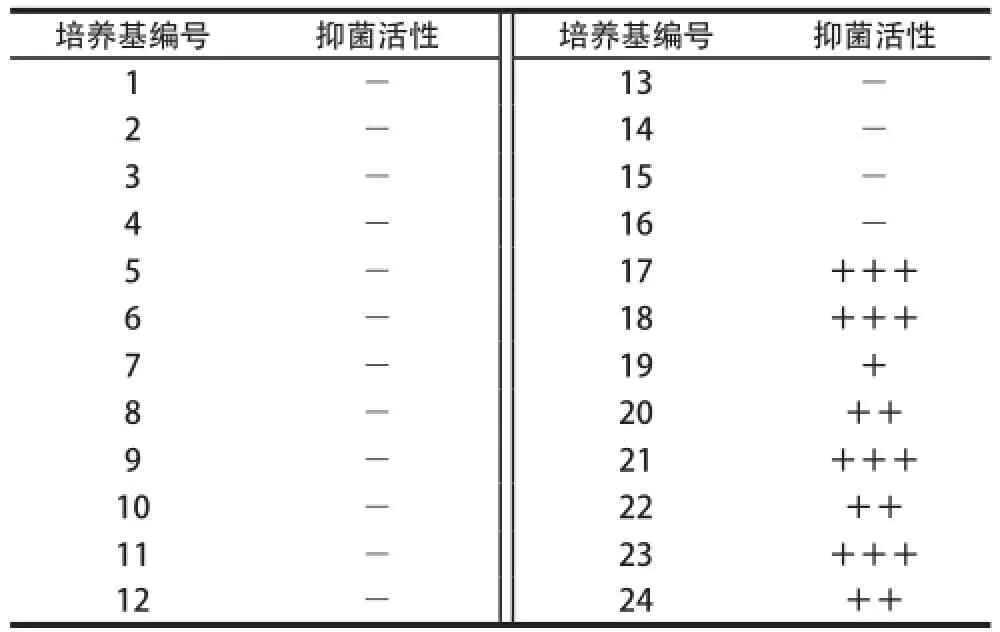
表1 Lb. plantarum 163食品级培养基的筛选Table 1 Screening of food-based medium for Lb. plantarum 163
2.2Lb. plantarum 163食品级培养基Plackett-Burman设计
Plackett-Burman试验的设计方案及结果见表2,方差分析见表3。P<0.000 1,表明该筛选模型极显著。根据表4显著性分析可知,影响Lb. plantarum 163食品级培养基产细菌素的主要因素是:接种量、K2HPO4添加量、pH值、大白菜汁添加量和培养温度,它们对抑菌圈大小具有极显著影响(P<0.000 1)。其中培养温度与抑菌圈直径成负相关,即培养温度越高,抑菌圈直径越少,另外从能耗上来看,培养温度越低,有利于降低能耗,故选择较低的温度不但有利于提升细菌素产量,且有利于降低生产成本,但是前期的实验发现,Lb. plantarum 163培养温度低于30 ℃,则菌体生长缓慢,如果选择30 ℃以下温度培养Lb. plantarum 163耗时,故综合考虑,培养温度不作为关键因子考察,培养温度设定于30 ℃。其余因素根据Plackett-Burman试验设计原理皆选定为低水平进行后续响应面试验。
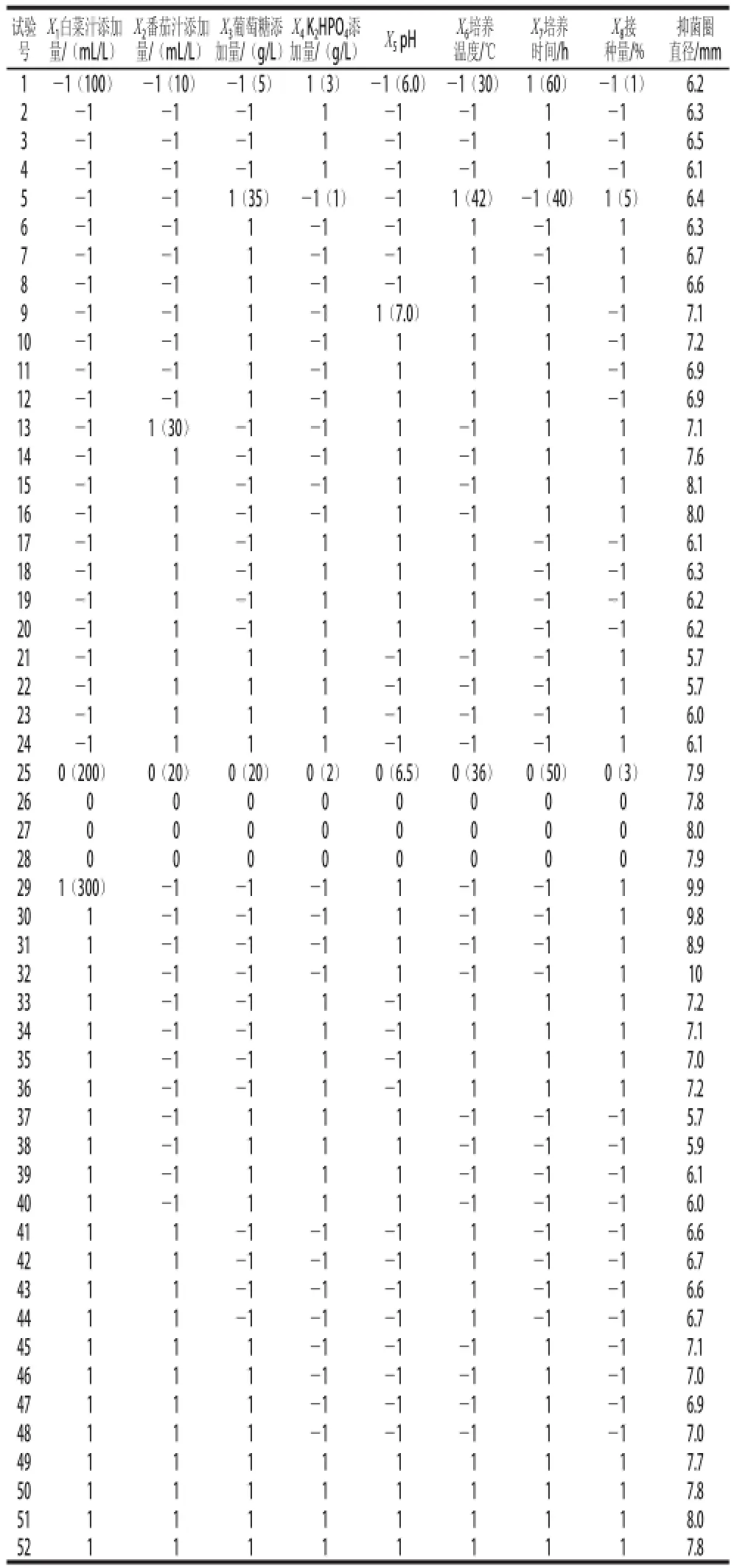
表2 Plackett-Burrmmaann试验设计及结果Table 2 Plackett-Burman design with experimental results
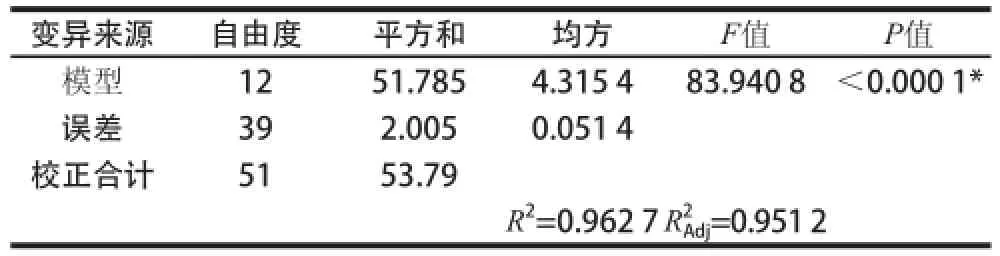
表3 Plackett-Burman方差分析Table 3 Analysis of variance of Plackett-Burman design
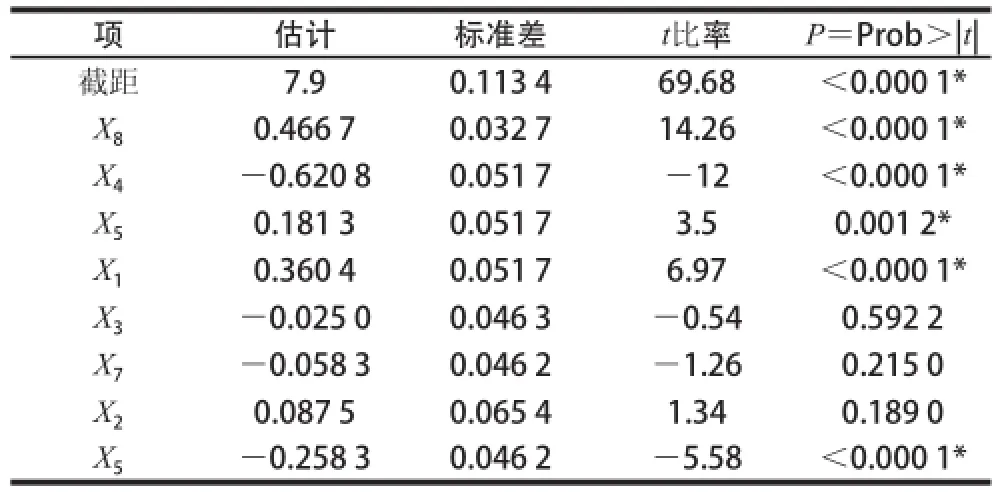
表4 Plackett-Burman试验回归系数及显著性检验Table 4 Regression coefficients and significance of Plackett-Burman design
2.2Lb. plantarum 163食品级培养基响应面设计
2.2.1预测模型及回归方程建立分析
从Plackett-Burman试验结果分析基础上,进行响应面设计,响应面采用Box-Behnken对各个关键因子进行进一步优化,得到其回归方程为:
试验响应值及预测值见表5。方差分析及显著性见表6。方差分析可知,模型F值为18.327 4,P<0.000 1,模型显著,失拟项F值为34.637 8,P= 0.131 5,失拟项不显著。校正决定系数,变异系数为4.874 3%,说明该模型拟合性比较好,可以采用此模型(回归方程)代替实验真实点对响应值进行相关预测。
回归方程回归系数显著性检验表明(表6):一次项系数B和D的P值均<0.000 1,表明线性影响效应中B(白菜汁添加量)和D(pH值)对Lb. plantarum 163食品级培养基细菌素产量效应显著,而A(K2HPO4添加量)和C(接种量)对Lb. plantarum 163食品级培养基细菌素产量效应不显著。二次项系数A2、B2、C2和D2的P值均<0.01,说明多个具体的试验因子对响应值的影响变化相对复杂,曲面效应显著,交互项BC和BD交互效应P<0.05,效应显著,其他两两交互效应不显著。
经过响应面优化,可分析得到Lb. plantarum 163最佳食品级培养基配方为:K2HPO41.89 g/L、大白菜汁341.5 mL/L、接种量3.56%、pH 6.95。为验证Lb. plantarum 163食品级培养基产细菌素的模型方程的有效性,在实验范围内选取最优发酵条件及相近的培养条件共5 组进行实际验证实验,结果见表7,所得抑菌圈直径(抑菌活性)与模型预测值非常接近,说明该模型是合适有效的。
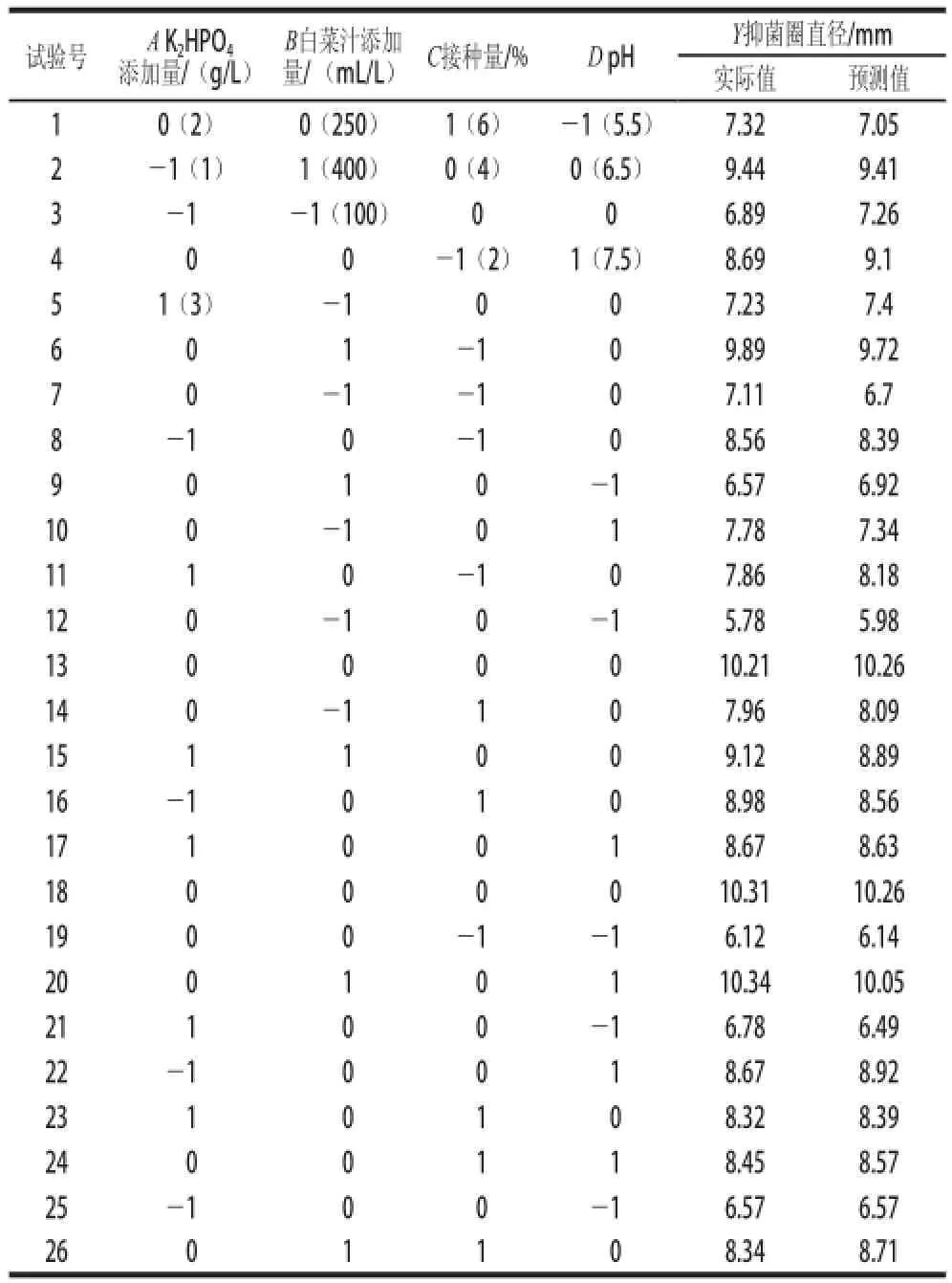
表5 Box-Behnken设计方案及抑菌活性实际值和预测值Table 5 Box-Behnken design (BBD) with actual and predicted values of antimicrobal activity
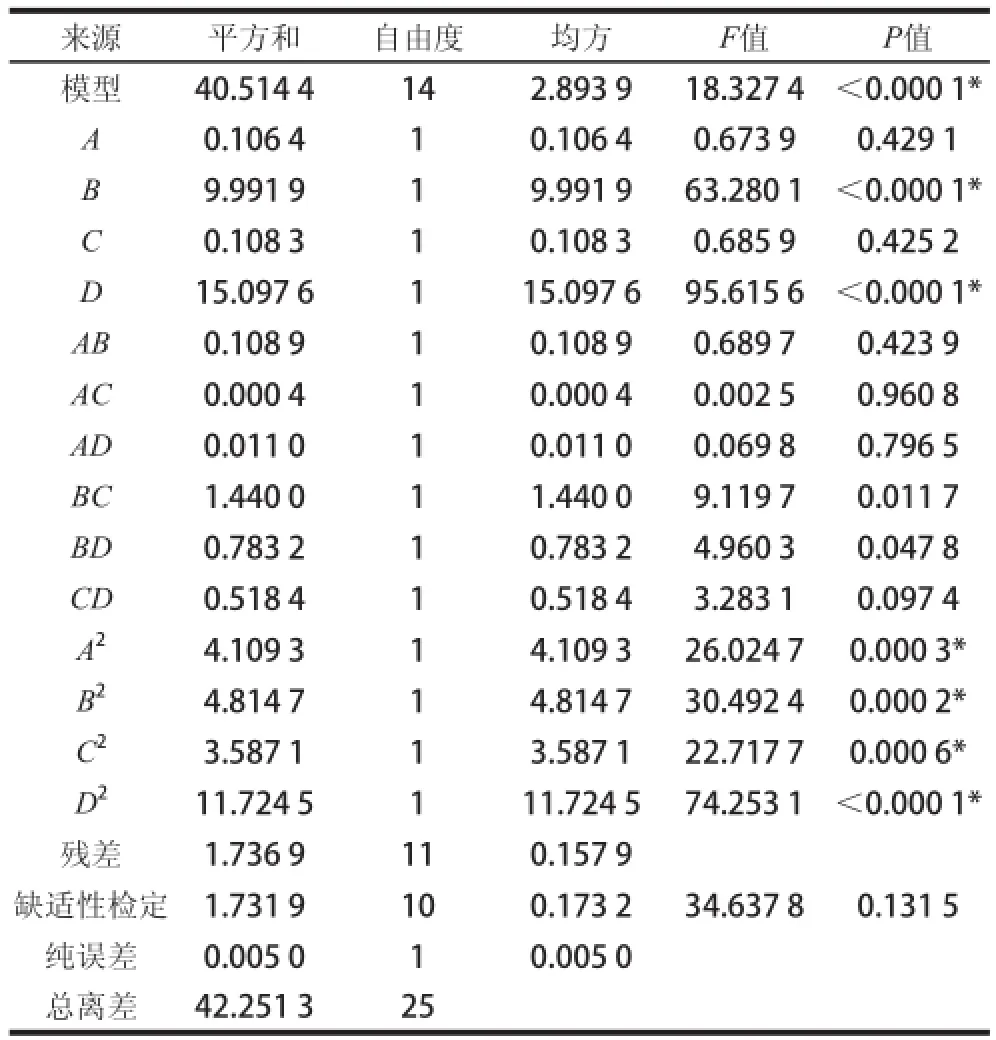
表6 Box-Behnken试验方差分析及显著性检验Table 6 Analysis of variance and significance test of BBD
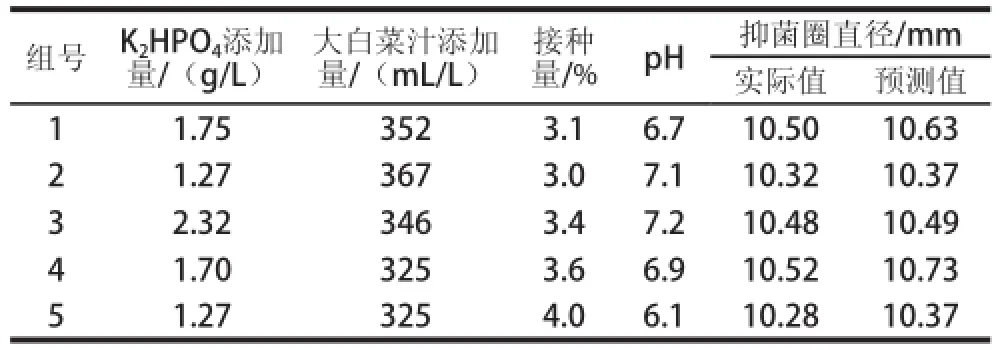
表7 抑菌活性模型验证实验Table 7 Model validation experiments for antimicrobal activity
3 讨 论
防腐剂可分为化学防腐剂和天然防腐剂,而化学防腐剂可能存在诱癌性、致畸性和易引起食物中毒等问题[12-13],近年来使用受到限制,而天然防腐剂则因为其安全的特性正在逐步取代化学防腐剂。可见,安全可靠是防腐剂选择的一个重要前提。
少部分乳酸菌会在代谢过程中分泌一种具有广谱抑菌作用的活性多肽-细菌素,而人类利用乳酸菌及发酵产物有几千年历史[14-15],现在广泛应用于食品制造,保健食品生产等方面[16],故由乳酸菌分泌产生的细菌素应用于食品防腐安全可行,本研究的Lb. plantarum 163产生的两种活性多肽就有应用于食品防腐的潜力。Lb. plantarum 163是植物乳杆菌,属于乳酸菌,来源安全,其代谢产物也安全[17],然而前期的研究,Lb. plantarum 163发酵培养基是MRS培养基,MRS培养基是实验室用培养基,其所含成分不符合安全的范畴,故要利用Lb. plantarum 163的发酵产物应用于食品防腐,需要筛选出食品级的培养基。
食品级培养基的筛选,除了考虑安全,即所有成分均符合国家标准GB 2760—2011明确规定可使用的范围外[4],也需要考虑生产的实际成本,即原料价廉,培养基组成简单。本研究的食品级培养基筛选就是基于这几点出发,筛选出Lb. plantarum 163食品级培养基。
Lb. plantarum 163食品级培养基发酵生产细菌素,产量自然是一个重要的考虑条件,本研究首先利用Plackett-Burman试验对筛选出来的食品级发酵培养基关键因子进行筛选,然后利用Box-Behnken响应面对各个关键因子进行优化,得到Lb. plantarum 163食品级培养基各组分的优化配方,最后利用验证实验验证模型的可靠性,最终结果显示,模型是可靠的。
Plackett-Burman是一种经济高效的二水平试验设计方法,可以在大量减轻工作量的前提下得到所需的试验要求,现在广泛应用于各种工艺优化研究[18-19]。如利用Plackett-Burman设计法筛选出影响假丝酵母HZ19生物量的重要影响因子[20],利用Plackett-Burman试验设计确定了8 种碳源、8 种氮源和6 种无机盐对Bacillus malacitensis Z-5菌株芽孢产量的影响[21]。
响应面法是一种高效的培养基优化方法,可同时评估影响产量的各因素及相互关系[22-23]。Ben Belgacem等[24]考察了pH值和温度对3 种细菌素的稳定性,Kaur等[25]使用响应面法优化Pediocin BA28的培养基,提高了Pediocin BA28的产量。
Lb. plantarum 163食品级培养基(21号培养基)经过优化后(K2HPO41.89 g/L、大白菜汁 341.5 mL/L、接种量3.56%、pH值为6.95)其抑菌活性相对于未优化前提升30%以上,效果显著。
[1] 饶瑜, 常伟, 唐洁, 等. 产细菌素乳酸菌在蔬菜发酵制品生物保鲜中的应用[J]. 食品工业科技, 2013, 34(16): 392-395.
[2] MEIZHONG H, HAIZHEN Z, CHONG Z, et al. Purification and characterization of plantaricin 163, a novel bacteriocin produced by Lactobacillus plantarum 163 isolated from traditional Chinese fermented vegetables[J]. Journal of Agricultural and Food Chemistry,2013, 61(47): 11676-11682. DOI:10.1021/jf403370y.
[3] 胡美忠. Lactobacillus plantarum 163分离鉴定及其细菌素研究[D].南京: 南京农业大学, 2014: 71-86.
[4] 卫生部. GB 2760—2011 食品安全国家标准 食品添加剂使用标准[S].北京: 中国标准出版社, 2011.
[5] 沈跃丽, 陈蕊, 张莉, 等. 枯草芽孢杆菌生产抗菌物质的食品级发酵培养基优化[J]. 食品科学, 2014, 35(9): 168-173. DOI:10.7506/ spkx1002-6630-201409034.
[6] 王海宽, 陈冲, 王应东, 等. 以食品级原料进行植物乳杆菌发酵及其抗真菌活性的研究[J]. 天津科技大学学报, 2014(2): 1-5. DOI:10.13364/j.issn.1672-6510.2014.02.001.
[7] 周颖, 高晓峰, 周晶, 等. 一株仅产L-乳酸的乳酸乳球菌发酵培养基的优化[J]. 食品科学, 2 015, 36(9): 84-88. DOI:10.7506/spkx1002-6630-201509016.
[8] 周慧敏, 刘琛, 郭宇星, 等. 固定化瑞士乳杆菌蛋白酶酶解乳清蛋白生产ACE抑制肽的条件优化[J]. 食品科学, 2015, 36(7): 61-65. DOI:10.7506/spkx1002-6630-201507012.
[9] KOBURGER T, WEIBEZAHN J, BERNHARDT J, et al. Genomewide mRNA profiling in glucose starved Bacillus subtilis cells[J]. Molecular Genetics and Genomics, 2005, 274(1): 1-12. DOI:10.1007/ s00438-005-1119-8.
[10] MARCOTTE E M, PELLEGRINI M, THOMPSON M J, et al. A combined algorithm for genome-wide prediction of protein function[J]. Nature, 1999, 40 2: 83-86. DOI:10.1038/47048.
[11] KAWAI Y, SAITO T, TOBA T, et al. Isolation and characteriza tion of a highly hydrophobic new bacteriocin (gassericin A) from Lactobacillus gasseri LA39[J]. Bioscience Biotechnology & Biochemistry, 1994, 58(7): 1218-1221. DOI:10.1271/bbb.58.1218.
[12] 吴燕燕, 李来好, 刁石强, 等. 环境激素对水产品安全性的影响及预防[J]. 海洋科学, 2008, 32(1): 94-96.
[13] 刘运荣. 中国乳与乳制品安全问题的探讨[J]. 农业工程技术(农产品加工), 2007(9): 32-37. DOI:10.3969/j.issn.1673-5404.2007.09.010.
[14] ENAN G, el-ESSAWY A A, UYTTENDAELE M, et al. Antibacterial activity of Lactobacillus p lantarum UG1 isolated from dry sausage: characterization, production and bactericidal action of plantaricin UG1[J]. International Journal of Food Microbiology, 1 996, 30(3): 189-215. DOI:10.1016/0168-1605(96)00947-6.
[15] K☒NIG H, FR☒HLICH J. Lactic acid bacteria[M]//K☒NIG H,UNDEN G, FR☒HLICH J, et al. Biology of microorganisms on grapes,in must and in wine. Berlin: Springer, 2009: 3-29. DOI:10.1007/978-3-540-85463-0.
[16] WOOD B J B. The lactic acid bacteria in health and disease[M]// SALMINEN S, DEIGHTON M, GORBACH S, et al. Lactic acid bacteria. London: Elsevier, 1993: 199-225.
[17] BURDOCK G A, CARABIN I G. Generally recognized as safe(GRAS): history and description[J]. Toxicology Letters, 2004, 150(1): 3-18. DOI:10.1016/j.toxlet.2003.07.004.
[18] JACQUES P, HBID C, DESTAIN J, et al. Optimization of biosurfactant lipopeptide production from Bacillus subtilis S499 by Placket t-Burman design[C]//Proceedings of the Twentieth Symposium on Biotechnology for Fuels and Chemicals. Berlin: Springer, 1999. DOI:1 0.1385/ABAB:77:1-3:223.
[19] NANTHAKUMAR K, KARTHIKEYAN K, SURIYANARAYANAN S,et al. Application of Plackett-Burman design to optimize bioprocess variables for decolorization of reactive Red 195 by a termite associated bacterial consortium BUTC7[M]//RAJESH KANNAN V. Microbiological research in agroecosyste m management. India: Springer, 2013: 23-34. DOI:10.1007/978-81-322-1087-0_3.
[20] 宋静. 废弃烟梗固态发酵生产假丝酵母[J]. 烟草科技, 2013(8): 75-78. DOI:10.3969/j.issn.1002-0861.2013.08.017.
[21] 张冬冬, 姜军坡, 朱宝成. 棉花黄萎病生防芽孢杆菌Z-5菌株发酵培养基的 优化[J]. 棉花学报, 2014, 26(1): 10-17. DOI:10.3969/ j.issn.1002-7807.2014.01.002.
[22] 龚国利, 王娜, 刘丽丽. 响应面法优化纤维堆囊菌SoF5-76产埃博霉素B发酵培养基[J]. 生物技术通报, 2014(1): 171-176.
[23] 程媛媛, 郑 谊丰, 王丽燕, 等. 响应面法优化β-聚苹果酸发酵培养基的研究[J]. 食品工业科技, 2011, 32(5): 197-199.
[24] BEN BELGACEM Z, REHAIEM A, FAJARDO BERN☒RDEZ P, et al. Interactive effects of pH and temperature o n the bacteriocin stability by response surface analysis[J]. Microbiology, 2012, 81(2): 195-200. DOI:10.1134/S002626171201002X.
[25] KAUR B, GARG N, SACHDEV A. Optimization of bacteriocin production in Pediococcus acidilactici BA28 using response surface methodology[J]. Asian Journal of Pharmaceutical & Clinical Research,2013, 6(1): 192-195.
Screening of Food-Based Medium and Optimization of Fermentation Conditions for Bacteriocin Production by Lactobacillus plantarum 163
HU Meizhong1,2, DANG Lijuan2, LU Zhaoxin2,*
(1. Department of Pharmacy, Tongren Polytechnic College, Tongren 554300, China;2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The intention of the current work was to obtain the optimal food-based medium and culture conditions for bacteriocin production by Lactobacillus plantarum 163. The appropriate medium (1 L) containing 200 mL of cabbage juice, 50 mL of tomato juice, 10 g of glucose, and 2 g of K2HPO4in distilled water was selected for further optimization. Inoculum concentration, K2HPO4,pH and cabbage juice were determined to be the key factors the influence bacteriocin production by using Plackett-Burman design. A quadratic polynomial model for describing the effects of the four factors on bacteriocin activity against Bacillus pumilus CMCC 63202 was obtained by Box-Behnken design. The optimal levels of these factors were found to be K2HPO41.89 g/L, cabbage juice 341.5 mL/L, inoculum concentration 3.56% (V/V) and pH 6.95. Under these conditions, the maximum antimicrobial activity was achieved, which was over 30% higher than that before optimization.
food-based medium; optimization; response surface methodology; Lactobacillus plantarum 163
10.7506/spkx1002-6630-201615028
TS201.3
A
1002-6630(2016)15-0165-06
2015-09-22
“十二五”国家科技支撑计划项目(2011BAD23B05)
胡美忠(1981—),男,副教授,博士,研究方向为食品科学。E-mail:42554573@qq.com
陆兆新(1957—),男,教授,博士,研究方向为食品生物技术。E-mail:fmb@njau.edu.cn
引文格式:

