矢车菊素-3-O-葡萄糖苷进入巨噬细胞的荧光检测
张英慧,王丙云,黄剑波,计慧琴,马艳玲,钟希琼,董华强
(1.佛山科学技术学院北院食品安全系,广东 南海 528231;2.佛山科学技术学院北院动物医学系,广东 南海 528231)
矢车菊素-3-O-葡萄糖苷进入巨噬细胞的荧光检测
张英慧1,王丙云2,黄剑波1,计慧琴2,马艳玲1,钟希琼1,董华强1
(1.佛山科学技术学院北院食品安全系,广东 南海 528231;2.佛山科学技术学院北院动物医学系,广东 南海 528231)
利用荧光技术探索矢车菊素-3-O-葡萄糖苷(cyanidin 3-O-glucoside,C3G)在体外培养的巨噬细胞中的分布。首先采用荧光分光光度法扫描C3G的特异激发波长和发射波长,再利用激光共聚焦技术探讨C3G进入小鼠和人巨噬细胞的过程以及C3G在细胞中的定位,并分析C3G孵育时间对细胞内荧光强度变化的影响。结果表明:在488 nm和520 nm的激发波长下,C3G孵育15 min的细胞质内开始呈现绿色和红色荧光,并且随着孵育时间的变化,细胞内荧光强度逐渐增强,其中孵育60 min可观察到荧光布满细胞核,其荧光强度是孵育前的6.45 倍。研究表明采用特异波长的激光共聚焦断层扫描技术可示踪到花色苷在干预细胞内的分布,结果显示花色苷C3G可快速穿过巨噬细胞的细胞膜和核膜,直达细胞核。
矢车菊素-3-O-葡萄糖苷;巨噬细胞;激光共聚焦显微技术;荧光分光光度法
矢车菊素-3-O-葡萄糖苷(cyanidin 3-O-glucoside,C3G)类属于植物中的花青素类,为呈色物质,其天然提取物粉末为紫红色,是自然界分布最广的花色苷。尽管大量的研究证实C3G具有抗氧化[1]、降血脂[1]、抗肿瘤[2]、抗炎症[3]、抑制血小板凝集[4]、预防糖尿病[5]、减肥[6]、保护视力[7]和保护神经元细胞[8]等诸多生理活性,但其在机体细胞中的存在部位和结合位点目前尚无定论。
高效液相色谱是目前普遍应用的检测C3G的方法,血液中C3G的含量可采用高效液相色谱的方法检测[9-10],但是这种方法应用于体外培养细胞中C3G的检测有一定的难度,由于细胞培养的数量有限,干预后进入细胞内的C3G有限,C3G的丰度往往低于仪器的灵敏度。另外,高效液相色谱也很难检测到C3G在细胞中的定位。再加上细胞膜、细胞浆、细胞核的分离过程必然增加了C3G的损失。Agati等[11]报道花青素为植物细胞中的荧光物质,具有特定的吸收波长和发射波长,例如葡萄中花青素的特异吸收波长为540 nm,最大发射波长为685 nm,并利用这一特性建立了植物活体中该类色素的检测方法;Lin Yakang等[12]利用包括花青素在内的类黄酮物质的荧光研究了植物化学物在玉米细胞中的合成与转运。
激光共聚焦显微镜作为近年来发展起来的大型生物学分析仪器,它借助荧光标记方法,采用激光作为光源,使激光经过照明针孔后形成点光源,对焦平面每一点进行扫描,并在共焦针孔处成像,大大提高了图像分辨率和检测灵敏度,具有活细胞动态监测、断层扫描及三维图像重建等功能,可对所观察细胞内荧光标记的物质进行定量、定性、定位和时空监测[13-14]。
本实验综合借鉴以上方法,首先扫描了C3G特异的荧光波长,并根据特征波长进行激光共聚焦断层扫描,尝试观察C3G是否可以进入小鼠和人的巨噬细胞中。
1 材料与方法
1.1 材料、培养基与试剂
15 只SPF级C57BL/6J雌性小鼠(动物合格证号:SCXK(粤)2013-0002),体质量为18~22 g,由广东省医学实验动物中心提供;THP-1细胞株 美国培养物典藏中心(American Type Culture Collection,ATCC)。
RPMI1640培养基 美国Gibco公司。
C3G 挪威Polyphenols Laboratories AS公司;豆蔻酰佛波醇乙酯(phorbol-12-myristate-13- acetate,PMA)、台盼蓝、多聚甲醛 美国Sigma公司;抗生素(青霉素和链霉素) 美国Invitrogen公司;0.01 mol/L pH 7.2~7.4磷酸盐缓冲液(phosphate buffered saline,PBS)福州迈新生物技术开发有限公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;细胞培养板 美国Corning公司;玻璃底细胞培养皿 美国MatTek公司。
1.2 仪器与设备
CO2培养箱 美国Haraeus公司;荧光分光光度计美国Varian公司;倒置显微镜 重庆光学仪器厂;冷冻离心机 德国Eppendorf公司;FV500-IX81 OLYMPUS激光共聚焦显微镜 日本Olympus公司。
1.3 方法
1.3.1 C3G荧光波长的扫描
将C3G溶解到PBS中,配成终浓度为1 mmol/L的溶液,利用荧光分光光度计进行发射波长和激发波长的扫描,确定C3G特异的激发波长和发射波长。对照组为PBS溶液。
1.3.2 激光共聚焦显微镜扫描C3G在巨噬细胞中的分布
1.3.2.1 检测C3G在小鼠腹腔巨噬细胞中的分布
1)小鼠腹腔注射1 mL无菌液体石蜡,3 d后收集腹部巨噬细胞。具体方法为:小鼠腹部消毒,沿中线注入3~4 mL冰中预冷的无菌PBS,轻轻按摩腹部5 min。无菌剪开腹壁,用吸管吸出渗出液,再用同样体积的预冷的PBS冲洗腹腔2~3 次,合并渗出液于离心管中,4 ℃、800 r/min条件下离心5 min,去上清液。用预冷的RPMI-1640培养液洗涤细胞2~3 次,每次4 ℃、800 r/min 离心5 min,去上清液,用预冷的适量RPMI-1640培养液悬浮细胞,台盼蓝染色计数,调整细胞浓度为1.0×105/mL,加于含盖玻片的6 孔培养板中,于玻片上爬壁4 h。
2)弃去未贴壁细胞,加含50 μmol/L C3G的体积分数10% FBS-RPMI1640完全培养基培养0~1 h。分别取0、15、30、45、60 min 各时段进行体积分数4%多聚甲醛固定5 min。每次实验设3个重复孔,独立重复3 次。
3)以FV500-IX81 OLYMPUS激光共聚焦显微镜600 倍水镜断层扫描固定后的细胞,激发波长分别设置为488 nm和520 nm。操作设置为:PmT1881,Gain 2.4,C.A 715,MAr220.5%;PmT2791,Gain 2.0,offset 5%,C.A 580nm,He 50.0%。图像生成采用FluoView软件。
1.3.2.2 检测C3G在人巨噬细胞株THP-1中的分布
1)将人THP-1单核/巨噬细胞以2.0×105/孔接种于6孔玻璃底细胞培养皿,以含100 ng/mL PMA、体积分数10% FBS、2 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 µg/mL链霉素的RPMI 1640在体积分数5% CO2的培养箱中37 ℃条件下诱导分化贴壁48 h。
2)PBS洗3 次,加含50 μmol/L C3G的10% FBSRPMI1640完全培养基培养0~1 h。每次实验设3 个重复孔,独立重复3 次。
3)以FV500-IX81 OLYMPUS激光共聚焦显微镜600 倍水镜断层扫描干预后的细胞,激发波长分别设置为488 nm和520 nm。操作设置同1.3.2.1节3),利用FluoView软件合成图像并计算平均荧光强度。
1.4 数据分析
采用SPSS13.0软件包建立数据库,并进行统计分析。结果以±s表示。多组均数进行单因素方差分析,各组间的两两比较采用Tukey's honestly法,P<0.05为差异显著。
2 结果与分析
2.1 C3G荧光波长的扫描
利用荧光分光光度计扫描1 mmol/L C3G-PBS溶液的发射波长和激发波长。由图1可知,1 mmol/L C3G-PBS溶液在488 nm激发下于520 nm处有弱的荧光发射(图1a),在520 nm激发下于630 nm左右有弱的荧光发射(图1c),而PBS在相同的激发条件下无荧光(图1b、d)。
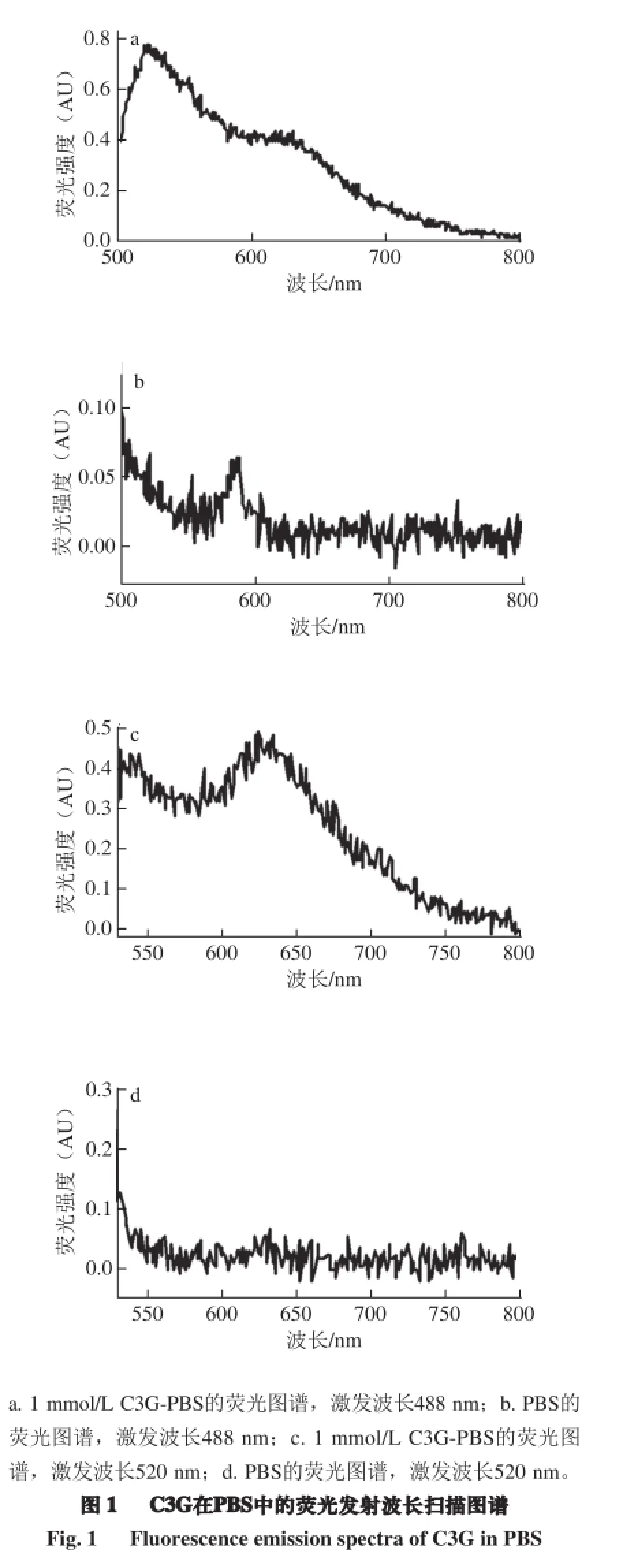
2.2 激光共聚焦显微镜断层扫描检测C3G在巨噬细胞中的分布
2.2.1 C3G在小鼠腹腔巨噬细胞中的分布
激光共聚焦断层扫描技术可逐层观察细胞的横切面,图2显示了50 μmol/L C3G孵育小鼠腹腔巨噬细胞0~60 min,激光共聚焦显微镜观察到的C3G的荧光分布。C3G在488 nm激发波长下呈现绿色荧光,在520 nm激发波长下呈现红色荧光,红色荧光的强度高于绿色荧光。孵育小鼠巨噬细胞15 min左右,即有带荧光的C3G进入细胞质,随时间的增加,荧光强度逐渐增加,孵育60 min左右C3G甚至可到达小鼠巨噬细胞的细胞核。

2.2.2 C3G在人巨噬细胞株THP-1中的分布
激光共聚焦显微镜观察到50 μmol/L C3G孵育人巨噬细胞株THP-1 30 min,仅有弱的荧光物质聚集于细胞膜周围,45 min时细胞中荧光略强,60 min继续增强,并有部分细胞表现为已染核(图3)。以FluoView软件计算平均荧光强度,C3G孵育THP-1细胞的时间延长到60 min,细胞内的平均荧光强度为孵育前的6.45 倍(表1)。


3 讨 论
实验结果显示C3G 具有特定的激发波长和发射波长,激光共聚焦显微镜断层扫描结果表明C3G可以进入小鼠和人的巨噬细胞,在488 nm和520 nm的光波激发下,C3G在细胞内分别呈现绿色和红色荧光,虽然荧光强度较弱。小鼠腹腔巨噬细胞对C3G的摄取能力高于人巨噬细胞系THP-1,孵育15 min即可呈现荧光,而分化的THP-1细胞只有在孵育30 min以后才呈现明显的时间-荧光强度梯度变化。有研究者发现小鼠在灌胃果汁30 min内可利用高效液相色谱的方法在血液和脑组织检测到花色苷的浓度高峰[9],人在饮用富含花色苷的饮料后1~2 h内血液中C3G可达到高峰[10,15],Fernandes等[16]报道花青素可以穿过中度分化的胃腺癌细胞MKN-28,提示花青素可能会穿过胃壁屏障,这也许是花色苷迅速出现在血液中的原因。花色苷如此快的吸收转运速率与本实验在巨噬细胞中检测到的结果相一致。
利用荧光检测动物细胞对类黄酮化合物的吸收方法曾经应用于矢车菊素的结构类似物槲皮素的研究上,槲皮素具有黄酮醇的结构,植物的花青素和黄酮醇都以二氢黄酮醇为前体物由酶催化生成,二氢黄酮醇还原酶是植物体内产生花青素的关键酶。酸性溶液中的还原反应可使槲皮素转化为矢车菊素。Kuo等[17]早在1996年利用荧光显微镜检测了经100 μmol/L槲皮素孵育40 min的Caco-2细胞,认为槲皮素在细胞内有积累,其最大发射峰为550 nm,并且槲皮素主要分布于核仁周围。Walgren等[18]证明了槲皮素-4'-β-葡萄糖苷15 min即可进入Caco-2细胞,并呈现出荧光,而其代谢物槲皮素-3-硫酸酯则没有荧光,说明分子的极性和结构的改变影响荧光的产生。Nifli等[19]利用另一个细胞系HepG2检测到细胞内摄的槲皮素在488 nm紫外光激发下,于500~540 nm波长处有特异的荧光,配合质谱分析认为天然的槲皮素是孵育初期细胞内的主要形式,也是荧光的来源,虽然在15 min后出现少量的甲基化代谢物,但是并未检测到槲皮素的氧化衍生物。
目前并未见有关C3G在培养的动物细胞中自发荧光的报道。本研究表明C3G在巨噬细胞中不但类似于槲皮素-4'-β-葡萄糖苷发射绿色荧光,还可以发射红色荧光,而且红色荧光的强度明显高于绿色荧光。
C3G在细胞内不同部位呈现多种生物活性,例如C3G可降低低氧环境下人脐静脉血管内皮细胞中自由基水平的增加,减缓氧化应激,并抑制血管生成和细胞凋亡[20];C3G可降低细胞内自由基的生成,抑制高糖诱导的线粒体膜电位损伤,下调细胞内促凋亡因子Bax的表达[21];C3G可以降低糖尿病小鼠内皮细胞的内质网应激水平[22];研究表明C3G可以通过氢键和疏水作用力直接结合在小牛胸腺DNA上,并自发地保护DNA免受自由基的损伤[23],C3G还可抑制赭曲霉素A诱导的人成纤维细胞的DNA损伤[24];前期研究表明C3G可以激活多个细胞核受体报告基因的表达[25],本研究检测到C3G可进入细胞核,提示了C3G作为核受体的激动剂发挥作用或直接调控细胞核内基因表达的可能性。
本研究利用荧光分光光度计扫描1 mmol/L C3G-PBS溶液的发射波长和激发波长,确定1 mmol/L C3G-PBS溶液在488 nm激发下有弱的荧光发射波长520 nm,在520 nm激发下有弱的630 nm左右的荧光发射波长。利用激光共聚焦显微镜断层扫描C3G在小鼠腹腔巨噬细胞和人巨噬细胞株THP-1中的分布。检测结果表明,小鼠腹腔巨噬细胞对C3G的摄取能力高于人巨噬细胞THP-1。无论是小鼠巨噬细胞还是人巨噬细胞THP-1,C3G进入细胞中的荧光强度随着时间的增加而逐渐增加,并可穿过细胞质进入细胞核中,其跨膜转运的机制和C3G与细胞内各种物质的相互作用关系有待深入探讨。
[1] DUCHNOWICZ P, BRONCEL M, PODSĘDEK A, et al. Hypolipidemic and antioxidant effects of hydroxycinnamic acids,quercetin, and cyanidin 3-glucoside in hypercholesterolemic erythrocytes (in vitro study)[J]. European Journal of Nutrition, 2012,51(4): 435-443. DOI:10.1007/s00394-011-0227-y.
[2] 陈亮, 辛秀兰, 袁其朋. 矢车菊-3-葡萄糖的抗癌效应研究进展[J].食品科学, 2013, 34(13): 329-333. DOI:10.7506/spkx1002-6630-201313069.
[3] ZHANG Y H, LIAN F Z, ZHU Y N, et al. Cyanidin-3-O-β-glucoside inhibits LPS-induced expression of inflammatory mediators through decreasing IκBα phosphorylation in THP-1 cells[J]. Inflammation Research, 2010, 59(9): 723-730. DOI:10.1007/s00011-010-0183-7.
[4] 邓秀娟, 任婧, 宋丰林, 等.矢车菊素-3-葡萄糖苷对高胆固醇血症小鼠血小板颗粒物释放的影响[J]. 热带医学杂志, 2015, 15(1): 4-7.
[5] SUN C D, ZHANG B, ZHANG J K, et al. Cyanidin-3-glucoside-rich extract from Chinese bayberry fruit protects pancreatic β cells and ameliorates hyperglycemia in streptozotocin-induced diabetic mice[J]. Journal of Medicinal Food, 2012, 15(3): 288-298. DOI:10.1089/ jmf.2011.1806.
[6] 卫晓怡, 白晨, 唐立伟, 等. 矢车菊素-3-葡萄糖苷对骨骼肌细胞脂蛋白脂肪酶活性的影响[J]. 食品科学, 2013, 34(5): 246-250.
[7] LEE S H, JEONG E, PAIK S S, et al. Cyanidin-3-glucoside extracted from mulberry fruit can reduce N-methyl-N-nitrosourea-induced retinal degeneration in rats[J]. Current Eye Research, 2013, 39(1): 79-87. DOI:10.3109/02713683.2013.825275.
[8] MIN J, YU S W, BAEK S H, et al. Neuroprotective effect of cyanidin-3-O-glucoside anthocyanin in mice with focal cerebral ischemia[J]. Neuroscience Letters, 2011, 500(3): 157-161. DOI:10.1016/ j.neulet.2011.05.048.
[9] MARCZYLO T H, COOKE D, BROWN K, et al. Pharmacokinetics and metabolism of the putative cancer chemopreventive agent cyanidin-3-glucoside in mice[J]. Cancer Chemotherapy and Pharmacology, 2009, 64(6): 1261-1268. DOI:10.1007/s00280-009-0996-7.
[10] de FERRARS R M, CZANK C, ZHANG Q, et al. The pharmacokinetics of anthocyanins and their metabolites in humans[J]. British Journal of Pharmacology, 2014, 171(13): 3268-3282. DOI:10.1111/bph.12676.
[11] AGATI G, MEYER S, MATTEINI P, et al. Assessment of anthocyanins in grape (Vitis vinifera L.) berries using a noninvasive chlorophyll fluorescence method[J]. Journal of Agricultural and Food Chemistry, 2007, 55(4): 1053-1061. DOI:10.1021/jf062956k.
[12] LIN Y, IRANI N G, GROTEWOLD E. Sub-cellular trafficking of phytochemicals explored using auto-fluorescent compounds in maize cells[J]. BMC Plant Biology, 2003, 3(1): 1-12. DOI:10.1186/1471-2229-3-10.
[13] GUST A, ZANDER A, GIETL A, et al. A starting point for fluorescence-based single-molecule measurements in biomolecular research[J]. Molecules, 2014, 19(10): 15824-15865. DOI:10.3390/ molecules191015824.
[14] 游雪娇, 李良秋, 马连营, 等. 激光共聚焦扫描显微镜在抗菌机理研究中的应用[J]. 微生物学通报, 2015, 42(6): 1108-1121.
[15] CAO G, MUCCITELLI H U, SANCHEZ-MORENO C, et al. Anthocyanins are absorbed in glycated forms in elderly women: a pharmacokinetic study[J]. American Journal of Clinical Nutrition,2001, 73(5): 920-926. DOI:10.1016/j.jmr.2006.06.015.
[16] FERNANDES I, de FREITAS V, REIS C, et al. A new approach on the gastric absorption of anthocyanins[J]. Food & Function, 2012,3(5): 508-516. DOI:10.1039/C2FO10295A.
[17] KUO S M. Antiproliferative potency of structurally distinct dietary flavonoids on human colon cancer cells[J]. Cancer Letters, 1996,110(Suppl1/2): 41-48. DOI:10.1016/S0304-3835(96)04458-8.
[18] WALGREN R A, LIN J T, KINNE R K, et al. Cellular uptake of dietary flavonoid quercetin 4'-beta-glucoside by sodium-dependent glucose transporter SGLT1[J]. Journal of Pharmacology and Experimental Therapeutics, 2000, 294(3): 837-843. DOI:10.1134/ S0036023608100112.
[19] NIFLI A P, THEODOROPOULOS P A, MUNIER S, et al. Quercetin exhibits a specific fluorescence in cellular milieu: a valuable tool for the study of its intracellular distribution[J]. Journal of Agricultural and Food Chemistry, 2007, 55(8): 2873-2878. DOI:10.1021/jf0632637.
[20] ANWAR S, SPECIALE A, FRATANTONIO D, et al. Cyanidin-3-O-glucoside modulates intracellular redox status and prevents HIF-1 stabilization in endothelial cells in vitro exposed to chronic hypoxia[J]. Toxicology Letters, 2014, 226(2): 206-213. DOI:10.1016/ j.toxlet.2014.01.048.
[21] JIANG X W, TANG X L, ZHANG P W, et al. Cyanidin-3-O-βglucoside protects primary mouse hepatocytes against high glucoseinduced apoptosis by modulating mitochondrial dysfunction and the PI3K/Akt pathway[J]. Biochemical Pharmacology, 2014, 90(2): 135-144. DOI:10.1016/j.bcp.2014.04.018.
[22] ZHAO R Z, XIE X P, LE Khuong, et al. Endoplasmic reticulum stress in diabetic mouse or glycated LDL-treated endothelial cells:protective effect of Saskatoon berry powder and cyanidin glycans[J]. Journal of Nutritional Biochemistry, 2015, 26(11): 1248-1253. DOI:10.1016/j.jnutbio.2015.05.015.
[23] ZHANG C, GUO X F, CAI W Q, et al. Binding characteristics and protective capacity of cyanidin-3-glucoside and its aglycon to calf thymus DNA[J]. Journal of Food Science, 2015, 80(4): H889-H893. DOI:10.1111/1750-3841.12823.
[24] RUSSO A, FAUCI L L, ACQUAVIVA R, et al. Ochratoxin A-induced DNA damage in human fibroblast: protective effect of cyanidin 3-O-β-D-glucoside[J]. Journal of Nutritional Biochemistry, 2005, 16(1): 31-37. DOI:10.1016/j.jnutbio.2004.05.005.
[25] 张英慧, 王丙云, 计慧琴, 等. 花色苷对LO2细胞核受体报告基因的影响[J]. 食品科学, 2011, 32(21): 156-160.
Fluorescence Detection of the Entry of Cyanidin-3-O-Glucoside into Macrophages
ZHANG Yinghui1, WANG Bingyun2, HUANG Jianbo1, JI Huiqin2, MA Yanling1, ZHONG Xiqiong1, DONG Huaqiang1
(1. Department of Food Safety, Foshan University (Northern Campus), Nanhai 528231, China;2. Department of Veterinary Medicine, Foshan University (Northern Campus), Nanhai 528231, China)
The distribution of cyanidin-3-O-glucoside (C3G) in cultured mouse and human macrophages was detected with fluorescence technique. First, the specific excitation wavelength and emission wavelength of C3G were scanned with fluorescence spectrophotometric assay. Then, a confocal laser scanning microscopy was utilized to investigate the entry process of C3G into cultured mouse macrophages and human macrophage THP-1 cells, and to trace the location of C3G as well as the change in fluorescence intensity in the cells during incubation. The results showed that green and red fluorescence in macrophages after 15 min C3G incubation could be detected with light excitation at 488 nm and 520 nm, respectively. The fluorescence signals were enhanced in the cells as the incubation time was prolonged. The special fluorescence appeared in nuclei when the cells were treated with C3G for 60 min, and the average fluorescence intensity was enhanced by 6.45 folds when C3G incubation time was increased up to 60 min. These results indicated that the distribution of C3G in cells during incubation could be traced with laser scanning confocal microscopy assay. It was concluded that C3G could pass rapidly through the cell membrane and nuclear membrane of macrophages, and entered directly the cell nucleus.
cyanidin-3-O-glucoside; macrophages; confocal laser scanning microscopy; fluorescence spectrophotometric assay
10.7506/spkx1002-6630-201609037
TS201.4
A
1002-6630(2016)09-0198-05
张英慧, 王丙云, 黄剑波, 等. 矢车菊素-3-O-葡萄糖苷进入巨噬细胞的荧光检测[J]. 食品科学, 2016, 37(9): 198-202. DOI:10.7506/spkx1002-6630-201609037. http://www.spkx.net.cn
ZHANG Yinghui, WANG Bingyun, HUANG Jianbo, et al. Fluorescence detection of the entry of cyanidin-3-O-glucoside into macrophages[J]. Food Science, 2016, 37(9): 198-202. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609037. http://www.spkx.net.cn
2015-07-24
国家自然科学基金项目面上项目(31071537);广东省科技计划项目(2011A030100018);佛山市科技创新专项资金项目(2014GA000425)
张英慧(1974—),女,副教授,博士,研究方向为食品营养与安全。E-mail:zhang_ying-hui@163.com

