小分子化合物开放夹心免疫分析研究进展
饶美芳,伍伟健,许 超,毛小晓,徐振林,王 弘,雷红涛,孙远明
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
小分子化合物开放夹心免疫分析研究进展
饶美芳,伍伟健,许 超,毛小晓,徐振林,王 弘*,雷红涛,孙远明
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
基于抗原-抗体识别的免疫分析技术在小分子监测领域占有重要地位,已成功应用于生理活性物质、化学有害物、农兽药等的快速检测,在临床诊断、环境、食品以及卫生领域发挥重要作用。由于缺乏结合位点,小分子化合物的分析大多采用竞争模式,与传统的三明治夹心法相比,稳定性和灵敏度往往都难以满足实际检测需求。近几年来,科学家开始尝试建立针对小分子化合物的非竞争模式免疫分析方法,比如基于抗独特型抗体、基于抗体可变区片段、基于抗异型抗体及抗免疫复合物多肽。其中基于抗体重链和轻链结合的开放夹心免疫分析由于具有只需要单个抗体、快速非竞争的均相检测小分子等优点,备受研究者关注。本文主要综述基于抗体可变区片段的小分子非竞争免疫分析方法,重点介绍了建立小分子非竞争检测模式所需要抗体可变区的获得及筛选途径、几种形式信号放大载体的研究现状,最后对其在小分子物质检测领域的应用前景进行了评述,期望能为本领域研究提供借鉴。
小分子化合物;非竞争式;开放夹心免疫分析方法
基于抗原-抗体识别的免疫分析技术在小分子监测领域占有重要地位,已成功应用于生理活性物质、化学有害物、农兽药等的快速检测[1-3],在临床诊断、环境、食品以及卫生领域发挥重要作用。但是,由于缺乏结合位点,小分子化合物的分析大多采用竞争模式,与传统的三明治夹心法相比,灵敏度和线性范围往往都难以满足实际检测需求[4-6]。为了克服这个缺点,学者们尝试建立非竞争式免疫分析检测小分子。目前,小分子非竞争的检测方法主要有基于抗独特型抗体非竞争型检测小分子化合物[7-8]、基于抗体可变区片段非竞争检测小分子化合物、基于抗异型抗体及抗免疫复合物多肽检测小分子化合物[9]。研究表明,这些非竞争的检测方法具有高灵敏度、宽线性范围、低性噪比等优点,且不可取代。其中基于抗体重链和轻链结合的开放夹心免疫分析具备只需要单个抗体,就能快速非竞争地均相检测小分子等优点,备受研究者关注。本文主要综述基于抗体可变区片段建立的一种新的非竞争免疫检测方法,重点介绍了该小分子非竞争检测模式建立需要的抗体可变区获得有效途径、几种形式信号放大载体的研究现状,旨在扩大该方法在食品安全检测领域的应用、提高检测灵敏度,为开放夹心免疫分析方法应用提供一些参考。
1 开放夹心免疫分析的原理
1996年Ueda等[10]用表面等离子共振生物传感器测定抗鸡卵溶菌酶抗体的重链可变区(heavy chain variable region,VH)和轻链可变区(light chain variable region,VL)相互作用,发现抗原诱导抗体可变区结合稳定化。目前,开放夹心的原理主要应用于基于抗体可变区片段的非竞争模式检测小分子,用于筛选亲和力高的抗体[11];结合分子印迹技术,用表面等离子共振监测分子的吸附和解吸[12];利用荧光蛋白与抗体的融合蛋白荧光能量共振转移,建立开放花式荧光免疫分析(open flower fluoroimmunoassay,OF-FIA),检测分子质量较大的生物标志物[13]。基于抗体VH和VL可变区之间相互作用检测待测抗原而建立的免疫检测方法(图1),是待测抗原与抗体可变区结合,而不是传统夹心法两个抗体与待测抗原之间。因此,这种夹心法被称为开放夹心酶联免疫吸附测定(open sandwich enzyme-linked immunosorbent assay,OS-ELISA)。与传统的夹心法相比,OS-ELISA具有低检测限、宽线性工作范围和高灵敏度等优点。然而缺乏易于使用的抗体筛选及制备的方法,限制了OS-ELISA的应用。只有一种情况适合建立OS-ELISA,即在缺少抗原时,抗体的可变区VH与VL之间存在微弱的作用,而抗原存在时,可以显著增强VH与VL的作用,利用这个作用的差别来检测待测抗原,如果这个作用没有差别,或者前者大于后者,都不能建立OSELISA。所以,学者进行了一系列的研究来改变VH和VL之间的作用差别。有报道指出,对于这个作用差别不大的可变区,可通过突变VH和VL相互作用的关键氨基酸,使检测信号增强200%[14]。对于不适合构建的OSELISA的抗体可变区,可通过VH和VL相互作用的蛋白质工程,将其转化为能够建立OS-ELISA可变区[15]。然而,缺乏易于使用的抗体筛选及制备的方法。因此,寻求能够快速、简单及有效地获得可变区方法成为现今的热点。

图1 OS-ELISA的原理Fig.1 Principle of OS-ELISA[10]
2 OS-ELISA的建立方法
2.1 表面等离子共振分析VH和VL相互作用
起初OS-ELISA建立,是从单克隆抗体获得VH和VL基因,利用该改造表达载体pKTN2在大肠杆菌表达抗体可变区(antibody variable fragment,Fv)蛋白,用阴离子交换柱得到分离及纯化后的可变区片段(即VH片段蛋白)和VL可变区片段相互作用,通过表面等离子共振探索抗鸡卵溶菌酶抗体VH和VL相互作用,发现抗体的可变区VH与VL之间存在微弱的作用,而抗原存在时,可以显著增强VH与VL的作用,基于此原理建立OSELISA[10]。然而,此筛选方法操作较为繁琐、耗时长。
2.2 VH筛选系统
噬菌体展示是具有筛选和评价蛋白相互作用功能的分子生物学技术[16]。这项技术不仅能展示抗体可变区,还可以用作为抗体展示和筛选。起初,基于VH蛋白库筛选合适的Fv蛋白,Tsumoto等[11]根据抗鸡卵溶菌酶抗体可以识别鸟类的溶菌酶,但是不能识别人类的溶菌酶,从分子机制的角度看,其最大区别在于抗鸡卵溶菌酶抗体重链可变区的互补决定区(heavy chain complementarity determining region,HCDR2)。基于此建立重链HCDR2的随机突变库,用人类溶菌酶以开放夹心的模式去筛选亲和力高的Fv蛋白片段(图2)。
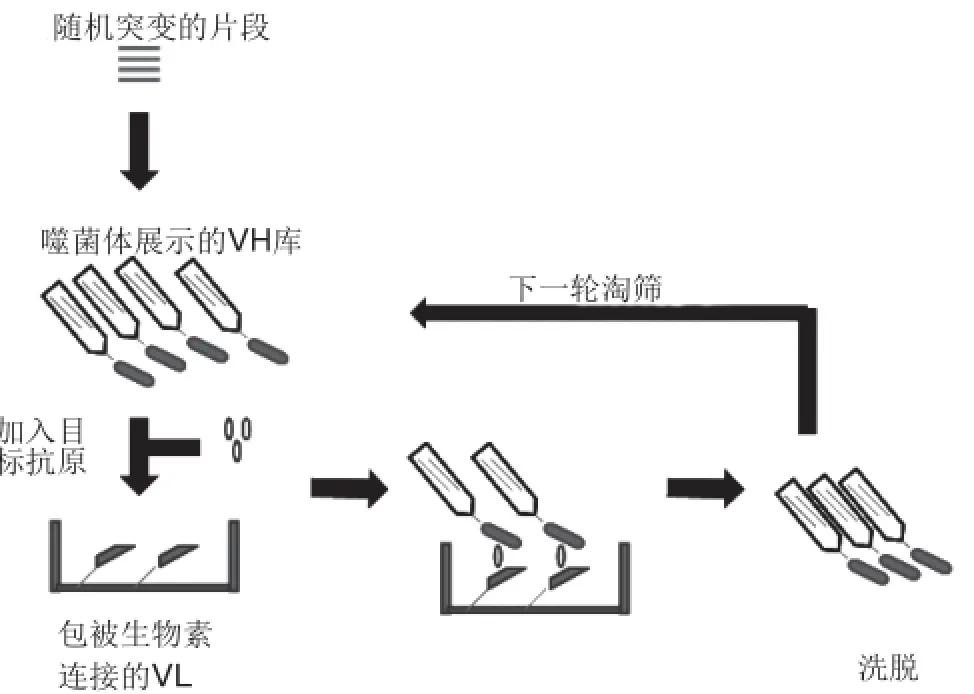
图2 开放夹心的模式筛选亲和力高的Fv蛋白[11]Fig.2 Schematic representation of open sandwich selection method[11]
2.3 单链抗体(antibody split chain variable fragment,spFv)筛选系统
传统的OS-ELISA是通过直接建立OS-ELISA检测目标物是否适合于该体系,操作耗时、繁琐且不是所有的目标物都适合于该体系,成为OS-ELISA广泛应用的限制因素。为了克服这个缺点,学者们研究简化筛选的方法。spFv展示系统(图3)是M13辅助噬菌体外壳pIX和pVII的N端展示VH/VL蛋白片段,在这个系统中,在VL和VH基因之间设计了一个琥珀密码子。当在对琥珀密码子产生作用的大肠杆菌表达系统中,该系统只能展示VH蛋白片段,而VL蛋白片段分泌到上清。因此,能够通过固定的VL蛋白检测被固定的噬菌体的数量来研究两个片段的相互作用。这个方法已成功用于检测人类骨钙素[17]、类固醇[18]、雌激素的真菌毒素玉米烯酮[19]等。到目前为止,有许多展示系统被用于表面展示抗体及其片段,特别是建库筛选高亲和力的抗体。例如,许多用于spFv筛选的噬菌体载体如pIT2[20]、pCANTAB5E[21]以及用于Fab展示的载体如pComb3[22]和pCES[23],这些载体适用于构建文库,筛选特异结合抗原的阳性克隆。然而,所有这类载体都不能评价两个展示片段的相互作用。对于spFv展示系统,既能展示抗体,又能评价两个展示片段的相互作用的噬菌体载体,用于筛选合适的抗体可变区片段。虽然这个系统可以用来筛选和克隆Fv片段,建立OS-ELISA,但是存在一些抗体Fv蛋白片段,它们不能有效结合抗原,或者是由于独立的VL蛋白片段稳定性比较差,分泌的VL蛋白片段太少,这些都不利于建立OS-ELISA。

图3 SpFv载体及SpFv筛选技术[17]Fig.3 Structure of the phagemid for spFv display and selection method based on spFv-phage display[17]
2.4 抗体结合片段(antibody-binding fragment,Fab)筛选系统
Dong Jinhua等[24]研究了一种新型Fab噬菌体展示系统,可以用来展示Fab蛋白片段、筛选特异结合抗原的Fab蛋白片段,评估目标物是否适合通过OS-ELISA检测方法来定量。这个新型的噬菌体展示载体pDong1,具有两个分泌表达信号肽(pelB和ompA)、琥珀密码子(amber codon)和抗体重链的恒定区1(heavy chain constant region 1,CH1)两端含有SgrAI酶基因。该载体可以在丝状噬菌体的表面上展示的L链和H链在大肠杆菌周质腔形成二硫键,展示Fab蛋白片段(图4)。用SgrAI酶切切除CH1基因,使得展示的VH蛋白与分泌表达的L链不会在周质腔形成二硫键,将噬菌体的展示Fab转化成噬菌体展示的VH蛋白和分泌表达的VL,利用于生物淘筛,将Fab噬菌体展示系统成功被转换为可以评价VH/VL相互作用的OS-ELISA。此方法直接绕过复杂的杂交瘤技术,通过免疫老鼠脾脏获得可变区基因,简化了可变区制备过程。对比spFv展示系统和Fab展示系统,由于单链抗体scFv片段倾向于形成多聚体[25-26],而Fab保持单体形成存在,在筛选高亲和力抗体中,Fab有更大自由度[27-28]。因此,这个系统提供一个优于传统方法、快速、有效的筛选合适的可变区的途径。目前,该方法已成功用于贝类毒素[29]、甲状腺激素T4[30]。
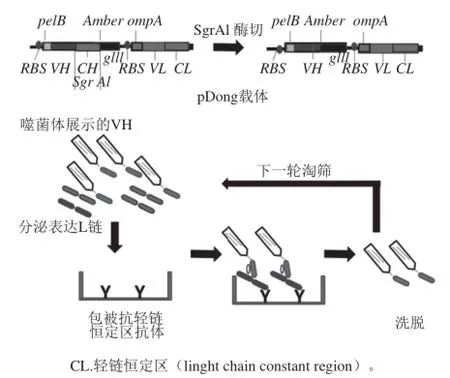
图4 pDong载体及Fab筛选技术[24]Fig.4 Structure of the phagemid for Fab display (pDong1) and selection method based on of Fab-phage display[24]
3 信号放大的方式
3.1 酶标记法
起初的OS-ELISA,通过噬菌体展示的VH片段用来评价VH/VL的相互作用[10]。由于实验操作繁琐,最终将VH/VL与细菌碱性磷酸酶融合表达,是通过加入标签底物,用比色法或化学发光信号来对检测的抗原进行量化。实验证明无论是包被生物素链接的VL检测VH偶联碱性磷酸酶(VH conjugated alkaline phosphatase,VH-phoA)的模式(图5),还是包被生物素的VH检测VL-PhoA的模式,都显示融合蛋白模式在OS-ELISA检测中应用是可行的。目前主要应用的酶是碱性磷酸酶[17]和辣根过氧化物酶[30]。此外,科学家还发现融合蛋白表达可以促进目标物在大肠杆菌表达系统可溶表达[31],而且研究表明VH-phoA融合蛋白的形式要比独立的VH要稳定[18],不易形成二聚体,造成反应高背景。推测原因是VH连接在一个较大的蛋白标签上,减少非特异性碰撞而不被聚合[32]。因此,酶标记抗体可变区在OS-ELISA广泛应用的检测信号。
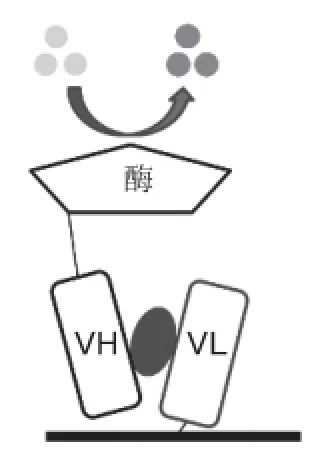
图5 酶标记的OS-ELISA[17]Fig.5 Enzyme-labeled OS-ELISA[17]
3.2 共振能量转移法
传统的免疫方法通过固相载体来固定抗原或抗体,这需要繁琐的洗涤步骤来将未结合的试剂洗去。为了克服该限制,Ueda等[10]研究了开放夹心荧光共振能量转移(open sandwich fluoroimmunoassay,OS-FIA),这个方法基于VH和VL之间的共振能量转移测定(图6A),实现非均相检测小分子物质。荧光蛋白对主要有荧光素(fluocrescein,FI)和红色荧光染料(rhodamine-X,Rh)[33]、增强型蓝色荧光蛋白(enhanced blue fluorescent protein,EBFP)和增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)[34]以及海肾荧光素(renilla luciferase,Rluc)和增强型黄色荧光染料(enhanced yellow fluorescent protein,EYFP)[35],将VH与荧光蛋白供体偶连,VL与荧光蛋白受体偶连。当偶连后的VH和VL与抗原混合,可以通过监测两个绿色荧光蛋白之间的共振能量转移来测定抗原的浓度。这种测定方法较传统的非均相OS-ELISA,具有操作简单、快速、检测限低的优点。然而,对于这种一般的荧光共振能量转移(fluorescence resonance energy transfer,FRET)而言,都存在因为强激发光而导致的光漂白和自身荧光的局限。因此,为了克服这个缺点,后来出现了用生物荧光素酶代替FRET的供体,构建了开放夹心生物发光共振能量转移免疫测定(bioluminescence resonance energy transfer,OS-BRET)(图6B)。这不需要外界激发荧光的参与,解决了FRET交叉激发的问题;背景荧光较FRET低,大大提高实验的简便性和可重复性[36]。

图6 共振能量转移[35-36]Fig.6 Schemes of OS-FIA and OS-BRET[35-36]
3.3 蛋白片段互补系统法
β-半乳糖苷酶互补系统常被用来研究蛋白质的相互。学者们尝试利用β-半乳糖苷酶互补系统与OS-ELISA原理相结合,建立非竞争均相免疫测定,即开放夹心酶互补免疫分析(open sandwich enzymatic complementation immunoassay,OS-ECIA)。将Δα、Δω分别与VH、VL融合表达,在抗原存在情况下,VH、VL相互作用,使得Δα、Δω蛋白之间结合形成β-半乳糖苷酶,通过酶活性来反映待测抗原的浓度(图7)。与传统的均相OS-ELISA比较,发现灵敏度提高了1 000 倍,降低了反应的背景值。此外,减少了所需的反应时间、操作、样品量和测定的抗体试剂[36-37]。后来,Lee等[38]研究将绿色荧光蛋白互补系统绿色荧光蛋白的N端片段(N-terminal fragment green fluorescent protein,NGFP)和绿色荧光蛋白的C端片段(C-terminal fragment green fluorescent protein,CGFP)应用在OS-ELISA,实现在活细胞中检测赤霉素。

图7 开放夹心酶互补免疫分析法[38]Fig.7 Principle of open sandwich enzymatic complementation immunoassay[38]
3.4 基于聚合酶链式反应免疫分析的技术法
传统的开放夹心噬菌体免疫分析(open sandwich immunoassay based on phage display,OS-phage ELISA)(图8A)是用辣根过氧化物酶(horseradish peroxidase,HRP)酶标的抗M13噬菌体抗体结合固定在板上的噬菌粒,从而检测抗原浓度。其背景信号主要受到非特异性结合的一些测定的试剂影响(噬菌体展示的抗体重链可变区蛋白和HRP酶标的抗M13噬菌体抗体等)。而免疫分析法基于聚合酶链式反应(polymerase chain reaction,PCR),是一种超灵敏的检测微量抗原的方法[39]。为了进一步提高检测灵敏度,近来学者将OS-ELISA与定量PCR技术相结合,建立开放夹心免疫PCR方法(open sandwich immunoassay based on polymerase chain reaction and phage display,OS-phage immune-PCR)。该方法虽然是基于OS-phage ELISA,但是它的检测步骤是定量。通过热处理,将携带VH基因的噬菌体的载体洗脱出来,用于定量PCR检测(图8B)。理论上,其检测灵敏度是由幅值和检测背景信号决定的。因此OS phage immune-PCR不仅省略加入HRP酶标的抗M13噬菌体抗体,而且通过PCR的扩增来放大检测信号,目前已经应用于检测骨钙素肽和17β-雌二醇[40],其检测特异性和灵敏度都高于传统的OS-phage ELISA。
但是,由于噬菌体热稳定性好,用热处理提取噬菌体携带的DNA效率重复性较差。且此检测中的噬菌体必须要新制备的,这必然影响检测的重复性和实用性。为了避免这个局限,Hasan等[41]建立了基于生物素链接的开放夹心噬菌体荧光定量PCR免疫分析方法(图8C)。其主要的区别是将OS-ELISA与实时定量PCR相结合,在链霉亲和素(chain mildew avidin,SA)-VL和生物素标记的探针DNA同时加入包被了VH-麦芽糖结合蛋白(maltose binding protein,MBP)酶标板中预反应,再加入药物。其检测信号是用高度专一酶将反应后的复合物的DNA链切下,作为实时定量PCR的探针,最终转化为目标抗原的浓度。目前已成功应用于检测人类骨钙素C端片段,其最低检测限达100 fg/mL,比以往的OS-phage-ELISA检测限都低。该方法用酶切特异去洗脱作为检测信号的DNA,对超灵敏的在线监测小分子抗原发挥重要作用。


图8 开放夹心免疫PCR法测定原理[39-41]Fig.8 Scheme of open sandwich immunoassay based on PCR and phage display[39-41]
3.5 传感器法
近来,Sakata等[42]将OS-ELISA的机理与基于电场效应的生物传感器相结合,建立不需要添加检测标签的新方法,即为开放夹心免疫电场效应晶体管(open sandwich based immuno-field effect transistor,OS-FET)(图9)。其理论依据是在场效应中,小分子抗原驱动VH与VL相互作用,使得修饰在晶体管的分子的内部电荷改变[43],以此作为检测信号。已知可变区VH(在德拜长度范围内)在水溶液中带负电,将其修饰在在场效应器件表面,当加入抗原与一条可变区链,抗原会诱导抗体可变区VH与VL相互作用,固定在器件的生物分子的电荷密度就会发生改变并转化成电信号,从而检测抗原的浓度。与传统的OS-ELISA比较,既避免繁琐加入标签步骤,又可以提高检测的灵敏度。

图9 开放夹心免疫电场效应晶体管[43]Fig.9 Principle of open sandwich-based immuno-field effect transistor (OS-FET)[43]
最新报道的另外一种新型基于微流芯片传感器技术OS-ELISA,它的原理是将MBP-VL固定在聚苯乙烯微珠(物理吸附),孵育,接着微珠从入口孔进入玻璃芯片的微堰处,将微珠截留在芯片处,而后冲洗过量的微珠,接着以一定的流速加入药物和酶标VH。冲洗微通道后,酶的底物泵入微通道。反应积累的产物已一定的速度流出微通道,下游经过激光诱导的热透镜显微术检测器,用其光电二级管探测比色法产物的峰强(图10)。目前,已经成功应用于检测骨钙素[44]和甲状腺激素[45]。在微流控芯片上进行OS-ELISA,能有效地克服免疫分析的缺点,简化操作步骤,缩短检验时间,样品、试剂和能量消耗大大降低,有效降低检测限、提高灵敏度。然而在OS-ELISA中,引入微流芯片传感器技术,其关键因素是以信号/背景(signalling/background,S/B)的比率作为优化条件的评价指标,优化抗体在微珠固定的方式、孵育/洗涤的条件、封闭试剂的浓度、反应缓冲液的浓度、酶标VH的浓度和流入微流控芯片的流速等的条件。

图10 微通道的玻璃芯片应用于OS-ELISA[44-45]Fig.10 Micro-ELISA system. A glass chip integrated with microfluidic channels is used for the open-sandwich ELISA reaction[44-45]
4 OS-ELISA在食品安全中的应用
由于OS-ELISA原理是抗原驱动抗体可变区稳定化,通过此稳定化的检测信号检测抗原的含量。Naoto等[46]通过获得单抗的可变区,直接建立OS-ELISA方法检测食品饮料业的桃子风味物质苯甲醛,易于实现快速灵敏在线检测生产线中清洗残留物。由于不是所有的抗体都适合建立OS-ELISA模式,Suzuki等[19]利用spFv噬菌体库筛选合适的抗体可变区,获得更优玉米和小杂粮产生的雌激素真菌毒素玉米赤霉烯酮的检测限及检测线性工作范围。然而,scFv倾向于形成多聚体,影响筛选多样性。IHARA等[29]引入Fab噬菌体筛选文库,建立直接以开放夹心的模式筛选体系检测贝类毒素,其检测最低检测限为0.1 ng/mL,低于许多国家安全限量标准以及欧洲食品安全局的新的标准值,因此,此方法广泛适用于饮用水和贝肉中贝类麻痹性贝毒的检测。但是,前期研究表明,在OS-ELISA中随抗体浓度变化响应信号变化值小,造成检测误差大。随着传感器技术的迅速发展,传感器的应用为解决OS-ELISA所存在的问题提供了新的途径。Hasan等[41]将场效应晶体管与开放免疫分析相结合检测双酚A,直接对抗原进行快速检测,仪器简单,成本低廉,易于实现微型化,检测限可以达到100 fg/mL。OS-ELISA在食品安全中的应用研究进展如表1所示。

表1 OS-ELISA检测的小分子对象Table 1 Detection of small molecules by open sandwich immunoassay
5 结 语
基于可变区片段的OS-ELISA,与传统的夹心法检测相比,具有检测单价抗原、仅需要单个抗体、测量时间缩短、灵敏度高、线性范围广和可用于均相检测等优点,因此在食品安全检测领域中具有广泛的应用前景。但是,我国还未见此方面的报导。而现阶段,OS-ELISA已经建立的检测小分子化合物主要有生理活性物质、生物毒素、添加剂及非法添加物等。近年来的研究正在尝试基于抗体可变区的非竞争免疫检测有机磷农药和孔雀石绿及其代谢物隐性孔雀石绿,取得一定的进展。但是,研究发现其应用存在一些瓶颈问题:一是如何的高效和简便的获得可以用于建立开放夹心检测抗体的可变区;二是如何加大开放夹心免疫检测的信号响应变化。值得提及是结合噬菌体文库技术和pDong载体可以高效筛选检测目标抗原的抗体可变区,大大促进了开放免疫分析的发展。但是,不是每种抗体的可变区都可以直接满足建立该检测方法,研究者应该加强其在抗原抗体识别机制方面的研究,建立构效关系模型,从动力学和分子水平上真正掌握其作用机理,建立随机突变抗体库筛或定向突变改造抗体可变区的作用力,使它适合于构建开放夹心式免疫分析,使其广泛应用于检测各类小分子物质成为了可能。另外,可以开发新型的信号放大载体,其中都有:1)小型化的系统包括量子点、生物传感器、生物芯片等,使微量的待测物浓度改变能够带来高检测信号变化,能够减少检测时间、提高灵敏度和扩宽线性范围,满足食品安全监测的要求。同时,对分析仪器微型化、便携化及自动化中发挥重要作用,有可能实现食品安全的现场。2)结合荧光蛋白互补系统等的OS-ELISA,可以实现快速、简化操作的非竞争均相检测小分子化合物,应用在食品安全等现场快速检测具有巨大的潜在价值。
[1] JENNIFER K L, COUETNE Y, JERRY C H, et al. Thyroid hormones enhance the biomechanical functionality of scaffoldfree neocartilage[J]. Arthritis Research & Therapy, 2015, 17(1): 28. DOI:10.1186/s13075-015-0541-5.
[2] SCHRYVER E D, DEVUYST L, DERYCKE L, et al. Local immunoglobulin in the nasal mucosa: clinical implications[J]. Allergy, Asthma & Immunology Research, 2015, 7(4): 321-331. DOI:10.4168/ aair.2015.7.4.321.
[3] 张铭润, 张燕, 王弘, 等. 食品污染物残留的快速检测技术应用综述及展望[J]. 食品质量安全检测学报, 2014, 7(5): 1951-1959.
[4] WEI J W, KARSENTY G. An overview of the metabolic functions of osteocalcin[J]. Current Osteoposis Reports, 2015, 13(3): 180-185. DOI:10.1007/s11914-015-0267-y.
[5] LONG Q, LI H T, ZHANG Y Y, et al. Upconversion nanoparticlebased fluorescence resonance energy transfer assay for organophosphorus pesticides[J]. Biosensors and Bioelectronics, 2015, 68(15): 168-174. DOI:10.1016/j.bios.2014.12.046.
[6] LU G Y, SONG X X, YU Z M, et al. Environmental effects of modified clay flocculation on Alexandrium tamarense and paralytic shellfish poisoning toxins (PSTs)[J]. Chemosphere, 2015, 127(1): 188-194. DOI:10.1016/j.chemosphere.2015.01.039.
[7] VANGONE A, ABDEL S, CAPUTO I, et al. Basis for the Recognition in an idiotype-anti-idiotype antibody complex related to celiac disease[J]. PLoS ONE, 2014, 9(7): 1-12. DOI:10.1371/journal.pone.0102839.
[8] HUANG W J, LUO M E, ZHONG N, et al. Development of indirect competitive inhibition ELISA method for zearalenone based on idiotype-anti-idiotype reaction[J]. Chinese Journal of Biologicals, 2014, 27(3): 419-422.
[9] DONG J X, XU C, WANG H, et al. Enhanced sensitive immunoassay: noncompetitive phage anti-immune complex assay for the determination of malachite green and leucomalachite green[J]. Journal of Agricultural and Food Chemistry, 2014, 62(34): 8752-8758. DOI:10.1021/jf5019824.
[10] UEDA H, TSUMOTO K, KUBOTA K, et al. Open sandwich ELISA: a novel immunoassay based on the interchain interaction of antibody variable region[J]. Nature Biotechnology, 1996, 14(13): 1714-1718. DOI:10.1038/nbt1296-1714.
[11] TSUMOTO K, NISHIMIYA Y, KASAI N, et al. Novel selection method for engineered antibodies using the mechanisms of Fv fragment stabilization in the presence of antigen[J]. Protein Engineering, 1997, 10(11): 1311-1318. DOI:10.1093/protein/10.11.1311.
[12] MINAMI K, IHARA M, KURODA S, et al. Open-sandwich molecular imprinting: making a recognition matrix with antigen-imprinted antibody fragments[J]. Bioconjugate Chemistry, 2012, 23(7): 1463-1469. DOI:10.1021/bc3000782.
[13] CHUNG C I, MAKINO R, DONG J H, et al. Open flower fluoroimmunoassay: a general method to make fluorescent proteinbased immunosensor probes[J]. Analytical Chemistry, 2015, 87(6): 3513-3519. DOI:10.1021/acs.analchem.5b00088.
[14] ABURATANI T, SAKAMOTO K, MASUDA K, et al. A general method to select antibody fragments suitable for noncompetitive detection of monovalent antigens[J]. Analytical Chemistry, 2003, 75(16): 4057-4064. DOI:10.1021/ac034280n.
[15] SASAJIMA Y, ABURATANI T, SAKAMOTO K, et al. Detection of protein tyrosine phosphorylation by open sandwich fluoroimmunoassay[J]. Biotechnology Progress, 2006, 22(4): 968-973. DOI:10.1021/bp060104z.
[16] TOLED-MACHADO C M, BUENO L L, MENEZES-SOUZA D, et al. Use of phage displaytechnology in development of canine visceral leishmaniasis vaccine using synthetic peptide trapped in sphingomyelin/cholesterol liposomes[J]. Parasites & Vectors, 2015, 8(1): 1-8. DOI:10.1186/s13071-015-0747-z.
[17] LIM S L, ICHINOSE H, SHINODA T, et al. Noncompetitive detection of low molecular weight peptides by open sandwich immunoassay[J]. Analytical Chemistry, 2007, 79(16): 6193-6200. DOI:10.1021/ ac070653z.
[18] IHARA M, SUZUKI T, KOBAYASHI N, et al. Open-sandwich enzyme immunoassay for one-step noncompetitive detection of corticosteroid 11-deoxycortisol[J]. Analytical Chemistry, 2009, 81(20): 8298-8304. DOI:10.1021/ac900700a.
[19] SUZUKI T, MUNAKATA Y, MORITA K, et al. Sensitive detection of estrogenic mycotoxin zearalenone by open sandwich immunoassay[J]. Analytical Sciences, 2007, 23(1): 65-70. DOI:10.2116/analsci.23.65.
[20] WANG W Y, LUO J, XU L N, et al. Expression of scFv-Me1-Ga14 triple fusion protein as a targeted DNA-carrier in Escherichia coli[J]. Cell Biochemistry and Function, 2013, 31(8): 698-706. DOI:10.1002/ cbf.2958.
[21] HE Z, TIAN W Y, GAO Y, et al. Construction and screening of human single-chain antibody library of anti-mycobacterium smegmatis[J]. Journal of Natural Science of Human Normal University, 2011, 34(5): 70-74.
[22] XU L M, YIN C K, REN G P, et al. Establishment of bacteria display technology for Fab antibody library screening[J]. Chinese Journal of Cellular and Molecular Immunology, 2011, 27(10): 1090-1093.
[23] KIM H U, MI D, KIM J H, et al. Carbazole-containing fullerene derivatives for P3HT-based bulk-heterojunction solar cells[J]. Solar Energy Materials And Solar Cells, 2012, 105(10): 6-14. DOI:10.1016/ j.solmat.2012.05.017.
[24] DONG J, IHARA M, UEDA H. Antibody Fab display system that can perform open-sandwich ELISA[J]. Analytical Biochemstry, 2009, 386(1): 36-44. DOI:10.1016/j.ab.2008.11.045.
[25] WEIDNER K M, DENZIN L K, VOSS E W. Molecular stabilization effects of interactions between anti-metatype antibodies and liganded antibody[J]. Journal of Biological Chemistry, 1992, 267(15): 10281-10288.
[26] JOHNSON J L, ENTZMINGER K C, HYUN J. Structural and biophysical characterization of an epitope-specific engineered Fab fragment and complexation with membrane proteins: implications for co-crystallization[J]. Biological Crystallography, 2015, 71(4): 896-906. DOI:10.1107/S1399004715001856.
[27] KAVANAGH O, ELLIOTT C T, CAMPBELL K. Progress in the development of immunoanalytical methods incorporating recombinant antibodies to small molecular weight biotoxins[J]. Analytical and Bioanalytical Chemistry, 2015, 407(10): 2749-2770. DOI:10.1007/ s00216-015-8502-z.
[28] RAUCHENBERGER R, BORDES E, THOMSSEN-WOLF E, et al. Human combinatorial Fab library yielding specific and functional antibodies against the human fibroblast growth factor receptor 3[J]. Journal of Biological Chemistry, 2003, 278(40): 38194-38205. DOI:10.1074/jbc.M303164200.
[29] IHARA Y, DONG J, UEDA H. Open-sandwich immunoassay for sensitive and broad-range detection of a shellfish toxin gonyautoxin[J]. Analytica Chimica Acta, 2013, 793(2): 107-113. DOI:10.1016/ j.aca.2013.07.024.
[30] ISLAM K N, IHARA M, DONG J, et al. Direct construction of an open-sandwich enzyme immunoassay for one-step noncompetitive detection of thyroid hormone T4[J]. Analytical Chemistry, 2011, 83(3): 1008-1014. DOI:10.1021/ac102801r.
[31] RARAN-KURUSSI S, KEEFE K, WAUGH D S. Positional effects of fusion partners on the yield and solubility of MBP fusion proteins[J]. Protein Expression and Purification, 2015, 110(1): 159-164. DOI:10.1016/j.pep.2015.03.004.
[32] SUZUKI C, UEDA H, TSUMOTO K, et al. Open sandwich ELISA with VH-/VL-alkaline phosphatase fusion proteins[J]. Journal of Immunological Methods, 1999, 224(1/2): 171-184. DOI:10.1016/ S0022-1759(99)00020-4.
[33] UEDA H, KUBOTA K, WANG Y, et al. Homogeneous noncompetitive immunoassay based on the energy transfer between fluorolabeled antibody variable domains (open sandwich fluoroimmunoassay)[J]. Biotechniques, 1999, 27(4): 738-742.
[34] TIMO P, MATTI H, HANS S, et al. One-step homogeneous immunoassay for immunoassay for small analytes[J]. Analytical Chemistry, 2005, 77(8): 2637-2642. DOI:10.1021/ac048379l.
[35] ARAI R, NAKAGAWA H, TSUMUTO K, et al. Demonstration of a homogeneous noncompetitive immunoassay based on bioluminescence resonance energy transfer[J]. Analytical Biochemstry, 2001, 289(1): 77-81. DOI:10.1006/abio.2000.4924.
[36] YOKOZEK T, UEDA H, ARAI R, et al. A homogeneous noncompetitive immunoassay for the detection of small haptens[J]. Analytical Chemistry, 2002, 74(11): 2500-2504. DOI:10.1021/ ac015743x.
[37] UEDA H, YOKAZEKI T, ARAI R, et al. An optimized homogeneous noncompetitive immunoassay based on the antigen-driven enzymatic complementation[J]. Journal of Immunological Methods, 2003, 279(1/2): 209-218. DOI:10.1016/S0022-1759(03)00256-4.
[38] LEE Y, ASAMI T, YAMAGUCHI L, et al. A new gibberellin detection system in living cells based on antibody V(H)/V(L) interaction[J]. Biochemical and Biophysical Research Communications, 2008, 376(1): 134-138. DOI:10.1016/j.bbrc.2008.08.130.
[39] SUN R Y, ZHANG H S. Biotin-streptavidin-amplified real-time immune-PCR assay for detecting dimethyl phthalate in beverage and drinking water samples[J]. Analytical and Bioanalytical Chemistry, 2015, 407(4): 1261-1265. DOI:10.1093/jat/20.7.559.
[40] DONG J H, HASAN S, FUIJIOKA Y, et al. Detection of small molecule diagnostic markers with phage-based open-sandwich immuno-PCR[J]. Journal of Immunological Methods, 2012, 377(1/2): 1-7. DOI:10.1016/j.jim.2012.01.005.
[41] HASAN S, DONG J, UEDA H. Protein-based open sandwich immuno-PCR for sensitive detection of small biomarkers[J]. Analytical Sciences, 2013, 29(9): 871-876. DOI:10.2116/analsci.29.871.
[42] SAKATA T, IHARA M, MAKINO I, et al. Open sandwich-based immuno-transistor for label-free and noncompetitive detection of low molecular weight antigen[J]. Analytical Chemistry, 2009, 81(18): 7532-7537. DOI:10.1021/ac900457m.
[43] WU Yun, ZOU Jianjun, HUO Shuai, et al. Benzocyclobutene(BCB) polymer as amphibious buffer layer for grephene field effect transistor[J]. Journal of Nanoscience and Nanotechnology, 2015, 15(8): 5706-5710. DOI:10.1166/jnn.2015.10034.
[44] ISLAM K N, IHARA M, DONG J, et al. Micro open-sandwich ELISA to rapidly evaluate thyroid hormone concentration from serum samples[J]. Bioanalysis, 2010, 2(10): 1683-1687. DOI:10.4155/ bio.10.125.
[45] HARA M, YOSHIKAWA A, WU Y, et al. Micro OS-ELISA: Rapid noncompetitive detection of a small biomarker peptide by opensandwich enzyme-linked immunosorbent assay (OS-ELISA) integrated into microfluidic device[J]. Lab on a Chip, 2010, 10(1): 92-100. DOI:10.1039/b915516c.
[46] SIUZUKI C, UEDA H, MAHONEY W, et al. Open sandwich enzymelinked immunosorbent assay for the quantitation of small haptens[J]. Analytical Biochemistry, 2000, 286(2): 238-246. DOI:10.1006/ abio.2000.4800.
[47] NAOTO S, TAKE O, KAZUTAKA N, et al. Noncompetitive immunodetection of benzadhyde by open sandwich ELISA[J]. Analytical Sciences, 2009, 25(9): 1095-1100. DOI:10.2116/ analsci.25.1095.
Progress in Noncompetitive Detection of Small Molecules by Open Sandwich Immunoassay
RAO Meifang, WU Weijian, XU Chao, MAO Xiaoxiao, XU Zhenlin, WANG Hong*, LEI Hongtao, SUN Yuanming
(Guangdong Provincial Key Laboratory of Food Safety and Quality, College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Sensitive and quantitative determination of low molecular weight molecules is a major analytical task in biomedical, food and environmental fields. Although sandwich ELISA exhibits high specificity and sensitivity, it takes a long time and involves multiple incubation/washing steps. Moreover, the conventional sandwich immunoassay is not suitable to detect small molecules because of the lack of two discrete binding sites. Recently, open-sandwich immunoassay (OS-ELISA), phage anti-immune complex assay and idiotype-anti-idiotype reactions have been developed for the noncompetitive detection of haptens. However, OS-ELISA, based on antigen-dependent stabilization of antibody variable region to quantify various antigens, allows noncompetitive detection of small molecules with the applicability to a homogeneous assay, requires only a single antibody recognizing one epitope and simple instrumentation and suitable for full automation. In this paper, therefore, the principle, established methods, and signal amplification of this immunoassay are reviewed. The potential application of open sandwich immunoassay for detecting small molecules is also discussed.
small molecules; noncompetitive detection; open sandwich immunoassay
10.7506/spkx1002-6630-201607040
TS207.3
A
1002-6630(2016)07-0219-08
饶美芳, 伍伟健, 许超, 等. 小分子化合物开放夹心免疫分析研究进展[J]. 食品科学, 2016, 37(7): 219-226. DOI:10.7506/ spkx1002-6630-201607040. http://www.spkx.net.cn
RAO Meifang, WU Weijian, XU Chao, et al. Progress in noncompetitive detection of small molecules by open sandwich immunoassay[J]. Food Science, 2016, 37(7): 219-226. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607040. http://www.spkx.net.cn
2015-06-29
国家自然科学基金面上项目(31271866);广东省自然科学基金项目(2014A030311043);广东省教育厅创新强校工程项目;广州市科技计划项目(2014J4100185)
饶美芳(1991—),女,硕士研究生,研究方向为食品质量与安全。E-mail:rmfrwl@163.com
*通信作者:王弘(1973—),女,教授,博士,研究方向为食品质量与安全。E-mail:gzwhongd@163.com

